Сепсис и аутоиммунные заболевания

Клинически сепсис характеризуется наличием первичного инфекционного очага, бактериемии, множественных вторичных очагов-отсевов с практически непредсказуемой локализацией, ацикличностью течения инфекционного процесса. Развитие сепсиса у пациента ассоциируется с тяжелым клиническим течением болезни, труднопредсказуемым исходом и высокой летальностью.
Наблюдаемый в последние годы рост частоты случаев сепсиса обусловлен следующими факторами:
Ключевую роль в развитии сепсиса играет взаимодействие микрофлоры и макроорганизма: с одной стороны, изменение патогенности бактерий при их колонизации в ранах, на ожоговых поверхностях, на катетерах и т.д., с другой — развивающиеся у пациента иммунодефицитное состояние и иммунный паралич.
По вопросам определения и классификации сепсиса, механизмов его развития, лечения этого тяжелого заболевания у представителей разных медицинских специальностей существует большой разброс мнений. Во многом эта ситуация объясняется отсутствием у патологов единой точки зрения на сущность происходящих при сепсисе процессов, а также определенной нестыковкой смыслового наполнения представлений о заболевании у клиницистов и патологоанатомов.
С целью преодоления указанных противоречий на согласительной конференции американского Колледжа пульмонологов и Общества специалистов критической медицины в Чикаго [ACC/SCCM Consensus Conference Committee, 1991 г.] предложены определение, классификация и критерии клинической диагностики сепсиса, обсуждены вопросы его этиологии и патогенеза, разработаны рекомендации для лечения.

Синдром системного воспалительного ответа
Синдром системного воспалительного ответа (ССВО, Systemic Inflammatory Response Syndrome — SIRS) — это системный воспалительный ответ на повреждение тканей инфекционной или неинфекционной природы, сопровождающийся гиперпродукцией провоспалительных цитокинов и медиаторов.
Развитие ССВО констатируют при наличии двух или более из следующих симптомов:
- гипер- или гипотермия: температура тела выше 38°С или ниже 36°С;
- тахикардия более 90 уд/мин;
- тахипноэ: частота дыхания более 20 в минуту или рСО2 ниже 32 мм рт. ст.;
- лейкоцитоз или лейкопения: число лейкоцитов более 12 х 109/л или менее 4 х 109/л либо появление более 10% незрелых (палочкоядерных, юных) форм.
Признаки инфекционной природы ССВО:
- устойчивая бактериемия (идентичная флора);
- наличие не санированного обширного очага воспаления (не всегда);
- наличие устойчивых лабораторных признаков инфекционно-воспалительной альтерации при убедительном исключении местного деструктивного процесса.
ССВО может не только быть проявлением сепсиса, но и отражать высокую готовность макроорганизма к его развитию.
Согласно дефиниции, предложенной ACC/SCCM (1992) и широко распространенной в настоящее время в зарубежной литературе, сепсис представляет собой ССВО при выявленном очаге инфекции.
Тяжелый сепсис характеризуется наличием одной из форм органно-системной дисфункции (респираторный дистресс-синдром взрослых, кардиогенная недостаточность кровообращения, острая почечная недостаточность, ДВС-синдром и т. д.) при наличии установленного сепсиса.
Выделение в клинической классификации ССВО — вынужденная мера, так как в первые часы правильная диагностика заболевания затруднена, данные лабораторных и бактериологических исследований запаздывают, а пациент нуждается в лечении.
Развитие ССВО могут вызвать биологические (бактерии, грибы, вирусы, паразиты), физические (излучение, травма), иммунологические (аутоиммунные и иммуно-комплексные заболевания), химические или метаболические (гипоксия, нарушение метаболизма) факторы. В качестве примеров можно привести следующие патологические состояния, при которых может развиваться ССВО, — панкреатиты, обширные травмы, ожоговая болезнь, массивные кровоизлияния, распад опухолей и т. п.
Синдром полиорганной недостаточности
В предложенной Чикагской согласительной конференцией АСС/ SCCM (1992) классификации выделяют стадийность заболевания, коррелирующую с исходом: сепсис, тяжелый сепсис и септический шок. Основным отличием сепсиса от тяжелого сепсиса является отсутствие функциональных органных расстройств.
В свою очередь, для тяжелого сепсиса характерно появление признаков органно-системной дисфункции, которые могут нарастать и сопровождаться формированием выраженной декомпенсации с развитием синдрома полиорганной недостаточности (СПОН, Multiple Organ Failure Syndrome — MOFS).
СПОН — это клинический синдром прогрессирующей, но потенциально обратимой дисфункции двух или более органов (систем) с угрожающими нарушениями гомеостаза. Самостоятельное, без лечения, поддержание гомеостаза невозможно.
СПОН сопровождается системными нарушениями тканевых механизмов жизнеобеспечения, имеющими в своей основе дезорганизующий эффект медиаторов воспаления в условиях редуцированной перфузии тканей. Возникает неспособность поддерживать адекватный гомеостаз организма на органно-системном уровне. СПОН, по существу, представляет собой крайнюю степень выраженности ССВО.
Оценка тяжести состояния больных с сепсисом проводится по распространенным балльным шкалам оценки состояния пациента APACHE-II или SAPS-II, что позволяет объективизировать тяжесть течения заболевания с учетом возраста больного и наличия сопутствующей патологии. Оценка тяжести СПОН осуществляется по критериям A. Baue et al. (2000) или по шкале SOFA.
Для оценки ССВО и СПОН разработана система PIRO, которая характеризует предрасположенность к инфекции (Р), описывает особенности этиологии и локализации первичного очага (I), системную реакцию организма (R) и наличие органной дисфункции (О).

Септический шок, помимо СПОН, сопровождается развитием артериальной гипотензии, не устраняемой с помощью инфузионной терапии (адекватной коррекции гиповолемии) и требующей использования вазопрессоров.
По длительности заболевания достаточно условно выделяют сепсис:
- молниеносный (до суток или до 3 суток, также называемый острейшим);
- острый (до 2—3 или до 6 недель);
- подострый или затяжной (более 3 или 6 недель); подострым также считают сепсис давностью 2—12 недель, а затяжным, рецидивирующим — от 12 недель до нескольких лет.
Механизмы развития любого инфекционно-воспалительного заболевания, включая сепсис, являются результатом взаимодействия патогенов и макроорганизма. В зависимости от патогенных свойств возбудители делят на 4 класса.
Высокопатогенные возбудители I—II классов вызывают развитие острых инфекционно-воспалительных заболеваний, характеризующихся цикличностью течения. Факторы вирулентности возбудителей этих классов представлены главным образом инвазинами и экзотоксинами. Сепсис является гено-фенотипически обусловленным ациклическим заболеванием, вызванным бактериальной микрофлорой III—IV классов патогенности (условно-патогенной).
Для современной клиники дифференциальный диагноз между ССВО, вызванной инфекцией и другими, неинфекционными, причинами, представляет существенные трудности. Кроме того, клинические методы оценки тяжести ССВО и прогноз пока разработаны недостаточно.
Перспективен поиск иммунологических маркеров, которые позволили бы отличить ССВО инфекционной и неинфекционной природы и прогнозировать течение заболевания. В настоящее время проводятся исследования прогностической значимости содержания в периферической крови апоптотически измененных клеток, регуляторных Т-лимфоцитов, HLA- DR-положительных макрофагов, NK-клеток.
В клинической практике в качестве прогностических маркеров принято использовать определение уровней в сыворотке крови прокальцитонина, С-реактивного белка, ИЛ-6, ФНО-а, ИФН-у и т. д., но все они оказались недостаточно информативными.
Уровень прокальцитонина
Широкое распространение для диагностики ССВО, вызванного инфекцией, оценки тяжести и прогноза сепсиса получил метод определения уровня в сыворотке крови одного из прогормонов кальцитонина — прокальцитонина, который является медиатором системного воспаления.
В физиологических условиях прокальцитонин вырабатывается главным образом в нейроэндокринных клетках щитовидной железы (С-клетках) и легких. При тяжелой системной инфекции прокальцитонин образуется во многих клетках и тканях, включая лимфоциты и моноциты, и весь организм может рассматриваться как эндокринная железа.
Уровень прокальцитонина в сыворотке крови повышается при тяжелой генерализованной бактериальной, паразитарной и микотической инфекции. Локальные инфекции без системных проявлений, тяжелые генерализованные вирусные инфекции и ССВО неинфекционной этиологии вызывают лишь небольшое увеличение его уровня (от 0,3 до 1,5 нг/мл).
Уровень прокальцитонина коррелирует с тяжестью синдрома полиорганной недостаточности (оценивается по показателям SOFA), с клиническим состоянием пациента и поэтому служит для контроля течения заболевания. Кроме того, высокий уровень прокальцитонина отмечается достаточно рано (в пределах 3 часов от начала развития сепсиса).
Важно учитывать, что иногда повышение уровня прокальцитонина даже до 1000 нг/мл наблюдают у больных и при отсутствии сепсиса. Уровень прокальцитонина может повышаться у пациентов с тяжелыми травмами, ожогами, после хирургических операций, геморрагического шока, хотя его средние значения при этом обычно меньше, чем при тяжелом сепсисе и септическом шоке. Уровень прокальцитонина также нередко повышается при тяжелой пневмонии, перитоните, бактериальном менингите, малярии, мелиоидозе.
Таким образом, определение уровня прокальцитонина в сыворотке крови рекомендуется в следующих ситуациях:
- для диагностики сепсиса, септического шока и тяжелых бактериальных инфекций;
- для мониторинга состояния пациентов с сепсисом, шоком; оценки эффективности проводимого лечения; оценки прогноза для данного больного;
- для ранней диагностики инфекционных осложнений бактериальной и микотической этиологии после хирургических операций, трансплантации органов, у пациентов при интенсивной и иммуносупрессивной терапии, искусственной вентиляции легких, с нейтропенией и заболеваниями неясного генеза;
- для дифференциальной диагностики инфекционной и неинфекционной этиологии лихорадки неясного генеза, респираторного дистресс-синдрома, острого панкреатита, а также бактериальных и вирусных заболеваний (например, острого менингита, сепсиса новорожденных), острых бактериальных инфекций и аутоиммунных или иммунокомплексных болезней.
Этиология сепсиса
Сепсис полиэтиологичен. Тем не менее, основная роль принадлежит условно-патогенной бактериальной гноеродной флоре (стафилококк, стрептококк, пневмококки и т. д). Продолжаются дискуссии о возможности включения в число возбудителей сепсиса вирусов и грибов.
Генерализованные вирусные инфекции не принято рассматривать в качестве сепсиса, хотя об этом имеются указания в современных исследованиях. Не учитывают как сепсис тяжелое течение малярии и других паразитарных инвазий, а также инфекции, вызванные риккетсиями, хламидиями, микоплазмами.
Вопрос о возможности микотической этиологии сепсиса также дискутируется. В отдельных публикациях под микотическим сепсисом (кандидозная септицемия — В37.7) обычно подразумеваются кандемия и острый диссеминированный кандидоз, однако последний возникает, как правило, при очень тяжелом иммунодефиците, как, например, у ВИЧ-инфицированных пациентов в терминальных стадиях, больных онкологического профиля и при трансплантации органов в условиях иммуносупрессии.
В современных клинических классификациях инфекционных болезней указанные термины справедливо не употребляются. В этих случаях речь может идти о генерализованных формах заболеваний определенных нозологий, имеющих четко обозначенный возбудитель и требующих этиотропного лечения.
Сепсис есть примитивная общая реакция организма на инвазию инфекта, поскольку тканевые поражения при нем не имеют специфических признаков (например, специфических гранулем, как при ревматизме, сыпном тифе, туберкулезе и т. д.).
Известно, что кровь не может быть местом длительного обитания микроорганизмов, являясь для них лишь временной транспортной средой, и, чтобы выжить, возбудитель должен фиксироваться в тканях и органах, где он встретит подходящие условия для своего обитания и жизнедеятельности.
Сразу после фиксации микроба в органах и тканях возникает локальная клеточная воспалительная реакция, уже через 2—3 часа приводящая к формированию микроабсцесса, то есть развивается септикопиемия. Следует подчеркнуть и тот бесспорный факт, что способностью вызывать метастатические очаги в наибольшей мере обладают представители стрепто-, стафилококковой группы микроорганизмов, которые и являются в 95—98% случаев возбудителями септикопиемии.
В то же время представителям грамотрицательной бактериальной флоры более свойственно развитие местных резорбционно-токсических процессов и инфекционно-токсического шока. Тем самым подчеркивается значение этиологического фактора в специфике развития септических заболеваний.
Патогенез сепсиса
Для развития сепсиса необходимы определенные условия. Проникновение возбудителя через входные ворота (чаще травмированная кожа или слизистые оболочки) с развитием местной реакции (первичного аффекта) — септического очага.
Как правило, первичный аффект (септический очаг) совпадает с входными воротами, но иногда он возникает в отдаленных от места внедрения возбудителя тканях (например, гематогенный остеомиелит при внедрении инфекции через кожу).
Лимфогенное распространение инфекции ведет к развитию реактивного лимфангита, лимфотромбоза и лимфаденита. Регионарная лимфатическая система (структурная основа так называемого местного, или регионарного, иммунитета) является серьезным барьером для дальнейшего распространения инфекционного агента.
Расшифровка большой роли регионарной и общей лимфатических систем легла в основу специальных методов лечения (лимфотропная терапия, дренирование общего лимфатического протока и т. д.) инфекционно-воспалительных заболеваний и профилактики сепсиса.
Гематогенное распространение инфекции вызывает развитие гнойного флебита и тромбофлебита с последующим расплавлением тромбов и тромбо-бактериальной эмболией, бактериемией и токсемией. Поражение сосудистой стенки на большом протяжении приводит к образованию инфицированных микротромбов, развитию метастатических очагов, обусловливающих абсцессы и инфаркты внутренних органов.
Следует указать на два основных варианта образования гнойных метастазов. Первый развивается по следующей схеме: региональный тромбофлебит — тромбо-бактериальная эмболия — инфаркт — абсцесс органа. Второй заключается в предварительном развитии на фоне резорбционно- токсических процессов эндотелиальной дисфункции, токсических или токсико-аллергических васкулитов с последующей фиксацией на этих участках микроорганизмов в условиях бактериемии.
Примерно в 95—98% случаев это микробы стафило- стрептококковой группы, составляющие центральную зону метастатического очага и при смешанной кокко-бациллярной инфекции.
Грамотрицательная флора нередко присоединяется к первичной кокковой инвазии, гораздо реже возникают первичные колибациллярные и другие метастатические очаги при наличии определенных условий: токсико-аллергический васкулит, развивающийся инфаркт органа, некроз тканей в зоне инъекций и т. и.
Вместе с тем, по некоторым данным, микроорганизмы с высокими адгезивными свойствами могут сами прикрепляться к предварительно неизмененному эндотелию, затем, размножаясь, повреждают стенку сосуда, вызывая ее некроз с последующим развитием лейкоцитарного очажка.
Эпидемиологически и в зависимости от локализации входных ворот различают сепсис:
- нозокомиальный (внутрибольничный, госпитальный), хирургический, терапевтический, акушерский, ятрогенный (послеродовый, послеоперационный, посткатетеризационный, постинъекционный, после гинекологических осмотров), сепсис новорожденных (неонатальный, пупочный) и т. д.;
- криптогенный (при не выявленном септическом очаге), тонзилогенный, отогенный, одонтогенный, урогенный, генитальный, маточный, легочный, кишечный, абдоминальный раневой, ожоговый и т. д.
- тромбогеморрагический синдром (ДВС-синдром);
- септический (инфекционно-токсический) шок;
- полиорганный токсико-дистрофический;
- респираторный дистресс-синдром взрослых (РДСВ), развивающийся у 25—42% у пациентов с сепсисом.
РДСВ характеризуется альвеолярным и интерстициальным отеком, микроциркуляторными нарушениями с геморрагиями и интраальвеолярным выпадением фибрина с формированием гиалиновых мембран. Воспалительный инфильтрат минимален, в нем преобладают полиморфноядерные лейкоциты.
Взаимодействие перечисленных факторов, воздействие на организм возбудителей, их токсинов и продуктов распада тканей, всасывающихся в кровь из первичного и метастатических гнойных очагов, приводят к тяжелой интоксикации пациента, прогрессированию дистрофических и некротических изменений внутренних органов, нарушению функций всех систем гомеостаза и обусловливают клиническую картину заболевания.
Патологическая анатомия сепсиса
Различают местные и общие патоморфологические изменения.
Местные изменения чаще всего находят в месте внедрения инфекции — септический очаг (гнойное воспаление), лимфангит, лимфаденит, флебит и тромбофлебит. Реже входные ворота инфекции не совпадают с локализацией септического очага или септический очаг не обнаруживают (криптогенный сепсис).
Общие изменения при сепсисе характеризуются следующим.
- Дистрофические и некротические изменения паренхимы печени, почек, миокарда, мышц, ЦНС, а также РДСВ, которые лежат в основе СПОН.
- Воспаление, диффузное или очаговое межуточное (межуточный нефрит, гепатит, миокардит), продуктивные или продуктивно-некротические васкулиты. На клапанах сердца может развиваться острый бородавчатый эндокардит.
- Гиперплазия кроветворной и лимфоидной ткани (костного мозга, селезенки, лимфатических узлов).
- Бледность и желтушность кожи и склер (гемолитическая анемия и гемолитическая желтуха, впоследствии — смешанная, надпеченочная и печеночная), ДВС-синдром, петехиальная сыпь на коже и слизистых оболочках, кровоизлияния во внутренних органах, серозных оболочках.
Согласно современным концепциям этиологии инфекционного процесса, при нарушении специфического защитного механизма возникает инфекция, тип которой зависит от природы иммунного дефекта. Если ранее иммунная недостаточность рассматривалась как редкое событие, то сейчас считается, что она встречается довольно часто: в неонатальном периоде, при недостатке белка или витаминов в пище при различного рода интоксикациях, злокачественных опухолях и в процессе их лечения, при различного рода стрессах, нарушениях обмена и др. Существуют и генетические поздно проявляющиеся дефекты.
Реализм сменил эйфорию, продолжавшуюся несколько десятилетий и связанную с успешным применением антибиотиков. Возникли проблемы, связанные с инфекциями микроорганизмами, являющимися частью нормальной микрофлоры, с которыми больной еще несколько дней назад поддерживал мирное сосуществование. При нарушении иммунной защиты происходят быстрый рост и распространение безвредной в норме микрофлоры дыхательных путей, кожи, желудочно-кишечного тракта, мочевыводящих путей.
Сепсис представляет собой тяжелейшую форму генерализованной инфекции, являющуюся следствием несостоятельности защитных реакций. В механизмах его возникновения и патогенезе в определенные периоды на первый план могут выступать различные факторы: снижение фагоцитоза, обусловленное недостаточностью или потреблением антител, появление в крови блокирующих субстанций и вторичный иммунный дефицит, смена или присоединение другого возбудителя, интоксикация и поражение внутренних органов, нарушение в свертывающей системе крови и др.
Нарушение иммунной защиты при сепсисе. В системе противоинфекционной защиты организма существуют три функциональных уровня. Первый — это барьеры на пути инвазии. Они включают кожу, слизистые оболочки, секрет, который нередко оказывает бактерицидное или бактериостатическое действие, механически выводит микроорганизмы или стимулирует рост одних микробов, препятствующих размножению других. В большинстве случаев клиническим проявлениям сепсиса предшествуют механические, физические или трофические нарушения целости кожных покровов или слизистых оболочек. Входными воротами инфекции могут быть локальные очаги воспаления, места инъекций, введения катетера и др. Тщательно собранный анамнез и клиническое обследование в большинстве случаев позволяют выявить места повреждения.
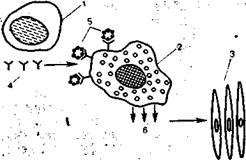
Рис. 9.1.Аллергическая атоническая реакция с участием клеток иммунной системы, гуморальных факторов и клеток-мишеней (схема).
1 — Ig Е — образующая клетка; 2 — лаброцит; 3 — клетки-мишени; 4 — lg Е-антитела; 5 — аллергены; 6 — медиаторы.
Кроме антител, главным опсонином является комплемент, особенно его третий компонент — С3b. Например, антитела к пневмококку типа 7 не инициируют фагоцитоз нейтрофильными гранулоцитами, выделенными из крови человека. Только после того, как С3b фиксируется на стенке бактерий, происходит иммунное прилипание и фагоцитоз становится эффективным. Инкапсулированные стафилококки могут быть опсонизированы как антителами, так и С3b-компонентом комплемента. В ряде случаев опсонизация может быть нарушена и ничто не сдерживает лавинообразного нарастания концентрации патогенного фактора и продуктов его метаболизма. Сказанное можно проиллюстрировать следующими примерами.
1. При изучении плевральной жидкости у больных тяжелым гнойным плевритом определялись продукты расщепления IgG. Протеазы Streptococcus pneumoniae разрушают иммуноглобулины (антитела) у человека. Аналогичным образом могут действовать и протеазы Pseudomonas aeruginosa [Doring G. et al, 1984].
3. Процесс фагоцитоза может быть нарушен в самом начале и привести к непредсказуемым осложнениям. Так, циркулирующие антитела класса IgA, не активирующие систему комплемента и не инициирующие фагоцитоз, могут своим присутствием на бактериальной стенке блокировать начальный период иммунного эффекторного механизма фагоцитоза, что может привести к генерализации инфекции. Такой опосредованный IgA-ингибирующий эффект может представлять большую опасность при менингите. Этим феноменом объясняются слабая опсонизация менингококка и нередкий летальный исход при менингите.
В то же время свободно циркулирующие в крови иммунные комплексы независимо от их природы могут блокировать рецепторы к Fc IgG на поверхности фагоцитов и снижать их бактерицидную активность. Эта ситуация нередко встречается при уже развившейся инфекции. При уточнении анамнеза в таких случаях выясняется, что сепсису предшествовало заболевание, протекавшее с повышением температуры и клиническими проявлениями нарушения функций легких, кишечника или мочеполовых органов.
Диагностика иммунной недостаточности. Современная лаборатория клинической иммунологии имеет довольно широкий набор диагностических тестов. Существуют тесты общего порядка: Т- и В-лимфоциты, бласттрансформация, уровень иммуноглобулинов в сыворотке крови. При необходимости выполняются дополнительные исследования [Зимин Ю. И. и др., 1982].
У детей, родившихся преждевременно (срок беременности: 30—37 нед), обнаруживается выраженная гипогаммаглобулинемия. Она является следствием незрелости плаценты и ее неспособности транспортировать IgG, а также отсутствия синтеза антител у плода. У детей, рожденных в срок, сохраняется довольно высокий уровень IgG в сыворотке. Однако данный белок имеет материнское происхождение и концентрация его понижается в течение первых недель жизни. Частота тяжелых генерализованных инфекций у новорожденных составляет от 0,2 до 1,5%. Следует помнить, что в 35% случаев смерть в течение первого года жизни является следствием сепсиса или септической пневмонии. Иммунологическая незрелость плода является важнейшим фактором возникновения перинатальных инфекций. Даже в настоящее время, несмотря на антибиотики, летальность новорожденных при сепсисе очень высока.
По мере инволюции органов иммунной системы у лиц пожилого или старческого возраста первичный иммунный ответ может существенно не изменяться. Однако снижение разнообразия иммуноглобулинов (антитела) прогрессирует. Их концентрация в сыворотке может оставаться нормальной, а за счет избыточной моноклональной пролиферации даже увеличиваться.
Врожденная недостаточность антител проявляется как аномальная подверженность инфекциям, особенно рецидивирующим инфекциям респираторного или желудочно-кишечного тракта. Нередко начало септицемии связано с локальным воспалительным процессом. Врожденные нарушения проявляются клинически в раннем детском возрасте или позже, особенно в 20—30 лет. Диагностика этой формы недостаточности антител основывается обычно на определении иммуноглобулинов сыворотки крови. Происходит снижение уровня всех иммуноглобулинов или отдельных классов, или субклассов. Селективный врожденный дефект, проявляющийся отсутствием или снижением синтеза одного из субклассов IgG или отсутствием антител определенной специфичности, возможен и при нормальном уровне иммуноглобулинов.
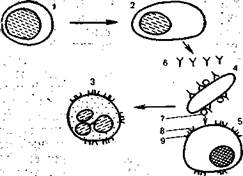
Рис. 9.2. Клеточный и гуморальный иммунные ответы (схема).
1 — В-лимфоцит; 2 — плазматическая клетка: 3— нейтрофильный гранулодит; 4 — бактерия; 5 — звездчатый ретику-лоэндотелиоцит; 6 — иммуноглобулины (антитела); 7 — С3b-компонент комплемента; 8 —рецептор к С3b; 9 —рецептор к Fc иммуноглобулина.
Приобретенный (симптоматический) синдром недостаточности антител встречается довольно часто при многих заболеваниях. Не всегда можно установить, является недостаточность антител вторичной для данного заболевания или она была причиной и вызвала его. Нарушения этого типа наиболее характерны при опухолях лимфоретикулярных тканей, особенно имеющих В-клеточную природу: хроническом лимфолейкозе, лимфомах, доброкачественной и злокачественной парапротеинемии и др. Происходит уменьшение числа или полное исчезновение нормальных поликлональных, секретирующих иммуноглобулины плазматических клеток в костном мозге и лимфоидной ткани. Нормальные клетки замещаются злокачественными, внешне имеющими интактную структуру. В некоторых случаях ткани, участвующие в формировании иммуноглобулинов, могут быть разрушены лимфотропным вирусом (в частности, при инфекционном мононуклеозе).
В большинстве случаев при сепсисе изменяются многие иммунологические показатели. Характеризуя состояние иммунной системы при сепсисе в целом, можно говорить о глубоком иммунном дефиците, который, несомненно, является причинным и осложняющим фактором в течении заболевания. Сепсис, начавшись на фоне иммунной недостаточности, усугубляет ее, нередко до фатального состояния. Этим можно объяснить присоединение другой инфекции, смену возбудителя, появление аллергических процессов, нарушение регенерации.
На рис. 9.3 в виде радиусов в системе полярных координат отложены иммунологические показатели, конкретных людей в процентах к норме (группа из 25 здоровых людей), представленной в виде окружности. Результаты отдельных тестов, характеризующих функционирование иммунной системы, представлены в виде векторов: лимфоциты в 1 мм 3 крови (Лф), Т-лимфоциты в абсолютных значениях на 1 мм 3 крови и в процентах (Т, Т%), вспомогательные клетки (Т4 и Т4%), супрессорные Т-клетки (Т8 и Т8%), реакция бласттрансформации in vitro под влиянием КонА (Is), IgM, IgA, IgG, IgE —иммуноглобулины в сыворотке крови, В-лимфоциты (В), фагоцитоз (Фг), соотношение к- и А,-цепей иммуноглобулинов в сыворотке. Иммунологические показатели интактного донора (см. рис. 9.3) отличаются не более чем на 10% от средних значений нормы. Площадь многоугольника, в определенной степени характеризующая иммунный статус человека, приближается к площади круга (норма).
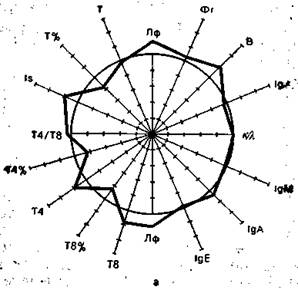
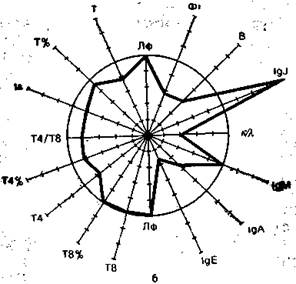
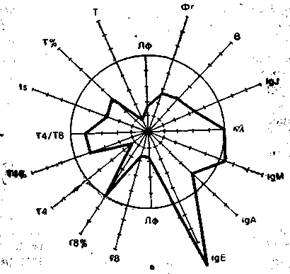
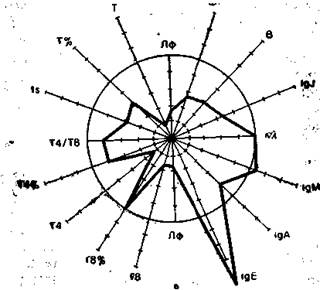
Рис. 9.3. Иммунный статус интактного донора (а), больного в предсептиче-ском состоянии (б) и при сепсисе (в). Объяснение в тексте.
Принципы профилактики и терапии септических состояний. Адекватная терапия заболеваний, вызывающих недостаточность иммунитета, компенсация сопутствующих нарушений микроциркуляции, водно-солевого баланса, потери белка, а также хирургическая санация абсцесса, флегмоны или эмпиемы, детоксицирующая терапия и др. являются важными моментами эффективной профилактики и терапии сепсиса.
К основным принципам терапии и профилактики сепсиса необходимо отнести: уход, применение антибиотиков, выведение ингибирующих факторов (плазмаферез, гемосорбция, гемодиализ, селективная плазмафильтрация), заместительную терапию (препараты иммуноглобулинов для внутривенного введения, тимопептиды, свежезамороженная плазма, гипериммунная сыворотка, лейкоцитная масса), стимуляцию эффекторного звена клеточного иммунитета.
Независимо от природы иммунной недостаточности (гипопротеинемия, облучение, интоксикация, кровопотеря и др.) у больных выявляется повышенная чувствительность к инфекции. В соответствии с этим и строится режим. В особо тяжелых случаях (агаммаглобулинемия, агранулоцитоз) больного помещают в палату, где обеспечивается стерильное содержание.
Антибиотики были и остаются эффективным средством лечения инфекционных осложнений при иммунной недостаточности. Следует указать на два важных аспекта. Во-первых, антибиотики эффективны только при сохранившихся иммунных реакциях. Многолетний опыт лечения больных с врожденным иммунодефицитом свидетельствует, что без иммунного ответа не удается достигнуть положительных результатов. Во-вторых, при нарушении фагоцитоза рекомендуется использовать антибиотики, избирательно накапливающиеся в макрофагах (например, рифампицин). Некоторые микроорганизмы способны выживать в фагоцитах и даже размножаться в них, следствием чего нередко бывает хроническая инфекция. Антибиотики, накапливающиеся в фагоцитах, усиливают функцию инактивирования бактерий.
Успех лечения антибиотиками зависит от ряда факторов: 1) идентификации возбудителя, что является крайне сложной задачей, если лечение сепсиса уже начато; 2) чувствительности микроорганизма к антибиотику; 3) транспорта антибиотика к месту инфекции в достаточной терапевтической концентрации.
Опыт показывает, что необходимы дополнительные знания, касающиеся взаимоотношений между организмом, антибиотиком и микробом. Антибиотики сами по себе недостаточно эффективны при лечении септических состояний. В лучшем случае они помогают выиграть время для проявления защитных реакций и для иммунологической ликвидации инфекции. В тех нередких случаях, когда защитные системы организма не работают, ан-тибиотикотерапия безуспешна.
При многих септических состояниях в сыворотке крови появляются блокирующие факторы макромолекулярной природы, препятствующие нормальному течению иммунных реакций. Это могут быть иммунные комплексы, продукты жизнедеятельности микроорганизмов, эндо- и экзотоксины, разного рода протеазы, продукты распада тканей. Применение плазмафереза, гемосорбции или гемодиализа может способствовать восстановлению иммунного реагирования (рис. 9.3). На фоне детоксикационной терапии, достигаемой экстракорпоральными методами, повышается эффективность всех последующих вмешательств.
Классическим показанием к заместительной терапии препаратами иммуноглобулинов для внутривенного введения является гуморальная иммунная недостаточность. Этот вид лечения рекомендуется при тяжелых бактериальных или вирусных инфекциях у больных со сниженным или нормальным уровнем иммуноглобулинов в сыворотке. При назначении препаратов этой группы исходят из того, что в основе тяжелых инфекций лежит либо первичная, либо вторичная недостаточность (потребление) антител. Поливалентные препараты иммуноглобулинов (иммуноглобулин внутривенный, гипериммунная сыворотка) содержат по крайней мере 10 млн различных типов антител.
Стимуляция эффекторного механизма клеточного иммунитета позволяет усилить, иммунный ответ при профилактике бактериальных и вирусных инфекций. Результат зависит от дозы и времени применения, а также от возраста больного и генетических факторов. Препараты иммуноглобулинов эффективны при хронических рецидивирующих инфекциях и при вспомогательной терапии у больных различными видами опухолей. Их используют с целью компенсации иммунодепрессии, вызванной облучением, химио- или стероидной терапией, а также при различного рода стрессах. К стимуляторам эффекторного механизма иммунных реакций относят левамизол, диуцифон, цимети-дин, интерферон и его индукторы.
Таким образом, достижения клинической иммунологии и иммунофармакологии и накопленный в последние годы опыт коррекции иммунодефицитных состояний позволяют сделать вывод, что современная клиническая медицина располагает средствами диагностики, профилактики и лечения иммунной недостаточности, предшествующей сепсису или усугубляющейся на фоне era течения.
Читайте также:


