Работа при диагностике чумы
Цель занятия: изучить методы диагностики чумы, систему профилактических и оздоровительных мероприятий.
Материалы и оборудование: плакаты, диапозитивы, ветеринарное законодательство, эпизоотологический макет.
Место проведения занятия: аудитория кафедры эпизоотологии.
Чума свиней — инфекционная, контагиозная болезнь, вызываемая пестивирусом семейства Flaviviridae. Возбудитель устойчив к высушиванию и низким температурам; в зимнее время может сохраняться во внешней среде в течение нескольких месяцев. Заражение свиней чумой происходит главным образом через пищеварительный тракт.
Методы диагностики. Ранняя диагностика чумы служит решающим условием ее быстрой ликвидации. Диагноз основан на эпизоотологических, клинических, патологоанатомических данных, результатах лабораторных исследований.
Основные эпизоотологические особенности чумы свиней: восприимчивость животных всех возрастов и пород; появление болезни в любое время года и быстрое распространение с охватом большого поголовья, особенно при тесном контакте между животными или при наличии общего источника инфекции.
Клинические симптомы болезни достаточно выражены в начале эпизоотии среди свиней, которых никогда не прививали против чумы: отказ от корма, температура тела повышается до 42 °С и держится почти до гибели животного. К важнейшим клиническим признакам болезни следует отнести и гнойный конъюнктивит: веки припухают, склеиваются (симптом особенно выражен у молодняка).
В зависимости от продолжительности болезни и степени поражения при вскрытии можно наблюдать разнообразные патологоанатомические изменения и поэтому для установления диагноза на чуму нужно вскрывать как можно больше трупов. Основные изменения заключаются в следующем: лимфоузлы увеличены, темно-красного цвета, на разрезе отмечают мраморный рисунок. Селезенка нормальная или слегка припухшая, с ограниченными геморрагическими инфарктами по краям. Почки анемичны; множественные кровоизлияния отмечают под капсулой и в почечной лоханке, а также на слизистой желудка и тонкого отдела кишечника.
Для лабораторной диагностики направляют кусочки селезенки, почки, печень, лимфоузлы, взятые от вынужденно убитых в агональном состоянии свиней, у которых в течение 4…5 дней была повышена температура тела. Лабораторная диагностика включает в себя методы иммунофлюоресценции, РСК, РН и биопробу. Иммунофлюоресцентным методом (прямым и непрямым) обнаруживают вирус чумы в мазках-отпечатках, замороженных срезах или в культуре клеток почек эмбриона поросят. Флюоресценцию считают положительной при обнаружении ярких, зеленовато-светящихся округлых клеток.
Биопробу применяют в сомнительных случаях, чтобы подтвердить диагноз, и только с разрешения вышестоящих ветеринарных органов. 10%-й суспензией из органов вынужденно убитых животных заражают внутримышечно 3 неиммунных и 3 иммунизированных против чумы подсвинков в дозе 10 мл. За подопытными животными наблюдают в течение 21 дня. Биопробу считают положительной, если все неиммунные подсвинки заболели и пали, а иммунные остались здоровыми.
При дифференциальной диагностике следует исключить африканскую чуму свиней, трансмиссивный гастроэнтерит, дизентерию, сальмонеллез, пастереллез, рожу, а также отравления.
Африканскую чуму от классической отличить весьма трудно. При африканской чуме в большей степени выражены контагиозность и геморрагический диатез.
Трансмиссивный гастроэнтерит характеризуется 100%-й летальностью поросят-сосунов в возрасте до 1О…14дней.
Дизентерия поражает свиней в возрасте 6…8 мес, среди поросят первых дней жизни болезнь наблюдают редко; ведущий симптом — понос, фекалии темного цвета.
Сальмонеллезом болеют чаше поросята в послеотъемном периоде. Встречается, как правило, в холодное время года и в хозяйствах с низкой ветеринарно-санитарной культурой. Сопровождается высокой температурой тела —до 41…42°С, посинением кончиков ушей и темно-красным окрашиванием кожи в области груди и живота.
Пастереллез широко не распространяется, его наблюдают при плохих условиях содержания.
Рожей свиньи болеют в возрасте от 3 до 12 мес. Болезнь чаще регистрируют в жаркое время года.
Отравления возникают в результате скармливания недоброкачественного корма, пораженного плесневыми грибами или содержащего примесь ядовитых веществ. Они характеризуются острым течением с симптомами гастроэнтерита или гастроэнтероколита.
Профилактические и оздоровительные мероприятия. В системе профилактических мероприятий важное место занимает правильный ветеринарно-санитарный и зоогигиенический режим содержания свиней, однако основной мерой предупреждения заболевания остается охрана хозяйств от заноса возбудителя инфекции.
Очень часто возбудитель чумы заносится в благополучные хозяйства вирусоносителями, а также с пищевыми отходами мясокомбинатов и столовых. Увеличение численности диких кабанов обусловливает активизацию эпизоотического процесса и способствует формированию активных природных резервуаров болезни, что ведет к постоянному риску возникновения новых эпизоотических очагов. Радикальную защиту свиноферм от заноса возбудителя чумы строят в двух направлениях: 1) создают нормальные зоогигиенические условия содержания и кормления (используют боенские отходы мясокомбинатов, столовых и других предприятий только после термической обработки в течение 1 ч), систему общепрофилактических мер (карантин вновь приобретенных свиней и поросят); 2) постоянно поддерживают невосприимчивость свиного поголовья с помощью иммунизации.
С профилактической целью свиней иммунизируют:
При непосредственной угрозе заноса вируса чумы в благополучное хозяйство;
В хозяйствах, комплектующих свинофермы сборным поголовьем, а также использующих в корм свиньям пищевые и боенские отходы;
В хозяйствах, расположенных в непосредственной близости от мясокомбинатов, а также от границ с государствами, неблагополучными по чуме свиней;
В хозяйствах, расположенных в зоне, где есть или были отмечены в течение последних трех лет случаи заболевания чумой диких свиней;
В хозяйствах граждан тех населенных пунктов, на территории которых размещены общественные свинофермы, где поголовье иммунизируют против чумы.
Для иммунизации применяют: сухую лапинизированную вирусвакцину (АСВ) из штамма К, сухую культуральную вирусвак-цину ЛК-ВНИИВВиМ, сухую культуральную вирусвакцину из штамма К (ВГНКИ), сухую вирусвакцину (ЛК-ВНИИВВиМ ВГНКИ, АСВ) из штамма К.
При угрозе заноса возбудителя инфекции в хозяйства, где свиней не вакцинировали против чумы, прививают все поголовье, начиная с поросят однодневного возраста.
Вакцинированных свиней разрешается сдавать на убой независимо от сроков иммунизации и передавать в другие хозяйства через 1О…12дней после вакцинации.
В случае возникновения чумы свиней главный ветеринарный врач района в суточный срок обязан представить главе администрации соответствующие документы для наложения карантина на неблагополучный пункт с определением границ угрожаемой зоны и план мероприятий по ликвидации заболевания.
При ликвидации чумы необходимо учитывать производственное направление хозяйства.
В откормочных подсобных хозяйствах все поголовье неблагополучных свинарников целесообразно направить на убой. В последующем комплектовать хозяйство только животными, вакцинированными против чумы.
В репродукторных племенных хозяйствах убой всего поголовья неблагополучной фермы нецелесообразен. Животных осматривают (с термометрией) и направляют на убой всех клинически больных, подозрительных по заболеванию, отстающих в росте, а также с легочными и желудочно-кишечными патологиями. Всех остальных свиней хозяйства вакцинируют. Вакцинированное поголовье не используют для воспроизводства и по мере откорма сдают на убой.
При убое шкуры не снимают, а опаливают. Мясо используют после проварки, а внутренние органы, кровь, полученные от убоя, уничтожают. Трупы свиней, павших от чумы, сжигают.
Карантин снимают через 40 дней после ликвидации болезни. Ограничения сохраняют, в частности запрещают вывозить оставшихся свиней за пределы неблагополучного хозяйства (кроме вы-
Воза на мясокомбинат). По завершении откорма всех свиней сдают на мясокомбинат и после комплекса закрепительных мероприятий и заключительной дезинфекции снимают ограничения.
ЗАДАНИЕ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
Решить эпизоотологическую задачу.
Свиноферма на 2000 свиней, из которых на откорме 1500 животных. Свиньи размещены в шести типовых свинарниках, расположенных друг от друга на расстоянии от 30 до 50 м. Для откормочного поголовья отведена отдельная кормокухня. Основные корма в хозяйстве собственного производства. Свиноферма ряд лет была благополучной по острым инфекционным болезням. Животных вакцинировали только против рожи.
В конце мая в корм свиньям начали давать пищевые отходы из столовых близлежащего города после термической обработки, которая была с перебоями и не всегда качественной. Утром свинарка заметила, что в откормочной группе 7 свиней не поднялись при утреннем кормлении. Ветеринарный фельдшер измерил у больных температуру: она была в пределах 41…41,5 °С. Больных изолировали, ввели антибиотики с противорожистой сывороткой в лечебных дозах. К вечеру 3 животных пали. На следующее утро в группе откорма было выявлено еще 20 больных.
Разработать план мероприятий по оздоровлению хозяйства согласно поставленному диагнозу.
Возбудитель чумы – Yersinia pestis относится к высокопатогенным микроорганизмам (1 группы патогенности). Взятие, доставка материала при подозрении на чуму и работа с ним производятся в специализированных лабораториях с соблюдением особых правил предосторожности (в противочумном костюме, с применением специальных средств и устройств, предотвращающих попадание микроорганизма на кожу, слизистые оболочки и в дыхательные пути медицинского персонала, а также на различные объекты внешней среды).
Лица, контактировавшие с материалом, подозрительным на содержание возбудителя чумы, подвергаются полной санитарной обработке.
Принципы микробиологической диагностики чумы отражены в схеме 4.
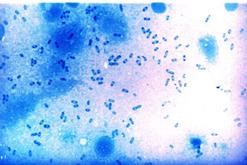
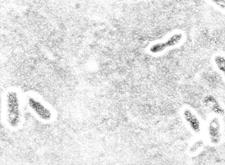
Бактериоскопический метод. Мазки, приготовленные из исследуемого материала, фиксируют в смеси Никифорова, окрашивают по Граму и метиленовым синим. С целью экспресс-диагностики мазки обрабатывают также меченой люминесцирующей сывороткой к Y. pestis (прямой ИФМ). Предварительный положительный ответ выдается в случае обнаружения в мазках биполярно окрашенных грамотрицательных овоидных бактерий, окруженных нежной капсулой (рис.7), дающих специфическое свечение в РИФ.
В качестве других методов экспресс-диагностики чумы применяют РНГА с иммуноглобулиновым чумным диагностикумом, ИФА для индикации антигенов возбудителя.
Методы ускоренной и экспресс-диагностики дают возможность дать предварительный ответ через 4 ч от начала исследования, окончательный - через 18-20 ч.
Схема 4. Микробиологическая диагностика чумы
| |
|
|
а б
Рис. 7. Возбудитель чумы(Yersinia pestis). а - чистая культура, окраска метиленовым синим. Палочки овоидной формы, окрашенные биполярно.х 630. б– мазок из материала от больного, окраска по Граму. Грамотрицательные, биполярно окрашенные, капсулообразующие палочки овоидной формы. х1350
Типичные колонии пересевают на скошенный МПА, чистую культуру чумных бактерий идентифицируют по морфологическим, культуральным, ферментативным, антигенным свойствам (РА с использованием диагностических сывороток против высокоспецифичного капсульного и соматического антигенов), фаголизабельности, определяют ее чувствительность к антибиотикам. Возбудитель чумы восстанавливает нитраты в нитриты, ферментирует глюкозу, ксилозу, маннит с образованием кислоты (без газа). В отличие от многих других представителей семейства энтеробактерий имеет более низкий температурный оптимум роста и физиологической активности - 28 °С. В процессе идентификации возбудитель чумы необходимо дифференцировать с другими иерсиниями (табл. 6).
Биологическое исследование. Заражают морских свинок или мышей подкожно, внутрибрюшинно или накожно, материалом от трупов – методом скарификации.
Животные погибают на 2—7-е сутки. Одно из зараженных животных умерщвляют на 2—3-й день с целью выделения культуры иерсиний из крови и внутренних органов. В мазках из внутренних органов, крови, экссудата погибших животных обнаруживают большое количество грамотрицательных, биполярно окрашенных бактерий. После исследования трупы животных погружают в 5% лизол, а затем сжигают.
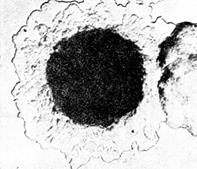
Рис. 8. Колонии возбудителя чумы(Yersinia pestis). х56
Таблица 6. Биологические свойства иерсиний
| Свойства | Y. pestis | Y. pseudotuberculosis | Y. enterocolitica |
| Подвижность при: 25 0 С 28-37 0 С | - - | + - | + - |
| Ферментация: рамнозы раффинозы инозита мочевины сахарозы | - - - - - | + + - + - | - - + + + |
| уреаза орнитиндекарбоксилаза | - - | - - | + - |
| Фракция 1 | + | - | - |
| Мышиный токсин | + | - | - |
| Пестицин 1 | + | - | - |
| Плазмокоагулаза | + | - | - |
| Фибринолизин | + | - | - |
| Чувствительность к чумному фагу | + | - | - |
| Вирулентная форма колоний | R | S | S |
Серологическое исследование проводится с целью ретроспективной диагностики чумы. Ставят РНГА с эритроцитами, на которых адсорбирован капсульный антиген возбудителя чумы, реакцию нейтрализации антигена (РНАг), ИФА и непрямую РИФ. Диагностический титр 1:40 и выше.
Генодиагностика. Разработана ПЦР для экспресс-диагностики чумы.
Для лабораторной диагностики чумы используют бактериоскопический, бактериологический, биологический, серологические и молекулярно-генетические методы.
Диагноз чумы у человека ставится на основании выявления у него возбудителя – выделение и идентификация культуры, обнаружения специфического для чумного микроба антигена FI и специфических антител к антигену FI в сыворотках больных и переболевших.
В качестве экспресс-методов используют иммунофлюоресцентный анализ (обнаружение микроба с помощью флюоресцирующих иммуноглобулинов), ПЦР (обнаружение микроба по наличию искомого участка ДНК в результате его многократного копирования), иммуносуспензионные методы – система 2-3 компонентных реакций с эритроцитарными диагностикумами или иммуноферментный анализ для обнаружения специфических антигенов чумного микроба. С этой же целью применяют и другие варианты иммуносуспензионных методов: дот-иммуноферментный анализ, радиоиммунный анализ. Все экспресс-методы выполняют после обеззараживания материала.
Обязательному лабораторному исследованию подлежит материал:
- от больных людей с симптомами болезни, сходными с клиническими проявлениями всех форм чумы;
- лиц, контактировавших с больными легочной чумой;
- лиц, участвовавших (без защитной одежды) во вскрытии трупов людей и верблюдов, погибших от чумы;
- лиц, участвовавших в прирезке и разделке туши больного чумой верблюда и других животных, обработке мяса в процессе приготовления пищи, употреблявших в пищу мясо больных чумой животных;
- лиц, совершивших аварию с разбрызгиванием заразного материала при работе с возбудителем чумы.
Материал от больных, как правило, целесообразно брать сразу при поступлении в лечебное учреждение и спустя 3 дня после окончания специфического лечения антибиотиками с интервалами между очередными исследованиями 24 ч до получения трех отрицательных результатов. Материал от лиц, контактировавших с больными или контаминированными объектами – при поступлении в изолятор и по окончании профилактического лечения, перед выпиской.
Исследованию подлежит: при легочной форме чумы – мокрота, при её отсутствии – мазок из зева, кровь из вены, моча; при септической форме – кровь, моча; при бубонной форме – пунктат бубона, кровь, моча; при кожной форме – отделяемое язвы, кровь, моча; при кишечной форме – кал, кровь, моча; при менингиальных явлениях – спинномозговая жидкость.
У лиц, контактировавших с больным легочной формой чумы, а также в других случаях, если есть подозрение, что заражение произошло аэрогенным путем, исследуют мазок из зева. В остальных случаях у контактных исследования не проводят.
Забор материала на исследование у больных с подозрением на чуму следует, как правило, проводить в условиях стационара до начала специфического лечения обученным квалифицированным медицинским персоналом под наблюдением специалиста противочумного учреждения или специалиста по особо опасным инфекциям ЦГиЭ субъекта Российской Федерации. В случае невозможности забрать материал в первые 2 ч после возникновения подозрения, лечение начинают по клиническим показаниям до забора материала.
Забор материала у лиц, контактировавших с больными чумой и совершивших аварию, производят в изоляторе до начала профилактического лечения.
Исследование материала проводят специалисты территориальных противочумных учреждений на своей базе, а также на базе лабораторий отделов особо опасных инфекций ФГУЗ ЦГиЭ субъекта Российской Федерации, если они соответствуют требованиям действующих "Санитарных правил безопасности работы с микроорганизмами I-II групп патогенности". Специалисты отделов особо опасных инфекций проводят исследование обеззараженного материала экспресс-методами. Ведущим методом является люминесцентно-серологический. Определение антигена у больного возможно только при осложненной клинике в спинномозговой жидкости, в пунктате бубона – при тяжелом течении болезни, в моче – при всех формах болезни, начиная с 3-4 дня заболевания в низких титрах.
Методы забора материала – в приложении 8.
Запрещается давать окончательный (отрицательный или положительный) ответ на основании результатов экспресс-методов.
Исследование материала от больного чумой.
- приготовление мазков, окраска фиксированных мазков анилиновыми красителями, чумными флюоресцирующими иммуноглобулинами;
- полимеразная цепная реакция;
- посев на жидкие и плотные питательные среды со стимуляторами роста чумного микроба (кровь, моча, спинномозговая жидкость, пунктат бубона);
- посев на плотные питательные среды со стимулятором роста чумного микроба и ингибиторами посторонней флоры (мокрота, мазок из зева, субстрат из вскрывшегося бубона, отделяемое язвы, моча, испражнения);
- проба с диагностическими бактериофагами нативного материала на соответствующей плотной среде;
- проба на чувствительность к антибиотикам с нативным материалом на плотной среде методом дисков;
- поиск антигена FI иммуносуспензионными методами: реакция непрямой гемагглютинации, реакция нейтрализации антител, иммуноферментный анализ, дот-иммуноферментный анализ, радиоиммунный анализ (моча, спинномозговая жидкость, пунктат бубона); параллельно в качестве контроля ставят те же реакции с диагностикумами на другие инфекции (туляремия, бруцеллёз, холера и др.);
- заражение лабораторных животных (морские свинки, белые мыши) внутрибрюшинно и подкожно (кровь, пунктат бубона, спинномозговая жидкость), подкожно и накожно (мокрота, мазок из зева, вскрывшийся бубон, отделяемое язвы, моча, испражнения).
II этап (2-5 ч от начала исследования):
- выдача предварительного положительного ответа на основании наличия в мазках биополярно окрашенных грамотрицательных овоидных палочек, их специфического свечения при окраске мазка флюоресцирующими чумными иммуноглобулинами, положительной ПЦР, положительных иммуносуспензионных реакций при отрицательных контролях.
III этап (24-48 ч):
- выдача подтверждения предварительного положительного ответа на основании наличия характерного роста на жидких и плотных питательных средах, наличия в мазках из этих сред грамотрицательных овоидных палочек с биполярным окрашиванием, положительной пробой с бактериофагами (лизис культуры чумными бактериофагами Покровской и Л-413С).
Высев культуры для дальнейшей идентификации на питательный агар и агар с содержанием дефибринированной крови (5 %) для определения продукции FI после инкубации при 37° С. Одновременно выдача предварительного ответа о чувствительности выделенной культуры к антибиотикам. Посев культуры на среды Гисса с рамнозой, глицерином, сахарозой, арабинозой, ЦДС или среду Ленской для определения уреазной активности (после накопления чистой культуры).
IV этап (3-7-е сутки):
- выдача окончательного положительного ответа на основании выделения чистой культуры чумного микроба из посевов нативного материала, его идентификации по морфологическим, культуральным, биохимическим признакам, чувствительности к диагностическим бактериофагам, наличию специфических плазмид, а также на основании подтверждения диагноза выделением идентичных культур от павших или забитых лабораторных животных.
V этап (5-8-е сутки):
- выдача отрицательного ответа на основании отсутствия специфического роста на питательных средах при посеве нативного материала и органов забитых биопробных животных, отрицательной ПЦР, отрицательных иммуносуспензионных реакций с нативным материалом и органами забитых или павших биологических проб, отсутствия патологоанатомических изменений у последних, отсутствия в парных сыворотках больного специфических антител к чумному микробу.
Исследование материала от лиц, контактировавших с больными легочной формой чумы, а также лиц, присутствовавших при аварии с разбрызгиванием заразного материала.
Исследуемый материал – мазок из зева.
- приготовление мазков, окраска анилиновыми красителями, флюоресцирующими чумными иммуноглобулинами;
- полимеразная цепная реакция;
- посев на плотные селективные среды;
- заражение лабораторных животных подкожно и накожно.
- выдача предварительного положительного ответа на основании обнаружения специфически светящихся клеток в люминесцентном микроскопе, положительной ПЦР.
- выдача подтверждения предварительного положительного ответа на основании наличия характерных по морфологии колоний в посевах на плотной среде;
- пересев колоний на питательный слабощелочной агар, на селективный агар и на агар с кровью для дальнейшей идентификации (последний посев ставят в термостат с 37° С для последующего определения F1);
- при достаточном количестве колоний постановка пробы на чувствительность с диагностическими бактериофагами на плотной среде и пробы на чувствительность к антибиотикам методом дисков.
IV этап (3-4-е сутки):
- выдача положительного ответа на основании выделения типичной по морфологии культуры, лизирующейся диагностическими бактериофагами;
- положительных иммуносуспензионных реакций на наличие антигена F1;
- дальнейшая идентификация выделенной культуры.
V этап (5-8-е сутки):
- вскрытие забитых биопроб, их исследование бактериологически и серологически;
- выдача окончательного положительного ответа на основании выделения и идентификации культуры чумного микроба, типичной по морфологическим, культуральным, биохимическим свойствам, фаголизабельности, наличию специфических плазмид, подтверждения диагноза выделением идентичной культуры от павших или забитых биопробных животных (схема идентификации выделенных культур – в приложении 9;
- выдача отрицательного ответа на основании отсутствия специфически светящихся клеток в мазках, окрашенных люминесцирующими чумными иммуноглобулинами, отрицательной ПЦР, отсутствия роста характерных по морфологии колоний на плотной среде, отсутствия характерных для чумы изменений в органах у биопробных животных и отсутствия специфического роста на плотной среде из посевов отпечатков их органов.
Исследование материала от трупа человека, погибшего от чумы.
Исследованию подлежат: кусочки паренхиматозных органов, легких из мест, где есть характерные для чумы изменения, лимфатические узлы, как регионарные к первичному аффекту, так и другие, увеличенные и имеющие изменения, сгустки крови из сердца и крупных сосудов, сыворотка крови, полученная из сгустков при их сокращении, участки любой ткани, имеющие изменения септического характера, спинномозговая жидкость, моча, содержимое кишечника, в случае наличия признаков загнивания трупа исследуют спинной и головной мозг.
Исследования ведут по этапам, как исследование материала от больного чумой человека.
Положительный предварительный диагноз может быть поставлен на любом этапе, так как при гибели от чумы все органы и ткани содержат большое количество возбудителя и его антигенов, в том числе FI. Поэтому весьма вероятен первый положительный ответ уже через 2 ч после исследования на основании наличия грамотрицательных биполярно окрашенных палочек, специфически светящихся в люминесцентном микроскопе при обработке мазков-отпечатков флюоресцирующим чумным иммуноглобулином, положительной ПЦР, высокого титра антигена FI в тканях и органах, наличия противочумных антител в сыворотке.
Высокая вероятность подтверждения диагноза через 24-48 ч после начала исследования на основании обнаружения типичных по морфологии колоний чумного микроба, положительной пробы с бактериофагом, которую следует ставить на селективном агаре во избежании зарастания пятна лизиса культуры посторонней флорой и отрицательного ответа в 2-5 часов исследований
Окончательный положительный ответ может быть поставлен через 48 ч – 6 сут. по результатам идентификации культуры чумного микроба и подтверждения ее выделением идентичной культуры от биопробного животного.
Окончательный отрицательный диагноз дают на 5-8 сутки, как и при исследовании материала от больного.
Запрещается выдавать отрицательный ответ по результатам ускоренного исследования и на основании результатов экспресс-методов.
Дата добавления: 2015-09-15 ; просмотров: 3853 . Нарушение авторских прав
Лабораторные исследования на чуму проводят специализированные лаборатории, имеющие лицензию на данный вид деятельности.
Объектами для исследования от людей (больных, контактных) и трупов являются:
- отделяемое язвы или пунктат из карбункула, везикулы (кожная форма);
- содержимое бубона (бубонная форма);
- мокрота, слизь из зева и мазок с миндалин (легочная форма);
-испражнения (кишечная форма);
- кровь (все формы);
- в зависимости от поражений отдельных органов и систем - моча при наличии в ней крови, спинномозговая жидкость - при менингиальных явлениях (табл. 25).
Способы забора материала
| Материал | Способы забора |
| Пунктат из бубона | Забирают стерильно шприцем емкостью не менее 5 мл. Пораженный участок и окружающую его ткань обрабатывают 70 °-ным этиловым спиртом, затем 5 %-ным раствором йода и вновь спиртом. Иглу осторожно вводят с таким расчетом, чтобы ее острие достигло центральной части бубона. Затем, оттянув до отказа поршень, медленно вытягивают иглу. После извлечения иглы из бубона через нее набирают в шприц 0,5 мл стерильного питательного бульона, содержимое выливают в стерильную пробирку и закрывают резиновой пробкой. |
| Содержимое везикулы (пустулы) | Иглу вводят у края образования и медленно продвигают в центр. |
| Пунктат из язвы и карбункула | Пунктируют плотный край. |
| Вскрывшийся бубон | Забирают материал отдельно из периферической плотной части и отделяемое свища. |
| Слизь из зева | Забирают стерильным ватным тампоном. |
| Мокрота | Забирают в стерильную широкогорлую стеклянную банку с притертой пробкой или крышкой. |
| Испражнения | То же. |
| Моча | То же. |
| Кровь | 10 мл крови берут стерильным шприцем и 5 мл засевают у постели больного во флакон с 50 мл бульона и на чашки с плотной питательной средой. |
| От трупа кусочки пораженных органов | Забирают в стерильные широкогорлые стеклянные банки с притертыми пробками или крышками. |
Посевы взятого материала желательно проводить у постели больного. Время от момента взятия материала и до начала его исследования не должно превышать 5-6 ч, если нет условий для хранения его на холоде. С целью сохранения материала можно использовать транспортную среду Кери-Блэра, консерванты Берлина и Башевой, жидкость Брокэ.
Из доставленного материала готовят мазки с окраской по Граму и метиленовым синим. При обнаружении первых случаев заболеваний подозрительных на чуму или трупа человека готовят не менее 6-8 мазков (один окрашивают метиленовым синим, второй – по Граму, третий – чумной люминесцирующей сывороткой, остальные оставляют неокрашенными для повторных исследований). Наличие типичных для заболевания чумой клинических проявлений и обнаружение в мазках биполярных грамотрицательных палочек овоидной формы дает право поставить предварительный диагноз - подозрение на чуму. Выявление специфически светящихся микробов, окрашенных чумной люминесцирующей сывороткой, подтверждает предварительный ответ.
Незагрязненный посторонней микрофлорой материал (пунктат из бубона, карбункула, содержимое пустулы, везикулы, кровь и т.д.) засевают на плотные и жидкие питательные среды. Материал, содержащий постороннюю микрофлору (мокрота, слизь из зева, вскрывшийся бубон, содержимое язвы), засевают на плотные среды с ингибитором посторонней микрофлоры. Пунктат из бубона, везикулы наносят бактериологической петлей или пастеровской пипеткой на чашку агара и распределяют его шпателем или петлей частыми штрихами, оставшийся материал вносят в пробирку с бульоном.
Жидкую мокроту (особое внимание уделяют участкам с прожилками крови) петлей (2-3 петли) или пастеровской пипеткой с широким капилляром наносят на поверхность агара, растирают шпателем или частыми штрихами петлей. Затем без обжигания переносят на вторую и третью чашки плотного агара. Если мокрота вязкая, то ее комочек захватывают стерильным пинцетом, переносят на поверхность агара и тщательно растирают шпателем или частым штрихом бактериологической петлей сначала в первой, затем во второй чашке.
Слизь из зева засевают ватным тампоном, остатки материала промывают в 1мл жидкой питательной среды и используют для заражения биопробных животных. Сгусток крови (если посев не сделан у постели больного) из пробирки осторожно переносят в чашку Петри, разрушают его целостность стерильными препаровальными иглами, затем жидкую часть крови набирают в пипетку, засевают во флаконы с бульоном и 0,1 мл - на агаровую пластину, рассевая частым штрихом. Посевы инкубируют в термостате при 28 °С, а для обнаружения фракции FI - при 37 °С.
В первый день исследования с нативным материалом целесообразно ставить пробы с чумным бактериофагом ускоренным методом (приложение) и на чувствительность к антибактериальным препаратам дискодиффузионным методом (прямым посевом нативного материала сплошным газоном на чашку Петри). Это позволит при значительном числе клеток возбудителя чумы в материале получить результат чувствительности к антибиотикам через 20-24 ч с момента исследования, а не через 36-40 ч, как при постановке пробы на чувствительность к антибиотикам стандартизированным методом. Для выбора антибиотиков необходимо обратиться к схемам применения антибактериальных препаратов при экстренной профилактике чумы.
Биологическая проба является обязательной, так как не только повышает вероятность выделения культуры, но и необходима для ее идентификации. Ставят на морских свинках и/или белых мышах. Метод введения исследуемого материала зависит от характера материала. Незагрязненный материал вводят животным подкожно (0,5 мл морским свинкам и 0,2 мл белым мышам) или для ускорения гибели биопробного животного - внутрибрюшинно (0,5-1,0 мл морским свинкам и 0,3-0,5 мл белым мышам). Мокротой, слизью из зева, гноем из открытого абсцесса заражают накожным методом. В зависимости от метода введения, животное погибает на 3-9-й день. Ускорить постановку диагноза позволяет введение части биопробных животных (1 морской свинке и 1 белой мыши) гидрокортизона за 2 ч до заражения в дозе 5 мг (в 0,5 мл 0,85 %-ного хлористого натрия) под кожу области бедра. Животных с пониженной резистентностью вскрывают на первые сутки - одну белую мышь, на третьи сутки – морскую свинку. Остальных вскрывают на шестые сутки. Чувствительность биопробных животных также можно повысить, если исследуемый материал ввести с желтком куриного яйца. У животных, погибших от чумы в результате подкожного или накожного заражения, в месте введения наблюдают полнокровие, серозно-геморрагическое пропитывание тканей, нагноение, некроз. Лимфатические узлы увеличены, гиперемированы, часто инфильтрированы геморрагическим экссудатом, могут быть плотными или размягченными, окружающие ткани пропитаны студневидной серозно-геморрагической или гнойно-геморрагической жидкостью. В тканях узла могут быть очаги некроза или нагноения. В селезенке, печени, легких наблюдаются единичные или множественные узелки сероватого цвета. Узелки могут быть точечными или достигать величины булавочной головки. Вокруг некоторых из них наблюдаются венчики гиперемии. В легких могут быть очаги кровоизлияния и участки уплотнения темно-красного или серовато-красного цвета. Селезенка, печень, надпочечники увеличены, дряблой консистенции, полнокровны, с участками некроза. Иногда в брюшной полости имеется вязкий экссудат. При накожном заражении на месте введения часто наблюдаются мелкие везикулы, окруженные зоной гиперемии, или язвочки. При внутрибрюшинном заражении развивается экссудативный перитонит с образованием фибринозно-гнойных пленок на капсуле селезенки и печени.
От погибшего животного (паренхиматозных органов, лимфатических узлов и крови) делают мазки-отпечатки, производят посевы на среды, готовят суспензию для заражения второго биопробного животного и исследования на наличие фракции I чумного микроба.
Выживших животных умерщвляют на 7 сутки и производят патологоанатомическое, бактериологическое и серологическое исследования.
Для обнаружения в нативном материале фракции I возбудителя чумы ставят реакцию пассивной гемагглютинации (РПГА) с иммуноглобулиновым и реакцию нейтрализации антител (РНАт) с антигенным эритроцитарными диагностикумами или иммунофлуоресцентный анализ с использованием чумной люминесцирующей сыворотки.
Через 18-24 ч. Изучают рост на плотной и жидкой питательных средах. При наличии типичного роста в бульоне делают мазки: окрашивают по Граму и метиленовым синим. С плотной питательной среды отбирают типичные колонии с целью выделения чистой культуры и ее идентификации. Учитывают результаты постановки пробы с чумным бактериофагом ускоренным методом. При сомнительном результате на 2-3 подозрительные колонии наносят чумной бактериофаг. После инкубации в термостате в течение 10-12 ч проводят учет результатов пробы с чумным бактериофагом. Лизис колоний под действием чумного бактериофага подтверждает положительный ответ.
Учитывают результаты чувствительности к антибиотикам диско-диффузионным методом.
Через 36-48 ч. Выделенную культуру идентифицируют на основании следующих признаков:
1) характерная морфология микроба (микропрепараты из нативного материала и чистых культур);
2) характерная морфология роста на плотной и жидкой питательных средах;
3) чувствительность к чумному бактериофагу;
4) специфическое свечение при люминесцентной микроскопии чистой культуры;
5) наличие специфического для возбудителя чумы антигена фракции FI, выявленного в РПГА или РНАт;
6) ферментативная активность (глицерин, мочевина, рамноза, сахароза, глюкоза и др.);
7) одновременно с идентификацией проводят определение чувствительности к антибиотикам стандартизованным дискодиффузионным методом и методом серийных разведений в агаре или бульоне.
Через 60-72 чпроизводят учет результатов идентификации по следующим тестам:
- чувствительность к чумному бактериофагу и антибиотикам;
- наличие FI, выявленной методом флуоресцирующих антител и в РПГА-РНАт.
Для дальнейшей дифференциации выделенной культуры ставят тест на наличие пестицин-фибринолизин-плазмокоагулазной активности и ПЦР для детекции плазмид pFra и pPst.
Диагноз чумы у человека ставится на основании выделения у него культуры возбудителя чумы и ее идентификации, а так же при обнаружении специфического для чумного микроба антигена FI и специфических антител к антигену FI в сыворотках больных и переболевших.
Занятие 13.
Последнее изменение этой страницы: 2016-12-30; Нарушение авторского права страницы
Читайте также:


