Питательные среды для культивирования бруцеллеза
Глава 29. Возбудители бруцеллеза
В 1886 г. Д. Брюс в селезенке больного, погибшего от мальтийской лихорадки, обнаружил маленькую коккобактерию, которую выделил в чистой культуре и назвал Micrococcus.
В 1896 г. Б. Банг из околоплодной жидкости при аборте коров также выделил коккобактерии. В 1914 г. Ж. Траум выделил подобную палочку от больных свиней. А в 1916 г. Ивенс, изучив все выделенные микроорганизмы, определила их схожесть и в честь Брюса они были названы бруцеллами. В дальнейшем (1953, 1957, 1966) были открыты и другие виды бруцелл. Все они объединены в род Brucella.
В настоящее время бруцеллы подразделяют на виды по признаку их основного хозяина: В. melitensis - болеет мелкий рогатый скот (овцы, козы); В. abortus - болеет крупный рогатый скот; В. suis - болеют свиньи и т. д.
Каждый вид бруцелл подразделяют на биовары: В. melitensis включает 3 биовара; В. abortus - 9 биоваров; В. suis - 5 биоваров. Наиболее патогенным для человека является В. melitensis. B. abortus редко вызывают клиническое проявление заболевания у человека.
Морфология. Возбудители бруцеллеза мелкие 0,6-0,8 × 0,3-0,5 мкм бактерии палочковидной или овоидной формы. Неподвижны. Спор не имеют. Образуют нежную капсулу. Грамотрицательны. В мазке располагаются беспорядочно.
Культивирование. Бруцеллы - аэробы. Прихотливы к питательным средам. Характеризуются замедленным ростом (2-3 нед). Выращивают их на специальных питательных средах: сывороточно-декстрозном агаре, на агаре из картофельного настоя с сывороткой и кровяным агаром (5% овечьей крови), среде "Д", печеночном агаре МПА и МПБ. Растут они при температуре 37° С и рН 6,8-7,2. Некоторые штаммы требуют для роста 5-10% СО2, особенно при первоначальном выделении. На плотных питательных средах вырастают нежные, мелкие, бесцветные, выпуклые с перламутровым блеском колонии в S-форме. Под влиянием некоторых факторов они могут диссоциировать в R-форму. Под действием антибиотиков у них возникают L-формы. В жидких питательных средах бруцеллы дают равномерную муть. Бруцеллы можно культивировать в желточном мешке куриного эмбриона.
Дифференцируют виды бруцелл на основании их способности образовывать сероводород и расти на средах с красителями - основным фуксином и тионином (табл. 44).
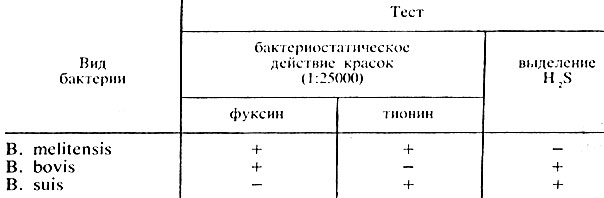
Таблица 44. Биологические свойства бруцелл
Ферментативные свойства. Бруцеллы расщепляют D-рибозу, D-галактозу, аланин, аспарагин. Некоторые штаммы гидролизуют аминокислоты с образованием аммиака.
Бруцеллы образуют гиалуронидазу, каталазу, пероксидазу, липазу, фосфатазу и др. Бруцеллы обладают выраженными инвазивными и агрессивными свойствами.
Токсинообразование. Патогенное действие бруцелл определяется, по-видимому, наличием эндотоксина. Кроме того, они обладают аллергенными свойствами.
Антигенная структура. Бруцеллы содержат два соматических антигена А и М. Эти антигены являются видоспецифичными. Они всегда входят в состав микробной клетки, но в разных соотношениях. У В. melitensis преобладает антиген М, у В. abortus и В. suis - антиген А. Кроме того, у них выявлен термолабильный Vi-антиген.
Устойчивость к факторам окружающей среды. При 100° С бруцеллы погибают мгновенно. При температуре 80-85° С - через 5 мин, при 60° С - через 30 мин. К низким температурам они очень устойчивы. Прямые солнечные лучи действуют на них губительно. Во влажной среде бруцеллы сохраняются длительно - 3-4 мес. В молочных продуктах - до 40-45 дней, замороженном мясе - до 5 мес, почве и воде - до 3-5 мес.
Восприимчивость животных. Бруцеллезом болеют в основном сельскохозяйственные животные: мелкий и крупный рогатый скот, свиньи, олени и др. Каждый вид бруцелл поражает определенный вид животного. Но бруцеллы могут мигрировать, т. е. переходить от одного вида животного другому. Например, В. abortus могут поражать мелкий рогатый скот.
Основными признаками заболевания являются: у самок - аборты, у самцов - орхиты. Кроме того, у них бывает поражение суставов, похудание, выпадение шерсти и т. д. Но бруцеллез у животных может протекать в скрытой форме, что способствует распространению инфекции.
Из экспериментальных животных к бруцеллам чувствительны белые мыши и морские свинки. После заражения они абортируют, резко худеют, у них выпадает шерсть. У мышей иногда развивается септицемия.
Источники инфекции. Основным источником заболевания бруцеллезом людей являются мелкий и крупный рогатый скот. Роль человека в передаче бруцеллезной инфекции эпидемиологического значения не имеет.
Пути передачи. Пищевой, контактно-бытовой, воздушно-капельный.
Контактный путь - при работе с животными: в процессе ухода за животными, на предприятиях, перерабатывающих сырье и продукты животного происхождения; при соприкосновении с выделениями больных животных, плодом, в процессе убоя, разделки туши и т. д.
Аэрогенным путем бруцеллы проникают в кожу и неповрежденные слизистые оболочки.
Пищевой путь - употребление зараженных пищевых продуктов. Наиболее опасны молочные продукты - молоко, брынза и т. д.
Патогенез. Попав в организм, бруцеллы по лимфатическим путям проникают в лимфатические узлы, кровь, костный мозг, паренхиматозные органы и локализуются внутри клеток. При обострении процесса бруцеллы из клеток вновь попадают в кровь и возникает рецидив. Заболевание характеризуется воспалением суставов, невралгией и естественными абортами.
Иммунитет - обусловливается клеточными (фагоцитоз) и гуморальными факторами - агглютининами, комплементсвязывающими антителами и др. Иммунитет сочетается с состоянием аллергии. В опытах на морских свинках было показано, что устойчивость к повторному заражению у них сочеталась с положительной реакцией к бруцеллину.
Профилактика. Плановые обследования в животноводческих хозяйствах, на пастбищах, в убойных пунктах, на мясных и молочных комбинатах.
Специфическая профилактика. Вакцинация живой вакциной В. abortus (штамм 19-ВА). Прививки проводят накожным методом однократно, ревакцинируют через 8-12 мес.
Лечение. Антибиотики: левомицетин, эритромицин. Для предупреждения рецидивов используют также бруцеллезный иммуноглобулин.
1. Какие Вы знаете виды бруцелл и какой из них патогенен для человека?
2. На каких средах культивируют бруцеллы и чем характеризуется их рост на средах?
3. С чем связано патогенное действие бруцелл?
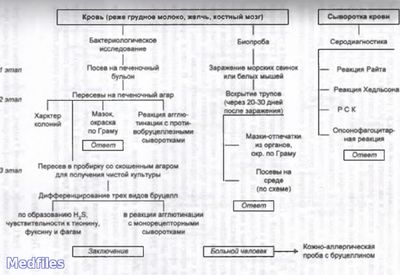
Цель исследования: выявление возбудителя бруцеллеза.
Работу с бруцеллами проводят в строго режимных условиях.
2. Спинномозговая жидкость.
5. Грудное молоко.
6. Секционный материал.

Способы сбора материала

Ход исследования

Ход исследования
1. В каких условиях проводят работу с материалом, полученным от больного бруцеллезом?
2. Какой материал служит для диагностического исследования?
3. Перечислите основные методы исследования.
4. На каких животных ставят биологическую пробу?
Сывороточно-декстрозный агар. Основой этой среды является питательный агар, который готовят следующим образом: к 835 мл дистиллированной воды добавляют 15 г агар-агара, 10 г пептона, 5 г х. ч. хлорида натрия и 165 мл мясной воды. Все ингредиенты вводят в сосуд и подвергают обработке текучим паром в течение часа. Устанавливают рН 7,8. Затем сосуд ставят в автоклав, при 2 атм, температуре 120° С выпадают фосфаты. Среду фильтрют через бумажные фильтры, устанавливают рН 7,4, разливают в мерную посуду и стерилизуют при температуре 116° С в течение 15 мин. Заготовленный таким образом агар по мере надобности расплавляют на водяной бане и охлаждают до 50° С. Затем к нему добавляют нормальную инактивированную (при 56° С 30 мин) лошадиную или бычью сыворотку и раствор декстрозы, простерилизованный путем фильтрации через фильтр Зейтца. Окончательная концентрация сыворотки должна быть 5% и декстразы - 1%.
Кровяной агар. См. главу 7.
Среда "Д": а) бульон "Д" - к 100 мл холодной дистиллированной воды добавляют 2,5 г порошка стандартного бульона "Д", прогревают и тщательно размешивают до полного его растворения; затем бульон фильтруют, разливают в необходимую посуду и стерилизуют при 120° С в течение 20 мин (рН среды 7,1-7,2); б) агар "Д" - к 100 мл холодной дистиллированной воды добавляют 20 г порошка стандартного агара "Д", прогревают при помешивании до полного растворения порошка, не допуская его подгорания, затем фильтруют, разливают в необходимую посуду и стерилизуют при 120° С в течение 20 мин (рН среды 7,2). Среды готовит Институт эпидемиологии и микробиологии имени Н. Ф. Гамалея АМН СССР.
Для выделения и поддержания культур бруцелл используют мясо-пептонный печеночный бульон, печеночно-глюкозо-глицериновый бульон, картофельный агар, мясо-пептонный печеночно-глюкозо-глицериновый агар, печеночно-глюкозо-глицериновый агар, сывороточно-декстрозный агар, эритрит-агар, агар Альбими и другие среды. При выделении бруцелл из загрязненного материала в среды добавляют генцианвиолет 1:100-250 тыс., малахитовый зеленый — 1:500 тыс., кристаллвиолет — 1:100 тыс.
Мясо-пептонный печеночный бульон (МППБ). К 610 мл мясной воды добавляют 305 мл печеночного настоя, 10 г пептона, 5 г натрия хлорида. Кипятят 60 минут, водой доводят объем до первоначального. Фильтруют, разливают в пробирки (колбы), стерилизуют при 110°С 30 минут.
Печеночно-глюкозо-глицериновый агар. К 900 мл печеночного настоя добавляют 9 г пептона, 5 г натрия хлорида, 25 г агар-агара. Варят в автоклаве 60 минут при 100-110°С. Фильтруют, устанавливают рН 7-7,2. Добавляют 20 г глюкозы и 25 мл глицерина. Разливают в пробирки, стерилизуют при 110°С 30 минут.
Печеночно-глюкозо-глицериновый бульон готовят так же, как и предыдущую среду, но агар не добавляют.
Печеночно-сывороточный и печеночно-аминопептидный агар. К 1 л печеночного настоя добавляют 10 г пептона, 5 г натрия хлорида, 20 г агар-агара, 17 мл 10%-ного раствора натрия двууглекислого. Автоклавируют при 115°С 20 минут. Фильтруют, устанавливают рН 7-7,2. Добавляют 10 г глюкозы и 20 мл глицерина. Разливают по сосудам, стерилизуют при 110°С 20 минут. Перед использованием в расплавленную и охлажденную до 45°С среду вносят 10-20% стерильной сыворотки крови крупного рогатого скота или 10-15% аминопептида Среду разливают в пробирки или бактериологические чашки.
Полужидкий печеночно-сывороточный и печеночно-аминопептидный агар. К 500 мл мясной воды добавляют 500 мл печеночного настоя, 10 г пептона, 5 г натрия хлорида и 2 г агар-агара. Кипятят до расплавления агара. Устанавливают рН 7-7,2. Разливают по сосудам и стерилизуют при 115°С 30 минут. Перед использованием в подогретый до 45°С агар добавляют 10% стерильной сыворотки крови крупного рогатого скота или барана или аминопептида.
Сывороточно-декстрозный агар. К 835 мл дистиллированной воды добавляют 20 г агар-агара, 10 г пептона, 5 г натрия хлорида, 165 мл мясной воды. Кипятят до расплавления агара. Фильтруют, устанавливают рН 7,4. Разливают в колбы и стерилизуют 15 минут при 115°С. Перед использованием в расплавленный и охлажденный до 45°С агар вносят 10% стерильной сыворотки крови крупного рогатого скота или лошади, 1% декстрозы.
Картофельный агар. В 1 л дистиллированной воды 15 минут варят 500 г очищенного и мелко нарезанного картофеля. Отвар фильтруют через ватно-марлевый фильтр, доводят объем водой до 1 л. Добавляют 10 г пептона, 5 г натрия хлорида, 25 г агар-агара, кипятят до расплавления агара. Устанавливают рН 7,2. Агар оставляют для застывания; прозрачную верхнюю часть отрезают, расплавляют, фильтруют через ватный фильтр. Корректируют рН до 7,2. Добавляют 10 г глюкозы и 30 мл глицерина. Разливают по колбам или пробиркам. Стерилизуют при 115°С 20 минут. Готовая смесь должна иметь рН 6,8.
Среда Альбими. В 1 л дистиллированной воды растворяют 2 г пептона, 1 г декстрозы, 5 г натрия хлорида, 0,1 г натрия бисульфата. Добавляют 2 мл дрожжевого аутолизата. При изготовлении плотной среды добавляют 2-2,5% промытого агар-агара. Стерилизуют при 115°С 30 минут.
Заменитель среды Альбими. К 1 л дистиллированной воды добавляют 20 г пептона Дифко, 20 мл дрожжевой воды, 5 г натрия хлорида, 20 г промытого агар-агара или агара Дифко. Устанавливают рН 7,3, Нагревают до расплавления агара, фильтруют через ватный фильтр. В горячую среду добавляют 1 г глюкозы и 0,1 г натрия бисульфата. Корректируют рН до 7,2—7,3. Разливают в колбы или пробирки, стерилизуют 20 минут при 110°С.
Для приготовления дрожжевой воды в 1 л дистиллированной воды суспендируют 1 кг пекарских (хлебных) дрожжей, кипятят 5-10 минут, фильтруют через плотный фильтр. Хранят в темном месте под хлороформом не более 2 недель.
Селективные среды для выделения бруцелл из молока и других материалов (рецепты фирмы Oxoid). К расплавленным и охлажденным до 55-60°С агаровым средам (сывороточно-декстрозный или кровяной агары с 5% лошадиной сыворотки и 1% декстрозы) добавляют следующие антибиотики (из расчета на 1 л среды): полимиксин В — 500 ИЕ, бацитрацин – 25 000 ИЕ, циклогексимид — 100 мг, налидиксовая кислота — 5 мг, нистатин — 100 000 ИЕ и ванкомицин — 20 мг. Антибиотики суспендируют в 10 мл метанола. Вносят суспензию в среду и тщательно перемешивают.
Среда с красителями для дифференциации видов бруцелл. В предварительном опыте с использованием эталонных культур бруцелл разных видов определяют необходимую концентрацию красителей в среде, позволяющую дифференцировать виды.
В 20 мл этанола растирают 0,1 г тионина и отдельно — основного фуксина. Доводят объем красок до 100 мл дистиллированной водой. Полученные разведения красителей 1:10 000 добавляют в расплавленный и охлажденный до 45-60°С сывороточно-декстрозный агар, перемешивают и разливают в чашки Петри. Готовят суспензию из 48-часовой агаровой культуры исследуемого штамма бруцелл на 0,8%-ном растворе натрия хлорида концентрацией 10 10 бактериальных клеток в 1 мл. Одну каплю суспензии засевают штрихом на агар с красителем (отдельно с тионином и фуксином). Одновременно эту суспензию засевают на агар без красителя. Инкубируют до появления роста культуры на агаре без красителей. Учитывают результат по наличию роста на агаре с красителями.
Дифференциация S- и R-колоний бруцелл по Уайту-Вильсону. На подсушенный в течение 24 ч агар Альбими в чашке Петри засевают исследуемую культуру бруцелл и инкубируют при 37°С до появления колоний. Затем на колонии наливают водный раствор кристаллвиолета и выдерживают 15 с. Раствор краски сливают в чашку с дезинфицирующим раствором, а колонии рассматривают под лупой (или при малом увеличении микроскопа). Колонии S-формы светлого, а R-формы — фиолетового цвета.
Печеночный настой. К 1л водопроводной воды добавляют 500 г фарша из свежей печени крупного рогатого скота. Настаивают 3 ч при 25-30°С или 6-10 ч при 4°С. Кипятят, помешивая, 1-2 ч, доливают водой до первоначального объема. Осевший фарш удаляют. Настой фильтруют через ватно-марлевый фильтр, разливают в колбы и стерилизуют при 115°С 20 минут.
Мясная вода. К 1л водопроводной воды добавляют 500 г фарша из свежего мяса крупного рогатого скота. Настаивают при 4°С 15-18 ч. Фарш удаляют. Настой кипятят 30-40 минут, доливают водой до первоначального объема. Фильтруют через ватно-марлевый фильтр, разливают в колбы. Стерилизуют при 120°С 20 минут.
Бруцеллез – зоонозное инфекционно-аллергическое заболевание, характеризующееся длительной лихорадкой, поражением опорно-двигательного аппарата, нервной, сердечно-сосудистой, мочеполовой и других систем организма со склонностью к затяжному, хроническому течению.
Виды – наиболее патогенные для человека – В. melitensis, B. abortus, B. suis.
Мелкие кокковидные палочки размерами 0,5-0,7×0,6-1,5 мкм, грамотрицательные, в мазках располагаются беспорядочно, неподвижны, спор не образуют, свежевыделенные штаммы могут образовывать нежную капсулу.
Строгие аэробы. Оптимальные условия культивирования: температура – 37 0 С, рН – 6,8-7,2. Особенностью бруцелл бычьего типа является их потребность в повышенном содержании в атмосфере углекислого газа (5-10% СО 2 ). Характерен медленный рост бруцелл – первые генерации появляются через 1-3 недели и более. При пересеве лабораторных культур рост наблюдается через 1-2 дня. Требовательны к питательным средам: хорошо растут на печеночном, сывороточном или кровяном агаре. В жидкой среде наблюдается рост в виде диффузного помутнения. На плотных питательных средах бруцеллы образуют перламутровые мелкие выпуклые гладкие колонии с нежной зернистостью (S-форы). Возможна диссоциация в R-формы.
Биохимическая активность.
Выражена слабо. Ферментируют глюкозу и арабинозу до кислоты без газа. Восстанавливают нитраты, разлагают белки с образованием Н 2 S, индол не образуют.
Разделение на виды основано на биохимических и культуральных различиях
Рост на средах с красителями
Потребность в СО 2
У бруцелл выявлено до 15 антигенных фракций: родовые и видовые поверхностные антигены.
1. Выделяют два соматических антигена – А и М, причем М-антиген доминирует у В. melitensis, А-антиген преобладает у B. abortus и B. suis.
2. Третий – L(Vi)-антиген – поверхностно расположенный капсульный антиген вирулентности, термолабильный, имеет сходство с Vi-антигеном сальмонелл.
Токсины. Бруцеллы обладают эндотоксином (ЛПС КС), имеющим высокую инвазивную способность.
Ферменты – гиалуронидаза и нейроминидаза.
Структурные и химические компоненты клетки: пили I порядка и белки клеточной стенки (адгезивные свойства), капсула.
Считают, что бруцеллы обладают высокой инвазивностью: могут проникать в организм человека через неповрежденные кожные и слизистые покровы.
Также являются факультативными внутриклеточными паразитами.
Бруцеллы довольно устойчивы во внешней среде:
- В воде и влажной почве – они могут сохраняться до 5 месяцев;
- В молоке – 9 месяцев;
- В сыре – до 1 года;
- Они устойчивы к низким температурам и в замороженном мясе выживают до 5 месяцев.
Чувствительны к повышенной температуре (до 60 0 С – погибают за 30 минут, кипячение – мгновенно), действию дезинфиктантов (3% раствор хлорной извести, 1% хлорамин, 2% формалин убивают их за 5 минут), антибиотикам (стрептомицину, тетрациклину, рифампицину).
Основной резервуар и источник инфекции – больные домашние животные: овцы, козы, свиньи, КРС.
- Фекально-оральный (путь – алиментарный – большую опасность представляет сырое молоко и молочные продукты, не подвергающиеся в процессе приготовления тепловой обработке, например, сыр, брынза);
- Контактный (путь – прямой контактный – при попадании возбудителя на поврежденные кожные или слизистые покровы при уходе за больными животными);
- Аэрогенный (путь – воздушно-пылевой – описан при вдыхании воздушно-пылевой смеси, содержащей инфицированные частицы шерсти, навоза, земли во время уборки помещения).
Для бруцеллеза свойственен выраженный профессиональный характер заболевания!
Инкубационный период – 1-4 недели (может длиться до 2-3месяцев).
Патогенез и клинические особенности.
Бруцеллы проникают в организм человека через слизистые оболочки или кожные покровы, не оставляя никаких изменений в области входных ворот. Лимфогенным путем возбудители заносятся в региональные лимфоузлы и подвергаются незавершенному фагоцитозу. С макрофагами возбудители проникают в кровоток и диссеминируют в печень, селезенку, почки, костный мозг, суставы, эндокард. В пораженных органах образуются очаги некроза, окруженные инфильтратами. Появляются признаки очаговых поражений со стороны опорно-двигательного аппарата, нервной, сердечно-сосудистой, мочеполовой и других систем. Внутри фагоцитов бруцеллы способны формировать L-формы и длительно персистировать в организме. Переход в исходные формы обуславливает рецидив болезни.
Постинфекционный иммунитет – гуморальный (образуются неполные антитела) и клеточный, нестойкий, нестерильный. Формируется ГЗТ.
Бруцеллы могут быть выявлены непосредственно в патологическом материале и объектах внешней среды с помощью прямой или непрямой реакции иммунофлюоресценции.Ее используют также для идентификации выделенной культуры.
Бруцеллы в острую фазу болезни выделяют из крови при посеве на питательный бульон. Кроме того, делают посевы пунктатов костного мозга и лимфатического узла, а также стерильно взятой мочи. Выделенную культуру идентифицируют по типичной морфологии бактерий и колоний, положительной реакции агглютинации на стекле с поливалентной бруцеллезной сывороткой. Для видовой идентификации используют признаки видов и биоваров бруцелл. Серодиагностику проводят в развернутой реакции агглютинации (р. Райта) и пластинчатой реакции агглютинации (р. Хедльсона), реже ставят РНГА, а также р. Кумбса для выявления
Кожно-аллергическую пробу (по Бюрне) применяют для выявления ГЗТ к бруцеллам. Положительная реакция наблюдается как у больных, так и у привитых живой бруцеллезной вакциной
Проводят вакцинацию по эпидпоказаниям живой вакциной из аттенуированного штамма B. abortus.
Специфическое лечение – противобруцеллезный иммуноглобулин, для лечения хронических форм заболевания применяется убитая бруцеллезная вакцина.
Окраска бруцелл по Шуляку-Шин. Мазок фиксируют на пламени, окрашивают 2 минуты карболовым фуксином Циля, разведенным водой 1:5, промывают водой, окрашивают 5 минут 2%-ным водным раствором метиленового синего, промывают водой. Микроскопическая картина: бруцеллы — красные, другие бактерии имеют синий цвет.
Окраска бруцелл по Кюстеру. Препарат фиксируют на пламени, окрашивают 60 секунд щелочным раствором сафранина, промывают водой, обрабатывают 15 секунд 0,05%-ным раствором серной кислоты, тщательно промывают водой, окрашивают 15-20 секунд 3%-ным водным раствором метиленового синего. Микроскопическая картина: бруцеллы — красные, другие бактерии синего цвета.
Микроскопическое исследование исходного материала
Из поступившего материала готовят мазки, окрашивают их по Граму и одним из специальных методов (по Козловскому, Стампу и т.д.), а также бруцеллезными люминесцирующими сыворотками.
В препаратах, окрашенных по методу Грама, бруцеллы имеют форму мелких, коротких, коккоподобных или палочковидных грамотрицательных бактерий, размером 0,5-0,7х0,6-1,5 мкм, истинной капсулы не образуют, расположены одиночно, реже — парами, короткими цепочками или небольшими группами.
Для бруцелл характерно более медленное окрашивание и отдача красителя при промывании водой или обработке слабыми растворами кислот по сравнению с другими видами бактерий, что позволило ряду авторов предложить дифференциальные методы окраски клеток возбудителя.
Окраска бруцелл по Е.В. Козловскому. Мазок фиксируют на пламени, окрашивают 2%-ным водным раствором сафранина 2 минуты с подогреванием до появления пузырьков, затем промывают водой и докрашивают 0,75-1%-ным водным раствором бриллиантовой или малахитовой зелени (или метиленового синего) в течение 1-2 минут, споласкивают водой. Микроскопическая картина: бруцеллы — ярко-красные, другие бактерии — зеленого или синего цвета.
Окраска бруцелл по Стампу (модифицированный метод Циля- Нильсена). Мазок фиксируют на пламени, окрашивают фуксином Пфейффера в течение 10 минут, промывают водой, обрабатывают
30 секунд 0,5%-ным водным раствором уксусной кислоты, промывают водой, окрашивают 20-30 секунд 1%-ным водным раствором метиленового синего, промывают водой. Микроскопическая картина: бруцеллы — красные, прочие бактерии имеют синий цвет.
Приготовление щелочного раствора сафранина (ex tempore). Смешивают 5 капель 3%-ного водного раствора сафранина и 1,5 мл нормального раствора КОН (5,6 г на 100 мл воды).
Иммунолюминесцентное выявление бруцелл проводят прямым или непрямым способом.
Культивирование.Обычно исследуемый материал засевают в пробирку с жидкой и в несколько пробирок (5-10) — с агаровой питательной средой (мясо-пептонный печеночный бульон, мясо-пептонный-печеночно-глюкозный-глицериновый бульон, альбими-бульон, аналогичные агаровые среды, сывороточнокартофельный агар, сывороточно-декстрозный агар). Бруцеллы хорошо растут на кровяном агаре (5-10%). Загрязненный материал высевают на сывороточно-декстрозный агар с ингибиторами (рекомендация Объединенного комитета экспертов ФАО/ВОЗ по бруцеллезу): генцианвиолет 1:200 тыс. или кристаллический фиолетовый 1:100 тыс., уксуснокислый натрий (0,25 мг/мл) или паранитрофенилглицерин (0,005-0,007%).
Бруцеллы — аэробы или микроаэрофилы. Температурный оптимум 37°С, диапазон - 20-40°С, оптимум рН 6,6-7,4. Микроаэрофильные свойства проявляют В. abortus и В. ovis. Поскольку не известно, какой вид бруцелл присутствует в исследуемом материале от крупного рогатого скота, то половину пробирок с посевами инкубируют в условиях обычной атмосферы, вторую — в атмосфере с повышенным содержанием СО2 (10-12%). Посевы при исследовании на наличие В. ovis инкубируют только в атмосфере СО2. В первой генерации бруцеллы обладают замедленным ростом, поэтому посевы культивируют, периодически просматривая, до 30 дней. Подготовка и исследование различных материалов имеют некоторые особенности.
При исследовании абортированного плода производят посев тканевого гомогената или пастеровскими пипетками непосредственно из органов. Посевы делают из экссудата грудной и брюшной полостей, содержимого желудка, крови сердца, печени, селезенки, легких. При посеве из паренхиматозных органов выбирают участки с фокусами некрозов, кровоизлияниями.
Для изготовления тканевого гомогената кусочки паренхиматозных органов обжигают, растирают в ступке со стерильным кварцевым песком и физиологическим раствором (1:10), гомогенат высевают на среды. Аналогичным образом подготавливают для посева материал, взятый при диагностическом убое животных.
При осмотре плаценты отбирают участки с утолщенными ворсинками и стенками, с наличием гнойного экссудата. Поверхность плаценты обрабатывают тампонами с дезинфектантами, просушивают стерильными тампонами, прижигают выбранный участок, вырезают необходимые фрагменты, измельчают, как было описано выше, и высевают на среды с ингибиторами.
Порции молока из каждой четверти вымени центрифугируют при 1000-3000 об/мин в течение 10-20 минут. Посев производят из осадка и слоя сливок на селективные среды. Рекомендуется исследовать пробы молока, взятые от животного несколько раз с интервалом 5-10 суток.
Мочу (75-100 мл) перед посевом на питательные среды центрифугируют при 3000 об/мин в течение 10 минут и осадок высевают на селективные среды. Возможна концентрация бруцелл путем добавления к моче бруцеллезной агглютинирующей сыворотки (1-2%) с титром не менее 1:800. После непродолжительного инкубирования мочу центрифугируют и осадок высевают на питательные среды.
Эффективен посев в жировые куриные яйца при исследовании крови, мочи и других материалов, содержащих малое количество возбудителя. Используют свежие куриные яйца (3-5 дней). На каждый материал берут 3-5 яиц. Исследуемый материал в количестве 0,2 мл вводят в желточный мешок, инкубируют при 37° С в течение пяти суток, вскрывают, набирают пастеровскими пипетками белок и желток и высевают на плотные и жидкие питательные среды (методика Одесского ИМ имени И.И. Мечникова).
Кровь высевают сразу после взятия в жидкие питательные среды с антикоагулянтом (2%-ный цитрат натрия). В 100 мл среды засевают около 20 мл крови. В качестве питательной среды используют бульон Альбими, триптозный бульон, среду Первушина, МПБ с 1% глюкозы и 2-3% глицерина. Хорошие результаты получаются при посеве на комбинированные среды (метод Кастанеда). Например, в колбе (пробирке) скашивают агар (ППГГА), добавляют какую-либо жидкую питательную среду, чтобы она покрывала половину поверхности агара, и в нее засевают кровь (П.А. Триленко 1976). Через 4-6 дней культивирования поверхность агара увлажняют жидкой средой и в последующем периодически просматривают с целью обнаружения колоний бруцелл.
Характер роста бруцелл на питательных средах.Колонии бруцелл появляются на поверхности плотных питательных сред на 5-10-е, реже — на 20-25-е сутки. В первичных посевах формируются, как правило, колонии S-формы: бесцветные, круглые, выпуклые, с ровными краями, гладкой маслянистой поверхностью, полупрозрачные, диаметр колоний в зависимости от типа питательной среды от 0,1-0,7 до 2,0-2,5 мм и более. По мере старения колонии теряют прозрачность, мутнеют и темнеют за с 1ст появления пигмента. На ППГГА в проходящем свете колонии имеют ян-гарный оттенок.
При изучении колоний в косопроходящем пучке света они имеют зеленовато-серо-голубой цвет с небольшим красновато-желтым центром.
При исследовании материала от животных с хроническим течением бруцеллеза могут быть выделены бруцеллы в R-форме, отличающиеся не только по форме, но особенно по характеру свечения колоний.
В жидких питательных средах бруцеллы растут с равномерным помутнением среды, медленным появлением небольшого, голубоватого в проходящем свете пристеночного кольца или кольца и поверхностной пленки. На дне пробирки постепенно образуется рыхлый осадок.
Морфология и тинкториальные свойства клеток бруцелл в культуре.Из подозрительных колоний делают мазки, окрашивают по Граму, Козловскому. Клетки бруцелл в культуре не отличаются по морфологии от клеток возбудителя в исходном материале (см. выше), жгутиков не имеют.
Если испытуемая культура дает положительную РА (два креста и более) с обеими или любой одной диагностической сывороткой и отрицательный результат с физиологическим раствором, то ее относят к бруцеллам.
Оценка результатов РА проводится при условии, что R- и S-сыворотки дают в контролях с гомологичными антигенами агглютинацию интенсив ностью минимум на три креста, при отсутствии реакции с гетерологичными антигенами. Агглютинация с R-сывороткой происходит замедленно, с ней всегда реагируют культуры В. ovis и В. canis.
Бруцеллы не обладают подвижностью, образуют каталазу, обычно ок-сидазу (кроме В. ovis и В. neotomae) и уреазу (кроме В. ovis и некоторых штаммов В. melitensis), редуцируют нитраты, не образуют индол.
Наставлением по диагностике бруцеллеза животных (2000) в РФ предусмотрено использование полимеразной цепной реакции.
Идентификация бруцелл на уровне вида и биовара.Критерии дифференциации видов и биоваров бруцелл представлены в таблицах.
Определение вида и биовара выделенной культуры бруцелл дает возможность более детально проводить эпизоотологический и эпидемиологический анализ.
Разработанные методы дифференциации видов бруцелл предполагают работу с бруцеллами в S-форме (кроме В.ovis и В. canis), поэтому перед проведением таких исследований проверяют популяцию на диссоциацию методом окраски колоний кристаллвиолетом по Уайту-Вильсону. Для этого готовят взвесь 48-часовой изучаемой агаровой культуры в стерильном физиологическом растворе концентрацией 0,5-1 млрд. микробных клеток в 1 мл по бруцеллезному стандарту мутности. Одну каплю взвеси засевают последовательно шпателем на поверхность агаровой среды в трех чашках Петри.
Посевы инкубируют 5 суток при 37-38°С. При таком методе посева на плотной среде вырастает достаточно большое количество изолированных колоний бруцелл. В чашки Петри с колониями осторожно пастеровской пипеткой наливают рабочий раствор кристаллвиолета 1 тонким слоем. Через пять минут краситель осторожно отсасывают пипеткой и сливают в емкость с дезраствором. Затем колонии изучают при помощи стереоскопического микроскопа.
Диссоциированные колонии имеют цвет от темно-фиолетового до светло-синего, S-колонии окрашиваются в светло-желтый, реже — в светло-зеленый цвет. Для изучения отвивают несколько колоний в
S-форме.
Читайте также:


