Нейтрофильные внеклеточные ловушки сепсис
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Читайте в новом номере
В 2004 г. был описан новый иммунологический процесс, заключающийся в выбросе активированными нейтрофилами нитей ДНК, обрамленных катионными белками и пептидами. Эти структуры получили название нейтрофильных внеклеточных ловушек (НВЛ). Было показано, что, наряду с положительными свойствами в отношении защиты от инфекции, НВЛ оказывают серьезное негативное влияние на организм, связанное с их белковым составом: они на 70% состоят из положительно заряженных гистонов и на 20–30% — из катионных белков типа α-дефензинов и пептида LL-37, которые так же, как и гистоны, попав во внеклеточное пространство, оказывают токсическое действие на ткани человека. В настоящее время доказано, что НВЛ участвуют в многочисленных патологических процессах, в т. ч. при респираторных инфекциях, значительно усугубляя течение заболевания.
Цель исследования: изучить влияние азоксимера бромида (выпускается под торговым наименованием Полиоксидоний) на формирование внеклеточных нейтрофильных ловушек in vitro.
Материал и методы: нейтрофилы здоровых доноров выделяли с помощью центрифугирования в одноступенчатом градиенте плотности Ficoll-Hypaque. Полиоксидоний в дозах 10, 100, 500 или 1000 мкг/мл добавляли к нейтрофилам за 1 ч до внесения в лунки планшета форбол-миристат-ацетата. Для обнаружения НВЛ использовали флуоресцентную микроскопию. Препараты окрашивали, применяя Syber Green.
Результаты исследования: показано влияние препарата Полиоксидоний на формирование НВЛ, заключающееся в снижении способности активированных нейтрофилов выделять макромолекулярные комплексы, состоящие из ДНК и гранулярных, ядерных и цитоплазматических белков, в т. ч. антимикробных белков, одинаково токсичных как для прокариотических, так и для эукариотических клеток. Снижение образования и выделения НВЛ вносит существенный вклад в лечебно-профилактический эффект Полиоксидония и наряду с иммуномодулирующими (в т. ч. интерферон-индуцирующим) и детоксицирующими свойствами, объясняет его высокую клиническую эффективность в терапии острых и хронических инфекционно-воспалительных заболеваний респираторного тракта.
Заключение: проведенные исследования выявили принципиально новые механизмы лечебного действия Полиоксидония, а именно его способность уменьшать образование НВЛ активированными нейтрофилами с полным сохранением иммуномодулирующих и детоксицирующих свойств.
Ключевые слова: нейтрофильные внеклеточные ловушки, НЕТоз, респираторные заболевания, ОРВИ, нейтрофилы человека, азоксимера бромид, Полиоксидоний.
Для цитирования: Пинегин Б.В., Дагиль Ю.А., Воробьева Н.В., Пащенков М.В. Влияние азоксимера бромида на формирование внеклеточных нейтрофильных ловушек. РМЖ. 2019;1(II):42-46.
Azoximer bromide effect on the neutrophil extracellular traps formation
B.V. Pinegin 1 , Yu.A. Dagil 2 , N.V. Vorobieva 3 , M.V. Pashchenkov 1
1 National Research Center — Institute of Immunology Federal Medical-Biological Agency of Russia, Moscow
2 LLC “Petrovax Pharm”, Moscow
3 Lomonosov Moscow State University
Keywords: neutrophil extracellular traps, NETosis, respiratory diseases, ARVI, human neutrophils, azoximer bromide, Polyoxidonium.
For citation: Pinegin B.V., Dagil Yu.A., Vorobieva N.V., Pashchenkov M.V. Azoximer bromide effect on the neutrophil extracellular traps formation. RMJ. 2019;1(II):42–46.
В статье представлены результаты оригинального экспериментального исследования, посвященного изучению влияния азоксимера бромида на формирование внеклеточных нейтрофильных ловушек.
Введение
Материал и методы
Результаты исследования
Обсуждение
Практически при всех острых и хронических воспалительных процессах как инфекционной, так и неинфекционной природы происходит образование НВЛ, вносящих значительный негативный вклад в течение заболеваний [18, 20]. В состав НВЛ входят белки и пептиды, одинаково токсичные как для эукариотических, так и для прокариотических клеток. Важные в составе фагосом нейтрофилов и макрофагов, эти белки и пептиды, выходя за пределы клетки, оказывают повреждающее действие на клетки хозяина и существенно ухудшают течение патологического процесса [10–14].
Патогенетическая роль НВЛ доказана при различных заболеваниях, в т. ч. сопряженных с нарушением функционирования слизистых оболочек, в частности при респираторных инфекциях. Так, например, доказано, что в механизме формирования экссудата (выпота) среднего уха как при остром, так и при хроническом процессе НВЛ играют ключевую роль. Формирование НВЛ приводит к повышению вязкости секрета и ассоциируется с гиперпродукцией преимущественно MUC5B-муцина, что в дальнейшем препятствует процессу элиминации слизи и очищению полости среднего уха, снижая эффективность этиотропной терапии [21].
НВЛ играют также значимую роль в развитии пневмококковой внебольничной пневмонии. Формируясь как на эпителии, так и в эндотелиальном пространстве, они вызывают повреждение альвеолярно-эндотелиального барьера с последующим развитием дыхательной недостаточности. В исследованиях показано, что уровень образования НВЛ напрямую коррелирует с тяжестью течения пневмонии [22].
В основе патогенеза вирусных инфекций, обусловленных вирусами гриппа, респираторно-синцитиальными (РС) вирусами и риновирусами, важную роль также играют НВЛ. Вирус-индуцированные НВЛ приводят к повреждению эпителия и повышают вязкость слизи. С образованием НВЛ связывают обструкцию дыхательных путей у детей при РС-бронхиолитах, сопровождающихся свистящим дыханием [16].
Риновирусные инфекции также небезобидны. Инфицирование риновирусом слизистой оболочки экспериментальных животных повышало формирование НВЛ, которые определялись в большом количестве в носоглоточном смыве и бронхоальвеолярном лаваже. При этом пик продукции НВЛ наблюдался через 2 сут после инфицирования. Тяжесть респираторных симптомов кор-
релировала с уровнем ДНК в слизистой. Снижение уровня НВЛ приводило к снижению тяжести респираторных симптомов, в т. ч. обострения астмы на фоне аллергенов клеща домашней пыли, обусловленных ринови-русом [23].
Повреждающий эффект НВЛ выявлен при развитии инфекционно-воспалительных процессов практически всех органов и тканей, особенно при поражении респираторного тракта, когда наблюдается длительное и повышенное образование НВЛ [10, 11]. На сегодняшний день терапевтические подходы к коррекции формирования НВЛ крайне ограничены, поэтому актуальной задачей клинической медицины является разработка методов, снижающих формирование и токсический эффект НВЛ, образующихся при развитии воспалительного процесса. Такие методы должны входить в комплекс лечебных и профилактических мероприятий.
Данная работа открывает новые перспективные возможности коррекции НВЛ при инфекционно-воспалительной патологии с помощью Полиоксидония. Важно отметить, что Полиоксидоний, обладающий противовоспалительным, иммуномодулирующим и детоксицирующим действием, уже более 20 лет используется в рутинной клинической практике и демонстрирует хороший клинический эффект при лечении острых и хронических инфекционно-воспалительных процессов, в т. ч. респираторного тракта, и высокий профиль безопасности [24]. Это позволяет применять его у детей с 6 мес. и у пациентов с аллергическими заболеваниями, а также в комплексной терапии с антибактериальными, противовирусными, противогрибковыми и антигистаминными препаратами, глюкокортикостероидами и цитостатиками.
Проведенные исследования выявили принципиально новые лечебные свойства Полиоксидония, а именно его способность подавлять образование активированными нейтрофилами внеклеточных ловушек наряду с его противовоспалительными, иммуномодулирующими и детоксицирующими свойствами. Эти эффекты наблюдаются параллельно со снижением образования нейтрофилами внеклеточных активных форм кислорода (АФК, выявляемых с помощью люминол- и люцигенин-зависимой хемилюминесценции) и повышением образования внутриклеточных АФК, а именно супероксидного аниона и перекиси водорода (выявляемых с помощью дихлорфлуоресцеин диацетата), что было показано методом проточной цитометрии [17, 25]. Общеизвестно, что внеклеточные и внутриклеточные АФК играют различную роль в жизни клетки. Если внеклеточные АФК, в т. ч. в составе НВЛ, оказывают преимущественно токсический эффект на окружающие ткани, то внутриклеточные АФК стимулируют клеточный метаболизм. От них зависит усиление фагоцитоза, бактерицидности, синтеза цитокинов [17, 25]. Таким образом, к комплексу известных положительных эффектов Полиоксидония добавляется и такое важное свойство, как способность снижать образование НВЛ и, следовательно, их цитотоксический эффект, что, без сомнения, вносит существенный вклад в лечебный эффект препарата и открывает новые возможности для коррекции формирования НВЛ и патогенетической терапии большого числа заболеваний.
Только для зарегистрированных пользователей

Нейтрофилы — наиболее распространенный вид лейкоцитов. Они являются важной составляющей врожденного иммунитета и представляют собой первую линию защиты организма от инфицирования бактериями, грибами и простейшими. Фагоцитоз и секреция антимикробных веществ из гранул — не единственные функции нейтрофилов. В 2004 году был открыт еще один механизм борьбы с микробной инвазией: формирование нейтрофильных внеклеточных ловушек (NET — neutrophil extracellular traps). Эти ловушки позволяют нейтрофилам уничтожать внеклеточные патогены при минимальном повреждении клеток хозяина.
Механизм образования NETs
Основными компонентами внеклеточных нейтрофильных ловушек являются гистоны, ферменты и пептиды гранул (нейтрофильная эластаза, миелопероксидаза, катепсин G, лактоферрин, желатиназа, лизоцим С, кальпротектин и другие). Процесс образования NETs называется NETosis и может быть вызван различными индукторами: микроорганизмами, бактериальными компонентами, активированными тромбоцитами, комплементарными пептидами, аутоантителами, IL-8, перекисью водорода, кристаллами урата, сигаретным дымом. После контакта индуктора с рецепторами на мембране клетки активируется молекулярный каскад, который приводит к выходу кальция из эндоплазматического ретикулума, что в свою очередь вызывает повышение активности цитоплазматической деиминазы PAD4. Наряду с этим уменьшается конденсация хроматина. Через некоторое время нейтрофилы теряют гетерохроматические области ядра, в результате чего ядра расширяются и становятся круглыми. Ядерная оболочка распадается на везикулы, мембраны гранул и митохондрий разрушаются, что приводит к смешению цитоплазмы, кариоплазмы и антибактериальных пептидов. Белки гранул адсорбируются на отрицательно заряженных фибриллах деконденсированного хроматина, который служит скелетом для ловушки. В конечном итоге клеточная мембрана разрывается и содержимое клетки выбрасывается наружу и разворачивается в пространстве, образуя сеть [1].
Описанный механизм называется suicidal NETosis (суицидальный нетоз). Однако известно, что нейтрофилы могут продуцировать NET, выделяя часть ядра или ядро целиком, и не нарушать целостность клеточной мембраны. Такой механизм получил название vital NETosis (прижизненный нетоз). Эти две формы одного и того же процесса имеют существенные различия. Во-первых, суицидальный нетоз вызывается в основном химической стимуляцией гранулоцитов и требует несколько часов для продукции NET, в то время как прижизненный нетоз активируется при раздражении нейтрофилов бактериальными агентами и занимает меньшее время. Во-вторых, vital NETosis не приводит к лизированию клетки, и она сохраняет способность к хемотаксису и фагоцитозу. Третье отличие заключается в механизме выпуска ловушек. Как было описано выше, при суицидальном нетозе происходит деконденсация хроматина, растворение ядерной оболочки и выброс содержимого клетки через перфорацию в плазматической мембране. Во время прижизненного нетоза происходит перенос ДНК из ядра во внеклеточное пространство с помощью везикул. Везикулы с ДНК, отделившиеся от ядра, проходят через цитоплазму и сливаются с клеточной мембраной, тем самым выбрасывая NET из клетки без перфорации мембраны [2].
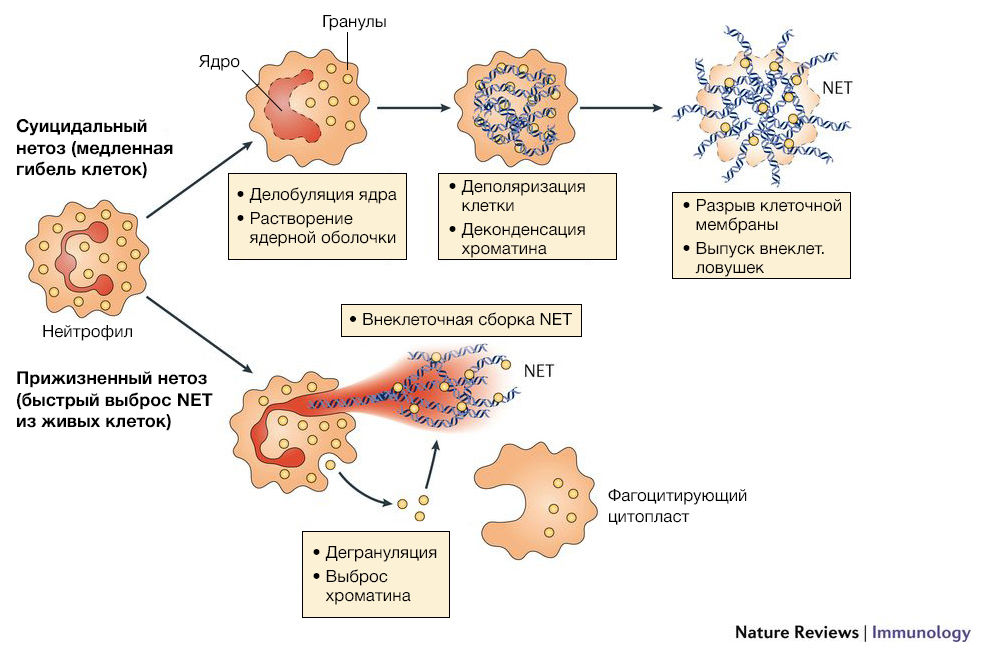
Источник: Nature Reviews Immunology
Антимикробные функции NETs
Антимикробная функция внеклеточных нейтрофильных ловушек связана с уничтожением микроорганизмов, а также с предотвращением их распространения из точки входа. Отрицательно заряженная ДНК служит каркасом для компонентов NET, одновременно захватывая и удерживая микроорганизмы. Бактерии, продуцирующие нуклеазы, могут расщеплять ловушки и высвобождаться из них, что способствует распространению бактерий за пределы места инвазии. Например, род Streptococcus, вызывающий у людей опасные заболевания, продуцирует нуклеазы. Ингибирование экспрессии ДНКаз способствует снижению вирулентности, а индуцирование их экспрессии способствует образованию гипервирулентной формы стрептококков [1] [2].
NETs также эффективны против грибов. Они могут захватывать и уничтожать как дрожжевые, так и гифальные формы. Причем дрожжевые формы грибов задерживаются относительно низким количеством нейтрофилов, тогда как штаммы, образующие гифы, подвергаются атакам большего числа гранулоцитов [1].
Роль NETs в тромбозе
Хотя патогенез артериального и венозного тромбоза различен, в обоих этих процессах принимают участие NETs. При венозном тромбозе активированный эндотелий высвобождает фактор фон Виллебранда и P-селектин, которые привлекают тромбоциты и нейтрофилы. Во время активации тромбоциты индуцируют нейтрофилы, и те высвобождают внеклеточные ловушки, которые становятся каркасом для построения тромба и адгезии тромбоцитов. NETs способствует расщеплению ингибитора тканевого фактора и стимуляции Ха фактора [3].
NETs также играют значимую роль в образовании атеросклеротических бляшек, которые могут привести к артериальному тромбозу. При контакте нейтрофилов с кристаллами холестерина может спонтанно запускаться нетоз, который приводит к задержке тромбоцитов, активации коагуляции и образованию артериальных тромбов [4].
NETs при заболеваниях легких
Муковисцидоз (кистозный фиброз) — наследственное заболевание, при котором происходит мутация гена трансмембранного регулятора муковисцидоза. Пациенты с этим заболеванием страдают от скопления вязкой слизи в легких, которая закупоривает дыхательные пути. Различные инфекции легких, которые развиваются на фоне этого заболевания, вызывают массивную инфильтрацию нейтрофилами и хроническое воспаление. Слизь у больных муковисцидозом содержит большое количество ДНК, большая часть которой находится в NETs [5]. Количество внеклеточной ДНК напрямую коррелирует со сниженной функцией легких [6]. Для симптоматического лечения можно использовать ингаляции ДНКазы I. При этом уменьшается вязкость слизи и улучшается функция легких, однако возрастает риск высвобождения высокоактивных ферментов и токсинов, которые могут повредить эпителий легких [1].
При хронической обструктивной болезни легких также обнаруживается большое количество нейтрофилов в легочной ткани. После длительного воздействия на дыхательные пути раздражителей, например, табачного дыма, больные начинают страдать от рецидивирующих бактериальных и вирусных инфекций, приводящих к повторным обострениям. Табачный дым провоцирует образование нейтрофильных внеклеточных ловушек. Кроме того, никотин непосредственно вызывает нетоз. Как и в случае с муковисцидозом, при тяжелой степени ХОБЛ повышается содержание NETs в слизи, особенно в фазе обострения [1].
NETs и рак
Длительное время считалось, что нейтрофилы остаются инертными по отношению к раковым клеткам во время роста опухоли и метастазирования. Однако в недавнем исследовании пациентов с саркомой Юинга в 25 % случаев NETs были найдены внутри опухоли. Впоследствии у этих пациентов появились метастазы, что указывает на то, что внеклеточные нейтрофильные ловушки могут способствовать прогрессированию опухоли [7].
В исследовании, сравнивающем две линии мышей с раком молочной железы (метастатическим и не метастатическим), было обнаружено большое количество нейтрофилов в местах имплантации метастаз, где они формировали внеклеточные ловушки, однако в местах имплантации не метастатических клеток они найдены не были [8].
В последние годы внеклеточные нейтрофильные ловушки интересны не только как фактор врожденного иммунитета, их также изучают с позиции участия в патогенезе различных заболеваний. Очевидно, что неконтролируемое избыточное или недостаточное формирование NETs может иметь серьезные последствия. Однако необходимо более точно определить их роль в механизмах развития различных заболеваний, поскольку это может открывать новые, более прогрессивные методы диагностики и лечения болезней.
Источники
8. Park J. et al. Cancer cells induce metastasis-supporting neutrophil extracellular DNA traps //Science translational medicine. – 2016. – Т. 8. – №. 361. – С. 361ra138-361ra138.


Нейтрофильных внеклеточные ловушки ( сетки ) представляют собой сеть внеклеточных волокон, в основном состоит из ДНК из нейтрофилов , которые связывают патогены . Нейтрофилы иммунной системы первой линия защиты от инфекции и традиционно думали убить вторжение болезнетворных микроорганизмов через две стратегии: охват микробов и секрецию противомикробных средств. В 2004 году был идентифицирован новым третьей функции: формирование сетками. НРТ позволяют нейтрофилы убивать внеклеточные патогены , минимизируя повреждение клеток - хозяев. При ин витро активации с фармакологическим агентом форболмиристатацетатом (РМА), интерлейкина 8 (IL-8) или липополисахаридом (LPS), нейтрофилы высвобождение гранул белки и хроматин с образованием фибрилл внеклеточного матрикса , известным как ИЕ посредством активного процесса.
содержание
Структура и состав
Высокое разрешение сканирования электронной микроскопии показало , что НРТ состоят из отрезков ДНК и глобулярных доменов белка с диаметром 15-17 нм и 25 нм соответственно. Они агрегировать в более крупные нитей с диаметром 50 нм. Однако в условиях потока, НРТ могут образовывать более крупные структуры, достигая сотен нанометров в длину и ширину.
Анализ методом иммунофлуоресценции подтвердил , что НРТ содержат белки из азурофильных гранул (эластазы нейтрофилов, катепсина G и миелопероксидазы ), специфические гранулы ( лактоферрин ), третичные гранулы ( желатиназа ), так и в цитоплазме; Однако, CD63 , актин , тубулин и различные другие цитоплазматические белки не присутствует в сетках.
Антимикробная активность
НРТ обезвредить патогены с антимикробными белками , такими как нейтрофильной эластазы , катепсина G и гистоны , которые имеют высокое сродство к ДНК. НРТ обеспечивает высокую локальную концентрацию антимикробных компонентов и связывается, обезвредить, и убивают микробы внеклеточны независимо от фагоцитарного поглощения. В дополнении к их антимикробным свойствам, НРТ может служить в качестве физического барьера , который предотвращает дальнейшее распространение патогенных микроорганизмов. Кроме того, обеспечивая гранулы белков в НЭО может держать потенциально вредные белки , такие как протеазы , диффузию прочь и вызывая повреждение в ткани , прилегающей к месту воспаления .
Совсем недавно было также показано , что не только бактерии , но и патогенные грибы , такие как Candida Albicans индуцируют нейтрофилы с образованием сетками , которые захватывают и убивают C. Albicans гиф, а также дрожжи образуют клетки. НРТ также были зарегистрированы в ассоциации с малярийного плазмодия инфекций у детей.
Несмотря на то , что первоначально было предложено , что НРТ будет сформирована в тканях на участке бактериальной / дрожжевой инфекции, НРТ также было показано , чтобы сформировать внутри кровеносных сосудов во время сепсиса ( в частности , в легких капилляров и синусоиды печени ). Затраты на формирование внутри-сосудистое жестко контролируется и регулируется тромбоцитами , которые ощущающие тяжелая инфекцию с помощью тромбоцитов TLR4 , а затем связываются с и активируют нейтрофилы с образованием сеток. Тромбоциты-индуцированные NET формирования происходит очень быстро (в течение нескольких минут) и могут или не может привести к гибели нейтрофилов. НРТ , образованный в кровеносных сосудах могут поймать циркулирующие бактерий , поскольку они проходят через сосуды. Ловушки бактерий в потоке было отображены непосредственно в проточных камерах в лабораторных и прижизненной микроскопии показано , что бактериальная захват происходит в синусоиды печени и капилляров легких (участков , где тромбоциты связывают нейтрофилы).
NETosis
NET активация и освобождение или NETosis, является динамическим процессом, который может прийти в двух формах, суицидальное и жизненно NETosis. В целом, многие из ключевых компонентов процесса одинаковы для обоих типов NETosis, однако, есть ключевые различия в раздражители, сроки и конечной конечный результат.
Полная NETosis активация пути еще находится в стадии расследования , но несколько ключевых белков были идентифицированы и медленно полная картина пути появляется. Процесс , как полагают , чтобы начать с NADPH - оксидаза активации белка-аргинина deiminase 4 (PAD4) через реактивно-кислородных видов (ROS) посредников. PAD4 отвечает за citrullination гистонов в нейтрофилов, что приводит к деконденсации хроматина. Азурофильные белки , такие как гранулы миелопероксидаза (МРО) и эластазы нейтрофилов (NE) , а затем проникают в ядро и далее процесс деконденсации, что приводит к разрыву ядерной оболочки. Неуплотняемый хроматин входит в цитоплазму , где дополнительные гранулы и цитоплазматические белки добавляются к ранней стадии NET. Конечный результат процесса затем зависит от того , NETosis путь активируется.
Суицидальное NETosis было впервые описано в исследовании 2007, отметило, что выпуск ИХ привел к нейтрофилам смерти через другой путь, чем апоптоз или некроз. В суицидальных NETosis, внутриклеточное образование NET сопровождается разрывом мембраны плазмы, выпуская его во внеклеточное пространство. Этот путь NETosis может быть инициировано путем активации Toll-подобных рецепторов (TLRs), рецепторы Fc, и дополняют рецепторы с различными лигандами, такими как антитела, РМА, и так далее. Нынешнее понимание является то, что при активации этих рецепторов, вниз по течению сигнализации результаты в выпуске кальция из эндоплазматического ретикулума. Этот внутриклеточный приток кальция в свою очередь, активирует НАДФН-оксидазы, в результате активации пути NETosis, как описано выше. Следует отметить, что суицидальное NETosis может занять несколько часов, даже при высоких уровнях PMA стимуляции, в то время как жизненно NETosis, которая может быть завершена в течение нескольких минут.
Образование НЭА регулируются липоксигеназы путей - при определенных формах активации ( в том числе контакта с бактериями) нейтрофильной 5-липоксигеназой формой 5-НЕТ-фосфолипиды , которые ингибируют образование NET. Данные лабораторных экспериментов показывают , что НРТ убираются прочь макрофагами , которые фагоцитируют и разлагают их.
NET-ассоциированного повреждения хост
НРТ также может оказывать вредное воздействие на хозяина, потому что воздействие внеклеточного гистонов комплексов может играть роль в развитии аутоиммунных заболеваний , таких как системная красная волчанка . НРТ может также играть роль в воспалительных заболеваний, а НРТ может быть идентифицирован в преэклампсии , родственный беременность воспалительное заболевание , при котором , как известно , нейтрофилы , которые будут активированы. НРТ также сообщались в толстой слизистой оболочке пациентов с воспалительным заболеванием кишечника неспецифическим язвенным колитом . НРТ также были связаны с производством IgG антинуклеарных антител двойных скрученных ДНК у детей , инфицированных P. трехдневной малярии .
НРТ было показано , что вклад в патогенез ВИЧ / ВИО . НРТ способны захватывать вирионы ВИЧ и уничтожить их. Существует увеличение чистой продукции на протяжении всего курса ВИЧ / SIV, которая уменьшается на АРТ . Кроме того, НРТ способны захватывать и убивать различные группы иммунных клеток , такие как CD4 + и CD8 + Т - клетки , В - клетки и моноциты . Этот эффект проявляется не только с нейтрофилами в крови, но также и в различных тканях , таких как кишечник, легких, печени и кровеносных сосудов. НРТ , возможно , внести свой вклад в состояние гиперкоагуляции в ВИЧ путем улавливания тромбоцитов , и экспрессии тканевого фактора .
НРТ также играет роль в тромбозе .
Эти наблюдения указывают на то, что НРТ может играть важную роль в патогенезе инфекционных, воспалительных и тромботических заболеваний.

Введение. Тщательное изучение морфологических форм нейтрофильных гранулоцитов и их функциональной активности всё ещё остается важной задачей практической медицины. Нейтрофильные гранулоциты активно участвуют в реакциях как врожденного так и приобретенного иммунитета, а также в поддержании гомеостаза организма в целом [1,2]. В современной литературе известно, что нейтрофилы обладают свойством сохранять свою антимикробную активность даже после того, как клетка заканчивает свой антимикробный цикл.
Цель данной статьи - изучить современные представления о механизмах формирования нейтрофильных внеклеточных ловушек для формулирования дальнейших научных поисков по данной проблеме.
Материал исследования - аналитический обзор научных данных за последние 10 лет по проблеме исследования НВЛ; систематизация имеющихся материалов. Методы исследования – теоретический, методологический, организационный, построение научной гипотезы.
В 2004 году описан новый механизм антимикробного действия нейтрофилов – образование нейтрофильных внеклеточных ловушек (neutrophil extracellulartraps, NETs или НВЛ). Длительный период времени апоптоз считался единственной физиологической формой программируемой гибели нейтрофилов в процессе поддержания гомеостаза. Тем не менее, в исследованиях последних лет было обнаружено, что для эффективного разрешения исхода воспаления в нейтрофилах предусмотрены и иные антибактериальные стратегии – дегрануляция и нетоз (внеклеточные ловушки, НВЛ). Эти пути взаимодействия организма и патогена также играют ключевую роль в повреждении тканей, обеспечивая цитотоксические функции.
Нейтрофилы являютсяодним из важнейших компонентов неспецифической защитной системы организма. После активации нейтрофилов патогенными микроорганизмами в них происходит каскад окислительных реакций. Окислительные реакции провоцируют формирование большого количества свободных радикалов, обладающих выраженным бактерицидным действием. Нейтрофильные гранулы содержат ряд веществ, разрушающие клеточную стенку бактерий: лизоцим и лактоферрин, а также и гидролитические ферменты [3]. Нейтрофилы, являясь первыми иммунными клетками, достигающие места повреждения или инфицирования, являются ключевыми компонентами в уничтожении микробов [4, 5]. Следовательно, нейтрофилы выступают в качестве первой линии защиты от патогенных микроорганизмов посредством фагоцитоза, выделения активных форм кислорода (АФК) и дегрануляции [6,7].
Процесс формирования внеклеточных ловушек отличается от некроза морфологическими изменениями ядра, предшествующие образованию сетей. Ядерная мембрана во время некроза остается обычно неизменной, а при образования сетей распадается на большое количество пузырьков. Нейтрофилы нейтрализуют или локализуют распространение патогенных микроорганизмов, образовав внеклеточные ловушки в тех случаях, когда поглощаемый патоген слишком велик для фагоцитоза [9]. Еще одной отличительной особенностью в процессе формирования НВЛ является специфическая активация нейтрофила с участием NADPH оксидазы. Выявлено, что большинство нейтрофильных гранулоцитов имеют способность генерировать внеклеточные сети. Литературные источники свидетельствуют, что существуют механизмы регулирования программы запуска нейтрофилов, которая завершается формированием НВЛ [10]. Данная стратегия действия нейтрофилов является последним шагом в программе активной контролируемой клеточной гибели нейтрофилов. По мнению ряда исследователей, установлено, что генерация нейтрофилами внеклеточных ловушек является важным механизмом врожденного иммунного ответа, защищающий организм от большинства инфекционных агентов [11, 12].
В результате проведенных исследований были предложены две модели формирования нейтрофильных ловушек. Первая модель генерации нейтрофилами ловушек является одной из форм запрограммируемой клеточной гибели, характеризующаяся нарушением целостности клеточной мембраны с последующей секрецией деконденсированного хроматина и содержимого гранул во внеклеточное пространство [13]. Эта модель формирования ловушек является зависимой от НАДФН-оксидазы. Данный механизм характеризуется фрагментацией ядерной оболочки, секрецией деконденсированного хроматина вместе с гистоновыми белками в цитоплазму. Впоследствии чего происходит сокращение нитей цитоскелета, клеточная мембрана теряет свою целостность, и сформированная масса биологически активных веществ высвобождается во внеклеточное пространство[14]. Механизм формирования сети занимает 120–240 минут [15]. Вторая модель (альтернативный механизм) формирования ловушек представлена образованием сетей из митохондриальной ДНК интактных нейтрофилов, содержащих пузырьки, которые секрктируют деконденсированный хроматин и гранулярные гистоновые белки в межклеточное пространство. Альтернативный механизм образования внеклеточных ловушек зависит от индукции активных форм кислорода, протекающий быстро (в течение 5–60 мин). Данная модель не связана с клеточной гибелью, но ассоциирована с аутофагией [16]. Из анализа литературных источников установлено, что нейтрофильная внеклеточная ловушка, образованная из митохондриальной ДНК отличается от ловушек, полученных из ядерной ДНК. Исследования показали, что митохондриальные внеклеточные ловушки содержат гистоновые белки и ферменты гранул нейтрофилов с митохондриальной ДНК, в которых отсутствовали ядерные протеины (Yousefi et al. 2009).
Исследованиями ученых выявлено, что количество формирования нейтрофильных внеклеточных ловушек зависит от течения заболевания. Распределение нейтрофилов и нейтрофильных внеклеточных ловушек при сердечно-сосудистой патологии обусловлено в различных типах осложнений бляшек или кровоизлияний. Ученые доказали, что присутствие нейтрофильных сетей обратно пропорционально возрасту массы тромба или кровотечения, но остается высоким в продолжающихся кровотечениях.
Таким образом, доказано что образование нейтрофильных внеклеточных ловушек может способствовать прогрессированию тромботических или геморрагических осложнений, приводящих к формированию клинических коронарных ишемических синдромов[17, 18].
Представления о роли НВЛ при онкологии сильно варьируют. С одной стороны, есть данные об антиканцерогенных свойствах НВЛ, связанных с прямым разрушением опухолевых клеток и стимуляцией иммунной системы. Миелоидные клетки секретируют нейтрофильную эластазу и внеклеточные ловушки нейтрофилов в ответ на сигналы в микроокружении опухоли, что приводит к усилению активности при различных типах рака. Нейтрофильная эластаза, действительно, может быть движущей силой онкогенеза, в качестве стимулирующего фактора при раке, уделяя особое внимание точным механизмам, с помощью которых она способствует росту первичной опухоли и метастазированию вторичных органов [19].
Высокая заболеваемость внебольничной пневмонией и возрастающая доля в их числе резистентных и тяжелых форм, приводящих к летальному исходу, определяют необходимость углубленных исследований патогенетических механизмов тяжелых пневмоний в целях открытия путей оптимизации диагностики и лечения.
Одним из актуальных направлений исследования ВП является изучение внеклеточных нейтрофильных ловушек, обладающих двоякой ролью: с одной стороны, выполняют защитную функцию, с другой - являются потенциальными медиаторами тканевого повреждения [20]. В этой связи оценка образования внеклеточных ловушек представляет безусловную актуальность и важность поскольку во многом может определить развитие и исходы острой пневмонии и ХОБЛ.
Таким образом, представляет интерес оценка способности нейтрофилов к образованию внеклеточных ловушек при социально-значимых заболеваниях. Необходимо провести дальнейшие исследования, которые расширят представление о механизмах формирования НВЛ при различной патологии. Полученные результаты исследования возможно внесут определенный вклад в изучение механизмов развития внеклеточных ловушек и определить новые цели для терапевтического воздействия.
Читайте также:


