Менингококковая вакцина форма выпуска
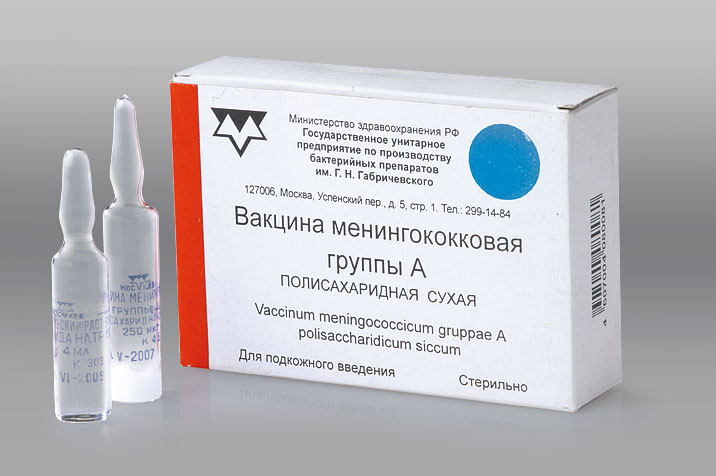
- Форма выпуска:
1 ампула / 5 доз для детей 9 лет и старше
и 10 доз для детей от 1 до 8 лет включительно №5 + растворитель. - Схема вакцинации: однократно. Прививочная доза для детей от 1 года до 8 лет включительно – 0,25 мл; в возрасте от 9 лет и старше – 0,5 мл. Ревакцинация через 3 года.
Инструкция по применению
НПО МИКРОГЕН, ФГУП (Россия)
Код ATX: J07AH01 (Meningococcus A, purified polysaccharides antigen)
Активное вещество: вакцина менингитная полисахаридная (meningococcal polysaccharide vaccine)
Ph.Eur. Европейская Фармакопея
ВАКЦИНА МЕНИНГОКОККОВАЯ ГРУППЫ А ПОЛИСАХАРИДНАЯ СУХАЯ
лиофилизат д/пригот. р-ра д/п/к инъекций 5 доз: амп. 5 шт.
рег. №: ЛС-000302 от 27.04.10 - Действующее
Лиофилизат для приготовления раствора для п/к введения
1 амп.
очищенные полисахариды Neisseria meningitidis серогруппы A
Растворитель: 0.9% р-р натрия хлорида - 5 мл.
1 амп. (5 доз) - ампулы (5) в комплекте с растворителем (5 амп. по 5 мл) - пачки картонные.
Клинико-фармакологическая группа: Вакцина для профилактики заболеваний, вызванных менингококками
Фармако-терапевтическая группа: МИБП-вакцина
Приведенная научная информация является обобщающей и не может быть использована для принятия решения о возможности применения конкретного лекарственного препарата.
Вызывает нарастание специфических антител к Neisseria meningitidis серогрупп A, C, W135 и Y.
Профилактика менингококковой инфекции, вызванной менингококками групп А и С у детей и взрослых.
Однократная вакцинация начиная с 18-месячного возраста в 1 дозе независимо от возраста. Вакцину вводят п/к или в/м.
Очень редко: (более вероятно у взрослых) в первые 72 ч после введения - незначительная лихорадка, озноб, слабость; незначительное и непродолжительное покраснение кожи и болезненность в месте введения вакцины.
Острые и хронические заболевания.
Беременность и лактация не являются противопоказанием в неблагоприятных эпидемических ситуациях.
Не подлежат вакцинации дети в возрасте до 18 месяцев, исключая эпидемические ситуации, т.к. на компонент А вакцины иммунитет может развиваться уже с 3 месяцев, а на компонент С - практически не развивается.
Не подлежат вакцинации дети в возрасте до 18 месяцев, исключая эпидемические ситуации, т.к. на компонент А вакцины иммунитет может развиваться уже с 3 месяцев, а на компонент С - практически не развивается.
Всё, что вам нужно знать о китайском коронавирусе
Интервью телеканала RT с Дмитрием Львовым — легендой советской вирусологии, экспертом ВОЗ по гриппу и респираторным инфекциям с 1987 года.
Ротавирусная инфекция: что важно знать?
Существует несколько типов вируса, но патогенными для человека являются серотипы А, В, С, а наиболее распространен тип А. Этот вирус поражает не только человека, но и разные виды млекопитающих и птиц. Ротавирус группы А считается одной из наиболее частых причин возникновения инфекционных диарей у детей.
Полиомиелит – симптомы, последствия, как не заразиться
Полиомиелит – это острое инфекционное заболевание человека, которое сопровождается поражением нервной системы, развитием парезов и параличей. Полиомиелит в основном поражает детей в возрасте до 5 лет. 1 из 200 инфекций приводит к необратимому параличу. Среди тех парализованных, от 5% до 10% умирают, когда их дыхательные мышцы становятся неподвижными.
Отличие ротавирусной инфекции от кишечной инфекции.
Многие родители паникуют, путая ротавирус, дизентерию и отравление. Врачи предупреждают, что одно из главных отличий – характер стула.
Коронавирус: Молот и Танец
Эта статья была результатом невероятных усилий группы обычных людей, работающих круглосуточно, чтобы найти все соответствующие исследования, чтобы структурировать их в единое целое, если это может помочь другим обработать всю имеющуюся информацию о коронавируса.
Действующее вещество:
Инструкция по медицинскому применению
Вакцина менингококковая группы А полисахаридная
Инструкция по медицинскому применению - РУ № ЛС-000302
Дата последнего изменения: 27.04.2017
Лиофилизат для приготовления раствора для подкожного введения.
Препарат представляет собой очищенный капсульный специфический полисахарид штамма Neisseria meningitidis серогруппы А № 208.
Состав (1 ампула).
Очищенный капсульный специфический полисахарид штамма N.meningitidis серогруппы А №208 - 250 мкг.
Вспомогательное вещество: лактозы моногидрат - 10 мг.
Не содержит консервантов.
1 ампула содержит 5 доз для детей от 9 лет, подростков и взрослых или 10 доз для детей от 1 года до 8 лет включительно.
Выпускается в комплекте с растворителем - натрия хлорид растворитель для приготовления лекарственных форм для инъекций 0,9%.
Аморфная масса в форме таблетки или рыхлого порошка от белого до беловато-серого цвета. Восстановленный препарат: бесцветный или желтоватого цвета раствор.
Введение вакцины приводит к интенсивному нарастанию в крови вакцинированных специфических антител, обеспечивающих через 1 неделю невосприимчивость к менингококковой инфекции, вызываемой менингококком серогруппы А.
Иммунитет сохраняется в течение 3 лет после вакцинации. Ревакцинацию проводят при необходимости не ранее чем через 3 года после первой иммунизации.
Профилактика генерализованных форм менингококковой инфекции, вызванной менингококком серогруппы А, у детей от 1 года, подростков и взрослых.
Вакцинация рекомендуется в эндемичных регионах, а также в случае эпидемии, вызванной менингококками группы А.
Вакцинопрофилактику проводят всем контактным лицам в очагах менингококковой инфекции (совместно проживающие члены семьи; лица учреждений, где имеется совместное проживание; воспитанники и персонал детских дошкольных учреждений; лица, которые имели установленный контакт с назофарингеальными секретами больного).
При угрозе эпидемического подъема менингококковой инфекции вакцина, в первую очередь, показана лицам повышенного риска заражения (дети от 1,5 лет до 8 лет включительно; учащиеся первых курсов средних и высших учебных заведений, а также лица, прибывшие из разных территорий Российской Федерации, стран ближнего и дальнего зарубежья и объединенные совместным проживанием в общежитиях).
При подъеме заболеваемости (свыше 20 на 100000 населения) рекомендуется вакцинация населения с охватом не менее 85%.
1. Гиперчувствительность к лактозе, аллергическая реакция на предыдущее введение менингококковой вакцины.
2. Острые заболевания (инфекционные и неинфекционные); обострение хронических заболеваний. Прививки проводят не ранее, чем через 1 месяц после выздоровления (ремиссии). В очагах вакцинация допускается после нормализации температуры.
3. Хронические заболевания в стадии декомпенсации.
4. Злокачественные новообразования, болезни крови.
5. Беременность и период грудного вскармливания.
Противопоказано введение вакцины при беременности и кормлении грудью (безопасность применения у беременных и кормящих женщин не изучена, контролируемых клинических исследований не проводилось).
Препарат вводят однократно подкожно в подлопаточную область или в верхнюю треть плеча. В ампулу с вакциной вносят 2,5 мл прилагаемого к вакцине растворителя - натрия хлорида растворителя для приготовления лекарственных форм для инъекций 0,9% (отбирают из ампулы с растворителем градуированным шприцем). Время растворения не должно превышать 1 минуты. Растворенная вакцина должна быть прозрачной, без содержания каких-либо частиц, включений или осадка.
Прививочная доза для детей от 1 года до 8 лет включительно составляет 0,25 мл (25 мкг); в возрасте от 9 лет, подростков и взрослых - 0,5 мл (50 мкг).
Введение вакцины может вызывать у части привитых слабую и непродолжительную реакцию. Местная реакция выражается в гиперемии кожи (до 25% привитых) и болезненности в области введения вакцины. Продолжительность ее не превышает двух суток. У части привитых через 6-8 часов после вакцинации может повыситься температура, как правило, до 37,1-37,5 °С с последующей нормализацией через 24 часа. Частота температурных реакций, превышающих 37,5 °С, не должна быть более 5%.
Учитывая возможность возникновения анафилактического шока, необходимо обеспечить медицинское наблюдение за привитыми в течение 30 минут после введения препарата. Места проведения прививок должны быть оснащены средствами противошоковой терапии.
Вакцину можно вводить одновременно с инактивированными вакцинами Национального календаря профилактических прививок (а также инактивированными вакцинами календаря по эпидпоказаниям) разными шприцами в разные участки тела.
Прививки проводят в очаге менингококковой инфекции не ранее чем через 3 дня после окончания химиопрофилактических мероприятий.
Вскрытие ампул и процедуру вакцинации проводят при строгом соблюдении правил асептики и антисептики. Растворенная вакцина хранению не подлежит.
Не пригоден к применению препарат в ампулах с нарушенной целостностью или маркировкой, при изменении физических свойств (цвет, прозрачность), при истекшем сроке годности, неправильном хранении.
С целью выявления противопоказаний врач (фельдшер) в день прививки проводит опрос и осмотр прививаемого с обязательной термометрией.
Сведения о возможном влиянии лекарственного препарата на способность управлять транспортными средствами, механизмами.
Лиофилизат для приготовления раствора для подкожного введения. Вакцина - по 250 мкг полисахарида менингококкового группы А в ампуле. Растворитель (натрия хлорид растворитель для приготовления лекарственных форм для инъекций 0,9%) - по 5 мл в ампуле. Выпускают в комплекте. Комплект состоит из 1 ампулы вакцины и 1 ампулы растворителя.
По 5 комплектов с инструкцией по применению и скарификатором ампульным или ножом ампульным (при необходимости) в пачке из картона.
В соответствии с СП 3.3.2.1248-03 при температуре от 2 до 8 °С в недоступном для детей месте. Не замораживать.
В соответствии с СП 3.3.2.1248-03 при температуре от 2 до 8 °С. Допускается кратковременное (не более 7 суток) транспортирование вакцины при температуре не выше 25 °С. Не замораживать.
2 года. Препарат с истекшим сроком годности применению не подлежит. Датой окончания срока годности является последний день месяца, указанного на упаковке.
Версия: Клинические рекомендации РФ (Россия)
Общая информация
Союз педиатров России
Год утверждения (частота пересмотра): 2017 (пересмотр каждые 3 года)
Этиология и патогенез
Эпидемиология
Клиническая картина
Диагностика
Главный метод диагностики заболеваний, вызванных менингококковой инфекцией, - культуральный посев крови, спинномозговой жидкости (СМЖ). Проводят микроскопию с окраской по Грамму всех биологических жидкостей, которые могут содержать возбудитель (кровь, СМЖ, петехии). В биологических жидкостях (сыворотке, моче, синовиальной жидкости, СМЖ) можно обнаружить капсульный полисахарид патогенного микроорганизма. Для этого чаще всего применяют встречный иммуноэлектрофорез и латекс-агглюцинацию. Также ДНК менингококка в образцах можно выявить с помощью полимеразной цепной реакции.
Профилактика
До недавнего времени использовались только полисахаридные менингококковые вакцины, для которых и формулировались показания. Появление конъюгированных вакцин позволило существенно расширить эти показания. Согласно позиции ВОЗ, массовая вакцинация против МИ рекомендована в высоко эндемичных (заболеваемость ГФМИ >10 на 100 тыс. населения) и эндемичных регионах (заболеваемость 2-10 на 100 тыс.), а также лицам, выезжающим в эпидемиологически неблагополучные регионы из стран с низкой заболеваемостью МИ [1].

Рис. 1. Т независимый тип иммунного ответа при использовании полисахаридной вакцины (на рисунке вакцина представлена в виде полисахаридных молекул).
В результате усовершенствования полисахаридных вакцин путем конъюгации с белком-носителем иммунный ответ становится Т зависимым (см. рис. 2). Взаимодействие В клеток с Т клетками приводит к выработке антител преимущественно IgG1 типа, обладающих более высоким уровнем бактерицидной активности. Кроме того, происходит выработка В клеток памяти и прайминг для последующей ревакцинации, что выражается в очень быстром нарастании титра антител при последующей иммунизации конъюгированной вакциной.

Рис. 2. Т зависимый тип иммунного ответа при использовании конъюгированной полисахаридной вакцины (на рисунке вакцина представлена в виде комплекса белка-переносчика с молекулами полисахаридов).
Сравнительная характеристика полисахаридных и конъюгированных вакцин отражена в таблице 1.
| Полисахаридная вакцина | Конъюгированная вакцина |
| Очищенный капсулярный полисахарид | Капсулярный полисахарид, конъюгированный с белком-носителем |
| Т-независимый иммунный ответ | Т-зависимый иммунный ответ |
| Нет выработки иммунологической памяти | Выработка иммунологической памяти |
| Выработка преимущественно антител класса IgM | IgG-антибактериальная активность сыворотки |
| Низкая эффективность бустерных доз (эффект слабого ответа) | Подходит для проведения ревакцинаций |
| Используется при вакцинации в целях контроля вспышек | Применяется для плановой иммунизации и контроля вспышек, включена в Национальные программы иммунизации некоторых стран |
Вакцины для профилактики менингококковой инфекции, зарегистрированные в Российской Федерации, представлены в таблице 2.
| Вакцина | Тип вакцины | Состав | Дозировка и схема введения |
| Вакцина менингококковая А, НПО Микроген, Россия | ПС | Полисахариды серогруппы А (25/50 мкг) | Детям 1-8 лет доза 0,25 мл, лицам 9 лет и старше доза 0,5 мл |
| Полисахаридная менингококковая А+С Санофи Пастер С.А., Франция | ПС | Полисахариды серогрупп А и С (по 50 мкг) | Детям с 2 лет и взрослым 1 доза 0,5 мл |
| Менцевакс АСWY -ГлаксоСмитКляйн Байолоджикалз с.а., Бельгия | ПС | Полисахариды серогрупп А, С,W135, Y (по 50 мкг) | Детям старше 2 лет и взрослым 1 доза 0,5 мл |
| Менюгейт - Новартис Вакцинс энд Диагностикс С.р.л., Италия | К | Олигосахариды серогруппы С (10 мкг), конъюгированные с белком CRM197 Cl. diphteriae | Детям с 2 мес. - 3 дозы (по 0,5 мл) с интервалом 4-6 нед., подросткам и взрослым – 1 доза |
| Менактра - Санофи Пастер Инк., США | К | Полисахариды серогрупп А, С,W135, Y (по 4 мкг), конъюгированные с дифтерийным анатоксином | Детям в возрасте 9-23 мес. 2 дозы (по 0,5 мл) с интервалом не менее 3 мес., лицам 2-55 лет – однократно |
| Менвео - Новартис Вакцинс энд Диагностикс С.р.л., Италия | К | Олигосахариды серогруппы А (10 мкг), С, Y, W135 (по 5 мкг), конъюгированные с белком CRM197 Cl. diphteriae | Детям с 2 до 23 мес - 3 дозы (по 0,5 мл) с интервалом 2 мес и ревакцинацией в 12-16 мес, детям с 7 до 23 мес - 1 доза (по 0,5 мл) с повторной дозой на 2-м году жизни, детям старше 23 мес и взрослым – 1 доза |
ПС – полисахаридная вакцина; К – конъюгированная вакцина
Вакцинацию в очаге инфекции проводят не ранее чем, через 3 дня после окончания химиопрофилактических процедур.
Способ и схема введения: вакцина вводится однократно внутримышечно или подкожно в дельтовидную мышцу плеча. Ревакцинация проводятся не раньше, чем через 3 года после вакцинации. Целесообразность ревакцинации в интервале от 2 до 4 лет после вакцинации может рассматриваться, если в момент вакцинации пациент был в возрасте до 4-х лет и сохраняется угроза эпидемии или предполагается контакт с носителем Neisseria meningitidis группы С. В тоже время, если не возможно точно установить дату вакцинации, то риск контакта с возбудителем выходит на первое место при рассмотрении необходимости проведения ревакцинации.
Способ и схема введения: вакцина вводится однократно подкожно в дельтовидную мышцу плеча. Ревакцинация проводятся не раньше, чем через 3 года.
При введении МКВ С следует учитывать потенциальный риск апноэ и необходимости дыхательного мониторинга в течение 48 – 72 часов у глубоко недоношенных детей (рожденных ранее 28 недели беременности) и особенно у детей с незрелостью дыхательной системы в анамнезе.
Необходимость проведения ревакцинации в настоящее время не определена.
Вакцина может применяться для ревакцинации лиц, привитых ранее другими конъюгированными или полисахаридными вакцинами. Необходимость проведения ревакцинации в настоящее время не определена.
Для обеспечения наиболее эффективной защиты ревакцинация конъюгированной менингококковой вакцины показана детям, страдающим аГУС или ПНГ, в возрасте до 10 лет - каждые 3 года; детям старше 10 лет - каждые - 5 лет.
Пациентам младше 9 мес допускается назначение конъюгированной менингококковой вакцины, несмотря на ограничение в инструкции по применению, так как риск инфекции превышает риск тяжелых осложнений от введения вакцины.
- лица, общавшиеся с больным в общежитиях, при возникновении заболевания в коллективах, укомплектованных иностранными гражданами [2].
Изучение безопасности вакцинопрофилактики менингококковой инфекции среди беременных женщин не проводилось. Однако, вакцинация в период беременности и лактации, как полисахаридными, так и конъюгированной менингококковыми вакцинами, не является категорически противопоказанной и может проводиться в случае высокого риска инфицирования, т.е. в период эпидемии.
В поствакцинальном периоде МОКВ4 очень часто регистрируются жалобы на бессоницу и головную боль, развиваются местные реакции в виде боли и уплотнения в месте введения вакцины; часто у привитых отмечается нарушение аппетита, тошнота, рвота, диарея, а также сыпь, боли в суставах и мышцах.
Возможность одновременной вакцинации с другими вакцинами
Менингококковые полисахаридные вакцины (МПВ2 АС, МПВ4 ACWY) можно вводить детям одновременно (в один день) с любыми вакцинами Национального календаря профилактических прививок, кроме вакцины БЦЖ (БЦЖ-м). Вакцину МПВ А разрешено применять в один день с любыми инактивированными вакцинами Национального календаря профилактических прививок. Вводить вакцины при одновременном применении следует в разные участки тела.
Менингококковую конъюгированную моновалентную вакцину МКВ С разрешено применять одновременно со следующими вакцинами (в разные участки тела): полиомиелитной (инактивированной и живой), АКДС-вакцинами (цельноклеточной и ацелюлярной), вакциной против гемофильной и пневмококковой инфекций, гепатита В, комбинированными вакцинами АКДС-Гепатит В-Полио-Хиб, против кори-краснухи-паротита (как комбинированными, так и моновакцинами).
Дети первых 2-х лет жизни, вакцинируемые МОКВ4, могут быть одновременно привиты с другими педиатрическими вакцинами (АаКДС, против гепатита В, гемофильной, пневмококковой и ротавирусной инфекций, против кори, краснухи, паротита и ветряной оспы, против гепатита А). Подросткам старше 11 лет иммунизация МОКВ4 может проводиться одновременно с АаКДС, АС и вакциной против папилломавирусной инфекции. Для детей в возрасте от 2 до 10 лет безопасность и иммуногенность других вакцин при одновременном введении с МОВ4 не подтверждена.
6. Курс аллерген-специфической иммунотерапии можно начинать через 2 недели после вакцинации, и наоборот, вакцинацию можно выполнить через 2-4 недели после введения очередной дозы аллергена.
(согласно Санитарным правилам СП3.1.2.2512-09) [3, 6].
Менактра (Menaktra) - вакцина менингококковая полисахаридная (серогрупп А, С, Y и W-135), конъюгированная с дифтерийным анатоксином
Регистрационный номер: ЛП-002636
Торговое название: Менактра
Группировочное название: вакцина для профилактики менингококковых инфекций
Лекарственная форма: раствор для внутримышечного введения
Страна-производитель: Sanofi Pasteur, США
Предварительное обследование: не требуется
Стоимость вакцины: 7700 руб.
Применяется: Для взрослых и детей
Условия отпуска из аптек: по рецепту

Оставьте заявку на вакцинацию.
Наш менеджер согласует удобное для вас время приема.
ОПИСАНИЕ ЛЕКАРСТВЕННОГО ПРЕПАРАТА
Внешний вид: Бесцветный прозрачный или слегка мутноватый раствор.
Фармакотерапевтическая группа: МИБП-вакцина.
Код АТХ: J07AH08.
Вакцина Менактра (Menaktra) представляет собой раствор очищенных капсульных полисахаридов Neisseria meningitidis групп А, С, Y и W-135 индивидульно конъюгированных с белком-носителем (очищенным анатоксином Carynebacterium diphtheriae).
Возбудителем менингококковой инфекции, включая менингит и септицемию, является бактерия N. meningitidis,. выделен ряд серотипов возбудителя. Применение вакцины Менактра вызывает выработку специфических антител против капсулярных полисахаридов серо групп возбудителя менингококковой инфекции, входящих в вакцину С, С, Y и W-1З5) , которые обладают бактерицидной активностью.
Клинические исследования по изучению эффективности не проводились, поскольку выработка сывороточных бактерицидных антител (СБА) считается показателем эффективности менингококковых вакцин.
Иммунологические свойства вакцины Менактра изучали в 3 клинических исследованиях у детей в возрасте 9-18 мес, в 4 клинических исследованиях у детей в возрасте 2-10 лет и в 6 клинических исследованиях в группе лиц в возрасте 11-55 лет. Иммуногенность оценивали по уровню этих функциональных антител, определяемых с помощью бактерицидного анализа сыворотки с применением комплемента крольчат (БАС).
Первичный иммунологический профиль изучали в рамках клинических исследований на участниках от 2 до 10 лет. Иммунный ответ оценивали непосредственно перед однократным введением вакцины Менактра и спустя 28 дней. у участников исследования наблюдали значительное повышение среднего геометрического титров (СГТ) бактерицидных антител. Во всех серо группах у 86-100 участников при исходно неопределяемых значениях титров СБА «1: 8) была отмечена сероконверсия , определяемая как 4-кратное (или более) увеличение титров антител спустя 28 дней после вакцинации.
СОСТАВ
* - каждый полисахарид конъюгирован с дифтерийным анатоксином. Содержание белка дифтерийного анатоксина в прививочной дозе составляет около 48мкг.
- Натрия хлорид 4, З5 мг;
- Натрия гидрофосфат 0, З48 мг;
- Натрия дигидрофосфата моногидрат 0,З52 мг;
- Вода для инъекций - до 0,5 мл.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Способность вакцины Менактра вызывать развитие иммунологической памяти после первичной вакцинации документирована данными клинических исследований как у детей, так и у взрослых.
Результаты З клинических исследований, проведенных у детей от 9 до 18 мес с однократным или двукратным введением вакцины Менактра отдельно или одновременно с другими педиатрическими вакцинами (пневмококковой конъюгированной вакциной СПКВ) или вакциной для профилактики кори, паротита, краснухи и ветряной оспы (КПКВ)), подтвердили, что у большинства участников в группах с двукратным введением вакцины Менактра, отдельно или одновременно с другими педиатрическими вакцинами, наблюдалось увеличение доли лиц с титром СБА
1:8 ко всем серогруппам вакцины. У 91% и 86% участников в группе с отдельным двукратным введением вакцины Менактра наблюдалось увеличение титра СБА>1:8 к серогруппам А, С, Y, и к серо группе W-1З5, соответственно. Когда вторая доза вакцины Менактра была введена одновременно с ПКВ или с КПКВ (или КПКВ + вакцина для профилактики инфекций, вызываемых Наеmорhilus influenzae), у большинства участников исследования наблюдалось нарастание титра СБА
1:8 (у > 90 участников исследования к серогруппам А, С и Y, и у > 81% участников к серогруппе W-1З5). Значения СГТ СБА оказались выше исходных ко всем четырем серо группам менингококков, включенных в вакцину.
Результаты исследований, проведенных у участников от 11 до 18 лет, подтвердили выраженный иммунный ответ на однократное введение вакцины Менактра. Значения СГТ СБА на 28-й день после вакцинации оказались значительно выше исходных. Кроме того, у 98-100 подростков, у которых первоначально титр антител не определялся «1:8), к 28-му дню наблюдалось 4-х кратное (или более) увеличение титра СБА ко всем серогруппам вакцины. Полученные результаты свидетельствуют о высокой иммуногенности вакцины у подростков. При анализе по серо группам выявлено, что у 9З-100 взрослых участников клинических исследований с исходно неопределяемыми титрами антител «1:8), к 28 дню наблюдалось 4-кратное (или более) увеличение титра СБА ко всем серо группам возбудителя, входящим в вакцину. В каждом из З исследований иммунологический ответ, индуцированный введением вакцины Менактра, оказался сходным при оценке групп по полу, возрасту и расовой принадлежности.
Кинетика иммунного ответа:
отсутствуют данные о кинетике первоначального ответа на введение вакцины Менактра, однако, как и в случае других полисахаридных и конъюгированных вакцин, иммунная защита может наблюдаться через 7-10 дней после вакцинации.
Способность вакцины Менактра индуцировать формирование иммунной памяти после первичной вакцинации была доказана в ходе клинических исследований. В одном из исследований было продемонстрировано, что персистенция бактерицидных антител в крови через З года после однократного введения вакцины Менактра было выше по сравнению с группой привитых , получивших однократную иммунизацию 4-валентной полисахаридной менингококковой вакциной против серогрупп А, С, Y и W-1З5. В группе привитых вакциной Менактра наблюдались более высокая концентрация сывороточных бактерицидных антител, а также более высокая доля лиц, имевших специфические высокоавидные антитела, что говорит о формировании иммунной памяти.
ПОКАЗАНИЯ К ПРИМЕНЕНИЮ
Профилактика инвазивной менингококковой инфекции, вызываемой N.meningitidis серогрупп А, С, Y и W-1З5 у лиц в возрасте от 9 мес до 55 лет.
Вакцинация особенно показана следующим группам с высоким риском заболевания менингококковой инфекцией:
- Люди, которые имели непосредственный контакт с пациентами, инфицированными менингококками серогрупп А, С, Y или W-135 (в семье или в учреждениях закрытого типа);
- Людям с дефицитом пропердина и компонентов комплемента; лицам с функциональной или анатомической аспленией;
- Туристам и людям, выезжающим в гиперэндемичные по менин ГО кокковой инфекции зоны, такие как страны Африки, расположенные к югу от Сахары;
- Сотрудникам исследовательских, промышленных и клинических лабораторий, регулярно подвергающиеся воздействию N. meningitidis, находящейся в растворах, способных образовывать аэрозоль;
- Cтудентам различных вузов, и, особенно, проживающих в общежитиях или в гостиницах квартирного типа;
- Призывникам и новобранцам.
ПРОТИВОПОКАЗАНИЯ
- Известная гиперчувствительность с системными проявлениями к любому компоненту вакцины, включая дифтерийный анатоксин, или на предыдущее введение других вакцин, включающих те же компоненты;
- Острые инфекционные и неинфекционные заболевания, обострение хронических заболеваний (в этих случаях вакцинацию проводят после выздоровления или в стадии ремиссии).
СПОСОБ ПРИМЕНЕНИЯ И ДОЗИРОВКА
Вакцинация проводится одной дозой 0,5 мл.
Вакцину следует вводить внутримышечно, принимая во внимание возраст и массу прививаемого: детям в возрасте от 9 до 12 мес - в передне-боковую область бедра; детям в возрасте от 12 мес и старше - в дельтовидную мышцу плеча.
у детей в возрасте от 9 до 2З мес, курс вакцинации вакциной Менактра состоит из 2 инъекций по одной дозе вакцины (0,5 мл) с интервалом не менее З мес.
у лиц в возрасте от 2 до 55 лет вакцинация проводится однократно в дозе 0,5 мл.
Исследования на животных не выявили отрицательного действия вакцины Менактра на течение беременности и фето-эмбрионального развития плода, процесс родов и постнатальное развитие. В связи с тем, что исследований вакцины у беременных женщин не проводилось, а постмаркетинговый опыт ее применения ограничен, введение вакцины беременным женщинам рекомендуется только в случае крайней необходимости, как например, во время вспышки менингококковой инфекции, перед поездкой в эндемичный район, и только после оценки соотношения пользы и риска вакцинации.
В настоящее время неизвестно, способны ли активные вещества, входящие в состав вакцины, проникать в грудное молоко. Однако ранее было показано, что антитела к полисахаридам обнаруживаются у молодых мышей, находившихся на грудном вскармливании.
В исследованиях на мышах не было продемонстрировано неблагоприятного влияния на постнатальное развитие потомства, получавшего материнские антитела с молоком и выработка которых было индуцировано введением вакцины Менактра. В то же время, эффекты у детей первого года жизни, матери которых мыши иммунизированы вакциной Менактра в период т рудного вскармливания, не исследовались. Перед принятием решения об иммунизации кормящей женщины, необходимо оценить риски и пользу данной иммунизации.
Перед введением вакцины необходимо принять необходимые меры предосторожности, направленные на профилактику тяжелых побочных реакций, которые включают изучение прививочного анамнеза пациента, выяснение наличия противопоказаний к иммунизации и оценку текущего состояния здоровья пациента.
Введение вакцины проводится под контролем медицинского работника, а в кабинете, где проводят вакцинацию, должны быть доступны необходимые средства противошоковой терапии (например, растворы эпинефрина гидрохлорида (1:1000) и глюкокортикостероидов для инъекций).
После введения вакцины Менактра отмечались случаи обморока. Необходимо предусмотреть меры для предотвращения травм, связанных с падением в обморок, а также медицинскую помощь в связи с обмороком.
ПОБОЧНЫЕ ДЕЙСТВИЯ
Характер и частота выявленных в исследованиях побочных эффектов различались в зависимости от возраста прививаемых.
- Потеря аппетита;
- Сонливость;
- Рвота;
- Диарея;
- Сыпь;
- Крапивница;
- Артралгия;
- Болезненность и уплотнение в месте инъекции;
- Раздражительность, покраснение в месте инъекции, отек в месте инъекции, лихорадка.
- Снижение аппетита;
- Сонливость;
- Диарея;
- Рвота;
- Сыпь, крапивница;
- Артралгия;
- Болезненность и уплотнение в месте инъекции;
- Раздражительность, покраснение в месте инъекции, отек в месте инъекции, лихорадка.
- Снижение аппетита;
- Головная боль;
- Диарея;
- Рвота;
- Сыпь;
- Артралгия;
- Боль, уплотнение, покраснение и отек в месте инъекции, повышенная утомляемость, общее недомогание;
- Озноб, лихорадка.
ПЕРЕДОЗИРОВКА
Нет достоверных данных.
ВЗАИМОДЕЙСТВИЕ С ДРУГИМИ ЛЕКАРСТВЕННЫМИ СРЕДСТВАМИ
Вакцину Менактра применяли одновременно с полисахаридной вакциной для профилактики брюшного тифа и с адсорбированной вакциной, содержащей столбнячный и дифтерийный анатоксины, предназначенной для использования у взрослых (Тd), у лиц в возрасте 18- 55 лет и 11-17 лет, соответственно.
У детей младше 2 лет вакцину Менактра применяли совместно с одной или несколькими из следующих вакцин: пневмококковой конъюгированной вакциной (ПКВ), вакциной для профилактики кори, паротита, краснухи, вакциной для профилактики ветряной оспы или вакциной для профилактики вирусного гепатита А.
Отсутствуют данные для оценки безопасности и иммуногенности вакцины Менактра при совместном применении в возрасте 18 мес с АКДС- содержащими вакцинами.
Титры пневмококковых антител против некоторых серотипов содержащихся в 7-валентной пневмококковой конъюгированной вакцине (ПКВ7) были снижены после одновременного введения вакцины Менактра и вакцины ПКВ7.
БЦЖ вакцина не должна применяться одновременно с вакциной Менактра. Вводить вакцины необходимо всегда в разные участки тела, используя отдельные шприцы для каждой из них.
ОСОБЫЕ УКАЗАНИЯ
Запрещено вводить вакцину Менактра внутривенно, подкожно или внутрикожно, поскольку данные о безопасности и эффективности вакцины при подкожном, внутривенном и внутрикожном введении отсутствуют.
Запрещается смешивать вакцину Менактра в одном шприце с другими вакцинами или препаратами.
Применение вакцины у лиц с тромбоцитопенией или нарушениями свертываемости крови не изучалось . Как и в случае других вакцин, вводимых внутримышечно, следует оценить соотношение пользы и риска применения вакцины у лиц с повышенным риском развития кровотечения при внутримышечной инъекции.
Риск развития синдрома Гийена-Барре (СГБ) после вакцинации Менактрой оценивался в рамках постмаркетингового ретроспективного когортного исследования. Описаны случаи развития СГБ, характеризовавшиеся наличием связи по времени с введением вакцины Менактра. Лица, которым ранее был установлен диагноз СГБ, могут составлять группу повышенного риска развития данного состояния после введения вакцины Менактра. Решение об использовании вакцины Менактра в данной ситуации должно приниматься после оценки потенциальных пользы и рисков.
Вакцина не предназначена для профилактики менингитов, вызванных другими микроорганизмами или для профилактики инвазивной менингококковой инфекции, вызванной менингококками серогруппы В у лиц с нарушенным иммунным статусом, а также на фоне иммуносупрессивной терапии, может наблюдаться сниженный иммунный ответ на введение вакцины Менактра.
Как при любой вакцинации, защитный иммунитет может вырабатываться не у всех 100 привитых.
Перед применением вакцины медицинский работник или лечащий врач должен информировать пациента, его родителей, опекунов или других ответственных взрослых лиц о возможной пользе и риске для пациента, связанных с введением вакцины.
Исследований по изучению влияния вакцины на способность к управлению автомобилем и другими механизмами не проводилось.
ФОРМА ВЫПУСКА
Внешний вид: Раствор для внутримышечного введения 0,5 мл/доза.
По 1 или 5 флаконов вместе с инструкцией по медицинскому применению в пачке картонной.
УСЛОВИЯ ХРАНЕНИЯ
При температуре от 2 до 8 С·. Не замораживать. Хранить в недоступном для детей месте.
Препарат, подвергшийся замораживанию, использованию не подлежит.
СРОК ГОДНОСТИ
Срок годности - 2 года.. Не использовать по истечении срока годности, указанного на упаковке.
УСЛОВИЯ ОТПУСКА
Препарат отпускается по рецепту .
ПРОИЗВОДИТЕЛЬ
Санофи Пастер Инк., США
Sапоfi. Pasteur Inc.,
Discovery Dri.ve, Swiftwater, Pennsylvania, 18370, USA
ПРЕТЕНЗИИ
Обо всех случаях необычных прививочных реаций и при выявлении рекламаций на качество препарата следует сообщать по адресу:
Федеральная служба по надзору в сфере здравоохранения (Росздравнадзор):
Записаться на прием, получить консультацию

Оставьте заявку на вакцинацию.
Наш менеджер согласует удобное для вас время приема.
Читайте также:


