Возбудители туберкулез по мокроте
Патогенные микобактерии - Ф. К. Черкес
Глава 33. Возбудители туберкулеза
Представители семейства микобактерий Mycobacteriaceae имеют вид тонких, иногда ветвистых палочек, чем напоминают гриб. Медленный рост на питательных средах также сближает их с грибами. Эти особенности объясняют название семейства, рода - Mycobacterium.
Микобактерий кислото-щелоче- и спиртоустойчивы, что обусловливается наличием в оболочках их клеток жировосковых веществ.
Род микобактерий включает патогенных и непатогенных представителей. Патогенными для человека являются возбудители туберкулеза и возбудитель лепры.
Туберкулез широко распространен среди животных, птиц, грызунов.
Существуют несколько видов туберкулезных палочек:
1. Человеческий - Mycobacterium tuberculosis
2. Бычий - Mycobacterium bovis
3. Птичий - Mycobacterium avium
4. Мышиный - Mycobacterium murium
5. Встречаются микобактерий, вызывающие заболевания у холоднокровных. К ним относится особая группа атипичных микобактерий.
В настоящее время атипичные микобактерий приобретают особое значение. Их делят по ряду признаков на 4 группы: I, II, III, IV (по Раньону). Они отличаются от микобактерий туберкулеза меньшей требовательностью к питательным средам. Между собой они различаются по отношению к питательным средам, скорости роста, по способности образовывать пигмент, а также по каталазной и пероксидазной активности. Вызывают заболевания у человека представители групп I и III.
Морфология. Возбудители туберкулеза были открыты р. Кохом в 1882 г. Это тонкие палочки величиной 1,5-4 × 0,3-0,5 мкм. Они очень полиморфны: встречаются прямые, изогнутые, колбовидные. Как результат изменчивости бактерий, имеются кислотоподатливые формы и очень мелкие, так называемые зерна Муха. Разнообразие форм нередко зависит от состава среды, воздействия на них антибиотиков и химиотерапевтических средств. Бактерии туберкулеза неподвижны, не имеют спор и капсул. Грамоположительны, однако они плохо воспринимают анилиновые краски. Хорошо окрашиваются в красный цвет по методу Циля- Нильсена (см. рис. 4), где используются концентрированные краски и протравливание.
Культивирование. Возбудители туберкулеза - аэробы. Растут при температуре 37-38° С и рН среды 5,8-7,0, Отличительными культуральными особенностями туберкулезной палочки являются медленный рост и требовательность к питательным средам. Первично они растут только на специальных средах: среде Петраньяни, Петрова, Левенштейна - Йенсена. Их можно выращивать на глицериновом бульоне, глицериновом агаре, глицериновом картофеле. Глицерин стимулирует рост микобактерий. М. bovis не нуждаются в глицерине. Наибольшее распространение получила среда Левенштейна - Йенсена, которая рекомендована ВОЗ в качестве стандартной среды для выращивания туберкулезных палочек. В настоящее время пользуются также средой Финна II, которая отличается от среды Левенштейна - Йенсена тем, что вместо аспарагина в ней используется глутамин натрия. На этой среде микобактерий туберкулезарастут несколько быстрее, чем на среде Левенштейна - Йенсена, и процент выделения культур выше. Туберкулезные палочки можно культивировать и на синтетических средах, например среде Сотона.
Микобактерий туберкулеза встречаются в R- и S-форме. Более вирулентной является R-форма (М. bovis чаще встречается в R-форме). На плотных питательных средах возбудители туберкулеза образуют сухие морщинистые колонии кремового цвета с чуть приподнятым Центром и изрезанными краями (см. рис. 26). В жидких питательных средах микобактерий туберкулеза вырастают на 10-15-й день в виде пленки, которая постепенно утолщается, становится грубой, морщинистой, ломкой и в силу тяжести иногда падает на дно. Бульон под пленкой остается прозрачным.
Ферментативные свойства. Возбудители туберкулеза биохимически мало активны. У них обнаружен протеолитический фермент, который в определенных условиях (кислая и щелочная среда) расщепляет белок. Они расщепляют также некоторые углеводы, образуют уреазу. Но свойства эти непостоянны. Поэтому изучение ферментов не имеет диагностического значения.
Токсинообразование. Возбудители туберкулеза образуют эндотоксин - это белковое вещество впервые выделил Р. Кох (1890) и назвал его туберкулином. "Старый" туберкулин - это культуральная жидкость, полученная при росте культуры в глицериновом бульоне и выпаренная при 70° С до 1 /10 своего первоначального объема. "Новый" туберкулин - очищенный белковый дериват туберкулина.
Туберкулин обладает свойствами аллергена. Он не оказывает токсического действия на здоровый организм. Его действие проявляется только в зараженном организме. Поэтому введение туберкулина используют с диагностической целью, в постановках аллергических проб (Пирке или Манту). Для этой цели туберкулин готовят из бычьего типа микобактерий туберкулеза.
Вирулентные штаммы возбудителей туберкулеза содержат особый липид корд-фактор, который способствует склеиванию микобактерий и росту их в виде кос и тяжей.
Антигенная структура. Микобактерий туберкулеза содержат антиген, в который входят белковые, липоидные и полисахаридные факторы. Этот антиген вызывает в организме выработку антител (агглютининов, преципитинов, комплементсвязывающих веществ и др.). Однако эти антитела обнаруживаются в малых концентрациях, поэтому практически с целью диагностики мало используются.
Устойчивость к факторам окружающей среды. Микобактерий туберкулеза самые устойчивые из неспороносных форм бактерий (устойчивость обусловливается наличием в их оболочке липидов). Температуру 100° С они переносят в течение 5 мин. УФ-лучи вызывают их гибель только через несколько часов.
В высохшей мокроте они живут до 10 мес. При низких температурах микобактерий туберкулеза длительно сохраняются.
Дезинфицирующие растворы: сулема (1:1000), карболовая кислота (5%) губят их только через сутки. Наиболее чувствительны они к хлорамину и хлорной извести.
Восприимчивость животных. К М. tuberculosis человек очень чувствителен, животные и птицы малочувствительны. Из экспериментальных животных к нему высокочувствительны морские свинки, у которых инфекция протекает генерализованно и заканчивается обычно гибелью животного.
К M. bovis чувствительны крупный и мелкий домашний скот и домашние животные (человек малочувствителен, но дети могут заражаться при использовании молока больных животных).
Из экспериментальных животных наиболее чувствительны кролики, у которых инфекция протекает генерализованно. М. avium вызывает заболевание у птиц: кур, голубей, фазанов и т. д. Однако могут болеть и некоторые животные (человек редко заражается).
Из экспериментальных животных чувствительны кролики. Инфекция протекает у них остро.
Мышиный вид патогенен главным образом для полевок. У кроликов и морских свинок заболевание протекает в хронической форме.
Источники инфекции. Человек. Реже животные.
Пути передачи. Наиболее частые пути передачи - воздушно-капельный и воздушно-пылевой; реже пищевой. Возможно внутриутробное инфицирование через плаценту.
Заболевания у человека и патогенез. Заболевание туберкулезом характеризуется многообразием клинических форм. Различают легочную (наиболее часто встречающуюся) и внелегочные формы: туберкулез желудка и кишечника, почек, мозговых оболочек, костей и других органов.
Каждая из этих форм может закончиться генерализацией процесса. При воздушно-капельном и воздушно-пылевом заражении первичный очаг возникает в легком. В пораженном органе образуется бугорок - tubercul. Бугорок представляет собой скопление лейкоцитов и гигантских клеток, внутри которых находятся микобактерий туберкулеза. При хорошей сопротивляемости организма соединительная ткань окружает бугорок, он обызвествляется и бактерии, оставаясь жизнеспособными, не выходят за пределы бугорка. Таков "очаг Гона" - обызвествленный, небольшой очаг на месте первичного внедрения туберкулезной палочки (закрытый процесс).
При закрытом процессе палочки туберкулеза не выделяются с мокротой, мочой и др.
Таким образом, даже при доброкачественном течении процесса организм не освобождается от возбудителей туберкулеза. Считают, что 80% людей инфицированы туберкулезными бактериями. Однако клинически они здоровы. Когда организм попадает в неблагоприятные условия, защитные функции его снижаются, бугорок подвергается некрозу, бактерии высвобождаются и вовлекают в процесс новые участки, наступает обострение, образуются каверны - открытый процесс. Иногда может быть генерализация процесса, которая приводит организм к гибели. Чаще туберкулез протекает в хронической форме (закрытый процесс). Большое значение при обострении имеют условия труда и быта.
Иммунитет. Человек обладает определенной резистентностью, т. е. при заражении не всегда возникает заболевание, а образуется инфекционный (нестерильный) иммунитет, который обусловливается комплексом защитных факторов: гуморальных, клеточных, а также резистентностью органов и тканей.
Профилактика. Ранняя диагностика, изоляция и т. д. Для специфической профилактики используется живая вакцина БЦЖ (BCG), полученная французскими учеными Кальметтом и Гереном. Эту вакцину вводят новорожденным однократно, внутрикожно в наружную поверхность плеча. Ревакцинацию проводят через 7-12 лет, а затем через каждые 5-6 лет до 30 лет.
Лечение. Антибактериальные препараты: стрептомицин, рифампицин, ПАСК, фтивазид и др.
1. Кем и когда был открыт возбудитель туберкулеза?
2. На какие типы делится туберкулезная палочка? Какой тип патогенен для человека?
3. Что обусловливает устойчивость микобактерий туберкулеза?
4. Каким методом окрашивают мазки для обнаружения туберкулезных микобактерий?
5. На какие формы диссоциируют микобактерий туберкулеза и какая форма является патогенной?
Цель исследования: выявление возбудителя.
1. Мокрота (туберкулез легких и бронхов).
2. Экссудат из плевральной полости (туберкулез легких, плевры).
3. Асцитическая жидкость и кал (кишечная форма туберкулеза).
4. Моча (туберкулез почек).
5. Спинномозговая жидкость (туберкулезный менингит).
6. Кровь (генерализация процесса).

Способы сбора материала
Примечание. Баночки для сбора материала должны быть с завинчивающимися пробками. Посуду для сбора материала стерилизуют в автоклаве при 120° С в течение 20 мин или кипячением в течение 1 ч.

Ход исследования
1. На каких питательных средах выращивают микобактерии туберкулеза и какова длительность их роста?
2. Чем и для чего обрабатывают мокроту до посева ее на питательные среды?
3. Опишите рост туберкулезной палочки на плотной и жидкой питательных средах.
4. Какое животное является наиболее чувствительным к человеческому типу туберкулезной палочки?
Среда Левенштейна - Йенсена: солевой раствор; однозамещенный фосфат калия - 2,4 г; магния сульфат - 0,24 г; магния цитрат 10,6 г; аспарагин - 3,6 г; глицерин - 12 мл; картофельная мука - 5 г; вода дистиллированная - 600 мл.
Реактивы растворяют в указанной последовательности при слабом подогреве и стерилизуют 2 ч текучим паром. Солевая основа может быть приготовлена с запасом на 3-4 нед.
Яичная масса. 24-27 (в зависимости от величины) свежих диетических яиц моют проточной теплой водой, щеткой с мылом, погружают на 30 мин в 70% спирт, затем над спиртовкой в боксе разбивают стерильным пинцетом в колбу с бусами, хорошо размешивают и к 1 л яичной массы добавляют 600 мл солевого раствора. Смесь фильтруют через марлевый фильтр, добавляют 20 мл стерильного 2% раствора малахитового зеленого и разливают в пробирки по 5 мл. Свертывание производят при 85° С в течение 45 мин.
Среда Финна II. Солевая основа: магния сульфат - 0,5 г; натрия цитрат - 1 г; квасцы железоаммиачные - 0,05 г; калия фосфат однозамещенный - 20 г; аммония цитрат однозамещенный - 20 г; натрия глутамат однозамещенный - 5 г; глицерин - 20 мл; вода дистиллированная - до 1 л.
Ингредиенты растворяют в указанном порядке в теплой дистиллированной воде. Устанавливают рН 6,3-6,5. Стерилизуют при 1 атм 20 мин.
Яичная среда. 12 яиц моют щеткой с мылом, обрабатывают спиртом. Разбивают стерильным пинцетом и выливают в стерильную колбу с бусами, которую после добавления каждого яйца встряхивают до образования однородной массы. Добавляют 10 мл 20% водного раствора малахитового зеленого и 300 мл солевого раствора. Фильтруют через марлевый фильтр и свертывают при температуре 85° С в течение 30 мин.
Синтетическая среда Сотона. К 200 мл дистиллированной воды добавляют 4 г аспарагина, 0,5 г цитрата железа, 2 г лимонной кислоты, 0,5 г сульфата магния, 0,5 г основного фосфата калия, 60 г глицерина, 800 мл дистиллированной воды.
Общие свойства мокроты и ее микроскопия. До того как мокрота будет исследована на наличие микобактерий, лаборант по ее внешнему виду определяет количество, запах, цвет, консистенцию, характер. Жидкую мокроту, состоящую из гнойных клеток, определяют как гнойную; мокроту с преобладанием гноя или слизи — как гнойно-слизистую или сли-зисто-гнойную; мокроту без гноя, содержащую только слизь, как слизистую, содержащую только кровь,— как кровянистую, а с примесью слизи и гноя — как кровянисто-слизисто-гнойную.
По консистенции мокрота может быть тягучей, студенистой, умеренно вязкой, жидкой.
Далее под микроскопом исследуют нативный препарат мокроты, для чего готовят 2 препарата на одном предметном стекле и накрывают двумя покровными стеклами. Исследование проводят при малом увеличении (объектив 10, окуляр 7) и с объектом 40.
В нативном препарате определяют наличие лейкоцитов, эозинофилов, эритроцитов, клеток эпителия, эластических и других видов волокон и прочих элементов.
Для диагностики туберкулеза большое значение имеет обнаружение в препарате эластических волокон, присутствие которых указывает на разрушение ткани. Эластические волокна в мокроте могут быть и при других заболеваниях (например, при абсцессе легких, новообразованиях, эхинокок-козе и др.). Под микроскопом эластические волокна имеют вид длинных, блестящих волокнистых образований равномерной толщины.
При наличии каверны эластические волокна покрываются мылами и приобретают вид кораллов. Коралловидные волокна образуются при наличии в каверне жира, солей кальция и магния, образующих мыла, которые и покрывают эластические волокна. Если в мокроту добавить 10 % раствор едкой щелочи, то мыла очищаются и выявляются обычные эластические волокна.
Большое диагностическое и прогностическое значение имеет выявление в препарате так называемой тетрады Эрлиха, в которую входят следующие элементы:
- 1) обызвествленные эластические волокна,
- 2) обызвествленные частицы жирового распада,
- 3) кристаллы холестерина,
- 4) измененные микобактерии туберкулеза.
Такие элементы в мокроте наблюдаются при распаде старых обызвествленных очагов.
Методы обнаружения и выделения возбудителя туберкулеза. Наиболее надежным подтверждением диагноза туберкулеза является обнаружение возбудителя в выделениях больного или взятых из организма материалах.
Основным материалом для исследования является мокрота. При отсутствии мокроты исследуют слизь из гортани или промывные воды бронхов, иногда — промывные воды желудка. Исследованию подлежат также моча, кал, спинномозговая жидкость, экссудат из плевральной полости, ас-цитическая жидкость, пунктат из закрытых натечников. При необходимости исследуют кусочки тканей или органов, взятые у больных во время операции. Материал для исследования должен быть взят с соблюдением правил асептики.
Результаты исследований во многом зависят от правильности сбора материала, его обработки и хранения. Важное значение имеет и правильное приготовление мазков или материала для посева на питательные среды.
Для обнаружения МТ в выделениях больного применяют бактериоскопический (микроскопия мазков), бактериологический (посев материала на питательные среды) и биологический (заражение лабораторных животных) методы.
Сбор и подготовка материала для исследования.
Мокрота. Следует собирать утренние порции мокроты и исследовать ее в тот же день. Если у больного мало мокроты, то ее собирают в течение дня (суточная мокрота). Для усиления секреции мокроты применяют раздражающую аэрозольную ингаляцию, для чего используют аэрозольный ингалятор типа АИ-1. Для ингаляции рекомендуется 15 % раствор натрия хлорида в 1 % растворе натрия гидрокарбоната. Ингалируют 30—60 мл раствора, нагретого до 42—45 °С. Индивидуальные мерные стаканчики и мундштуки подлежат дезинфекции. При отсутствии мокроты у больных получают промывные воды бронхов. У детей чаще исследуют промывные воды желудка, так как они плохо откашливают мокроту и заглатывают ее.
Лучше исследование мокроты проводить до начала лечения ежедневно в течение 3 дней подряд. Объяснить больному, что он должен собирать не носоглоточную слизь и слюну, а отделяемое из верхних дыхательных путей при кашле.
Перед сбором мокроты больной должен прополоскать рот и зев кипяченой водой. Мокрота должна быть собрана в стерильную плевательницу. Промывные воды бронхов получает врач-ларинголог. Для микроскопии и посева используют осадок, полученный при центрифугировании промывных вод.
Моча. В мочу могут попасть непатогенные микобактерии смегмы, которые имеют морфологическое сходство с мико-бактериями туберкулеза. Поэтому перед взятием мочи необходим тщательный туалет наружных половых органов. Утреннюю мочу следует брать стерильным катетером в стерильную посуду. Если результат утренней порции мочи отрицателен, то 2—3 дня подряд берут суточную порцию мочи, которую отстаивают в течение ночи, верхний слой сливают, а остаток центрифугируют в течение 30 мин при 3000 об/мин. Осадок используют для приготовления мазка и посева.
Кал. В хлопьях слизи и гноя можно обнаружить микобактерии туберкулеза (методом бактериоскопии и посева).
Спинномозговая жидкость. Ее оставляют на сутки при комнатной температуре. На поверхности жидкости образуется фибринозная пленка, из которой и делают мазок на стекле. При отсутствии пленки жидкость центрифугируют при 2000 об/мин в течение 30 мин, после чего ее сливают, а из осадка делают мазок.
Бактериоскопия (микроскопия) мазков. Микроскопическое исследование мазков является наиболее простым, доступным, дешевым и быстрым методом обнаружения микобактерий. Он остается одним из основных методов исследования.
Недостатком прямой бактериоскопии окрашенных мазков является низкая чувствительность метода. При микроскопии можно обнаружить М'Г в мокроте, если в 1 мл мокроты содержится не менее 10000—100000 палочек. В настоящее время под влиянием химиотерапии количество микробов в мокроте значительно снижается, что создает дополнительные трудности в выявлении возбудителя. В связи с этим в повседневной практике работы широко применяют методы обогащения и накопления микобактерий, которые позволяют концентрировать возбудителей туберкулеза в небольшом объеме материала. Совершенствуются и сами методы бактериоскопии и выделения возбудителя.
Мазки для микроскопии готовят из любого материала, полученного от больного (мокрота, кал, моча, плевральный экссудат, гной, спинномозговая жидкость).
Приготовление мазков из мокроты. Мокроту выливают в чашку Петри, под которую подкладывают лист черной бумаги, на фоне последней хорошо заметны жел-тогнойные комочки, которые и следует отбирать. Гнойные комочки деревянными заостренными палочками переносят на предметное стекло. Мазок готовят путем растирания комочков между 2 стеклами. Затем мазок высушивают на воздухе, фиксируют путем проведения мазка через пламя горелки и окрашивают по Цилю-Нильсену.
Окраска мазка по Цилю-Нильсену. На мазок наливают основной фуксин Циля и подогревают его до появления пара. После остывания мазка краску сливают и мазок промывают водопроводной водой, обесцвечивают 10—15 % раствором серной кислоты или 3 % раствором солянокислого спирта до появления бледно-розового цвета и после этого снова промывают водой. Затем мазок докрашивают 0,5 % раствором метиленового синего в течение 1/2 мин. Мазок промывают водой и высушивают.
На мазок наносят каплю кедрового масла и микроско-пируют. Микобактерии под микроскопом окрашены в рубиново-красный цвет в виде тонких прямых или слегка изогнутых палочек и располагаются единично или небольшими группами на сине-голубом фоне, в который окрашены вещество мокроты и различные клетки. При лечении химиопрепаратами микобактерии часто приобретают вид толстых и грубых палочек, похожих на кокки, и имеют более светлую окраску.
Бактериоскопия дает приблизительно на 10 % больше положительных результатов при использовании метода флотации, позволяющего в 5—10 раз увеличить концентрацию микобактерий.
Метод флотации заключается в том, что бензин, бензол, ксилол, толуол и другие углеводороды легче воды, добавленные в мокроту с водой, при встряхивании разбиваются на мельчайшие капельки, которые, поднимаясь кверху, адсорбируют на себе микобактерии.
В банку объемом 250 мл со стеклянными бусами вносят 10—15 мл мокроты (или другого исследуемого материала — кал, осадок мочи, экссудата и др.), добавляют примерно равное количество 0,5—1 % раствора едкого натра и встряхивают до полного разжижения мокроты. Затем добавляют 100 мл дистиллированной воды и 0,5—1 мл любого углеводорода и встряхивают в течение 5—10 мин. После этого в бутылку добавляют дистиллированной воды до горлышка и оставляют при комнатной температуре на 30—60 мин. На поверхности появляется беловатое пенистое флотационное кольцо, которое отсасывают пастеровской пипеткой с резиновым баллончиком и наносят на предметное стекло. По мере подсыхания капли на нее наносится новая порция. Наслаивание после подсыхания проводится 4—5 раз. После этого мазок фиксируют и окрашивают по Цилю-Нильсену.
Для концентрации возбудителя широко применяют также метод седиментации (осаждения). К мокроте прибавляют равный объем 10 % раствора натрия фосфата, который является хорошим гомогенизатором мокроты, не нарушает жизнедеятельность микобактерий и в то же время угнетает рост сопутствующей микрофлоры. После добавления натрия фосфата смесь инкубируют при температуре 37 °С в течение 24 ч, затем центрифугируют 5—10 мин при 2000 об/мин. Надосадочную жидкость потом сливают, а осадок используют как для посева, так и для микроскопии.
Более чувствительной является люминесцентная микроскопия, которая на 20—30 % по сравнению с обычной увеличивает положительный результат. Этот метод основан на способности липидов микобактерий воспринимать люминесцентные краски, которые светятся при облучении их короткими синими или ультрафиолетовыми лучами. Светящиеся микобактерии хорошо видны. Мазок можно просматривать при малом увеличении гораздо быстрее, чем при объективе с иммерсией. Мазок готовят как обычно, фиксируют смесью Никифорова и пропитывают специальными красителями (флюорохромами): аурамином в разведении 1:1000 или родамином С. Затем мазок обесцвечивают солянокислым спиртом и докрашивают кислым фуксином. Под микроскопом микобактерии светятся на темном фоне ярким золотисто-зеленым цветом. Микроскопию проводят в люминесцентном микроскопе или на обычном с опакиллюминатором (насадкой), пропускающим короткие синие и ультрафиолетовые лучи.
Недостаток метода микроскопии состоит в том, что он не позволяет безусловно дифференцировать патогенные и непатогенные микобактерии. С целью ориентировочной дифференциации патогенных и непатогенных микобактерий при микроскопии используют более длительное обесцвечивание мазков кислотой или спиртом. Сапрофиты после этого частично или полностью обесцвечиваются, а патогенные микобактерии удерживают окраску.
В последние годы появилась возможность отличать в мазках живые и мертвые микобактерии, что может служить дополнительным важным критерием оценки эффективности лечения. Суть метода состоит в том, что дезоксирибонуклеи-новая кислота (ДНК) живых микобактерий воспринимает окраску метиленовым зеленым, а у мертвых ДНК этой окраской не окрашивается. В то же время ДНК мертвых микобактерий может окрашиваться дополнительными красителями: пиронином, сафронином или карболовым фуксином.
Наиболее надежным, достоверным и чувствительным методом диагностики туберкулеза является метод выделения чистой культуры микобактерий (бактериологический). Этот метод позволяет выявить микобактерии при содержании 20—100 возбудителей в исследуемом материале, увеличивает положительный результат на 15—30 %. Выделенную культуру можно изучить, дифференцировать от непатогенных микобактерий, определить ее вирулентность и устойчивость возбудителя к лечебным препаратам. Недостатками бактериологического метода являются сложность обработки материала и длительный рост возбудителя на средах.
Засеваемый материал гомогенизируют и одновременно обрабатывают серной или соляной 6 % кислотой или 4—6 % раствором едкого натра для уничтожения посторонней микрофлоры. Осадок после центрифугирования служит материалом для посева. Посев производят на яичную среду Левенштейна-Йенсена, которая рекомендована Всемирной организацией здравоохранения в качестве стандартной среды. Посев материала делают в 5 пробирок. При обработке материала серной кислотой вся процедура подготовки для посева должна быть выполнена быстро — в пределах 15 мин, так как более длительная экспозиция в кислоте снижает способность микобактерий к росту. Микобактерии вырастают на среде на 15—25-й день после посева. Жидкие материалы (моча, ликвор, экссудат, промывные воды желудка и бронхов) перед посевом необходимо центрифугировать и для устранения посторонней микрофлоры обработать осадок 3 % раствором серной кислоты в течение 20 мин. После этого обработанный кислотой материал повторно центрифугируют, а осадок используют для посева на среду. Ликвор, полученный стерильно, засевают без обработки кислотой.
Можно делать также посев мазка из гортани. Мазок берут ватным тампоном с надгортанника под контролем гортанного зеркала. Тампон помещают в небольшой объем 3—5 % раствора серной кислоты, отжимают его, а раствор центрифугируют. Осадок засевают на среду.
Иногда пользуются ускоренными методами посевов, из которых наиболее известен метод Прайса. Этот метод состоит в том, что подсушенный мазок мокроты после обработки его в серной кислоте и промывания погружают в пробирки с кровяной средой на 7—10 дней. Затем мазок промывают, сушат, фиксируют и окрашивают по Цилю-Нильсену. Применение для обработки мокроты поверхностно-активных веществ (лаурилсульфат; лауросепт и др.) значительно увеличивает рост микобактерий.
Для посева патологического материала используют плотные, полужидкие и жидкие питательные среды, но ни одна из них не обладает всеми необходимыми качествами. Поэтому посев делают на 2—3 различные среды. Чистые культуры выделяют на плотных, полужидких яичных и агаровых средах.
В настоящее время обязательно определение устойчивости микобактерий к стрептомицину, тубазиду и ПАСКу (парааминосалициловая кислота). С этой целью готовят набор сред Левенштейна с тремя разными концентрациями каждого препарата. Микобактерии, которые растут при концентрации 10 мкг/мл и более стрептомицина и ПАСКа и при концентрации 1 мкг/мл и более тубазида, считаются лекарственно-устойчивыми.
Большое значение в микробиологической диагностике туберкулеза имеет определение количества микобактерий в исследуемом материале для оценки тяжести процесса, тактики лечения и его эффективности.
Биологический метод исследования основан на заражении патологическим материалом морских свинок, которые очень чувствительны к туберкулезной инфекции. Этот метод признается более чувствительным для обнаружения микобактерий. Появление измененных под влиянием химиотерапии микобактерий иногда дает отрицательные результаты заражения животных при положительных результатах посева на среды. Это происходит в результате значительного снижения или полной утраты микобактериями вирулентности. С целью повышения количества положительных результатов морским свинкам перед заражением ежедневно вводят большие дозы кортизона, снижающего их резистентность. Через 3—4 нед после введения исследуемого материала морской свинке ставят туберкулиновую пробу. Положительная реакция будет свидетельствовать о присутствии микобактерий туберкулеза. Если животное не погибает через 3 мес, его забивают и различные ткани подвергают микроскопическому исследованию. Для целей диагностики этот метод в настоящее время имеет ограниченное применение, поскольку посев на питательные среды дает достаточно хорошие результаты.
Туберкулез — опасное инфекционное заболевание, которое поражает внутренние органы человека и животных. В основном под удар попадают легкие, но также существует туберкулез почек, мочевого пузыря, костей и прочих органов и систем.
Несмотря на современные методы диагностики и лечения данного заболевания, статистика распространения туберкулеза остается печальной. Особенно это касается России. По некоторым данным, россияне подвержены риску заражения в десять раз больше, чем жители развитых стран. Кроме того, туберкулез встречается даже у членов благополучных семей с высоким уровнем жизни. Поэтому так важно регулярно проходить медицинские осмотры и в случае необходимости сдавать анализ мокроты на туберкулез.
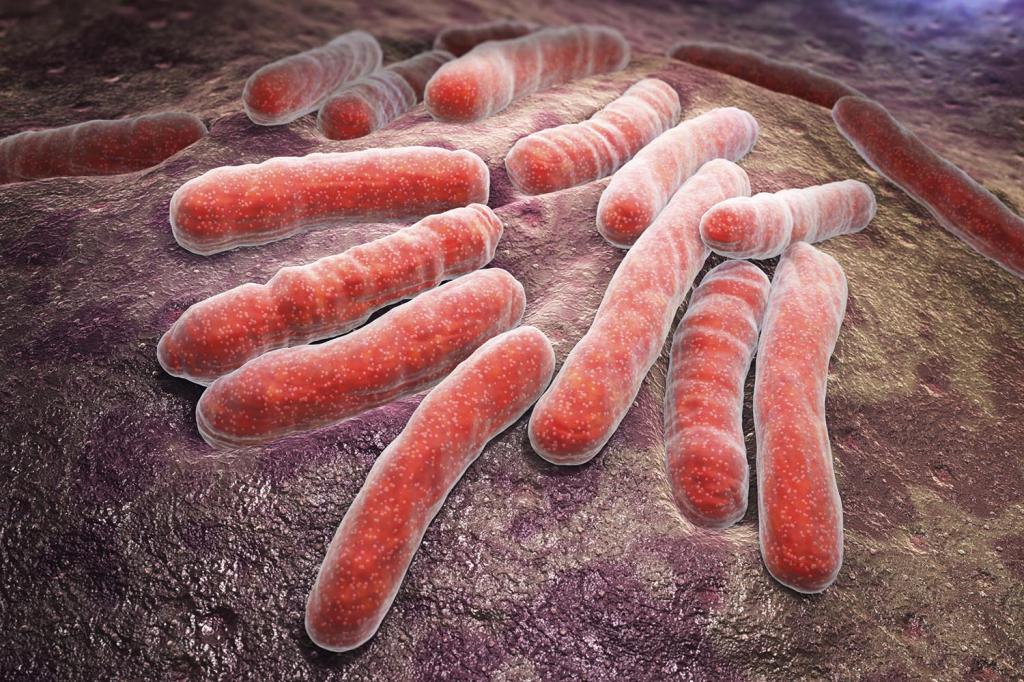
Этиология туберкулеза
Возбудитель этого опасного заболевания - палочка Коха. Это микобактерия (лат. Micobacterium tuberculosis) , которая передается воздушно-капельным путем. Бактерия относится к классу грибов, имеет небольшие размеры и плотную оболочку, которая позволяет ей выжить в окружающей среде и делает микроорганизм очень живучим. Этим и объясняется распространенность заболевания - им можно заразиться при обычном разговоре с больным, особенно если он в это время чихает или кашляет.
Коварность заболевания заключается еще и в том, что в большинстве случаев оно протекает бессимптомно. По статистике, только один из десяти случаев приобретает активную форму.
Каковы первые признаки туберкулеза?
Первыми тревожными симптомами будут являться:
- Длительный затяжной кашель.
- Появление в мокроте следов гноя и крови.
- Субфебрильные значения температуры.
- Снижение веса.
- Отсутствие аппетита.
- Постоянное ощущение усталости.
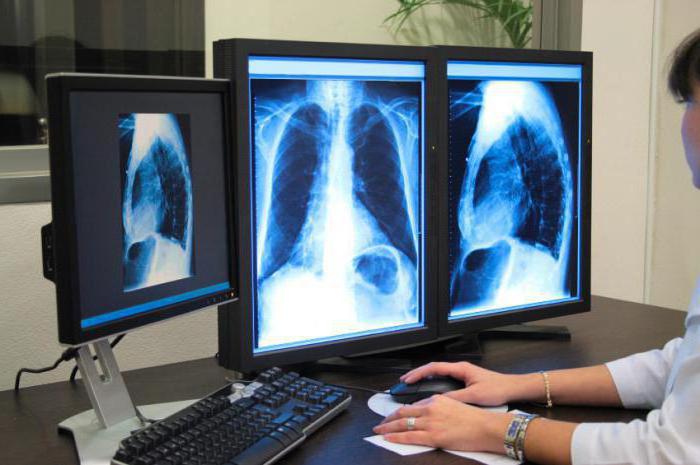
При наличии одного или нескольких признаков в обязательном порядке нужно пройти обследование. Особенно в том случае, если имеется кашель с отделением подозрительного секрета. Необходимо пройти флюорографию, которую должен делать каждый россиянин один раз в год.
В том случае, если на снимке будет обнаружено какое-либо образование, диаметр которого будет превышать один сантиметр, человека в обязательном порядке отправляют на сдачу дополнительных анализов.
Как выглядит мокрота при туберкулезе?
На начальных стадиях у пациента выделяется лишь немого секрета. Обычно он представляет собой слизь белого цвета, что объясняется высоким содержанием белка.
На последующих стадиях в слизи появляются прожилки крови и гноя. На данном этапе цвет мокроты может быть желтого, зеленого и даже красного цветов. Все зависит от соотношения в ней крови и гноя. Фото мокроты при туберкулезе последних стадий представлено ниже.

На начальных этапах мокрота, как правило, вязкая и содержит много слизи. По мере развития заболевания в ней появляется большое количество влаги, что делает ее более жидкой. Исходя из этого, можно сделать вывод, что мокрота при туберкулезе может быть самой разной консистенции.
Диагностика туберкулеза
В медицинской диагностике существует несколько способов определения заболевания у пациентов. Наиболее распространенным из них является бактериологический посев мокроты.
Анализ мокроты на туберкулез проводится в два этапа:
- Внешний осмотр мокроты (макроскопия).
- Бактериологический посев (микроскопия).
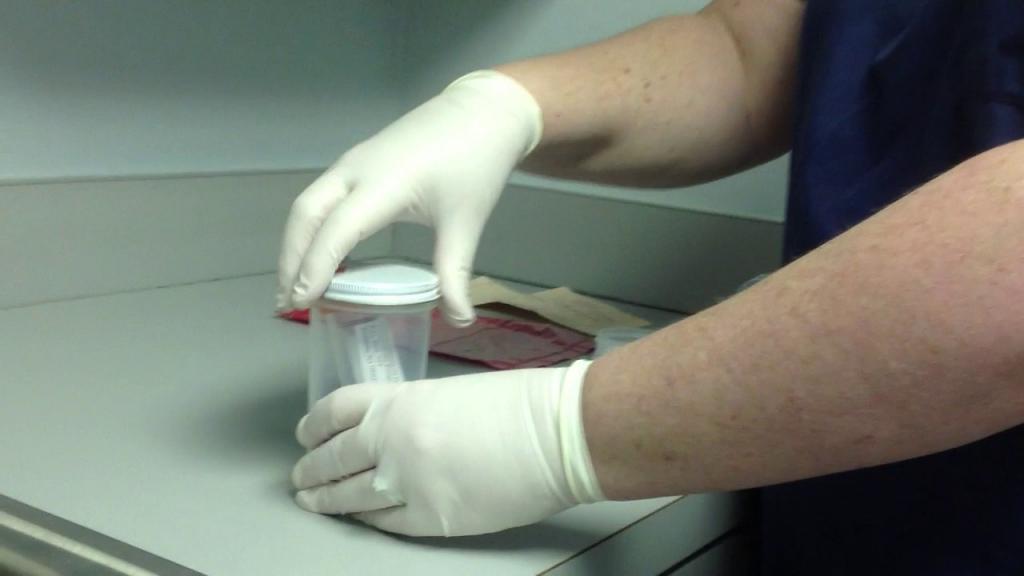
Сбор мокроты на туберкулез
Как правильно провести процедуру сбора биологического материала? У человека, больного туберкулезом, в мокроте содержится огромное количество палочек Коха. При исследовании слизистых выделений можно обнаружить возбудителя и сделать заключение о наличии или отсутствии заболевания у пациента.
Однако для точных и достоверных результатов пациенту необходимо правильно подготовиться к сдаче анализа и осуществить сбор мокроты на микобактерии туберкулеза в соответствии со всеми правилами:
- Чрезвычайно важно проводить анализ с утра, так как за ночь в верхних дыхательных путях скапливается большое количество секрета. Это поможет ему с легкостью отойти от стенок бронхов наутро.
- Пациент должен отложить завтрак, пока не будет собран биоматериал. Дело в том, что прием пищи может изменить состав мокроты при туберкулезе, а также затруднить ее отхождение.
- Некоторые врачи советуют пациентам предварительно принять отхаркивающее средство, чтобы облегчить отхождение биоматериала.
- Следует обратить внимание на то, что нужно собирать именно мокроту, а не слюну.
- Перед сдачей анализа необходимо почистить ротовую полость щеткой с зубной пастой, после чего прополоскать рот кипяченой водой. Это поможет избежать попадания в мокроту каких-либо посторонних бактерий. Чистить зубы следует зубной щеткой с жесткостью не выше средней. Это снизит риск травмирования десен и предотвратит попадание крови в мокроту. При туберкулезе она может присутствовать в биологическом материале только на поздних стадиях заболевания.
- Сдается биоматериал в специальный контейнер, который можно приобрести в любой аптеке. Контейнер является стерильным и имеет завинчивающуюся крышку, которую нужно открыть непосредственно перед взятием мокроты. После сбора контейнер сразу же закрывают.
- Для более продуктивного отхождения мокроты пациенту следует сделать три глубоких вдоха, после чего эффективно откашляться.
- Количество материала, необходимого для успешного проведения анализа, обычно можно получить за два-три отхаркивания.
- Очень важно сдавать мокроту в хорошо вентилируемом помещении. Вход в него должен быть помечен специальным знаком, означающим, что посторонним входить сюда строго запрещено. Врачи должны иметь определенный уровень защиты в виде маски или респиратора.

Проведение анализа
Даже на начальных этапах заболевания мокрота больного туберкулезом внешне отличается от нормы. Она приобретает сероватый или зеленоватый цвет, в ней присутствуют кусочки слизи или гноя. На первых стадиях наличие крови совсем необязательно, это больше характерно для кавернозной стадии, когда уже нарушена целостность сосудов.
При осмотре под микроскопом обнаруживаются овальные или слегка изогнутые палочки. Длина которых составляет от 1 до 10 мкм, а диаметр - от 0,2 до 0,6. Микобактерии туберкулеза в мокроте выглядят следующим образом: обратите внимание на фото, которое представлено ниже.
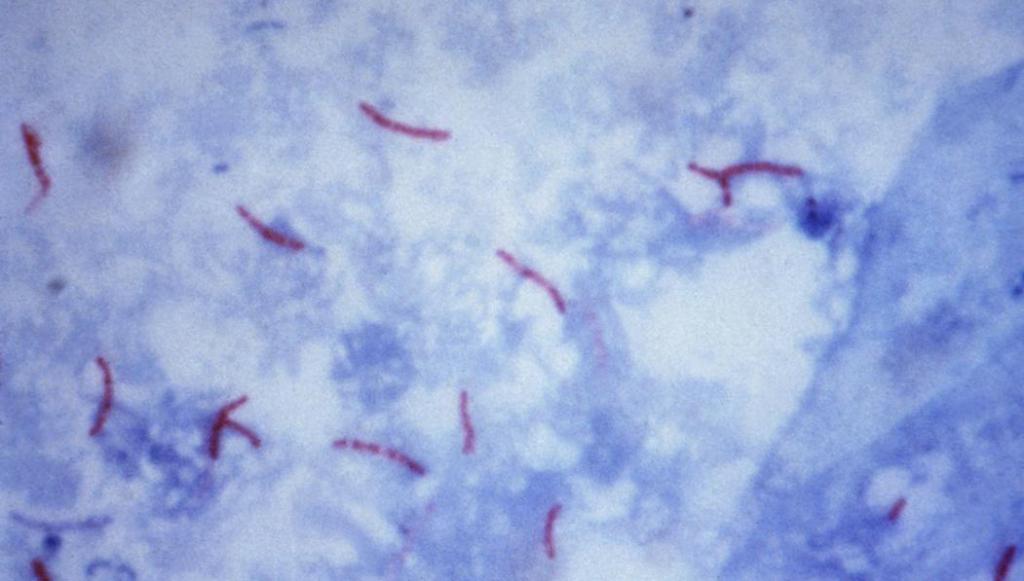
Кроме того, с помощью микроскопа можно обнаружить кальциевые соли, образования холестерина, эластичные волокна. Все это - продукты распада клеток легких. Обнаружение их в анализе говорит о том, что процесс поражения органов уже начался.
Затем проводится бактериологический посев мокроты на туберкулез:
- Лаборант проводит посев мокроты на питательную среду, помещенную в чашку Петри.
- На втором этапе работы производится окраска препарата с помощью метода Циля-Нельсона. Этот метод предполагает осветление карболовым раствором фуксина. После этого на препарат воздействуют рядом химических веществ (солянокислым спиртом, серной кислотой).
- Следующим действием является окрашивание препарата с помощью метилена синего.
- В результате этого весь препарат становится синим, а туберкулезные бациллы не окрашиваются. Поэтому в случае инфицирования их будет очень хорошо видно. Если же весь препарат синий, то это будет означать отсутствие туберкулеза у пациента.
Сколько раз требуется проведение данного анализа?
Стоит учесть, что первый отрицательный результат не является гарантией здоровья. Дело в том, что, хоть данный метод и является очень чувствительным, он гарантирует достоверность результата только при наличии в 1 мл образца не менее 100 тысяч микобактерий. Поэтому при наличии подозрений туберкулеза у пациента ему необходимо сдать мокроту еще два раза с интервалом в 1 месяц.
Чувствительность первого анализа составляет 80%, в то время как второго и третьего - 90% и 97% соответственно.
В случае, если все три анализа будут отрицательны, можно с уверенностью делать вывод о том, что пациент здоров. Анализ мокроты на туберкулез длится около двух - пяти недель. Столько времени требуется для определения возбудителей в мокроте.
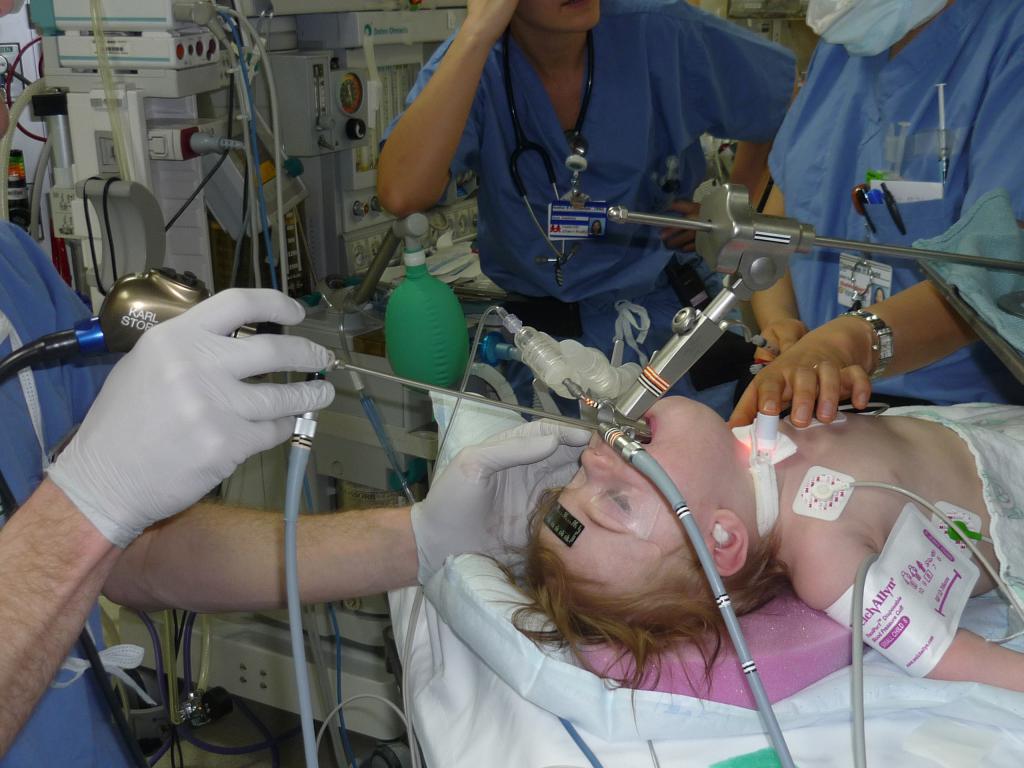
Бронхоскопия. Еще один метод диагностики туберкулеза
Однако проведение бактериологического анализа не всегда возможно. Бывают случаи, когда отхаркивание биоматериала неэффективно. Что же делать в таких ситуациях? В медицинской диагностике существует метод бронхоскопии, когда специалист с помощью аппарата берет образцы бронхолегочной ткани.
Делается данная процедура после проведения местной анестезии пациенту. В случае, если пациентом является ребенок, который не сможет спокойно лежать во время процедуры, то потребуется общий наркоз. Проведение бронхоскопии длится несколько минут, во время которых специалист вводит небольшой манипулятор через носовую или ротовую полость. На конце устройства имеется щуп, способный захватить нужное количество образца.
Один из плюсов данного метода - возможность удаления патологического секрета из бронхов больного.
ПЦР. Самый современный метод диагностики туберкулеза
Один из самых современных способов диагностики туберкулеза - проведение полимерной цепной реакции, которая заключается в выделении из биоматериала фрагмента ДНК микобактерий, что позволяет делать вывод об инфицировании пациента.
Основной ее плюс - экспрессивность. Результат анализа готов уже через 3-5 часов, а значит, не нужно ждать несколько недель, как в случае с бактериологическим посевом. К достоинствам метода также можно отнести:
- Высокую достоверность полученных результатов.
- Малое количество материала, необходимого для анализа.
- Возможность проведения анализа в любом биологическом материале.
Недостатками метода являются:
- Его высокая стоимость.
- Неэффективность анализа после противотуберкулезного лечения. Дело в том, что у выздоровевшего человека в организме присутствуют мертвые микобактерии. При этом ПЦР все равно даст положительный результат, несмотря на то, что человек уже здоров.
Заключение
В современном мире туберкулез перестал считаться смертельным заболеванием, как это было еще недавно. Данная болезнь лечится, и довольно успешно. Главное - вовремя обнаружить возбудителя в своем организме. Для этого в медицинской диагностике существует несколько эффективных способов обнаружения микобактерий туберкулеза: флюорография, бактериологический посев мокроты на туберкулез, бронхоскопия, ПЦР и другие. Не стоит пренебрегать такой возможностью. Нужно регулярно проходить медицинские осмотры, следить за общим самочувствием, стараться повышать уровень своей жизни.
Читайте также:


