Микроскопия мокроты при туберкулезе отрицательная

Палочки размножаются в лёгких, образуют там колонии, выделяются при кашле, именно поэтому исследование мокроты – важный диагностический этап. Лабораторная диагностика делается в основном микроскопическим, микробиологическим методом, бактерии культивируют на плотных средах Левенштейна-Йенсена или Финна-II, окрашивание выполняют по Цилю-Нильсену. Есть и другие технологии, но все они не идеальны, имеют свои преимущества и недостатки.
Общие сведенья о туберкулёзе
Туберкулёз легких называют ещё чахоткой, что является устаревшим названием. Возбудитель – различные представители вида Mycobacterium tuberculosis complex, которых ещё называют палочками Коха (в честь первооткрывателя). Бактерии туберкулёза поражают в основном лёгкие, где образуют многочисленные колонии. Именно поэтому можно исследовать мокроту на наличие возбудителя. Также они формируют туберкулы – полые узелки из соединительной ткани, внутри которых находится гной и масса бактерий.

Ценность лабораторной диагностики мокроты
Лабораторное исследование мокроты довольно редко проводится для обнаружения людей, заражённых туберкулёзом. Чаще применяется для подтверждения диагноза, анализа состояния пациента, подстройки лечения, дозировки при химиотерапии, контроля результатов терапии. То есть оценка мокроты является постоянным необходимым способом исследования.
К лабораторной диагностике относится множество методов:
- макроскопия,
- микроскопия,
- иммуноферментный анализ,
- флуоресцентная микроскопия,
- полимеразная цепная реакция,
- культивирование.
Показанием к исследованию мокроты лабораторными методами являются признаки туберкулёза:
- гипертермия,
- длительный продуктивный кашель,
- затемнения на флюорографии.
К достоинствам технологии относят следующие факты:
- результат можно получить достаточно быстро при ПЦР и микроскопии,
- установить точный штамм бактерии,
- проконтролировать влияние химиотерапии или антибиотиков.
Минусы анализа мокроты следующие:
- при скрытой форме туберкулёза бактерии не выделяются при кашле, из-за чего результат лабораторной диагностики будет отрицательным,
- мокроту довольно трудно собрать, для этого нужна специальная герметичная ёмкость,
- некоторые методы (культивирование) довольно длительные – более месяца.
Сбор мокроты
Можно брать экссудат следующего рода:
- материал после ингаляции небулайзером,
- промыванием бронхов специальными растворами,
- мокрота из альвеол,
- получение слизи при бронхоскопии,
- взятие биоптата их трахеи, бронхов или плевры,
- мокрота из бронхов,
- мазки с гортани.
Мокроту собирают в плотно закрывающиеся стерильные и герметичные ёмкости. Это нужно для снижения вероятности занесения микробов в окружающий мир.
Ёмкости должны соответствовать следующим требованиям:
- делаться из ударопрочного материала,
- иметь хорошую прозрачность для возможности визуальной оценки качества и количества мокроты,
- расплавляться при температуре 40-45 градусов,
- иметь объём не меньше 40-50 мл,
- отверстие должно быть шире 3 см.

Результативность и достоверность исследования мокроты зависит от правильности её сбора, соблюдения рекомендаций, которые должны минимизировать вероятность загрязнения материала. Кроме того, откашливание производится в герметичной комнате, так как данная процедура опасна для всех окружающих.
При сборе материала нужно соблюдать ряд правил:
- откашливание мокроты во флакон делается до начала химиотерапии,
- также его проводят обязательно с утра, до завтрака и приёма препаратов,
- при исследовании берут 3 пробы (каждый раз откашливая в новую ёмкость) в течение 3 суток подряд,
- материал сразу же отвозят в лабораторию (в течение часа). В идеале она должна находиться в одном здании с туберкулёзным стационаром,
- при невозможности это сделать пробу ставят в холодильник при +4оС, но держать там можно не более 2 суток,
- крайне важно следить за целостностью ёмкостей. Нарушение герметичности приводит не только к порче пробы, но и к опасному заражению окружающей среды,
- объём одной пробы должен составлять 3-5 мл,
- медицинский работник обязательно одевает халат, шапку, медицинскую маску, резиновые перчатки и специальный фартук,
- больному нужно откашливать не слюну или слизь из носа и глотки, а именно мокроту из нижних отделов бронхов. Для создания продуктивного кашля можно сделать 2-3 глубоких вдоха,
- перед откашливанием рот тщательно промывают водой, чтобы удалить естественную микрофлору и кусочки пищи,
- ёмкость держат у самых губ, после откашливания мокроту сразу сплёвывают,
- медицинский работник стоит сзади больного, чтобы мокрота не попала на него. Его задача – контролировать правильность сбора материала,
- после сбора слизи флаконы сразу герметично запечатывают,
- если больному трудно откашливать мокроту, то накануне вечером, а также рано утром перед сбором слизи пациенту даёт отхаркивающие препараты.
Режим сбора материала для лабораторного анализа на туберкулёз легких зависит от стадии развития и лечения заболевания:
- При первом поступлении в течение 3 суток делают по 3 пробы ежедневно.
- Во время лечения ежемесячно собирают 3 пробы за раз.
- На долечивании каждые 2-3 месяца берут 2 пробы мокроты.
Методы диагностики
Исследование мокроты делается множеством способов. У каждого метода есть свои преимущества и недостатки, выбор технологии диагностики зависит от решения врача и оснащения больницы.
Характер мокроты зависит от стадии туберкулёза лёгких:
- При инфицировании на латентной стадии мокроты может не быть, или она имеется, но в минимальном количестве и обладает белым цветом или прозрачностью.
- При развитии клинической стадии мокрота приобретает выраженный гнойный характер, оттенок меняется на серый, жёлтый или зелёный, появляется неприятный запах.
- На более поздних стадиях, при появлении рецидивов в мокроте обнаруживаются прожилки крови.
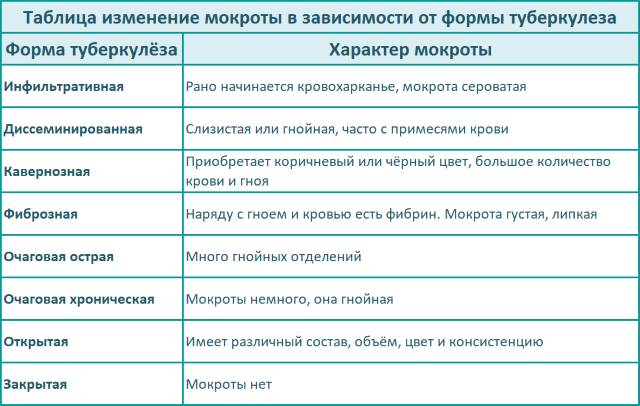
Наиболее быстрый, простой и дешёвый способ оценки материала на туберкулёз легких. За счёт этого может применяться для постановки диагноза, однако он не имеет достаточно высокой надёжности, поэтому его сочетают с флюорографией. Используется для оценки состояния больного в процессе лечения.
Применяется 2 метода:
- Прямая микроскопия. Материал готовится непосредственно из мокроты.
- Микроскопия осадка. Материал концентрируется с помощью центрифугирования.
Для 50% достоверности метода нужно минимум 5000 бактерий на мл мокроты.
Для увеличения надёжности способа исследуют минимум 3 пробы материала. Получение отрицательного результата не означает отсутствие туберкулёза, так как мокрота может содержать очень малое количество возбудителей из-за закрытой формы.
Окраска делается по Цилю-Нельсену:
- В материал вносится карболовый фуксин при повышенной температуре и протравливании фенолом, который проникает во все бактерии препарата.
- Препарат обесцвечивается 25% серной кислотой и 3% солянокислым спиртом. Из-за восково-липидной мембраны палочки Коха не подвергаются воздействию кислот, поэтому они сохраняют окраску.
- Остальные микробы подкрашиваются 0,3% метиленовой синью. Бактерии туберкулёза не восприимчивы к анилиновым краскам, из-за этого цвет у них не меняется.
В итоге палочки Коха приобретают красный цвет, а все остальные клетки – синий. Препарат надо рассматривать через световой бинокулярный иммерсионный микроскоп с тысячекратным увеличением. Для постановки диагноза обычно хватает 100 полей зрения. При отсутствии бактерий рекомендуется просмотреть ещё 200 полей.
Метод основан на реакции антигена и антитела. Антитела – специфические иммуноглобулины, которые образуются в ответ на проникновение бактерий и вирусов. Антиген – протеины, вызывающие выработку иммуноглобулинов.
Проводится в 2 этапа:
- Берётся антитело, меченное каким-либо веществом. Оно добавляется в материал, где присутствует антитело. В ходе реакции образуется единый комплекс.
- Добавляется фермент, который меняет цвет меченных комплексов антиген-антитело. Интенсивность окраски материала указывает на количество иммуноглобулинов.
ВАСТЕС MGIT960 – автоматизированный прибор на 960 проб, который самостоятельно проводит исследование материала. Суть метода состоит в следующем:
- В ёмкость вносится флюоресцирующий материал, флуоресцентные свойства которого блокируются с помощью кислорода.
- Бактерии при своей жизнедеятельности поглощают кислород, уменьшают его количество.
- Из-за снижения концентрации усиливаются флуоресцентные свойства материала. Оно регистрируется в автоматическом режиме.
Первые результата регистрируются на 4-5 день, а для достижения максимума нужно 11 суток.
Люминесценция позволяет поднять результативность исследования на 10-15%, а требуемое время на это снизить в 2-3 раза. Применяют флуоресцентные краски: аурамин и родамин. Их действие связано со способностью вступать в реакцию с воскоподобными веществами бактериальной мембраны возбудителя. При облучении ультрафиолетом окрашенные таким способом палочки Коха начинают светиться оранжевым или красным цветом, при том, что остальной материал имеет чёрный или тёмно-зелёный оттенок.
Важно! Недостатком является сравнительно высокая стоимость метода.
Из-за того, что бактерии в препарате становятся очень яркими и контрастными, то можно уменьшить расширение микроскопа в 4-10 раз, сократив тем самым необходимое время на исследование материала. К тому же флуоресцентная окраска при соотнесении с окрашиванием по Цилю-Нельсену может дать информацию, сколько бактерий потеряло кислотоустойчивые свойства вследствие химиотерапии.
Метод основан на увеличении количества ДНК возбудителя в материале в 100-110 раз за счёт специальных ферментов. Данный способ применим лишь для тех микробов, у которых точно установлен состав нуклеотидной последовательности. В отличие от копирования ДНК в результате деления клеток при ПЦР создаются лишь обрывчатые короткие участки ДНК.
Метод имеет множество преимуществ:
- для положительного результата достаточно 10-100 бактерий в пробе,
- абсолютная специфичность, так как метод применяется для конкретной ДНК,
- результат становится известным через 4-5 часов.
Тем не менее, из-за высокой чувствительности метода возможны ложноположительные результаты, что является существенным минусом. Диагностика проводится с помощью амплификатора – специального прибора, в котором проходит реакция. Он создаёт условия для ПЦР и может использоваться для хранения препарата.
Для культивирования рекомендуется плотная среда. На западе используется состав Левенштейна-Йенсена, который даёт колонии через 15-25 суток. В России применяют среду Финна-II, которая уменьшает срок получения результата на 2-3 дня и увеличивает вероятность появления колонии на 6-8%. Однако при любой среде рекомендуется посев минимум 2-3 материалов. Связано это с тем, что даже при нескольких пробах нет точной гарантии достоверности результата. Установлено, что при 6 посевах вероятность обнаружения туберкулёза увеличивается на 7-8%.
Заключение
Исследование мокроты при лечении туберкулёза – обязательное условие для контроля состояния пациента. Сбор слизи должен соответствовать всем требованиям, иначе будет портиться материал, появиться опасность заражения. Анализ можно проводить разными методами, каждый из которых имеет свои плюсы и минусы. При исследовании желательно сочетать сразу несколько технологий, чтобы повысить достоверность.
Консультант по гематологии,
цитохимии и микробиологии
Важное место в общем комплексе клинико-лабораторных исследований, применяемых для профилактики, диагностики и лечения гнойно-воспалительных заболеваний и осложнений у больных в лечебно-профилактических учреждениях занимают микробиологические исследования. Современная клиническая медицина предъявляет к микробиологическим (бактериологическим) исследованиям возрастающие требования по увеличению объема, повышению качества исследований, разработке и внедрению новых более совершенных методов. Это связано как с новыми научными достижениями в области эпидемиологии и бактериологии, так и с увеличением гнойно-воспалительных заболеваний, ростом госпитальных инфекций.
Материалом для изучения этиологии заболеваний дыхательных путей служат: отделяемое зева и носа; мокрота; содержимое бронхов, полученное при бронхоскопии или при отсасывании через трахеостому (у больных, находящихся на аппаратном дыхании); экссудаты; резецированные ткани и др. Материал собирают с соблюдением правил асептики в предварительно простерилизованные баночки или пробирки и доставляют в лабораторию. Хранение материала способствует размножению сапрофитирующей микрофлоры, развитию процессов гниения и брожения, что искажает результаты анализа. Интервал между взятием материала и его посевом не должен превышать 1-2 часа. Самым простым методом выявления микобактерий туберкулеза в выделениях больных является микроскопия мазка, приготовленного из мокроты. При бактериоскопии мазка, окрашенного по Цилю-Нильсену, микобактерии туберкулеза могут быть обнаружены при наличии не менее 100 000 - 1 000 000 бактериальных клеток в 1 мл патологического материала (мокроты). Такое большое количество микобактерий встречается у больных с далеко зашедшими прогрессирующими формами заболевания (диссеминированными и фиброзно-кавернозными). У значительно большего числа больных количество выделяемых ими микобактерий ниже предела метода бактериоскопии.
Чувствительность метода люминесцентной микроскопии значительно выше - от 10 000 до 100 000 микобактерий в 1 мл материала, кроме того, этот метод дает возможность за значительно более короткое время просмотреть необходимое количество препаратов. Эффективность бактериоскопии повышается также при передаче изображения на компьютер при помощи присоединенной к микроскопу видеокамеры.
Чтобы диагностировать туберкулез, необходимо сделать все возможное для выявления возбудителя заболевания. Микробиологически диагноз может быть подтвержден на основе результатов культурального исследования на комплекс M. tuberculosis (или, при возможности, путем идентификации специфических последовательностей нуклеиновых кислот) в пробах, взятых в месте локализации патологического процесса. Однако на практике в настоящее время многие лаборатории не располагают материально-технической базой для проведения культуральных исследований. К счастью, микроскопия окрашенных препаратов мокроты доступна практически везде, поэтому диагностика туберкулеза может проводиться на основе выявления кислотоустойчивых микобактерий. На территориях с высокой распространенностью туберкулеза выявление кислотоустойчивых микобактерий в окрашенных препаратах мокроты демонстрирует высокую специфичность, поэтому положительный результат микроскопии мокроты можно рассматривать как подтверждение диагноза. Кроме высокой специфичности к комплексу M. tuberculosis, выявление кислотоустойчивых микобактерий при микроскопии играет важную роль по трем причинам: это – наиболее быстрый метод диагностики туберкулеза; позволяет выявить больных с тяжелым развитием патологии, чреватым высоким риском летального исхода; дает возможность выявить больных, являющихся распространителями инфекции.
Оценка качества работы лабораторий микроскопии должна проводиться соответствующим государственными органом (как правило, представителями национальной программы борьбы с туберкулезом).
Неправильный диагноз, поставленный перед началом лечения, приводит к риску ненужного, неправильного или неудачного лечения. Более того, подобный подход чреват несвоевременной постановкой правильного диагноза и назначением соответствующего лечения. При надлежащем подходе и контроле в большинстве случаев у детей в возрасте пяти лет и старше могут быть получены образцы мокроты. У подростков (хотя они часто относятся к детской возрастной группе, по крайней мере, до 15 лет) получить пробы мокроты не составляет большого труда. Поэтому фактор возраста не может рассматриваться как препятствие для сбора проб мокроты у детей и подростков.
Исходя из имеющихся данных, можно прийти к заключению, что для диагностики туберкулеза необходимо взять не менее двух проб мокроты. В случаях, когда имеются соответствующие возможности, можно направлять для лабораторного исследования еще и третью пробу, но исследование более трех проб мокроты вряд ли целесообразно, поскольку не может в значительной мере повысить эффективность диагностики. Кроме того, исследование третьей пробы может оказаться полезным только для подтверждения диагноза, если одна или две предыдущие пробы дали положительный результат. Крайне желательно, чтобы результаты микроскопии мокроты направлялись лечащему врачу в течение одного рабочего дня с момента отправки проб. Не меньшее значение имеет также и время сбора проб. Результаты исследований показывают, что эффективность лабораторных анализов максимальна, если пробы мокроты получены утром, после пробуждения от ночного сна. Возможно, совершенно необязательно собирать только утренние пробы, но, про крайней мере, одна из них должна быть получена утром.
Как правило, внелегочные очаги туберкулезного процесса содержат гораздо меньшее количество M. tuberculosis, поэтому микроскопическое выявление кислотоустойчивых микобактерий в пробах из внелегочных очагов весьма затруднено, и в таких случаях результаты культуральных исследований приобретают большое значение. Учитывая низкую результативность микроскопии, при внелегочном туберкулезе культуральные и морфологические исследования приобретают особое значение, например, в диагностическом исследовании проб ткани лимфатических узлов, полученных при помощи игловой биопсии.
Лечение пациентов, у которых наблюдаются тяжелое или быстро развивающееся заболевания, ассоциированные с туберкулезом, необходимо начинать немедленно, даже до лабораторного подтверждения диагноза. Лечение следует начинать до получения результатов лабораторного исследования и лишь позднее внести необходимые поправки и изменения в схему лечения с учетом результатов микроскопии.
Хотя микроскопия мокроты является наиболее доступным бактериологическим тестом, там, где ресурсы позволяют и имеются условия для качественной лабораторной диагностики, в диагностический алгоритм необходимо включать культуральные исследования мокроты, в случаях отрицательных результатов микроскопии. Правильное проведение культуральных исследований связано с определенными трудностями и дополнительными затратами, но этот метод отличается более высокой чувствительностью и повышает вероятность раннего выявления больных туберкулезом.
Микроскопия мазков мокроты по Циль-Нильсену является важнейшим элементом диагностики туберкулеза. Исследование 3 мазков мокроты позволяет выявить более 60% случаев туберкулеза легких и 95% наиболее заразных случаев (исследование одного мазка мокроты выявляет 75% наиболее заразных случаев, исследование второго мазка мокроты добавляет еще 20%, а исследование третьего - еще 5%).
Микроскопия мазков мокроты по Циль-Нильсену позволяет быстро получить результаты, выявить основные источники инфекции, является менее дорогостоящей, чем посев мокроты и широко доступна для применения. Но она должна быть надежной и хорошо контролироваться. Вероятность обнаружения МБТ при бактериоскопии мазков мокроты прямо пропорциональна концентрации возбудителя в исследуемом материале. Например, когда в 1 мл мокроты содержится от 1000 до 10000 МБТ, то вероятность получения положительного результата составляет около 40-50%. При концентрации МБТ менее 1000 в 1 мл мокроты вероятность их обнаружения резко снижается – отрицательные результаты получаются примерно в 96% случаев.
Основным и наиболее часто изучаемым биоматериалом в пульмонологической практике является мокрота. Требования к забору и качеству мокроты следующие:
1) первую пробу мокроты желательно получить до начала курса антибиотикотерапии;
2) мокроту оптимально собирать утром, до приема пищи, после тщательного туалета полости рта (полоскание кипяченой водой);
3) больным нужно доступно объяснить, что требуется получить именно содержимое нижних отделов дыхательных путей, а не ротоглотки, и, по возможности, проконтролировать их действия;
4) забор материала проводить в стерильные интактные контейнеры;
5) продолжительность хранения мокроты в контейнерах не должна превышать 2 ч (в летнее время желательно не более 1 ч);
6) в условиях лаборатории качество мокроты оценивается после окрашивания мазка по Граму (при наличии в мазке менее 25 лейкоцитов и более 10 эпителиальных клеток, при просмотре не менее 8-10 полей зрения при малом увеличении, мокрота признается некачественной, дальнейшее ее исследование нецелесообразно, так как, скорее всего, материал получен из ротовой полости);
7) высокая диагностическая ценность исследования признается при выделении возбудителя в концентрации і106 КОЕ/мл.
Вообще, в диагностике заболеваний туберкулезом можно выделить несколько этапов:
· Преаналитический этап (предварительный диагноз, выбор материала и метода исследования, забор биомтериала и его транспортировка)
· Аналитический этап (непосредственно проведение анализа)
· Постаналитический этап (оценка результатов)
Часть этих этапов проводится вне лаборатории, поэтому очень важна согласованная и качественная работа всех специалистов, привлеченных в этот процесс. Важен правильный выбор исследуемого материала. Важным этапом диагностики являются процедуры взятия и доставки материала в лабораторию.При взятии всех видов исследуемого материала следует ориентироваться на стандартные системы для этой цели: тампоны, цитощетки, тубсеры, контейнеры и т.п. Эффективность аналитического этапа во многом определяется уровнем технического оснащения лабораторий. Постаналитический этап исследования включает две составляющие: проверку достоверности полученного результата и оценку этиологической значимости выделенных штаммов. В лаборатории должен осуществляться строгий внутренний контроль качества исследований, важной составляющей которого является проверка полученных результатов на достоверность. Оценка этиологической значимости выделенных микроорганизмов принципиальна для выбора адекватной терапии. Процедура приготовления мазков начинается с подготовки предметных стекол. Необходимо использовать только новые, отмытые и обезжиренные в спирте или смеси для обезжиривания предметных стекол (производство АБРИС+) стекла без царапин и сколов. При повторном использовании стекла могут быть недостаточно хорошо отмыты от предыдущего материала, что может привести к получению ложноположительных результатов. Не рекомендуется использовать саморезанные стекла, которые приводят к значительным аберрациям исследуемого изображения. Стекла должны соответствовать ГОСТу. Стекла, на которых при микроскопическом исследовании были обнаружены кислотоустойчивые микобактерии, сохраняются в лаборатории в течение 1 года, а затем подлежат обязательному уничтожению и не должны использоваться повторно. Новые предметные стекла кипятят 15 минут в 1% растворе питьевой соды (10 г двууглекислого натрия на 1 л воды), промывают в 1% растворе соляной кислоты (к 1 л воды добавляют 10 мл концентрированной соляной кислоты), а затем промывают в проточной воде и протирают насухо.

Анализ мокроты на туберкулез: отрицательный и положительный.
Туберкулез и пути распространения инфекции.
Туберкулез – инфекционное заболевание, которое вызывается микобактериями туберкулеза, кислотоустойчивыми грамположительными палочками.
В наше время эта болезнь настолько распространена, что приобрела характер эпидемии.
Туберкулез – это болезнь, которая поражает не только органы дыхания, как мы привыкли думать, под прицелом микобактерий также могут оказаться почки, кости, кишечник, мозг.
Пути заражения и передачи туберкулеза
Заболеваемость среди людей, которые имели непосредственный длительный контакт с бактериовыделителями, в 3-5 раз больше, чем среди людей, у которых таких контактов не наблюдалось.
Также большая заболеваемость обнаруживается среди детей, которые имели постоянные контакты с бактериовыделителями.
Как известно, основной путь передачи возбудителей туберкулеза — аэрогенный, что составляет 95-97% всех заражений туберкулезом.
То есть, микобактерии от больного человека могут распространяться с его слюной во время разговора, чиханья, кашля.
Но не стоит бояться таких людей, нет необходимости ездить в общественном транспорте в марлевой маске и избегать любых контактов, ведь вероятность заражения зависит от формы туберкулеза, а также количества возбудителей в единице объема воздуха и восприимчивости вашего организма.
Ведь наш иммунитет для того и существует, чтобы быть на страже и уничтожать всех патогенных микробов, которые атакуют организм.
К тому же попадание возбудителя в организм обуславливает заражение, но не во всех случаях вызывает заболевание.
Как известно, для передачи инфекции необходимо, чтобы туберкулезный больной выделял заразные частички в воздух, это возможно, как правило, при туберкулезе органов дыхания.
Но не все больные одинаковой мерой могут распространять болезнь.
Прежде всего это будет зависеть от количества микобактерий в бронхиальном секрете больного.
Причем существует прямая корреляция между количеством микобактерий туберкулеза в мокроте и контагиозностью, то есть, степенью заражения.
Анализ мокроты больного туберкулезом
Мокрота больного – это смесь бронхиального секрета, слюны, а также некротизированной легочной ткани.
Для получения адекватных результатов анализа, необходимо правильно собрать мокроту.
Обычно она собирается утром, после полоскания рта, путем откашливания содержимого верхних дыхательных путей в стерильную емкость. Если мокроты мало, ее собирают на протяжении дня.
Начинают анализ мокроты с макроскопического исследования, то есть, оценивают ее количество, характер (слизистый, гнойный, слизисто-гнойный, кровянистый), запах, гомогенность.
У туберкулезных больных мокрота обычно слизистая, без запаха и патологических примесей.
После макроскопического анализа, проводят микроскопический анализ мокроты.
Каким же методом можно определить наличие или отсутствие возбудителей туберкулеза в мокроте больного?
Прежде всего это бактериоскопическое исследование. Готовят мазок мокроты больного, проводят окрашивание по Цилю-Нильсену, высушивают и исследуют под микроскопом.
Этот метод помогает выявить микобактерии при том условии, что в 1 мл мокроты содержится от 5000 до 10000 бактерий.
При незначительном содержании микробов, этот метод не является достаточно эффективным.
Бактериоскопию проводят на протяжении трех дней, после чего применяют метод флотации.
Данный метод основывается на том, что готовят суспензию углеводородов (ксилол, бензол) и мокроты больного.
Таким образом, на поверхности оказывается пена с микобактериями, ее снимают и наносят на предметное стекло около 5-6 раз, затем окрашивают по Цилю-Нильсену и исследуют под микроскопом.
Этот способ увеличивает чувствительность метода бактериоскопии на 10-13%.
Большей эффективностью обладает метод люминисцентной бактериоскопии, суть которого состоит в том, что микобактерии окрашивают специальными красителями — флюорохромами, после чего первые приобретают способность светиться в ультрафиолетовом свете.
Методы анализа мокроты на туберкулез
Такой метод, как фазово-контрастная микроскопия, позволяет обнаруживать и исследовать палочки туберкулеза и их формы в нативном состоянии.
Для выполнения этого исследования необходимо специальное фазово-контрастное оборудование.
Цитологический метод исследования делает возможным выявление в мокроте нейтрофилов, мононуклеаров, казеозного некроза и гигантских клеток Лангханса, которые свидетельствуют о специфическом типе воспаления в легочной ткани.
В случае недостаточного количества мокроты, или ее отсутствия, больному показаны раздражающие ингаляции 15 %-ного раствора хлорида натрия в 1%-ном растворе соды, либо смыв с бронхов.
В последнем случае больному выполняют анестезию корня языка и задней стенки глотки раствором анестетика, затем шприцем вливают в трахею 10-15 мл 0,9%-ного раствора хлорида натрия.
У больного рефлекторно начинается кашель, и он выкашливает изотонический раствор в чашку Петри.
Затем проводят бактериоскопию и дальнейшее изучение биоматериала.
Следующий метод, который используют для анализа мокроты – бактериологический.
Его суть состоит в посеве исследуемого материала на питательные среды с дальнейшей дифференциацией микобактерий, определением чувствительности выделенных микробов к противотуберкулезным препаратам.
Его недостаток состоит в том, что первые колонии на питательной среде могут появиться лишь спустя 2-3 месяца, что значительно затрудняет диагностический поиск.
Как бактериоскопический, так и бактериологический анализ мокроты проводят трехкратно (3 дня подряд) до начала противотуберкулезной терапии.
Еще одним методом анализа является биологический метод. При этом патологический материал от больного прививается лабораторным животным, например в брюшную полость.
Если в материале присутствовали микобактерии, животные заболевают туберкулезом и гибнут через несколько месяцев.
Современные методы анализа биоматериала
К более быстрым методам определения возбудителей туберкулеза в исследуемого материале является метод индикаторной пробирки BBL MGIT (Micobacteria Growth Indicator Tube).
Такие пробирки содержат питательный бульон и флюоресцентное вещество, микобактерии поглощают кислород с бульона, соединение реагирует на уровень кислорода в пробирке и наблюдается явление флюоресценции.
Изначальный уровень кислорода в пробирке свечения не вызывает.
Сегодня достаточно эффективными являются методы молекулярной диагностики, такие как ПЦР-диагностика и метод ДНК-зондов.
Основаны на выявлении мельчайших частиц ДНК возбудителей в исследуемом материале. Эти методы имеют наибольшую чувствительность и позволяют выявить микроорганизмы в течение короткого времени (от 2 часов до 2 суток).
Так же в стадии исследований сейчас находятся методы выявления возбудителей туберкулеза с помощью моноклональных антител, что так же является более быстрым способом, чем тот же бактериологический метод.
На сегодняшний день методы, позволяющие определять наличие микобактерий в организме человека, постоянно разрабатываются и совершенствуются, что в скором времени приведет к улучшению диагностики, а таким образом и лечения туберкулеза.
Видео по теме
Читайте также:


