Кишечные палочки цвет в питательной среде
Глава 18. Эшерихии - Л. Б. Богоявленская, Ф. К. Черкес
Этот род представлен только одним видом бактерий - Е. coli, но объединяет множество вариантов. Разновидности кишечной палочки отличаются по биологическим свойствам, у них могут быть разные наборы ферментов (биовары) и разная антигенная структура (серовары).
Кишечная палочка впервые выделена в 1888 г. Эшерихом из испражнений человека и названа по его имени.
Естественным местом обитания E. coli является кишечник человека. Кишечная палочка - представитель нормальной микрофлоры кишечника.
В процессе жизнедеятельности E. coli вырабатывает ферменты, способствующие пищеварению (например, расщепляющие клетчатку), синтезирует некоторые витамины (например, витамины группы В). Кроме того, эти бактерии проявляют антагонистическое действие в отношении патогенных микроорганизмов, таких как возбудители Дизентерии, брюшного тифа, токсикоинфекций. Отсутствие кишечной палочки в толстом кишечнике ведет к тяжелому заболеванию - дисбактериозу. При этом нарушается нормальный состав микрофлоры кишечника, развиваются протей, кокковая флора, грибы и т. п.
При снижении устойчивости организма (голодании, переутомлении и т. п.) эшерихии могут проникнуть в Другие органы и ткани и стать причиной тяжелых патологических процессов. Таким образом, можно считать, что эшерихии - типичные условно-патогенные микроорганизмы: в обычных условиях они являются сапрофитами, а ПРИ изменении условий вызывают заболевания.
Выделяясь с фекалиями, кишечная палочка попадает во внешнюю среду. Обнаружение E. coli в почве, воде и на других объектах свидетельствует об их фекальном загрязнении, а определение количества E. coli (коли-титр, коли-индекс) характеризует санитарное состояние объекта (см. "Санитарная микробиология").
Морфология. E. coli - короткие, в среднем 0,5-3,0 × 0,5-0,8 мкм палочки. Грамотрицательны. В большинстве случаев они подвижны, перитрихи. Однако некоторые варианты кишечной палочки неподвижны. Многие штаммы образуют капсулу. Спор не образуют.
Культивирование. Кишечная палочка - факультативный анаэроб. Хорошо растет на простых питательных средах при 37° С и рН среды 7,2-7,8. Штаммы E. coli, выделенные из кишечника человека и животных, развиваются и при 43-45° С, а кишечные палочки холоднокровных при этих условиях не размножаются. Это различие в свойствах E. coli разного происхождения используют для определения санитарного состояния объекта, так как только обнаружение E. coli теплокровных свидетельствует о санитарном неблагополучии.
На МПА кишечная палочка образует мутноватые, слегка выпуклые влажные колонии с ровным краем. На МПБ дает равномерное помутнение. Культуры, имеющие капсулу, растут в виде слизистых колоний.
Для идентификации эшерихий используют дифференциально-диагностические среды: Эндо и агар с эозинметиленовым синим (ЭМС). На среде Эндо кишечная палочка растет в виде малиново-красных колоний с металлическим блеском или без него. На среде ЭМС - в виде темно-фиолетовых колоний.
Ферментативные свойства. E. coli обладают значительной ферментативной активностью. Расщепляют лактозу, глюкозу, маннит, мальтозу, сахарозу и другие углеводы и спирты с образованием кислоты и газа. Лротеолитические свойства: образуют индол. Желатин не расщепляют. Отдельные биовары не ферментируют лактозу и сахарозу (табл. 29).
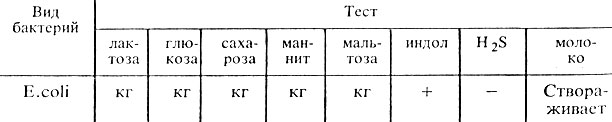
Таблица 29. Ферментативные свойства эшерихий
Примечание, кг - образование кислоты и газа; + наличие признака; - отсутствие признака.
Токсигенность. Эшерихий обладают эндотоксином (лиггополисахарид).
Антигенная структура. Эшерихий различаются по антигенной структуре микробной клетки, что положено в основу классификации бактерий этого рода. Различают три типа антигенов эшерихий: О-антиген (соматический), К-антиген (капсульный) и Н-антиген (жгутиковый). Термостабильный О-антиген является липополисахариднопротеиновым комплексом и расположен в клеточной стенке бактерий. О-антиген определяет принадлежность культуры к серологической группе. Описано более 170 таких групп. Некоторые компоненты О-антигена являются общими для разных О-групп эшерихий, а иногда и других энтеробактерий (шигелл, сальмонелл и др.). К-антигены эшерихий различны: А, В, L и М. Антигены А и М - термостабильны, В и L - термолабильны. К-антиген расположен в микробной клетке более поверхностно, чем О-антиген, и поэтому в его присутствии реакция агглютинации живой культуры с О-сывороткой не происходит. Для выявления О-антигена культуру прогревают в течение часа при 100° С: К-антиген при прогревании разрушается, а О-антиген становится способным вступать во взаимодействие с сывороткой. Установлено, что у эшерихий имеется около 100 типов К-антигенов, в основном типа В-антигенов (термолабильных). Н-антиген имеется только у подвижных штаммов, так как он связан с жгутиками. У эшерихий известно более 50 типов Н-антигена. Определение Н-антигена позволяет установить серовариант выделенной культуры (рис. 40).
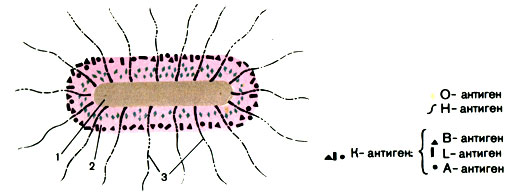
Рис. 40. Антигенная структура энтеропатогенной кишечной палочки. 1 - цитоплазма; 2 - клеточная стенка; 3 - жгутики
Характеристику антигенного состава выделенной культуры эшерихий дают на основании результатов реакции агглютинации с сыворотками, содержащими О-, К- и Н-антитела. При этом определяют, какие антигены имеются в культуре, а их сочетание характеризует антигенную формулу выделенной культуры, т. е. ее серовариант. В табл.30 представлены примеры антигенной структуры некоторых серовариантов E. coli, у которых К-антигены являются В-антигенами.
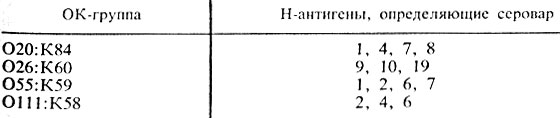
Таблица 30. Антигенная структура эшерихий
Если культура агглютинируется ОК-сывороткой ОП1:К58 (В4) и Н-сывороткой "6", то значит выделен серовариант E. coli О111:В4:Н6; если отмечена реакция агглютинации с ОК-сывороткой О26:К60 (В6) и с Н-сывороткой "11" - выделена культура E. coli 026:В6:Н11 и т. п.
Кроме определения сероварианта E. coli, можно определить и фаговар выделенной культуры. Имеются наборы бактериофагов, которые лизируют эшерихии отдельных серогрупп. По лизису культуры одним из фагов устанавливают ее фаговар. Определение фаговаров имеет эпидемиологическое значение.
Антагонистическое действие E. coli, их способность подавлять рост гнилостных и патогенных бактерий используют для создания бактерийных препаратов для лечения дисбактериоза и различных заболеваний кишечника (колибактерин, бификол).
Устойчивость к факторам окружающей среды. E. coli довольно устойчивы. При 55° С они погибают в течение часа, при 60° С - за 15 мин. В почве и воде сохраняются до 2-3 мес, в молоке не только сохраняются, но и размножаются. Растворы дезинфицирующих веществ (3% хлорамин, раствор сулемы 1:1000 и др.) убивают их за 20-30 мин. Особенно чувствительны E. coli к действию бриллиантового зеленого.
Восприимчивость животных. Эшерихии отдельных серогрупп патогенны для различных животных и вызывают у них заболевания желудочно-кишечного тракта. Из лабораторных животных наиболее чувствительны к E. coli морские свинки, кролики, белые мыши. В зависимости от способа введения культура кишечной палочки вызывает различные патологические процессы: воспаление и абсцесс при подкожных инъекциях, перитонит и сепсис - при внутрибрюшинном и внутривенном введении.
Источники инфекции. Больной человек. При этом бактерии проникают в организм из внешней среды (экзогенная инфекция). Кишечная палочка может также вызвать развитие патологического процесса "изнутри" (эндогенная инфекция).
Пути передачи. Основной путь передачи при экзогенной форме инфекции - контактно-бытовой (непрямой контакт). Возбудители могут быть перенесены на грязных руках, через посуду, игрушки, белье, пищу, мух.
Патогенез. Заболевания, вызываемые эшерихиями, называют эшерихиозами. Развитие эшерихиозов зависит от пути внедрения возбудителя в организм и от серогруппы, к которой принадлежит возбудитель. При проникновении бактерий через рот могут возникнуть кишечные заболевания детей и взрослых. Некоторые О-группы эшерихии (серовары) наиболее часто являются возбудителями заболеваний человека. Такие бактерии называют энтеропатогенными кишечными палочками (ЭПКП). В настоящее время известно много вариантов ЭПКП, обусловливающих разное течение эшерихиозов. Различают несколько групп ЭКПК:
группа I - возбудители колиэнтерита у детей раннего возраста (серогруппы О111, О26, О55, О86 и др.);
группа II - возбудители дизентериеподобных заболеваний у детей и взрослых (О25, О124, О143, О144 и др.);
группа III - возбудители холероподобных заболеваний (О1, О5, О6, О78 и др.).
Попадая в пищевые продукты, кишечная палочка может в них размножаться. Употребление в пищу таких продуктов ведет к развитию пищевой токсикоинфекции.
Развитие эндогенной инфекции приводит к поражению различных органов: воспалению желчного пузыря (холецистит), мочевого пузыря (цистит), заражению крови (сепсис) и др.
Иммунитет. Иммунитет вырабатывается только в отношении одного сероварианта эшерихии - возбудителя данного заболевания. Многообразие эшерихии делает практически этот иммунитет недейственным. В развитии иммунного состояния при заболевании детей большое значение имеет образование IgM-антител, которые не проходят через плаценту, а значит не передаются от матери. IgA-антитела к эшерихиям передаются ребенку от матери с грудным молоком.
Профилактика. Соблюдение личной гигиены и санитарно-гигиенического режима. Специфическая профилактика отсутствует.
Лечение. Антибиотики: ампициллин, тетрациклин и др. В настоящее время выпускают колипротейный фаг, использование которого дает хорошие результаты.
1. Каковы основные признаки бактерий семейства кишечных?
2. Какие антигены имеются у эшерихии?
3. Какие лечебные препараты готовят из кишечных палочек?
Цель исследования: выделение и идентификация ЭПКП.
2. Рвотные массы.
При необходимости исследует отделяемое из носа и зева, гной из уха, кровь, мочу, кусочки органов трупа.
При возникновении очага заболеваний коли-энтеритом исследуют (по эпидемиологическим показаниям) пищевые продукты, смывы с рук обслуживающего персонала, игрушек и других предметов.

Способы сбора материала
Примечание. Чем раньше от начала заболевания исследуют испражнения, тем вероятнее возможность выделения возбудителя.

Первый день исследования
Вынимают из термостата засеянные накануне чашки и просматривают их в падающем или проходящем свете. При наличии малиново-красных колоний на среде Эндо (с металлическим блеском или без него) или фиолетовых на среде ЭМС ставят пробную реакцию агглютинации на стекле для дифференциации ЭПКП от других разновидностей эшерихий.
Для постановки пробной реакции агглютинации отбирают не менее 10 изолированных колоний, отмечая или нумеруя их на обратной стороне чашки; часть каждой намеченной колонии снимают петлей и агглютинируют в капле поливалентной сыворотки или иммуноглобулина. Испытывают только часть колонии, чтобы в случае положительной реакции агглютинации можно было из оставшейся части колонии выделить чистую культуру.
Типовые или поливалентные эшерихиозные сыворотки (или иммуноглобулины) изготовляют в производственных условиях. Поливалентные эшерихиозные ОК-сыворотки (или ОК-иммуноглобулины) содержат антитела к нескольким О- и К-антигенам эшерихий. С их помощью ориентировочно определяют принадлежность выделенной культуры к ЭПКП. Например, поливалентная сыворотка О26, О55, О111 позволяет выявить одноименные культуры эшерихий. Сыворотки разводят согласно указанию на этикетке.
В лаборатории можно приготовить смесь отдельных ОК-сывороток, соединяя не более 5 сывороток, чтобы разведение каждой было не выше 1:10.
Постановка пробной реакции агглютинации. На одно или два хорошо обезжиренных предметных стекла наносят 10 капель поливалентной сыворотки (или иммуноглобулина). В каждую каплю вносят часть намеченной колонии и растирают ее. Колонии, давшие реакцию агглютинации, отсевают в пробирки со скошенным агаром и ставят в термостат на 18-20 ч. Если ни одна из 10 колоний не дала реакции агглютинации, дают отрицательный ответ.
Вынимают из термостата посевы и просматривают их. На МПА энтеропатогенные кишечные палочки образуют обычно влажный, блестящий, сероватый налет, реже он бывает мутным. Выросшую на скошенном агаре культуру проверяют повторно в реакции агглютинации на стекле с поливалентными эшерихиозными сыворотками (или иммуноглобулинами). Если выделенная культура дает реакцию агглютинации с поливалентной сывороткой (иммуноглобулином), то ее агглютинируют с каждой типовой сывороткой (иммуноглобулином) раздельно в разведении 1:5 - 1:10. Агглютинация с живой культурой имеет ориентировочное значение.
Далее необходимо подтвердить принадлежность выделенной культуры к роду Эшерихия биологическими тестами. Для этого производят посев культуры на полужидкие среды Гисса с лактозой, глюкозой, маннитом, сахарозой, мальтозой и другими сахарами, а также на бульон или пептонную воду для определения образования индола и сероводорода. Для этого в пробирки под пробку опускают две индикаторные бумажки, смоченные реактивами, выявляющими образование этих веществ. Одна бумажка при наличии индола краснеет, другая при наличии сероводорода чернеет.
При ферментации Сахаров реакция среды становится кислой и цвет индикатора изменяется. Если, помимо кислоты, образуется газ, в среде появляются пузырьки. Одновременно определяют подвижность бактерий: делают посев в полужидкий (0,2%) агар уколом. Подвижные бактерии дают помутнение всей среды, неподвижные - растут только по уколу.
Для окончательной идентификации выделенной культуры ставят развернутую реакцию агглютинации с живой и гретой культурами: с живой - для определения К-антигена, с гретой - для определения О-антигена. Для постановки развернутой реакции агглютинации антиген готовят следующим образом: 3-5 мл изотонического раствора натрия хлорида смывают культуру со скошенного агара. Полученную суспензию разливают в две пробирки. Одну из них прогревают на водяной бане при 100° С в течение часа.
Развернутую реакцию агглютинации ставят в двух рядах пробирок. Сыворотку в обоих рядах разводят в соотношении 1:50 - 1:100 (в 1-й пробирке) до титра, указанного на этикетке ампулы с сывороткой. В первый ряд добавляют по 2 капли живой культуры, во второй - по 2 капли гретой культуры.
Пробирки встряхивают и помещают в термостат на 18-24 ч.
Производят учет изменений сред Гисса, регистрируют образование индола и сероводорода.
Большинство представителей эшерихий ферментирует углеводы с образованием кислоты и газа, расщепляет белковый питательный субстрат до образования индола.
Учет пробирочной реакции агглютинации проводят при помощи лупы или агглютиноскопа. Агглютинация с живой культурой крупнохлопчатая, с убитой - мелкозернистая. Реакцию считают положительной, если агглютинация с гретой культурой отмечается в разведении сыворотки не ниже половины титра сыворотки, а живая культура агглютинируется сывороткой, разведенной не менее чем 1:200. Играет роль и соотношение антител к гретой и живой культуре. Разведение сыворотки, в котором отмечается агглютинация с гретой культурой, должно превышать разведение сыворотки, в котором агглютинируется живая культура, не менее чем в 2 раза. В табл. 31 приведены различные варианты результата реакции агглютинации.
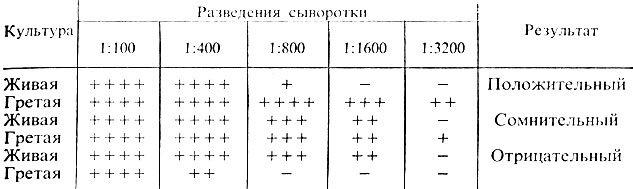
Таблица 31. Результаты реакции агглютинации с культурами эшерихий
Примечание. Возможны три варианта реакции: 1) гретая культура агглютинируется сывороткой в больших разведениях, чем живая, реакция - положительная; 2) живая и гретая культура дают агглютинацию в одинаковых разведениях сыворотки. Такой результат может свидетельствовать об отсутствии в культуре К-антигена; агглютинация живой и гретой культур вызвана О-антигеном. В этих случаях необходима повторная постановка реакции агглютинации; 3) агглютинация живой культуры при отсутствии агглютинации гретой позволяет дать отрицательный ответ. Очевидно, в культуре нет О-антигена, соответствующего O-антителам в сыворотке (рис. 41).
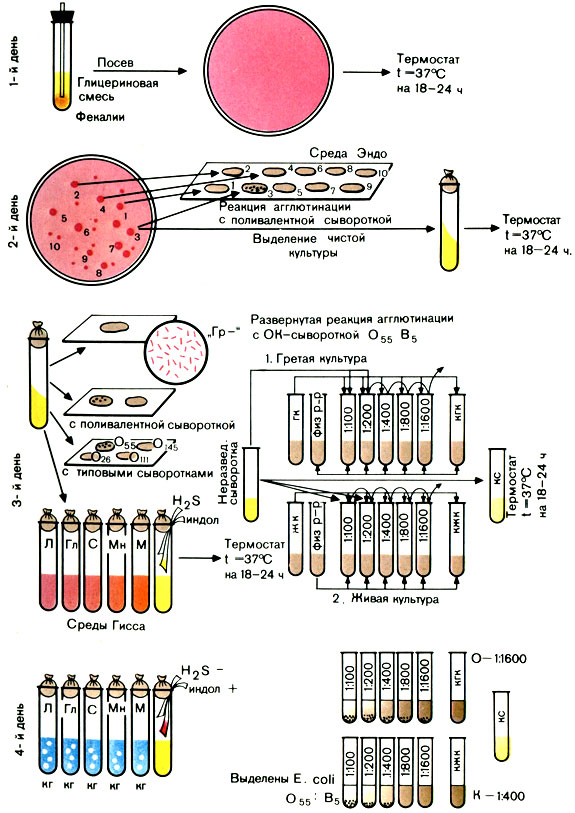
Рис. 41. Схема выделения и идентификации энтеропатогенных кишечных палочек
1. Какой материал исследуют для выделения эшерихий?
2. С помощью каких сывороток можно дифференцировать ЭПКП?
3. Для чего ставят развернутую реакцию агглютинации с живой и гретой культурами эшерихий?
1. Получите у преподавателя чашки Петри с засеянной на среде Эндо культурой и произведите пересев на пробирку со скошенным агаром.
2. Возьмите у преподавателя культуру ЭПКП на скошенном агаре, смойте изотоническим раствором натрия хлорида. Часть смыва прогрейте на водяной бане при 100° С. Разведите сыворотку в двух рядах пробирок и поставьте реакцию агглютинации описанным выше способом.
Дифференциальные среды Эндо и ЭМС служат для выращивания кишечных бактерий. Выпускаются в виде сухого порошка. Согласно указаниям на этикетке отвешивают определенное количество сухой среды, растворяют в соответствующем количестве воды, кипятят, помешивая, и разливают в стерильные чашки Петри.
В вашей приватной жизни безотносительная пустота? Нет постоянной девушки? Они соблазнительные шлюхи будут всемерно благоприятны возможности удовлетворить ваши половые надобности смазливыми способами.

Группа компаний "Униконс"
Продвижение и реализация пищевых добавок, антисептиков и другой продукции НПО Альтернатива.

"Бесплатные образцы"
Комплексные пищевые добавки "Униконс".
Для всех отраслей пищевой промышленности!

"Петритест"
Микробиологические экспресс-тесты. Первые результаты уже через 4 часа.
- Вы здесь:
- Библиотека технолога

- Молочная промышленность

- Микробиология молока и молочных продуктов
5.3. БАКТЕРИИ ГРУППЫ КИШЕЧНЫХ ПАЛОЧЕК (БГКП) КАК ОСНОВНЫЕ САНИТАРНО-ПОКАЗАТЕЛЬНЫЕ МИКРООРГАНИЗМЫ
В группу БГКП входят представители нескольких родов семейства Enterobacteriaceae, в том числе Escherichia, Citrobacter, Enterobacter, Klebsiella, Serratia. Эти микроорганизмы обладают многими общими морфологическими, культуральными и биохимическими свойствами.
Бактерии группы кишечных палочек - короткие (длина 1-3 мкм, ширина 0,5-0,8 мкм) полиморфные подвижные и неподвижные грамотрицательные палочки, не образующие спор. Бактерии этой группы хорошо растут на простых питательных средах: мясопептонном бульоне (МПБ), мясопептонном агаре (МПА). На МПБ дают обильный рост при значительном помутнении среды; осадок небольшой, сероватого цвета, легкоразбивающийся. Образуют пристеночное кольцо, пленка на поверхности бульона обычно отсутствует. На МПА колонии прозрачные с серовато-голубым отливом, легко сливающиеся между собой. На среде Эндо образуют плоские красные колонии средней величины. Красные колонии могут быть с темным металлическим блеском (Е. coli) или без блеска (Е. aerogenes). Для лактозоотрицательных вариантов кишечной палочки (В. paracoli) характерны бесцветные колонии. Им свойственна широкая приспособительная изменчивость, в результате которой возникают разнообразные варианты, что усложняет их классификацию.
Большинство бактерий группы кишечных палочек (БГКП) не разжижают желатина, свертывают молоко, расщепляют пептоны с образованием аминов, аммиака, сероводорода, обладают высокой ферментативной активностью в отношении лактозы, глюкозы и других Сахаров, а также спиртов. Не обладают оксидазной активностью. По способности расщеплять лактозу при температуре 37°С БГКП делят на лактозоотрицательные и лактозоположительные кишечные палочки (ЛКП), или колиформные, которые нормируются по международным стандартам. Из группы ЛКП выделяются фекальные кишечные палочки (ФКП), способные ферментировать лактозу при температуре 44,5°С. К ним относится Е. coli, не растущая на цитратной среде.
На этих свойствах основано определение БГКП в молочных продуктах в средах Кесслер (в соответствии с 32901-2014 по образованию газа) или Кода (по изменению цвета индикатора) после термостатирования при температуре 37±1°С в течение 24 ч, а для мороженого - 48 ч. Дифференциально- диагностическая - среда Эндо, на которой Е. coli образует красные колонии с металлическим блеском. Образование полупрозрачных бесцветных или бледно-розовых колоний говорит о принадлежности микроорганизмов к лакгозоотри- цательным, в том числе патогенным энтеробактериям.
Санитарно-показательное значение родов неодинаково: наличие эшери хий свидетельствуют о свежем фекальном загрязнении, цитробактер и энтеробактер (иногда их считают измененными эшерихиями под влиянием пребывания во внешней среде) - показатели давнего или нефекального загрязнения.
В молоке БГКП хорошо размножаются, доводя его кислотность до 50- 80°Т и образуя в нем неровный ноздреватый сгусток. Молочнокислые микроорганизмы замедляют развитие БГКП. При режимах пастеризации, принятых в молочной промышленности, БГКП гибнут. Обычные дезинфицирующие средства полностью обеззараживают оборудование, инвентарь, руки от БГКП.
Дифференциацию БГКП можно проводить с помощью специальных тестов (комплекс признаков ТИМАЦ + Л):
Т - температурный тест (тест Эйкмана, выявляет способность эшери- хий ферментировать глюкозу, лактозу, маннит с образованием газа при 44- 45°С, другие не обладают такой способностью);
И- индолообразование (способность эшерихий расщеплять аминокислоту триптофан с выделением индола);
М - реакция с метиловым красным, заключается в определении кислотообразования при ферментации глюкозы: если индикатор изменяет светло-желтый цвет на красный, это свидетельствует о снижении рН до 5 и о наличии эшерихий и цитробактер, энтеробактер не изменяет цвет индикатора;
А- реакция на ацетилметилкарбинол (ацетоин), выявляет способность микроорганизмов образовывать это вещество в среде с глюкозой; проводится качественная реакция с гидроксидом калия и креатином, дающая розовый цвет, такой способностью обладают только представители рода цитробактер;
Ц - цитратный тест (способность микроорганизмов усваивать в качестве единственного источника углерода лимонную кислоту или ее соли, используют среду Козера с цитратами, цитробактер и энтеробактер растут на таких средах, называются цитратположительными бактериями, эшерихии - нет);
Л - лактозный тест (способность ферментировать лактозу).
Основные (наиболее стабильные) тесты - температурный и цитратный.
При воздействии факторов внешней среды (например, в присутствии антибиотиков) свойства БГКП могут меняться. Для дифференциации видов дополнительно определяют уреазную активность, рост на средах с цианистым калием, ферментацию различных углеводов, используют специальные таблицы.
Критерии санитарной оценки молочных продуктов и других объектов по присутствию СПМ предусмотрены действующими ГОСТ и СанПиН. Использовавшийся ранее показатель бродильного титра заменен показателем отсутствия БГКП в определенной массе продукта. Так, например, в пастеризованном молоке БГКП должны отсутствовать в 0,01 см, в ультрапастеризованном молоке - в 10 см 3 , ряженке - в 1 г, в кефирной закваске - в 3 мл, в твороге - в 0,001 г.
Цель определения бактерий этой группы — проверка соблюдения режима варки колбас или санитарно-гигиенических условий в процессе производства сырокопченых колбасных изделий. Анализ на БГКП проводят по общепринятой методике с использованием сред, содержащих углеводы (глюкоза, лактоза). К ним относятся среды Хейфеца, ХБ, Кода, Кесслер. БГКП ферментируют глюкозу и лактозу, поэтому в средах ХБ, Хейфеца и Кода образуются кислые продукты, меняющие цвет индикаторов, а в среде Кесслер в поплавке образуется газ вследствие расщепления глюкозы.
При микробиологическом контроле колбасных изделий в производственных лабораториях можно ограничиваться обнаружением бактерий из группы кишечной палочки без их биохимической дифференциации. Для выявления БГКП в пробирки с 5 см3 среды ХБ или Хейфеца двойной концентрации либо Кода вносят по 5 см3 испытуемой взвеси стерильной пипеткой с широким концом вместимостью 5—10см3. Допускается применение среды Кесслер по 10см3.
Посевы термостатируют при 37 °С в течение 18—20ч. Посевы смывов, отобранных тампонами с поверхности изделий без оболочки, выдерживают при температуре 43 °С (для обнаружения повторного бактериального загрязнения). При росте бактерий группы кишечной палочки среды ХБ и Кода окрашиваются в желтый цвет, среда Хейфеца — в салатно-зеленый, на среде Кесслер в поплавке образуется газ.
Для окончательного заключения о присутствии в продукте БГКП проводят высев со среды Кесслер (забродившие пробы) или Хейфеца (изменение цвета среды) в чашки Петри со средой Эндо (Плоскирева, Левина) и помещают в термостат при 37 °С на 18— 20 ч. На среде Эндо бактерии этой группы образуют темно-красные колонии с металлическим блеском или розово-красные без блеска, на среде Плоскирева — кирпично-красные с глянцевой поверхностью, на среде Левина — темно-фиолетовые или фиолетово-черные блестящие колонии. Из подозреваемых колоний готовят мазки, окрашенные по Граму: при микроскопии обнаруживают грамотрицательные палочки различной величины.
Специфическое изменение сред ХБ и Кода не требует дальнейшего подтверждения.
При заведомо высокой обсеменности анализируемого продукта его навеску массой не более 0,25 г помещают в пустую пробирку, закладывают комочек стерильной фильтровальной бумаги размером 5 х 5 см и стерильной стеклянной палочкой или фламбированной проволокой проталкивают его до дна (не уплотняя). В пробирку наливают среду ХБ, Кода или Хейфеца (нормальной концентрации) на 3/4 высоты и помещают ее в термостат с температурой 37 °С на 8—10ч. При росте БГКП среды ХБ и Кода изменяют цвет из фиолетово-пурпурного в желтый, среда Хейфеца — из красно-фиолетового до салатно-зеленого.
Определение БГКП в пробах, отобранных с поверхности изделий без оболочки тампонами, осуществляют аналогично.
Обнаружение грамотрицательных палочек, специфически изменяющих цвет жидких дифференциально-диагностических сред и образующих характерные колонии на элективных средах с лактозой, указывает на наличие БГКП.
2.3 Методика определения сальмонелл (Salmonella)
Навеску продукта массой 25 г от объединенной пробы, тщательно измельченной стерильными ножницами, вносят во флакон Сокслета, содержащий 100см3 среды обогащения (Мюллера, Кауфмана, хлористо-магниевой) или 225 см3 селенитового бульона. Содержимое перемешивают встряхиванием и помещают в термостат при 37 °С. Через 16—24 ч содержимое флакона тщательно перемешивают бактериологической петлей (диаметр 0,4—0,5 мм) или пастеровской пипеткой и проводят посев из среды обогащения в чашки Петри с предварительно подсушенной средой Эндо, БФА, Плоскирева, Левина или висмут-сульфит-агар (по выбору). При значительном помутнении следует использовать среду Плоскирева.
Посевы помещают в термостат при 37 °С на 16—24 ч. На среде Эндо бактерии из рода сальмонелл образуют бесцветные или с розовым оттенком колонии.
На среде БФА сальмонеллы растут в виде крупных, гладких, красноватого оттенка прозрачных колоний (колонии Staphylococcus typhi suis как и на среде Эндо, мелкие). Колонии БГКП желто-зеленого цвета. Бактерии группы протея дают рост через 72 ч.
На среде Плоскирева колонии сальмонелл бесцветные, но более плотные и несколько меньшего размера, чем на среде Эндо; при обильном росте среда желтеет.
На среде Левина сальмонеллы растут в виде прозрачных, бледных, нежно-розовых или розовато-фиолетовых колоний.
На висмут-сульфитном агаре сальмонеллы образуют черные или коричневые колонии с металлическим блеском, участок среды под колонией чернеет. Исключение составляют некоторые серологические типы из группы С, растущие на этой среде в виде нежных светло-зеленых или крупных серовато-зеленых колоний.
Изолированные колонии (не менее 5), характерные для бактерий из рода сальмонелл, пересевают на трехсахарный агар Крумвиде—Олькеницкого в модификации Ковальчука штрихом по скошенной поверхности и уколом в столбик и инкубируют при 37 ± 1 °С в течение 12—16 ч.
При росте сальмонелл цвет скошенной поверхности среды Крумвиде — Олькеницкого в модификации Ковальчука розовый, столбик желто-бурый. Газообразование устанавливают по наличию трещин и разрыву столбика агара, образующие сероводород виды вызывают потемнение столбика.
Другие грамотрицательные бактерии семейства энтеробактерий дают следующие изменения цвета трехсахарного агара:
· БГКП — равномерное окрашивание в синий или сине-зеленый цвет с образованием газа или без него;
· бактерии из группы протея — окрашивание в ярко-красный цвет, в случаях выделения Н2S может образоваться черный осадок;
· шигеллы и возбудители брюшного тифа окрашивают скошенную поверхность в розовый цвет, столбик — в синий или сине-зеленый.
Вместо среды Крумвиде—Олькеницкого в модификации Ковальчука допускается посев: на углеводные среды короткого пестрого ряда с глюкозой, лактозой, сахарозой, маннитом и мальтозой; полужидкий агар уколом (для определения подвижности); бульон Хоттингера для определения образования индола и сероводорода. При использовании полужидких сред с углеводами и индикатором ВР одновременно с ферментативной активностью можно определить подвижность бактерий.
Для дальнейшей идентификации бактерий готовят мазки, которые окрашивают по Граму, микроскопируют и изучают антигенные свойства путем постановки пробной агглютинации на предметном стекле с агглютинирующей адсорбированной поливалентной сальмонеллезной О - сывороткой. При получении положительной реакции на стекле с поливалентной сывороткой проводят идентификацию с помощью монорецепторных агглютинирующих О-сывороток. Установив серологическую группу исследуемых бактерий, с помощью Н-сывороток определяют тип (вид) бактерий.
Обнаружение подвижных (кроме Salmonella pullorum и Salmonella gallinarum) грамотрицательных палочек, дающих характерный рост на элективных средах, неферментирующих лактозу и сахарозу, сбраживающих глюкозу и маннит до кислоты и газа (Salmonella typhi suis не ферментирует маннит), образующих сероводород и не образующих индол, дающих положительную реакцию агглютинации с монорецепторными О- и Н-сальмонеллезными сыворотками, указывает на наличие бактерий из рода сальмонелл.
2.4 Методика определения рода Proteus
При необходимости проведения исследований на наличие в продукте протея в Н-форме 0,5 см3 анализируемой взвеси вносят в конденсационную воду свежескошенного мясопептонного агара, разлитого в широкие пробирки, не касаясь поверхности среды (метод Шукевича). Вертикально поставленные пробирки помещают в термостат при 37 °С. Через 18—24ч отмечают образование ползучего вуалеобразного налета с голубым оттенком. На скошенном мясопептонном агаре культура поднимается из конденсационной жидкости вверх по поверхности среды. При появлении характерного роста микробов рода протея микроскопируют окрашенные по Граму мазки и изучают подвижность микробов в раздавленной или висячей капле.
Для обнаружения нероящихся О-форм можно проводить посев на поверхность агара Плоскирева. О-формы протея растут на этой среде в виде прозрачных колоний, слегка подщелачивающих среду, окрашивая ее в желтый цвет. Затем колонии пересевают в среду Крумвиде—Олькеницкого в модификации Ковальчука, которая при наличии бактерий из группы протея окрашивается в ярко-красный цвет (вследствие расщепления мочевины). В результате выделения сероводорода может образовываться черный осадок с возможным разрывом агарового столбика.
Идентификацию протея проводят по морфологическим признакам (это грамотрицательные палочки), способности к гидролизу мочевины и образованию сероводорода. Дополнительно изучают ферментацию глюкозы (положительный результат), лактозы и маннита (отрицательный результат), подвижность в висячей или раздавленной капле либо проводят посев уколом в столбик полужидкой среды.
Обнаружение полиморфных грамотрицательных палочек, подвижных, образующих характерный ползучий рост на скошенном мясопептонном агаре (по Шукевичу), сбраживающих глюкозу и мочевину, неферментрующих лактозу и маннит, указывает на наличие в продукте бактерий из рода протея.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Читайте также:


