Глюкоза и кишечная палочка
Глава 18. Эшерихии - Л. Б. Богоявленская, Ф. К. Черкес
Этот род представлен только одним видом бактерий - Е. coli, но объединяет множество вариантов. Разновидности кишечной палочки отличаются по биологическим свойствам, у них могут быть разные наборы ферментов (биовары) и разная антигенная структура (серовары).
Кишечная палочка впервые выделена в 1888 г. Эшерихом из испражнений человека и названа по его имени.
Естественным местом обитания E. coli является кишечник человека. Кишечная палочка - представитель нормальной микрофлоры кишечника.
В процессе жизнедеятельности E. coli вырабатывает ферменты, способствующие пищеварению (например, расщепляющие клетчатку), синтезирует некоторые витамины (например, витамины группы В). Кроме того, эти бактерии проявляют антагонистическое действие в отношении патогенных микроорганизмов, таких как возбудители Дизентерии, брюшного тифа, токсикоинфекций. Отсутствие кишечной палочки в толстом кишечнике ведет к тяжелому заболеванию - дисбактериозу. При этом нарушается нормальный состав микрофлоры кишечника, развиваются протей, кокковая флора, грибы и т. п.
При снижении устойчивости организма (голодании, переутомлении и т. п.) эшерихии могут проникнуть в Другие органы и ткани и стать причиной тяжелых патологических процессов. Таким образом, можно считать, что эшерихии - типичные условно-патогенные микроорганизмы: в обычных условиях они являются сапрофитами, а ПРИ изменении условий вызывают заболевания.
Выделяясь с фекалиями, кишечная палочка попадает во внешнюю среду. Обнаружение E. coli в почве, воде и на других объектах свидетельствует об их фекальном загрязнении, а определение количества E. coli (коли-титр, коли-индекс) характеризует санитарное состояние объекта (см. "Санитарная микробиология").
Морфология. E. coli - короткие, в среднем 0,5-3,0 × 0,5-0,8 мкм палочки. Грамотрицательны. В большинстве случаев они подвижны, перитрихи. Однако некоторые варианты кишечной палочки неподвижны. Многие штаммы образуют капсулу. Спор не образуют.
Культивирование. Кишечная палочка - факультативный анаэроб. Хорошо растет на простых питательных средах при 37° С и рН среды 7,2-7,8. Штаммы E. coli, выделенные из кишечника человека и животных, развиваются и при 43-45° С, а кишечные палочки холоднокровных при этих условиях не размножаются. Это различие в свойствах E. coli разного происхождения используют для определения санитарного состояния объекта, так как только обнаружение E. coli теплокровных свидетельствует о санитарном неблагополучии.
На МПА кишечная палочка образует мутноватые, слегка выпуклые влажные колонии с ровным краем. На МПБ дает равномерное помутнение. Культуры, имеющие капсулу, растут в виде слизистых колоний.
Для идентификации эшерихий используют дифференциально-диагностические среды: Эндо и агар с эозинметиленовым синим (ЭМС). На среде Эндо кишечная палочка растет в виде малиново-красных колоний с металлическим блеском или без него. На среде ЭМС - в виде темно-фиолетовых колоний.
Ферментативные свойства. E. coli обладают значительной ферментативной активностью. Расщепляют лактозу, глюкозу, маннит, мальтозу, сахарозу и другие углеводы и спирты с образованием кислоты и газа. Лротеолитические свойства: образуют индол. Желатин не расщепляют. Отдельные биовары не ферментируют лактозу и сахарозу (табл. 29).
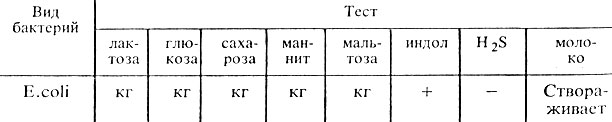
Таблица 29. Ферментативные свойства эшерихий
Примечание, кг - образование кислоты и газа; + наличие признака; - отсутствие признака.
Токсигенность. Эшерихий обладают эндотоксином (лиггополисахарид).
Антигенная структура. Эшерихий различаются по антигенной структуре микробной клетки, что положено в основу классификации бактерий этого рода. Различают три типа антигенов эшерихий: О-антиген (соматический), К-антиген (капсульный) и Н-антиген (жгутиковый). Термостабильный О-антиген является липополисахариднопротеиновым комплексом и расположен в клеточной стенке бактерий. О-антиген определяет принадлежность культуры к серологической группе. Описано более 170 таких групп. Некоторые компоненты О-антигена являются общими для разных О-групп эшерихий, а иногда и других энтеробактерий (шигелл, сальмонелл и др.). К-антигены эшерихий различны: А, В, L и М. Антигены А и М - термостабильны, В и L - термолабильны. К-антиген расположен в микробной клетке более поверхностно, чем О-антиген, и поэтому в его присутствии реакция агглютинации живой культуры с О-сывороткой не происходит. Для выявления О-антигена культуру прогревают в течение часа при 100° С: К-антиген при прогревании разрушается, а О-антиген становится способным вступать во взаимодействие с сывороткой. Установлено, что у эшерихий имеется около 100 типов К-антигенов, в основном типа В-антигенов (термолабильных). Н-антиген имеется только у подвижных штаммов, так как он связан с жгутиками. У эшерихий известно более 50 типов Н-антигена. Определение Н-антигена позволяет установить серовариант выделенной культуры (рис. 40).
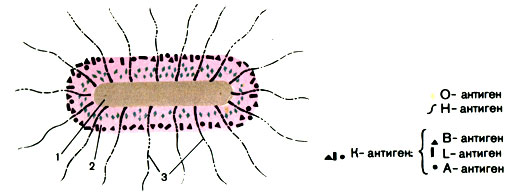
Рис. 40. Антигенная структура энтеропатогенной кишечной палочки. 1 - цитоплазма; 2 - клеточная стенка; 3 - жгутики
Характеристику антигенного состава выделенной культуры эшерихий дают на основании результатов реакции агглютинации с сыворотками, содержащими О-, К- и Н-антитела. При этом определяют, какие антигены имеются в культуре, а их сочетание характеризует антигенную формулу выделенной культуры, т. е. ее серовариант. В табл.30 представлены примеры антигенной структуры некоторых серовариантов E. coli, у которых К-антигены являются В-антигенами.
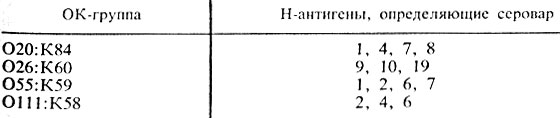
Таблица 30. Антигенная структура эшерихий
Если культура агглютинируется ОК-сывороткой ОП1:К58 (В4) и Н-сывороткой "6", то значит выделен серовариант E. coli О111:В4:Н6; если отмечена реакция агглютинации с ОК-сывороткой О26:К60 (В6) и с Н-сывороткой "11" - выделена культура E. coli 026:В6:Н11 и т. п.
Кроме определения сероварианта E. coli, можно определить и фаговар выделенной культуры. Имеются наборы бактериофагов, которые лизируют эшерихии отдельных серогрупп. По лизису культуры одним из фагов устанавливают ее фаговар. Определение фаговаров имеет эпидемиологическое значение.
Антагонистическое действие E. coli, их способность подавлять рост гнилостных и патогенных бактерий используют для создания бактерийных препаратов для лечения дисбактериоза и различных заболеваний кишечника (колибактерин, бификол).
Устойчивость к факторам окружающей среды. E. coli довольно устойчивы. При 55° С они погибают в течение часа, при 60° С - за 15 мин. В почве и воде сохраняются до 2-3 мес, в молоке не только сохраняются, но и размножаются. Растворы дезинфицирующих веществ (3% хлорамин, раствор сулемы 1:1000 и др.) убивают их за 20-30 мин. Особенно чувствительны E. coli к действию бриллиантового зеленого.
Восприимчивость животных. Эшерихии отдельных серогрупп патогенны для различных животных и вызывают у них заболевания желудочно-кишечного тракта. Из лабораторных животных наиболее чувствительны к E. coli морские свинки, кролики, белые мыши. В зависимости от способа введения культура кишечной палочки вызывает различные патологические процессы: воспаление и абсцесс при подкожных инъекциях, перитонит и сепсис - при внутрибрюшинном и внутривенном введении.
Источники инфекции. Больной человек. При этом бактерии проникают в организм из внешней среды (экзогенная инфекция). Кишечная палочка может также вызвать развитие патологического процесса "изнутри" (эндогенная инфекция).
Пути передачи. Основной путь передачи при экзогенной форме инфекции - контактно-бытовой (непрямой контакт). Возбудители могут быть перенесены на грязных руках, через посуду, игрушки, белье, пищу, мух.
Патогенез. Заболевания, вызываемые эшерихиями, называют эшерихиозами. Развитие эшерихиозов зависит от пути внедрения возбудителя в организм и от серогруппы, к которой принадлежит возбудитель. При проникновении бактерий через рот могут возникнуть кишечные заболевания детей и взрослых. Некоторые О-группы эшерихии (серовары) наиболее часто являются возбудителями заболеваний человека. Такие бактерии называют энтеропатогенными кишечными палочками (ЭПКП). В настоящее время известно много вариантов ЭПКП, обусловливающих разное течение эшерихиозов. Различают несколько групп ЭКПК:
группа I - возбудители колиэнтерита у детей раннего возраста (серогруппы О111, О26, О55, О86 и др.);
группа II - возбудители дизентериеподобных заболеваний у детей и взрослых (О25, О124, О143, О144 и др.);
группа III - возбудители холероподобных заболеваний (О1, О5, О6, О78 и др.).
Попадая в пищевые продукты, кишечная палочка может в них размножаться. Употребление в пищу таких продуктов ведет к развитию пищевой токсикоинфекции.
Развитие эндогенной инфекции приводит к поражению различных органов: воспалению желчного пузыря (холецистит), мочевого пузыря (цистит), заражению крови (сепсис) и др.
Иммунитет. Иммунитет вырабатывается только в отношении одного сероварианта эшерихии - возбудителя данного заболевания. Многообразие эшерихии делает практически этот иммунитет недейственным. В развитии иммунного состояния при заболевании детей большое значение имеет образование IgM-антител, которые не проходят через плаценту, а значит не передаются от матери. IgA-антитела к эшерихиям передаются ребенку от матери с грудным молоком.
Профилактика. Соблюдение личной гигиены и санитарно-гигиенического режима. Специфическая профилактика отсутствует.
Лечение. Антибиотики: ампициллин, тетрациклин и др. В настоящее время выпускают колипротейный фаг, использование которого дает хорошие результаты.
1. Каковы основные признаки бактерий семейства кишечных?
2. Какие антигены имеются у эшерихии?
3. Какие лечебные препараты готовят из кишечных палочек?
Цель исследования: выделение и идентификация ЭПКП.
2. Рвотные массы.
При необходимости исследует отделяемое из носа и зева, гной из уха, кровь, мочу, кусочки органов трупа.
При возникновении очага заболеваний коли-энтеритом исследуют (по эпидемиологическим показаниям) пищевые продукты, смывы с рук обслуживающего персонала, игрушек и других предметов.

Способы сбора материала
Примечание. Чем раньше от начала заболевания исследуют испражнения, тем вероятнее возможность выделения возбудителя.

Первый день исследования
Вынимают из термостата засеянные накануне чашки и просматривают их в падающем или проходящем свете. При наличии малиново-красных колоний на среде Эндо (с металлическим блеском или без него) или фиолетовых на среде ЭМС ставят пробную реакцию агглютинации на стекле для дифференциации ЭПКП от других разновидностей эшерихий.
Для постановки пробной реакции агглютинации отбирают не менее 10 изолированных колоний, отмечая или нумеруя их на обратной стороне чашки; часть каждой намеченной колонии снимают петлей и агглютинируют в капле поливалентной сыворотки или иммуноглобулина. Испытывают только часть колонии, чтобы в случае положительной реакции агглютинации можно было из оставшейся части колонии выделить чистую культуру.
Типовые или поливалентные эшерихиозные сыворотки (или иммуноглобулины) изготовляют в производственных условиях. Поливалентные эшерихиозные ОК-сыворотки (или ОК-иммуноглобулины) содержат антитела к нескольким О- и К-антигенам эшерихий. С их помощью ориентировочно определяют принадлежность выделенной культуры к ЭПКП. Например, поливалентная сыворотка О26, О55, О111 позволяет выявить одноименные культуры эшерихий. Сыворотки разводят согласно указанию на этикетке.
В лаборатории можно приготовить смесь отдельных ОК-сывороток, соединяя не более 5 сывороток, чтобы разведение каждой было не выше 1:10.
Постановка пробной реакции агглютинации. На одно или два хорошо обезжиренных предметных стекла наносят 10 капель поливалентной сыворотки (или иммуноглобулина). В каждую каплю вносят часть намеченной колонии и растирают ее. Колонии, давшие реакцию агглютинации, отсевают в пробирки со скошенным агаром и ставят в термостат на 18-20 ч. Если ни одна из 10 колоний не дала реакции агглютинации, дают отрицательный ответ.
Вынимают из термостата посевы и просматривают их. На МПА энтеропатогенные кишечные палочки образуют обычно влажный, блестящий, сероватый налет, реже он бывает мутным. Выросшую на скошенном агаре культуру проверяют повторно в реакции агглютинации на стекле с поливалентными эшерихиозными сыворотками (или иммуноглобулинами). Если выделенная культура дает реакцию агглютинации с поливалентной сывороткой (иммуноглобулином), то ее агглютинируют с каждой типовой сывороткой (иммуноглобулином) раздельно в разведении 1:5 - 1:10. Агглютинация с живой культурой имеет ориентировочное значение.
Далее необходимо подтвердить принадлежность выделенной культуры к роду Эшерихия биологическими тестами. Для этого производят посев культуры на полужидкие среды Гисса с лактозой, глюкозой, маннитом, сахарозой, мальтозой и другими сахарами, а также на бульон или пептонную воду для определения образования индола и сероводорода. Для этого в пробирки под пробку опускают две индикаторные бумажки, смоченные реактивами, выявляющими образование этих веществ. Одна бумажка при наличии индола краснеет, другая при наличии сероводорода чернеет.
При ферментации Сахаров реакция среды становится кислой и цвет индикатора изменяется. Если, помимо кислоты, образуется газ, в среде появляются пузырьки. Одновременно определяют подвижность бактерий: делают посев в полужидкий (0,2%) агар уколом. Подвижные бактерии дают помутнение всей среды, неподвижные - растут только по уколу.
Для окончательной идентификации выделенной культуры ставят развернутую реакцию агглютинации с живой и гретой культурами: с живой - для определения К-антигена, с гретой - для определения О-антигена. Для постановки развернутой реакции агглютинации антиген готовят следующим образом: 3-5 мл изотонического раствора натрия хлорида смывают культуру со скошенного агара. Полученную суспензию разливают в две пробирки. Одну из них прогревают на водяной бане при 100° С в течение часа.
Развернутую реакцию агглютинации ставят в двух рядах пробирок. Сыворотку в обоих рядах разводят в соотношении 1:50 - 1:100 (в 1-й пробирке) до титра, указанного на этикетке ампулы с сывороткой. В первый ряд добавляют по 2 капли живой культуры, во второй - по 2 капли гретой культуры.
Пробирки встряхивают и помещают в термостат на 18-24 ч.
Производят учет изменений сред Гисса, регистрируют образование индола и сероводорода.
Большинство представителей эшерихий ферментирует углеводы с образованием кислоты и газа, расщепляет белковый питательный субстрат до образования индола.
Учет пробирочной реакции агглютинации проводят при помощи лупы или агглютиноскопа. Агглютинация с живой культурой крупнохлопчатая, с убитой - мелкозернистая. Реакцию считают положительной, если агглютинация с гретой культурой отмечается в разведении сыворотки не ниже половины титра сыворотки, а живая культура агглютинируется сывороткой, разведенной не менее чем 1:200. Играет роль и соотношение антител к гретой и живой культуре. Разведение сыворотки, в котором отмечается агглютинация с гретой культурой, должно превышать разведение сыворотки, в котором агглютинируется живая культура, не менее чем в 2 раза. В табл. 31 приведены различные варианты результата реакции агглютинации.
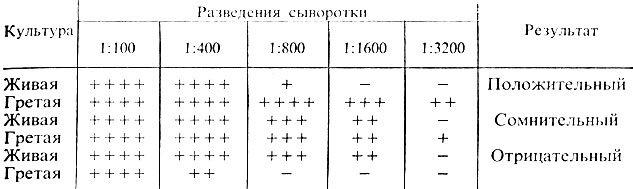
Таблица 31. Результаты реакции агглютинации с культурами эшерихий
Примечание. Возможны три варианта реакции: 1) гретая культура агглютинируется сывороткой в больших разведениях, чем живая, реакция - положительная; 2) живая и гретая культура дают агглютинацию в одинаковых разведениях сыворотки. Такой результат может свидетельствовать об отсутствии в культуре К-антигена; агглютинация живой и гретой культур вызвана О-антигеном. В этих случаях необходима повторная постановка реакции агглютинации; 3) агглютинация живой культуры при отсутствии агглютинации гретой позволяет дать отрицательный ответ. Очевидно, в культуре нет О-антигена, соответствующего O-антителам в сыворотке (рис. 41).
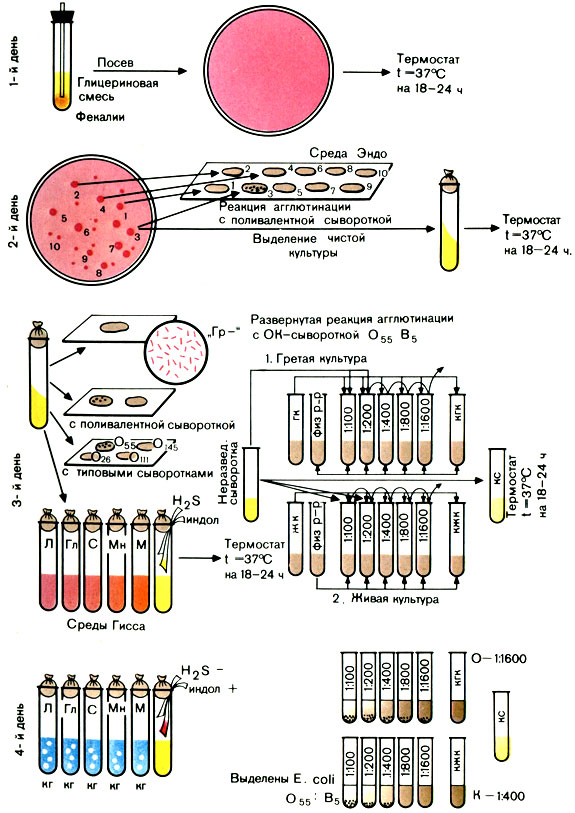
Рис. 41. Схема выделения и идентификации энтеропатогенных кишечных палочек
1. Какой материал исследуют для выделения эшерихий?
2. С помощью каких сывороток можно дифференцировать ЭПКП?
3. Для чего ставят развернутую реакцию агглютинации с живой и гретой культурами эшерихий?
1. Получите у преподавателя чашки Петри с засеянной на среде Эндо культурой и произведите пересев на пробирку со скошенным агаром.
2. Возьмите у преподавателя культуру ЭПКП на скошенном агаре, смойте изотоническим раствором натрия хлорида. Часть смыва прогрейте на водяной бане при 100° С. Разведите сыворотку в двух рядах пробирок и поставьте реакцию агглютинации описанным выше способом.
Дифференциальные среды Эндо и ЭМС служат для выращивания кишечных бактерий. Выпускаются в виде сухого порошка. Согласно указаниям на этикетке отвешивают определенное количество сухой среды, растворяют в соответствующем количестве воды, кипятят, помешивая, и разливают в стерильные чашки Петри.
В вашей приватной жизни безотносительная пустота? Нет постоянной девушки? Они соблазнительные шлюхи будут всемерно благоприятны возможности удовлетворить ваши половые надобности смазливыми способами.
| Вид микроба | Лактоза | Глюкоза | Маннит | Мальтоза | Сахароза | МПБ | |
| Индол | Сероводород | ||||||
| E. coli | КГ | КГ | КГ | КГ | - | + | - |
Примечание: К Г – ферментация углевода сообразованием кислоты и газа, (-) – отсутствие ферментации или образования
Ферментативная активность изучена на пестром ряду. Кроме питательной основы и углевода к среде добавлен индикатор бромкрезолпурпур. Исходный цвет среды фиолетовый, при образовании кислоты цвет среды становится желтым. Газообразование улавливают с помощью поплавков – коротких стеклянных трубочек, запаянных с одного конца, помещенных в питательную среду, открытым концом вниз. Образование индола определено с помощью реактива Ковача: при положительной реакции конец бумажки окрашивается в малиново-розовыйцвет.
4. Знакомство со схемой лабораторного диагноза эшерихиоза по схеме(зарисовать табл.3)
Среди кишечных палочек встречаются представители, которые способны вызывать заболевания кишечника, варьирирующие от умеренной диареи до тяжелого холероподобного заболевания. В основном заболевания возникают у детей 1 года жизни, но могут возникать также у детей старшего возраста и взрослых.
Кишечные палочки, вызывающие поражения кишечника, разделяют на три группы:
1. Энтеропатогенные кишечныепалочки (ЭПКП)– поражают детей первого года жизни, особенно часто в коллективах (серогруппы 026,055, 0111 и др.)
2. Энтеротоксигенные кишечные палочки (ЭТКП)– поражают детей старше года и взрослых людей (серогруппы 01,05,06 и др.). Эта группа кишечных палочек характеризуется способностью продуцировать энтеротоксин, который реагирует с аденилциклазной системой клеток эпителия слизистой тонкого кишечника, нарушает их функции вызывает холероподобные заболевания.
3. Энтероинвазионные кишечные палочки (ЭИКП)– поражают детей старше года и взрослых людей (серогруппы 025,0124 и др.) Эта группа кишечных палочек обладает способностью к инвазии в клетки слизистой оболочки толстой кишки и вызывает дизентериеподобные заболевания.
Помимо перечисленных заболеваний, которые могут принимать эпидемический характер, кишечные палочки могут вызывать аппендицит, перитонит, цистит, пиелонефрит и т.д. В последние годы нередко кишечные палочки самостоятельно или в ассоциациях с другими бактериями вызывают внутрибольничные инфекции в хирургических, педиатрических стационарах и др.
Кишечные палочки, выделяемые от больных различными заболеваниями, как кишечной, так и не кишечной локализации, невозможно различить от представителей нормальной микрофлоры ни по морфологическим, ни по культуральным свойствам. Дифференциация их проводится на основе антигенной структуры.
Главной особенностью ЭПКП является антигенная структура, постоянная и характерная для каждого штамма. Учитывают соматический 0-антиген, соматический К-антиген и жгутиковый Н-антиген.
Общепризнано, что поставить клинический диагноз острой кишечной инфекции нельзя. Обязательна постановка лабораторного диагноза. Основным в лабораторной диагностике является бактериологический диагноз.
Исследуемый материал: испражнения, рвотные массы.
Испражнения в количестве 3–5 гр. помещают в пробирку с изотоническим раствором хлорида натрия или глицериновой смесью. Целесообразно брать последние порции, т.к. при колиэнтеритах поражается тонкий кишечник. У грудных детей материал для исследования берут с пеленок. Чем раньше от начала заболевания исследуют испражнения, тем вероятнее возможность выделения возбудителя. Рекомендуется забор материала сделать до начала лечения.
Бактериологический метод. Бактериологический диагноз основан на выделении чистой культуры и определении её серовара.
Исследуемый материал засевают на среду Эндо, предварительно разведя его физ. раствором. Через сутки изучают колонии, выросшие на среде. Кишечные палочки вырастают на среде Эндо в виде малиново-красных колоний с металлическим блеском или без него. Отбор колоний патогенных кишечных палочек проводят с помощью ориентировочной реакции агглютинации с диагностической сывороткой. Употребляют смесь ОКБ – сывороток против патогенных кишечных палочек, соединяя не более 5 сывороток. Для постановки ориентировочной реакции агглютинации исследуют не менее 10 колоний. Если ни одна из них не агглютинирует, дают ответ: "Патогенные кишечные палочки не обнаружены". Из колоний с положительной реакцией агглютинации делают посев в пробирки со средой Олькеницкого (Клиглера) или скошенным агаром и ставят в термостат на 18–20 часов.
На следующий день (3 день исследования) просматривают посевы на среде Олькеницкого и скошенном МПА. Состав среды Олькеницкого (трехсахарная среда с мочевиной): к 100 г МПА расплавленного и охлажденного добавляют I г лактозы, I г сахарозы, 0,1 г глюкозы, I г мочевины, 0,02 г соли Мора, 0,03 г гипосульфита и индикатор ВР (водный голубой и розоловая кислота). Среду разливают так, чтобы был столбик и скошенная поверхность. Посев культуры делают штрихом на скошенную поверхность и уколом в глубину столбика. Ферментация глюкозы происходит в анаэробных условиях (её в среде мало), в этом случае цвет изменится только в столбике (среда посинеет). При ферментации лактозы или сахарозы среда посинеет как в столбике, так и на скошенной поверхности. При разложении мочевины (рН сдвигается в щелочную сторону) цвет среды станет оранжевым. Газообразование определяют по разрывам среды. При образовании сероводорода среда чернеет.
На скошенном МПА энтеропатогенные кишечные палочки образуют влажный блестящий сероватый налет.
На среде Олькеницкого кишечная палочка вызывает посинение среды, как в столбике, так и на скошенной поверхности, наблюдаются разрывы среды пузырьками газа (ферментация лактозы и глюкозы до кислоты и газа). Выделенную культуру проверяют в реакции агглютинации на стекле сначала с той же смесью сывороток, а затем раздельно с каждой сывороткой, входящей в смесь.
При отсутствии реакции агглютинации дают отрицательный ответ. При положительной реакции агглютинации необходимо подтвердить принадлежность выделенной культуры к роду кишечных палочек. Для этого культуру засевают на жидкие среды Гисса с лактозой, глюкозой, маннитом, сахарозой, в пробирку с МПБ для обнаружения индола и сероводорода, определяют подвижность.
Для окончательной идентификации выделенной эшерихии ставят развернутую реакцию агглютинации с типовой коли-ОКВ-сывороткой. Реакцию ставят с живой культурой для установления К-антигена и с гретой культурой для установления О-антигена.
По результатам пестрого ряда и развернутой реакции агглютинации может быть дан окончательный ответ.
Серологическая диагностика при кишечных инфекциях используется для подтверждения этиологического значения выделенных эшерихий, заподозренных в качестве возбудителя, в научно-исследовательских целях для изучения патогенеза и иммунитета кишечных заболеваний.
Основана она на обнаружении антител в сыворотке крови. Обнаруживают О-антитела в реакции агглютинации, используя в качестве антигена культуру, выделенную от больного и кипяченую в течение 2 часов. Положительная реакция проявляется непостоянно, титр антител невысокий – ниже 1:100. В-антитела не обнаруживаются.
Можно использовать реакцию пассивной гемагглютинации, которая более чувствительна. В качестве диагностикума используют эритроциты барана, сенсибилизированные смывом 48-часовой культуры, кипяченой 2 часа. Следовательно, в РПГА также выявляют только О-антитела. Эта реакция позволяет отличить больных от людей, выделяющих энтеропатогенные кишечные палочки без клинических проявлений болезни. У последних антитела не обнаруживаются.
Ускоренные методы лабораторной диагностики. Классическое бактериологическое исследование длится 4–5 дней. Это не всегда устраивает и клиницистов и эпидемиологов, поэтому прилагается много усилий, чтобы сократить время исследования и ускорить ответ лаборатории. Для решения этой проблемы предложено использовать наиболее рациональные питательные среды, сокращать интервалы между исследованиями, а также применять методы, основанные на определении антигенной структуры кишечных палочек. Наиболее чувствительным и быстрым методом является метод иммунофлюоресценции, основанный на обнаружении специфического антигена кишечных палочек в исследуемом материале с помощью флюоресцирующих антител.
Этапы бактериологического исследования
при подозрении на эшерихиоз
1. Сделать посев испражнений больного на среду Эндо. Для этого взять немного материала пипеткой и эмульгировать его в физиологическом растворе или глицериновой смеси, каплю эмульсии нанести на среду Эндо петлей или пипеткой. Стерильным шпателем растереть каплю на небольшом участке среды, затем, не прожигая шпатель, втереть оставшийся на нем материал по всей поверхности. Чашки с посевом поставить в термостат на 24 часа.
2. Изучить посевы на среде Эндо, описать выросшие колонии.
Отобрать малиново-красные колонии с металлическим блеском или без него с помощью ориентировочной реакции агглютинации (не менее 10). Для постановки реакции стерильной петлей взять часть колонии и смешать с каплей агглютинирующей диагностической поливалентной сыворотки. Поливалентные сыворотки готовят в производственных условиях, они содержат антитела к нескольким сероварам эшерихий из одной серологической группы. При положительной реакции агглютинации оставшуюся часть колоний отсеять на скошенный агар или среду Олькеницкого. Если же ни одна из десяти колоний не дала агглютинации, выдать отрицательный ответ.
3. Изучить посевы на скошенном агаре и среде Олькеницкого.
3.1. Поставить ориентировочную реакцию агглютинации на стекле с поливалентной сывороткой. Если реакция агглютинации положительна, поставить реакцию агглютинации на стекле с каждой типовой сывороткой, входящей в поливалентную.
3.2. Подтвердить принадлежность выделенной культуры к эшерихиям. Для этого изучить ферментативные свойства, сделав посев на жидкие среды Гисса с лактозой, глюкозой, маннитом, сахарозой, мальтозой. Сделать также посев на МПБ для определения образования индола и сероводорода.
3.3. Провести окончательную серологическую идентификацию культуры. Для этого поставить развернутую реакцию агглютинации с живой и гретой культурой. Диагностическую типовую сыворотку разводят от 1:100 до титра сыворотки, указанного на этикетке. Из разведений приготовить два ряда пробирок. Приготовить антиген. Для этого смыть культуру с поверхности среды 3–5 мл физиологического раствора, разлить взвесь в 2 стерильные пробирки. Одну из них прогреть на водяной бане при 100°С в течение часа. В первый ряд разведений сыворотки внести по 2 капли живой культуры, во второй – по 2 капли гретой культуры. После встряхивания пробирки поместить в термостат на 18–20 часов.
Учет результатов. Заключение по исследованию
4.1. Просмотреть посевы на пестром ряду. Для кишечной палочки характерна ферментация лактозы, глюкозы, мальтозы и маннита с образованием кислоты и газа, отсутствие ферментации, сахарозы, образование индола. Учет реакции агглютинации провести с помощью лупы. Агглютинация с живой культурой крупнохлопчатая (Н-агглютинация), с убитой – мелкозернистая (О-агглютинация).
Не нашли то, что искали? Воспользуйтесь поиском:
1. селективное обогащение (накопление):
· жидкая среда Кесслера с поплавком (с лактозой): культивирование – (36±1)°С, для E.coli используют температуру (43±1)°С в течение 24-48 ч. Проверяется сбраживание лактозы и образование газа. На среде Кесслера кишечная палочка дает обесцвечивание и помутнение среды связи с подкислением среды, и образование газа в поплавке.
· жидкая элективная среда Кода: культивирование – 37°С 18-24 ч. Проверяется сбраживание лактозы и образование газа. Признаком роста лактозоположительных энтеробактерий (БГКП, E. coli) является изменение цвета среды с темно-зеленого до ярко-желтого.
2. плотные дифференциально-диагностические среды:
· среда Эндо: культивировать – (37±1)°С в течение 18-20 ч. На среде Эндо Е.соli колонии имеют круглую форму, ровный, четко очерченный край, матовую поверхность, малиново-красный темно-красный цвет, который зависит от способности культуры расщеплять лактозу с образованием кислоты, с металлическим блеском. Колонии от бледно-розового до темно-красного цвета с нечетким металлическим блеском. Диаметр колоний 1,5-2,5 или 2,0-3,0 мм.
· среда Левина: культивировать – (37±1)°С в течение 24-48 ч. Колонии кишечной палочки темно-синего (темно-фиолетового) цвета с зеленым металлическим блеском (или без него) диаметром 1,5-2,0 мм, в остальном они не отличаются от колоний кишечной палочки на среде Эндо.
· скошенный РПА (МПА): культивировать – 37°С 18-20 ч. На поверхности агара кишечная палочка образует влажный, блестящий налет сероватого цвета, слегка опалесцирующий в проходящем свете.
3. морфология клеток:
4. биохимические тесты:
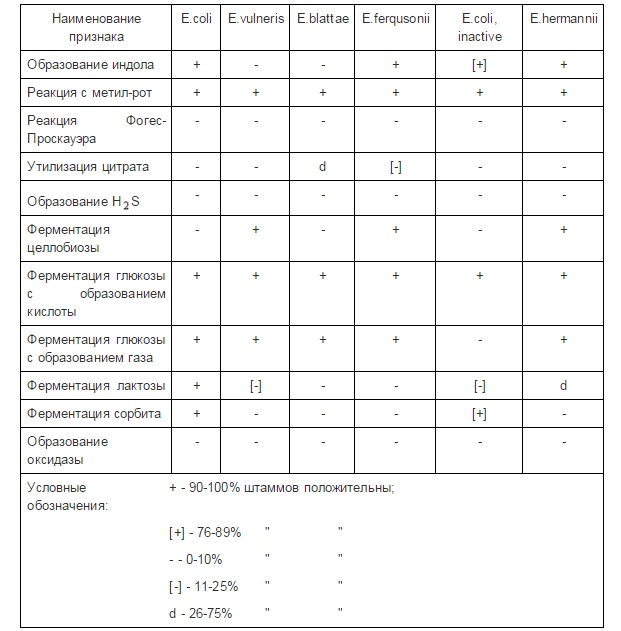
E. coli образует индол.
Оксидазоотрицательные бактерии пересевают на поверхность МПА (РПА) или среды, приготовленной из ПА. Посевы инкубируют до появления видимого роста при температуре (36±1)°С. У оксидазоотрицательных грамотрицательных культур (палочки размером 1,1×1,5×2 6 мкм), выросших в пересевах по 7.3, определяют возможность образования индола, ацетоина, сероводорода, утилизации цитрата, интенсивность ферментации углеводов с образованием кислоты, ферментацию сорбита, глюкозы и лактозы.
· способность образовывать индол: культуру высевают в пробирку с бульоном Хоттингера или МПБ (РПБ) с триптофаном. Под пробку в пробирку помещают полоску индикаторной бумажки. Посевы инкубируют при температуре (36±1)°С в течение 24 ч. Если за время инкубирования посевов в среде накапливается индол, то желтый цвет индикаторной бумажки меняется на цвет от сиренево-розового до интенсивного малинового. Образование индола можно определить с помощью реактивов Эрлиха и Ковача. Для этого к 5 см 24-часовой культуры добавляют 1 мл одного из реактивов. Образование красного слоя на поверхности культуральной жидкости указывает на положительную реакцию. E.coli образует индол.
E. coli не образует ацетоин.
· способность образовывать ацетоин (реакция Фогес-Проскауэра): культуру высевают в пробирки со средой Кларка. Посевы инкубируют при температуре (36±1)°С в течение 48 ч. После инкубирования посевов к 1 мл отобранной культуральной жидкости прибавляют 0,6 мл раствора 1-нафтола и 0,2 мл раствора гидроокиси калия. После прибавления каждого реактива пробирку встряхивают. Проявление розового окрашивания через 15-60 мин. указывает на положительную реакцию. E.coli не образует ацетоин.
E. coli не утилизирует цитрат.
· способность утилизировать цитрат: культуру высевают в пробирки со средой Козера или на поверхность среды Симмонса. Посевы инкубируют при температуре (36±1)°С в течение 24-48 ч. Изменение оливково-зеленого цвета сред на васильковый, синий указывает на положительную реакцию.
E.coli интенсивно ферментирует углеводы (реакция с метил-рот положительная).
· определение интенсивности ферментации углеводов с образованием кислоты (реакция с метил-рот): культуру высевают в пробирки с глюкозо-фосфатным бульоном или средой Кларка или используют посевы после отбора 1 мл культуральной жидкости для проведения реакции Фогес-Проскауэра. Посевы инкубируют при температуре (36±1)°С в течение 48 ч. К 5 мл культуральной жидкости прибавляют 5-10 капель реактива Кларка. Появление через 1 мин. красного цвета культуральной жидкости указывает на ферментацию углеводов до рН ниже 5,0.
E.coli ферментирует глюкозу, лактозу и сорбит.
· определение ферментации сорбита, глюкозы и лактозы: культуру высевают в среды Гисса с сорбитом или глюкозой, или лактозой. Посевы инкубируют при температуре (36±1)°С в течение 24 ч, а на среде Гисса с лактозой при температуре (44±1)°С в течение 24 ч. При ферментации глюкозы образуется газ. Ферментацию глюкозы можно учитывать в засеянных косяках ТСА или среды Клиглера по изменению цвета столбика среды и образованию в нем газа. Ферментацию лактозы учитывают по изменению цвета скошенной поверхности среды Клиглера. Ферментацию сорбита учитывают по изменению цвета среды. У культур типичных для Е.соli по всем изученным признакам, но не ферментирующим сорбит, изучают возможность ферментации целлобиозы на среде Гисса с целлобиозой, при температуре (36±1)°С в течение 24 ч.
Е.соli не образует сероводород.
· определение образования сероводорода: образование сероводорода учитывают в посевах на среду Клиглера или ТСА после инкубирования посевов при температуре (36±1)°С в течение 24 ч. Почернение в столбике среды указывает на образование сероводорода.
Идентификация Salmonella
Salmonella грамотрицательные палочки с закругленными концами.
1. первичное неселективное накопление (обогащение):
· ЗПВ (забуференная пептонная вода): навеску продукта засевают в среду. Соотношение продукта и ЗПВ 1:9. Рост проявляется в помутнении среды. Культивирование – (36±1)ºС 18±2 ч.
· магниевая среда (хлормагниевая): Засевают непосредственно продукт. Культивирование – (36±1)ºС 24-48 ч.
2. селективное обогащение:
· жидкая элективная среда Кода: культивировать. Признаком роста лактозоотрицательных энтеробактерий (сальмонелл) является помутнение среды без изменения цвета.
· магниевая среда (хлормагниевая): засевают культуру, полученную после предварительной инкубации. Культивирование – (36±1)ºС 24-48 ч.
· селенитовая среда (селенитовый бульон Лейфсона): засевают культуру, полученную после предварительной инкубации. Культивирование – 35ºС 18-24 ч.
· среда Раппапорта-Вассилиадиса с соей (RVS-бульон): засевают культуру, полученную после предварительной инкубации. Культивирование – (41,5±1)ºС 24±3 ч. Рост проявляется диффузным помутнением среды.
· тетратионатная среда Мюллер-Кауфман (МКТ-бульон): засевают культуру, полученную после предварительной инкубации. Культивирование – (43±1)ºС 24-48 ч. или (37±1)ºС 24±3 ч.
3. плотные дифференциально-диагностические среды:
· питательная среда Эндо: низкоселективная среда. Культивирование – (37±1)ºС 18-20 ч. На среде сальмонеллы круглые бесцветные или слегка розоватые, прозрачные. Образование полупрозрачных бесцветных или бледно-розовых колоний свидетельствует о принадлежности микроорганизмов, давших рост на накопительных питательных средах, к лактозоотрицательным энтеробактериям, в том числе сальмонелл.
· среда Плоскирева (или бактоагар Плоскирева): среднеселективная среда. Культивирование – (37±1)ºС 18-20 ч. На средах колонии сальмонелл бесцветные прозрачные, но более плотные, чем на среде Эндо. Бесцветные, нежные, гладкие, круглые диаметром 1,0-2,0 мм.
· среда ВСА (висмут-сульфит агар): высокоселективная среда. Культивирование – (37±1)ºС 24-48 ч. На ВСА колонии сальмонеллы имеют черный цвет с характерным сероватым металлическим блеском в виде ободка, а также зеленоватого цвета с темным центром и темно-зеленым ободком и с пигментированием (потемнением) среды под колониями.
· среда Левина: низкоселективная среда. Культивирование – (37±1)ºС 24-48 ч. На среде колонии сальмонеллы прозрачные, слабо-розовые или розовато-фиолетовые.
· ксилоза-лизин-дезоксихолатный агар (XLD-агар): культивирование – (37±1)ºС 24-48 ч. Колонии сальмонелл имеют черный центр и слегка прозрачную зону красноватого цвета, что принадлежит цвету индикатора. Бактерии рода сальмонелл сероводородотрицательные образуют на среде розовые колонии с темным розовым центром. Лактозоположительные бактерии рода сальмонелла на среде дают желтые колонии с почернением или без него. Круглые, блестящие, бесцветные с черным центром или без него, диаметром 1,0-3,0 мм.
· бриллиантовый зеленый агар: культивирование – (37±1)ºС 48 ч. На среде сальмонеллы образуют красноватые или розовые, почти белые колонии (их цвет зависит от штамма и срока культивирования). Лактозо- и сахарозоположительные сальмонеллы образуют зеленоватые колонии, окруженные яркой желто-зеленой зоной.
· сальмонелла-шигелла агар (SS-агар): культивировать 37°С 18-20 ч. Колонии бесцветные, диаметром 1-2 мм.
· среда Плоскирева: культивировать 37°С 18-20 ч. Колонии малинового цвета, круглые, выпуклые, гладкие диаметром 1,5-2,5 мм.
· скошенный РПА или ПА: Культивирование – (36±1)ºС 24 ч. Рост прозрачный по штриху.
4. морфология клеток:
· сальмонеллы грамотрицательные палочки с закругленными концами.
5. биохимические тесты:
Salmonella ферментирует глюкозу с образованием или без образования газа, не ферментирует лактозу и сахарозу.
· способность ферментировать сахара (лактозу, глюкозу и сахарозу): на трехсахарном агаре (ТСА, TSI-агар), среде Олькеницкого (3 сахара с мочевиной) среде Клиглера (2 сахара): Посев осуществляется петлей на скошенную поверхность и уколом в столбик с помощью бактериальной иглы. Культивирование – (36±1)ºС 24 ч. Пожелтение скошенной части среды указывает на ферментацию лактозы или сахарозы, или обоих сахаров. Красная или неизменившая цвета среда говорит о лактозо- и сахарозоотрицательных сальмонеллах. Пожелтение столбика среды указывает на ферментацию глюкозы. Красный или неизменившийся цвет – глюкоза отрицательная. Столбик с разрывом агара или пузырьками газа – образование газа. Отсутствие разрывов и пузырьков – газ не образуется. Агар Клиглера – по скошенной поверхности учитываю только ферментацию лактозы.
Salmonella образует сероводород.
· способность образовывать сероводород: Посев осуществляется петлей на скошенную поверхность и уколом в столбик ТСА, среду Олькеницкого, Клиглера с помощью бактериальной иглы. Культивирование – (36±1)ºС 24 ч. Почернение среды в столбике указывает на образование сероводорода.
Salmonella не расщепляет мочевину.
· способность расщеплять мочевину: культуру со скошенного РПА (ПА) пересевают штрихом на поверхность агара с мочевиной (агар Кристенсена с мочевиной). Культивирование – (36±1)ºС 24 ч. При положительной реакции – расщеплении мочевины с выделением аммония цвет среды фенолового красного меняется от розового до светло-вишневого. Для уреазоположительных бактерий реакция часто становится видимой после 2 ч. инкубации.
Salmonella не образует ацетоин (реакция Фогес-Проскауэра отрицательная).
· способность образовывать ацетоин: реакция Фогес-Проскауэра. Культуру со скошенного РПА (ПА) пересевают в МПБ (РМБ) с глюкозой или суспендируют петлей в стерильной пробирке с 3 мл VP среды. Культивирование – (36±1)ºС 48 ч. После культивирования к 1 мл отобранной культуральной жидкости прибавляют 0,6 мл раствора α-нафтола и 0,2 мл раствора гидроокиси калия концентрации 400 г/л. Или прибавляют две капли раствора креатина, три капли спиртового раствора 1-нафтола и две капли раствора гидроокиси калия, перемешивают содержимое пробирки после прибавления каждого реактива. После прибавления каждого реактива пробирку встряхивают. Появление розового или светло-красного окрашивания через 15 мин. указывает на положительную реакцию.
Salmonella не образует индол.
· способность образовывать индол: культуру со скошенного РПА (ПА) пересевают в бульон Хоттингера или в МПБ (РПБ) с L-триптофаном, или в 5 мл триптон/триптофановой среды. Культивирование – (36±1)ºС 24 ч. После инкубирования, к посеву прибавляют по 1 мл реактива Эрлиха и Ковача. Образование красного слоя указывает на положительную реакцию.
Salmonella не сбраживает сахарозу, но сбраживает манит. При сбраживании маннита цвет среды изменяется, образуется или не образуется газ.
· способность сбраживать манит и сахарозу: культуру со скошенного РПА (ПА) пересевают с среды Гисса с маннитом и сахарозой. Культивирование – (36±1)ºС 24 ч.
Большинство штаммов Salmonella подвижны.
· способность двигаться: культуру со скошенного РПА (ПА) пересевают уколом с помощью бактериальной иглы в полужидкий МПА. Культивирование – (36±1)ºС 24 ч. При росте подвижных культур отмечается диффузный рост по всему столбику агара, при росте неподвижных – вдоль места укола.
Salmonella paratyphi не образует L-лизиндекарбоксилазу, остальные образуют.
· образование L-лизиндекарбоксилазы: инокулируют снизу жидкую L-лизиндекарбоксилазную среду. Культивирование – (37±1)ºС 24±3 ч. Помутнение и пурпурный цвет среды указывает на положительную реакцию. Желтый цвет – на отрицательную.
Salmonella, кроме Salmonella arizonae не обладают β-галактозидазой.
· наличие β-галактозидазы: суспендируют петлей суточную культуру со скошенного РПА (ПА) в 0,25 мл физраствора, прибавляют одну каплю толуола и встряхивают пробирку. Помещают ее на водяную баню при температуре 37ºС и оставляют примерно на 5 мин. Затем добавляют0,25 мл реактива для определения β-галактозидазы и перемешивают. Оставляют пробирку на водяной бане при 37ºС в течение (24±3) ч, наблюдая за изменением цвета через определенные промежутки времени. Желтый цвет указывает на положительную реакцию. Изменение цвета обнаруживается примерно через 20 мин.
Читайте также:


