Дифференциальный диагноз токсокароза что это
Токсокароз — паразитарное заболевание, вызываемое миграцией личинок аскарид животных семейства псовых (T. canis ). Характеризуется длительным рецидивирующим течением и полиорганными поражениями иммунологической природы. Возбудителями токсокароза могут бы
- Биология возбудителя
Половозрелые формы T. canis — крупные раздельнополые черви длиной 4 — 18 см локализуются в желудке и тонком кишечнике животных (собак). Интенсивность инвазии у собак может быть очень высокой, особенно у молодых животных. Средняя продолжительность жизни половозрелых особей составляет 4 месяца, максимальная — 6 месяцев. Самка паразита за сутки откладывает более 200 тыс. яиц. В 1 г фекалий может содержаться 10 000—15 000 яиц, так что в почву попадают миллионы яиц, обусловливая тем самым высокий риск заражения токсокарозом.
 |
Яйца токсокар округлой формы, крупнее яиц аскариды (65—75 мкм). Наружная оболочка яйца толстая, плотная, мелкобугристая. Внутри яйца располагается темный бластомер.
Цикл развития возбудителя следующий. Выделившиеся яйца токсокар попадают в почву, где, в зависимости от влажности и температуры почвы, созревают за 5—36 суток, становясь инвазионными. Инвазионность яиц сохраняется в почве длительное время, в компосте — несколько лет.
Жизненный цикл токсокары сложный. Выделяют основной цикл и два варианта вспомогательных. Основной цикл происходит по схеме: окончательный хозяин (псовые) — почва — окончательный хозяин (псовые). Передача инвазии осуществляется геооральным путем. Вспомогательный цикл (вариант 1) идет трансплацентарно, в этом случае паразит в личиночной стадии переходит от беременной самки к плоду, в организме которого совершает полную миграцию, достигая в кишечнике щенка половозрелой стадии. Инвазированный щенок становится функционально полноценным окончательным хозяином, источником инвазии.
Вспомогательный цикл (вариант 2) осуществляется по цепи: окончательный хозяин (псовые) — почва — паратенический хозяин. Паратеническим (резервуарным) хозяином могут быть грызуны, свиньи, овцы, птицы, земляные черви. Человек также выступает в роли паратенического хозяина, но не включается в цикл передачи инвазии, являясь для паразита биологическим тупиком. Дальнейшее развитие возбудителя происходит при условии, что паратенический хозяин будет съеден собакой или другим окончательным хозяином. Механизм передачи инвазии при этом варианте — геооральный — ксенотрофный.
В зависимости от возраста хозяина реализуются разные пути миграции личинок токсокар. У молодых животных (щенков до 5 недель) почти все личинки совершают полную миграцию с достижением половозрелых форм в кишечнике и выделением яиц во внешнюю среду. В организме взрослых животных большая часть личинок мигрирует в соматические ткани, где сохраняет жизнеспособность несколько лет. В период беременности и лактации у беременных сук возобновляется миграция личинок. Мигрирующие личинки через плаценту попадают в организм плода. Личинки остаются в печени пренатально инвазированных щенков до рождения, а после рождения личинки из печени мигрируют в легкие, трахею, глотку, пищевод и попадают в желудочно-кишечный тракт, где через 3—4 недели достигают половозрелой стадии и начинают выделять во внешнюю среду яйца. Кормящие суки могут передавать щенкам инвазию также через молоко.
У человека цикл развития возбудителя, его миграция осуществляется следующим образом. Из яиц токсокар, попавших в рот, затем в желудок и тонкий кишечник выходят личинки, которые через слизистую оболочку проникают в кровеносные сосуды и через систему воротной вены мигрируют в печень, где часть из них оседает, инцистируется или окружается воспалительными инфильтратами, образуя гранулемы. Часть личинок по системе печеночных вен проходит фильтр печени, попадает в правое сердце и через легочную артерию — в капиллярную сеть легких. В легких часть личинок также задерживается, а часть, пройдя фильтр легких, по большому кругу кровообращения заносится в различные органы, оседая в них. Личинки токсокар могут локализоваться в различных органах и тканях — почках, мышцах, щитовидной железе, головном мозге и др. В тканях личинки сохраняют жизнеспособность многие годы и периодически, под влиянием различных факторов, возобновляют миграцию, обусловливая рецидивы заболевания.
- Географическое распространение и эпидемиология
Токсокароз — широко распространенная инвазия, она регистрируется во многих странах. Показатели пораженности плотоядных являются высокими во всех странах мира. Средняя пораженность собак кишечным токсокарозом, обследованных на различных континентах, составляет свыше 15%, но в некоторых регионах у части животных достигает 93%. По данным сероэпидемиологических исследований, от 2 до 14% обследованных практически здоровых лиц в различных очагах токсокароза имеют положительные иммунологические реакции на токсокароз. Распространенность инвазии в различных регионах точно неизвестна, поскольку токсокароз не подлежит обязательной регистрации. Совершенно очевидно, что токсокароз имеет широкую геграфию распространения, и число больных значительно выше официально регистрируемых.
| Токсокароз широко распространен и регистрируется во многих странах. Средняя пораженность кишечным токсокарозом собак, обследованных на различных континентах, составляет свыше 15%, но в некоторых регионах достигает 93%. По данным сероэпидемиологических исследований, от 2 до 14% обследованных практически здоровых лиц в различных очагах токсокароза имеют положительные иммунологические реакции на токсокароз |
Основным источником инвазии для человека являются собаки, особенно щенки. Заражение происходит при непосредственном контакте с инвазированным животным, шерсть которого загрязнена инвазионными яйцами, или при попадании в рот земли, в которой были яйца токсокар. Особенно подвержены заражению дети во время игры в песке или с собакой. Наибольший риск заражения у детей, страдающих геофагией. Взрослые заражаются при бытовом контакте с инвазированными животными или в процессе профессиональной деятельности (ветеринары, собаководы, работники коммунальной службы, шоферы, землекопы и др.). У человека возможно заражение также при поедании сырого или плохо обработанного термически мяса паратенических хозяев. Описаны случаи заражения токсокарозом при употреблении в пищу печени ягненка. Не исключается возможность трансплацентарной и трансмаммарной передачи инвазии и у человека.
- Патогенез и патологическая анатомия
Патогенез токсокароза сложный и определяется комплексом механизмов в системе паразит — хозяин. В период миграции личинки травмируют кровеносные сосуды и ткани, вызывая геморрагии, некроз, воспалительные изменения. Ведущая роль принадлежит иммунологическим реакциям организма в ответ на инвазию. Экскреторно-секреторные антигены личинок оказывают сенсибилизирующее действие с развитием реакций немедленного и замедленного типов. При разрушении личинок в организм человека попадают соматические антигены личинок. Аллергические реакции проявляются отеками, кожной эритемой, увеличением резистентности дыхательных путей к вдыхаемому воздуху, что клинически выражается развитием приступов удушья. В аллергических реакциях принимают участие тучные клетки, базофилы, нейтрофилы, но основную роль играют эозинофилы. Пролиферация эозинофилов регулируется Т-лимфоцитами при участии медиаторов воспалительных реакций, выделяемых сенсибилизированными лимфоцитами, нейтрофилами, базофилами. Образующиеся иммунные комплексы привлекают в очаг поражения эозинофилы. Вокруг личинок токсокар кумулируются сенсибилизированные Т-лимфоциты, привлекаются макрофаги и другие клетки — формируется паразитарная гранулома.
Патоморфологическим субстратом токсокароза является выраженное в различной степени гранулематозное поражение тканей. При интенсивной инвазии развиваются тяжелые гранулематозные поражения многих органов и систем, которые при повторных заражениях могут стать хроническими. При токсокарозе находят многочисленные гранулемы в печени, легких, поджелудочной железе, миокарде, лимфатических узлах, головном мозге и других органах.
- Клиническая картина токсокароза
Наиболее характерным лабораторным показателем является повышенное содержание эозинофилов в периферической крови. Относительный уровень эозинофилии может колебаться в широких пределах, достигая в ряде случаев 70 — 80% и более. Повышается содержание лейкоцитов (от 20х109 до 30х109 на 1 л). При исследовании пунктата костного мозга выявляется гиперплазия зрелых эозинофилов. У детей нередко отмечается умеренная анемия. Некоторые исследователи отмечают прямую корреляцию между тяжестью клинических проявлений инвазии и уровнем эозинофилии и гиперлейкоцитоза периферической крови. Характерным лабораторным признаком является также ускорение СОЭ, гипергаммаглобулинемия. В случаях поражения печени наблюдается повышение билирубина, гиперферментемия.
В хронической стадии болезни острые клинические и лабораторные признаки затухают. Наиболее стабильным лабораторным показателем остается гиперэозинофилия периферической крови.
Выделяют субклиническое, легкое, среднетяжелое и тяжелое течение токсокароза. Возможна так называемая бессимптомная эозинофилия крови, когда явные клинические проявления инвазии отсутствуют, но наряду с гиперэозинофилией выявляются антитела к антигенам T.canis.
Одной из наиболее серьезных проблем, связанных с токсокарозом, является его взаимосвязь с бронхиальной астмой. При сероэпидемиологических исследованиях установлено, что у больных бронхиальной астмой нередко обнаруживаются антитела к антигенам T.canis классов Ig G и Ig E. В зависимости от остроты паразитарного процесса, его длительности и длительности клинических проявлений бронхиальной астмы преобладает тот или другой класс иммуноглобулинов. Имеются клинические наблюдения, свидетельствующие об улучшении течения бронхиальной астмы или выздоровлении после ликвидации токсокарозной инвазии.
Паразитологический диагноз устанавливается редко и только по наличию в тканях характерных гранулем и личинок и их идентификации при исследовании биопсийного и секционного материала. Это возможно при пункционной биопсии печени, легких, оперативном вмешательстве. Обычно диагноз токсокароза устанавливается на основании данных эпидемиологического анамнеза, клинической симптоматики и гематологических проявлений. Используют также иммунологические реакции, позволяющие выявлять антитела к антигенам токсокар. Обычно применяют ИФА с секреторно-экскреторным антигеном личинок токсокар второго возраста. В настоящее время в России выпускается коммерческий диагностикум. Диагностическим титром считают титр антител 1:400 и выше (в ИФА). Титр антител 1:400 свидетельствует об инвазированности, но не болезни. Титр антител 1:800 и выше свидетельствует о заболевании токсокарозом. Практика показывает, что прямая корреляция между уровнем антител и тяжестью клинических проявлений токсокароза существует не всегда. Не всегда имеется и корреляция между уровнем антител и гиперэозинофилии крови.
При постановке диагноза и определении показаний к специфической терапии следует учитывать, что токсокароз протекает циклически с рецидивами и ремиссиями, в связи с чем возможны значительные колебания клинических, гематологических и иммунологических показателей у одного и того же больного.
М. И. Алексеева и соавт. (1984) разработали алгоритм диагностики токсокароза, основанный на оценках в баллах значимости клинических симптомов и сопоставлении клинико-эпидемиологических и лабораторных показателей. Этот метод может быть перспективен при проведении массовых обследований населения.
Дифференциальный диагноз проводят с миграционной стадией других гельминтозов (аскаридоз, описторхоз), стронгилоидозом, эозинофильной гранулемой, лимфогранулематозом, эозинофильным васкулитом, метастазирующей аденомой поджелудочной железы, гипернефромой и другими заболеваниями, сопровождающимися повышенным содержанием эозинофилов в периферической крови. Следует иметь в виду, что у больных с системными лимфопролиферативными заболеваниями и серьезными нарушениями в системе иммунитета иммунологические реакции могут быть ложно положительными. В этих случаях необходим тщательный анализ клинической картины заболевания.
| При интенсивной инвазии развиваются тяжелые гранулематозные поражения многих органов и систем, которые при повторных заражениях могут стать хроническими |
Глазной токсокароз. Патогенез этой формы токсокароза до конца не ясен. Существует гипотеза об избирательном поражении глаз у лиц с инвазией низкой интенсивности, при которой не развивается достаточно выраженная иммунная реакция организма из-за слабого антигенного воздействия небольшого числа поступивших в организм личинок токсокар.
Эта форма токсокароза чаще наблюдается у детей и подростков, хотя описаны случаи заболевания и у взрослых.
Для токсокароза характерно одностороннее поражение глаз. Патологический процесс развивается в сетчатке, поражается хрусталик, иногда параорбитальная клетчатка. В тканях глаза формируется воспалительная реакция гранулематозного характера. Патологический процесс часто принимают за ретинобластому, проводят энуклеацию глаза. При морфологическом исследовании обнаруживают эозинофильные гранулемы, иногда — личинки токсокар.
Клинически поражение глаз протекает как хронический эндофтальмит, хориоретинит, иридоциклит, кератит, папиллит. Глазной токсокароз — одна из частых причин потери зрения.
Диагностика глазного токсокароза сложна. Количество эозинофилов обычно нормальное или незначительно повышено. Специфические антитела не выявляются или выявляются в низких титрах.
- Лечение токсокароза
Разработано недостаточно. Применяют противонематодозные препараты — тиабендазол (минтезол), мебендазол (вермокс), медамин, диэтилкарбамазин. Эти препараты эффективны в отношении мигрирующих личинок и недостаточно эффективны в отношении тканевых форм, находящихся в гранулемах внутренних органов.
Минтезол (тиабендазол) назначают в дозах 25—50 мг/кг массы тела в сутки в три приема в течение 5—10 дней. Побочные явления возникают часто и проявляются тошнотой, головной болью, болями в животе, чувством отвращения к препарату (в настоящее время препарат в аптечную сеть России не поступает).
Вермокс (мебендазол) назначают по 200 —300 мг в сутки в течение 1—4 недель. Побочные реакции обычно не наблюдаются.
 |
Медамин применяют в дозе 10 мг/кг массы тела в сутки повторными циклами по 10 — 14 дней.
Диэтилкарбамазин назначают в дозах 2 — 6 мг/кг массы тела в сутки в течение 2 — 4 недель. (В настоящее время препарат в России не производится, не закупается за рубежом. — Прим. ред.)
Альбендазол назначают в дозе 10 мг/кг массы тела в сутки в два приема (утро — вечер) в течение 7 — 14 дней. В процессе лечения необходим контроль анализа крови (возможность развития агранулоцитоза) и уровня аминотрансфераз (гепатотоксическое действие препарата). Небольшое повышение уровня аминотрансфераз не является показанием к отмене препарата. В случае нарастающей гиперферментемии и угрозы развития токсического гепатита требуется отмена препарата.
Критерии эффективности лечения: улучшение общего состояния, постепенная регрессия клинических симптомов, снижение уровня эозинофилии и титров специфических антител. Следует отметить, что клинический эффект лечения опережает положительную динамику гематологических и иммунологических изменений. При рецидивах клинической симптоматики, стойкой эозинофилии и положительных иммунологических реакциях проводят повторные курсы лечения.
Прогноз для жизни благоприятный, однако при массивной инвазии и тяжелых полиорганных поражениях, особенно у лиц с нарушениями иммунитета, возможен летальный исход.
Включает соблюдение личной гигиены, обучение детей санитарным навыкам.
Важным профилактическим мероприятием является своевременное обследование и дегельминтизация собак. Наиболее эффективно преимагинальное лечение щенков в возрасте 4 — 5 недель, а также беременных сук. Для лечения собак используют противонематодозные препараты. Необходимо ограничение численности безнадзорных собак, оборудование специальных площадок для выгула собак.
Следует улучшить санитарно-просветительскую работу среди населения, давать информацию о возможных источниках инвазии и путях ее передачи. Особого внимания требуют лица, по роду деятельности имеющие контакты с источниками инвазии (ветеринарные работники, собаководы, землекопы и другие).

Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Прижизненный паразитологический диагноз токсокароза возможен крайне редко и только при исследовании биопсийного материала, когда в тканях удаётся обнаружить и верифицировать личинки токсокар. Диагностика токсокароза основывается на данных эпидемиологического анамнеза, клинической симптоматики. Учитывают наличие стойкой длительной эозинофилии, хотя при глазном токсокарозе она не всегда встречается. Указание на содержание в семье собаки или на тесный контакт с собаками, на геофагию свидетельствует об относительно высоком риске заражения токсокарозом.
Иммунологическая диагностика токсокароза направлена на определение содержания специфических IgG к антигену Т. cams в сыворотке крови методом ИФА. который обладает высокой чувствительностью и достаточной специфичностью при висцеральной локализации личинок - 93.7 и 89.3% соответственно, однако недостаточно информативен при поражении глаз. Титр антител 1:400 свидетельствует об инвазированности, но не о болезни; о заболевании токсокарозом говорит титр 1:800 и выше. У больных хронической формой с выраженным лёгочным синдромом уровень специфических антител, как правило, повышен умеренно (1:800 или 1:1600). Однако у этой группы больных закономерно выявляют повышенное содержание в сыворотке крови специфических противотоксокарных антител класса IgE. Для подтверждения результатов ИФА можно использовать иммуноблотинг. Не всегда существует корреляция между уровнем антител и тяжестью клинических проявлений токсокароза, также как и между уровнем антител и пшерэозинофилией крови. В связи с циклическим течением инвазии с рецидивами и ремиссиями в динамике возможны значительные колебания клинических, гематологических и иммунологических показателей у одного и того же больного. В клиническое исследование больных токсокарозом рекомендуют включать биохимический анализ крови, рентгенологическое исследование лёгких, по показаниям - бронхоскопию, бронхографию. ЭКГ, УЗИ органов брюшной полости.
Показания к госпитализации
Лечение токсокароза больных с тяжёлой формой и детей до 3 лет проводят в стационаре. Больные токсокарозом неконтагиозны и в изоляции не нуждаются.
Дифференциальная диагностика токсокароза
Дифференциальная диагностика токсокароза проводится с ранней стадией гельминтозов, свойственных человеку (аскаридоз, стронгилоидоз, шистосомозы, описторхоз). бронхиальной астмой, а также с многочисленными заболеваниями, которые сопровождаются эозинофилией в периферической крови (синдром Лёффлера, тропическая эозинофилия, хронический неспецифический полиартрит у детей, лимфогранулематоз, рак, медикаментозная сенсибилизация, пристеночный фибропластический миокардит и др.). Глазной токсокароз необходимо дифференцировать от ретинобластомы и хориоретинита туберкулёзной, цитомегаловирусной и другой этиологии. Надёжных методов диагностики глазного токсокароза не существует. Во многих случаях диагноз ставят только при гистологическом исследовании. В диагностических целях используют УЗИ и КТ глаза. Иногда диагноз "токсокароз" можно поставить только на основании эффекта от проведённого курса противопаразитарного лечения. Вопросы диагностики и лечения больных глазным токсокарозом решают совместно офтальмолог и врач-инфекционист.

[1], [2], [3], [4], [5], [6], [7]

Токсокароз — это инфицирование внутренних тканей и органов человека личинками паразита токсокары. Болезнь вызывается червями Toxocara canis. На территории нашей страны, токсокароз у человека занимает лидирующие позиции среди всех гельминтозов. Такая статистика обуславливается широким распространением паразита. Данное заболевание входит в группу геогельминтозов. Подобное название произошло от того, что местом созревания и хранения яиц червя является земля. Природным носителем токсокары являются хищные животные семейства псовых (собаки, лисы, и т.д.) и кошачьих.
В организм людей паразиты проникают случайно и не формируются до взрослого индивида. Симптоматика заболевания столь многообразна, что врачи с многолетним опытом не берутся ставить диагноз на основании внешних проявлений. В организме, личинка червя переносится посредством крови, в следствие чего, она может попасть в любой орган, где токсокары и вызовут соответствующие симптомы. Нередки случаи, когда токсокароз протекает, как аллергия (сыпь, бронхиальная астма, отек Квинке).
Токсокароз диагностируют с помощью специального теста, который проводится на основании общего анализа крови. Правильное лечение обезопасит человека от осложнений, которые чаще всего, очень тяжело поддаются стандартной терапии.
Возбудитель токсокароза
Токсокароз могут вызывать следующие виды червей:
- Toxocara canis. Переносчиками являются собаки;
- Toxocara cati. Переносчики — кошки;
- Toxocara vitulorum. Переносчиками является крупный рогатый скот (буйволы, коровы).

Яйца червя имеют коричневый оттенок, круглые, с тугой внешней оболочкой. Размер яиц может достигать 65-75 мкм. Несмотря на столь малый размер, они имеют похожее строение с аскаридами. В достаточно сформированном яйце находится подвижная личинка. Если же яйцо еще не сформировалось полностью, то личинки еще нет, а внутри находится эмбрион в форме шара.

Особи, достигшие половой зрелости, в большинстве случаев, находятся в тонком кишечнике, а также желудке животных. В особенности, этому подвержены молодые особи семейства псовых, кошек, а также промежуточные хозяева. Жизненный цикл паразитов составляет от 4 до 6 месяцев. При этом, взрослая самка токсокары способна произвести до 200 тысяч яиц в сутки. Ввиду того, что 1 гр кала инфицированного животного содержит 12-15 тысяч яиц, можно представить, какое количество оказывается в грунте после процесса дефекации. После попадания в почту, при благоприятных факторах (определенная температура и влажность), они начинают созревать на протяжении 5-30 дней. Созревшие яйца способны сохранять жизнеспособность длительное время, вплоть до 2 лет.
Сокращенный цикл формирования токсокароза у животных имеет несколько стадий. Окончательным хозяином являются животные. Инфицирование происходит оральным путем (проглатывание зараженной земли) или от самки к щенку. После этого, жизненный цикл проходит либо по основному направлению (животное-грунт-животное), либо по второстепенному (животные – грунт – промежуточный хозяин). Второе направление является тупиковым для гельминта (человек, как промежуточное звено, не участвует в их распространении).
Справочно. Отличительной чертой токсокароза является то, что червь либо проникает в кишечник и развивается до зрелой стадии (способной откладывать яйца), либо попадает в соматические органы (заражение происходит от беременной особи к потомству).
По своему протеканию, у человека токсокароз похож на аскаридоз. Начальным пунктом базирования яиц является тонкий кишечник. В нем, из яиц появляются личинки, которые транспортируются кровью в печень. Там, их некоторая часть оседает и создает вокруг себя специфические очаги воспаления. Оставшаяся часть переносится в правую часть сердца. Оттуда, через легочную артерию попадают в легкие — еще одно место обитание червей. Через легочные артерии, оставшиеся личинки попадают в легочные вены, через которые переносятся в левые отделы сердца.
После этого, посредством большого кровотока паразиты разносятся по организму. Проходя через сосуды, диаметром 0,02 мм, они застревают и проникают в орган, в котором остановились. Вследствие чего, возможно заболевание сразу нескольких органов — легких, печени, желез, почек, мышц мозга, и т.д. В этих органах личинки способны сохраняться многие годы.

С понижением иммунитета, личинки вновь могут активизироваться и начать свою миграцию, что вызывает рецидив заболевания. Некоторая часть личинок, осевшая в органах, формирует вокруг себя тугую оболочку. Со временем она разрушается, и паразиты попадают в носоглотку, пищевод и т.д. Гельминты не передаются от человека к человеку, т.к. они паразитируют лишь в форме личинок.
Последствия заражения личинками токсокар
Основное последствие — возникновение аллергии. К тому же, не стоит забывать, что личинки способны оседать во внутренних органах, нарушая их функционирование. Также, при снижении иммунитета может вновь начаться миграция паразитов и, как следствие — инфицирование новых органов, и нарушение их работы.
Виды токсокароза
Для человека, источником инфекции являются собаки, особенно маленькие щенки. Однако, в число переносчиков также можно отнести и кошек, хотя это случается довольно редко. Человек не может являть переносчиком токсокароза.
Токсокароз достаточно широко распространен в ряде стран, одни из которых Африка, Юго-Восточная Азия, Россия, США, Англия, Польша и другие. Это паразитоз, который не характерен для человека, в основном распространен среди бродячих кошек и собак с пожизненным носительством личинок в организме, выбрасывающих в жилых массивах с фекалиями яйца гельминтов. Средняя инфицированность его среди собак и кошек около 16%, однако, в ряде регионов достигает до 90%. В популяции совершенно здоровых людей положительные иммунологические пробы на токсокароз регистрируются в 5-15% случаев.
Токсокароз – зоонозное паразитарное заболевание, характеризующееся попаданием (миграцией) и вредоносной жизнедеятельностью в организме человека личинок круглых червей – токсокар, с возможным поражением внутренних органов и систем.
Возбудитель токсокароза
Яйца токсокар коричневого цвета (от светлого до темного оттенка), имеют округлую форму с плотной наружной оболочкой, размер яиц до 65-75 мкм (они крупнее, чем у аскарид, однако имеют сходное строение). Если яйцо инвазионное (созревшее), то внутри его находится достаточно подвижная личинка. Если же яйцо неинвазионное (несозревшее), то внутри личинки нет, а присутствует бластомер шаровидной формы.
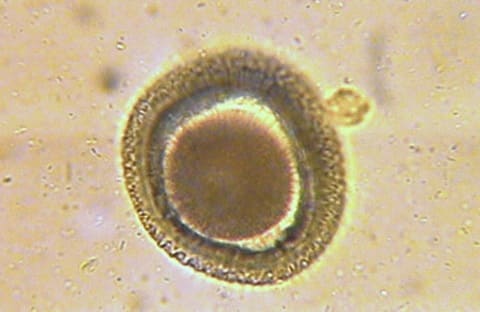
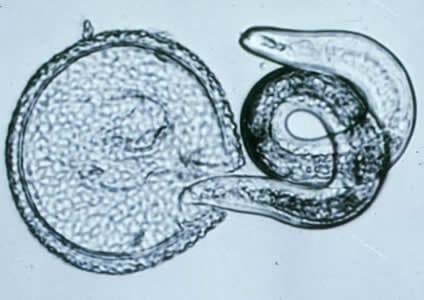
Половозрелые формы токсокар обитают в основном в тонком кишечнике и желудке животных, в основном молодых собак, кошек и других животных, а также промежуточных хозяев. Продолжительность жизни червей от 4 до 6 месяцев. Половозрелая самка за сутки способна отложить до 200 тысяч яиц. Поскольку в 1 гр испражнений больного животного могут содержаться до 12-15 тыс. яиц, то несложно представить, сколько их оказывается в почве при дефекации. Яйца при дефекации попадают в почву, где при определенных условиях (температуре и влажности) созревают в течение 5-30 дней, причем созревшие яйца в почве могут сохранять свою жизнеспособность в течение нескольких месяцев и даже лет.

Токсокара половозрелая особь
Цикл развития токсокароза у человека напоминает аскаридоз. После заглатывания яйца попадают в тонкий кишечник, где из них выходят личинки, которые через кровеносные сосуды попадают в печень, в которой часть из них оседает и образует вокруг себя своеобразные воспалительные гранулемы. Затем через нижнюю полую вену личинки перемещаются в правые отделы сердца. Оттуда по легочной артерии попадают в легкие, где опять же часть из них задерживается. Из легочной артерии остальные личинки проникают в легочные вены и попадают в левые отделы сердца. Далее по большому кровотоку двигается до сосудов в диаметром около 0,02 мм, где застревают и выходят в тот орган, где застряли. Следовательно, возможна полиорганная патология (легкие, печень, поджелудочная железа, мышцы, глаза, щитовидная железа, почки, головной мозг и другие). В этих органах в течение длительного времени (месяцы, годы) личинки сохраняют свою жизнеспособность. Под влиянием разных факторов, влияющих на иммунитет человека, личинки вновь могут осуществлять свою миграцию, что характеризуется рецидивом токсокароза. Личинки токсокар в организме человека могут выживать до 10 лет. Часть осевших в органах личинок инкапсулируется (образует вокруг себя плотные капсулы), в которых постепенно разрушаются. Из легких по бронхиальному дереву попадают в носоглотку, пищевод, созревают в сальнике.
У человека токсокары паразитируют только на стадии личинок, поэтому человек не является заразным для окружающих.
Причины появления токсокароза человека
Источник инфекции для человека – собаки, особенно молодые щенки, а также возможны и другие представители (например, кошки, что наблюдается реже). Человек источником заражения не является.
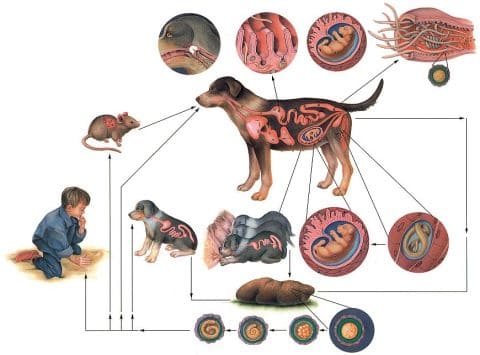
Источник инвазии при токсокарозе
Механизм передачи – фекально-оральный. Заражение происходит при заглатывании яиц токсокар в случае прямого контакта с шерстью больного животного, на которой могут находиться инвазионные яйца, а также контакт с почвой, содержащей яйца, потребление загрязненных продуктов питания. Факторами передачи могут быть грязные руки, немытые овощи, фрукты, ягоды, плохо термически обработанное мясо промежуточного хозяина – свиньи, цыплят, ягнят, например, загрязненная вода. Не исключена возможность передачи инфекции от беременной женщины плоду, а также при грудном вскармливании, однако данный путь практически не доказан.
Группы риска при заражении токсокарозом:
1) дети дошкольной возрастной группы (3-5 лет), играющие с песком, почвой или с собакой;
2) профессиональные группы (ветеринары, собаководы, кинологи, работники коммунальных учреждений, шоферы, работники питомников для собак, продавцы овощных магазинов и отделов, лица, имеющие контакт с почвой и прочие);
3) владельцы дач, приусадебных участков, земельных наделов и огородов;
4) любители охоты с привлечением собак.
Заболевают преимущественно дети, которые, играя во дворе (песочницах), с грязными руками заглатывают яйца. Характерна летне-осенняя сезонность.
Клинические формы и симптомы токсокароза
Выделяют две формы: висцеральную (системную) и глазной токсокароз.
Могут быть поражения: поджелудочной железы (панкреатит), сердца (миокардит), головного мозга
(продолжительные головные боли, эпилептиформные припадки, парезы, параличи).
В общем анализе крови: эозинофилия (до 70-90%), лейкоцитоз (до 15-20 тыс.), незначительное увеличение СОЭ. При длительном течении у больных развивается анемия (снижается гемоглобин), гипергаммаглобулинемия, увеличение Ig E. В биохимическом анализе крови: может быть увеличение билирубина, повышение активности ферментов – АЛТ, АСТ, ГГТП.
Достаточно важная проблема токсокароза – его взаимосвязь с развитием бонхиальной астмы. В ряде научных исследований показано выявление антител к токсокарам у пациентов с бронхиальной астмой, а также улучшение течения астмы после терапии токсокароза.
2. Глазной токсокароз (67% всех случаев заболевания)
Развивается при неинтенсивной инвазии. Чаще поражается один глаз: токсокары проникают в сосудистую оболочку глаза, вызывают воспаление и образование специфических гранулем в сетчатке, хрусталике. Может развиться эндофтальмия, иридоциклит, кератит вплоть до полной потери зрения.
В общем анализе крови: эозинофилии нет. Используются методы обнаружения токсокар в содержимом особого элемента глаза - стекловидного тела. Чаще всего при токсокарозе процесс односторонний.
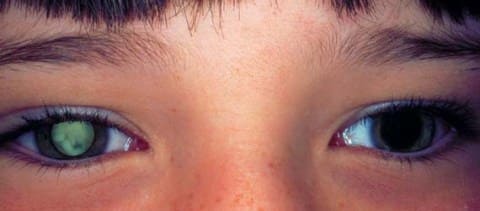
Поражение глаз при токсокарозе
Фиброз и отслойка сетчатки при токсокарозе
Течение токсокароза может быть различным: от субклинических и легких форм до развития рецидивирующего течения болезни (месяцы, года), что обусловлено повторными процессами миграции личинок токсокар.
Диагностика токсокароза
Предварительный диагноз токсокароза выставляется на основании клинических симптомов забоелвания (аллергическая реакция, бронхолегочной синдром, гепатоспленомегалия и другие), общего анализа крови (выраженное увеличение эозинофилов в периферической крови, увеличение лейкоцитов, СОЭ, снижение гемоглобина), изменения биохимии (повышение билирубина, АЛТ, АСТ, ГГТП), увеличение гамма-глобулинов.
Дифференциальный диагноз токсокароза проводят с другими гельминтозами – описторхоз, аскаридоз, лимфогранулематозом, васкулитами, эозинофильной гранулемой и другими.
Окончательный анализ выставляется после специфического лабораторного обследования. Используется серологическая диагностика – реакция ИФА с целью выявления специфических антител – ИФА с токсокарозными антигенами.
Диагностическим титром является 1:400. Титры ниже 1:400 (1:100, 1:200), особенно в отсутствие симптомов заболевания рассматриваются как признак инвазивности, но не наличия болезни в настоящем (напомним о способности токсокар инкапсулироваться и возможности погибнуть внутри капсул, что также будет сопровождаться циркуляцией антител в крови в течение определенного времени). В этом случае назначенное лечение не принесет желаемого эффекта, титры останутся на прежнем уровне. Титр 1:200 также может указывать на ремиссию (выздоровление) висцерального токсокароза в течение нескольких месяцев после лечения.
Титры 1:200-1:400 могут говорить о наличии токсокароносительства (носительства инкапсулированных личинок).
Титр 1:400 указывает на вероятный токсокароз глаз или ремиссию висцерального токсокароза после лечения в течение первых недель. Назначение терапии должно быть взвешено и доказано клиническими симптомами заболевания.
Титр 1:800 и более указывает на заболеваемость висцеральным токсокарозом, что является абсолютным показанием для назначения лечения.
Нельзя забывать о возможности рецидивов болезни, поэтому у конкретного пациента титры антител могут варьировать и колебаться. Ложноположительные реакции на антитела к токсокарам могут выявляться: у пациентов с лимфопролиферативными заболеваниями системного характера, грубыми нарушениями в системе иммунитета. Окончательная верификация диагноза также требует обнаружения личинок в биоптатах тканей (чаще всего это удается при поражении печени).
Лечение токсокароза
Специфическое (противопаразитарное) лечение назначает только доктор при наличии строгих показаний (симптомы болезни, изменения общего анализа крови, высокий титр реакции ИФА). Препараты эффективны только при наличии мигрирующих личинок, отмечается слабая эффективность при наличии гранулем в тканях и отсутствии миграции.
В качестве противопаразитарной терапии применяются препараты албендазола (зентел, немозол), мебендазола (вермокс, вормин), тиабендазол (минтезол), медамин. Курсы лечения от 10 до 30 дней в зависимости от формы болезни и выбранного препарата. Лечение проводят 3-5 курсами с интервалом 3-4 месяца (можно 2 месяца при стойком снижении титра АТ). Критерии эффективности: снижение уровня эозинофилов, титра антител, стихание симптомов.
С целью интенсификации лечения назначается симптоматическая терапия: гепатопротекторы (эссливер, карсил, гепатрин и другие), антигистаминные средства (кларитин, зодак, зиртек, цетрин, эриус и другие), нестероидные противовоспалительные средства (диклофенак, индометацин, ибупрофен и другие), отхаркивающие, энтеросептики, иммуномодуляторы и другие.
Прогноз токсокароза в целом благоприятный. Летальные исходы редки в случае интенсивной инвазии, отсутствии лечебных мероприятий.
В случае с глазным токсокарозом прогноз зависит от выраженности изменений. Если сроки инфицироания небольшие и идет активная инфекция (то есть идет активная миграция), есть шанс лекарственного воздействия на личинки и регрес воспалительного процесса в органах зрения. Если же имеет место центральное расположение очагов, а также при формировании фиброза прогноз в плане зрительных функций неблагоприятный, изменения необратимы.
Профилактика токсокароза
Профилактические меры связаны с санитарно-гигиеническим воспитанием детей, обучением гигиеническим навыкам подрастающее поколение. Одно из направлений профилактики – своевременное обследование собак и их дегельминтизация. Защита детских площадок, песочниц от посещений животных, их хорошая инсоляция (освещенность лучами солнца).
Врач инфекционист Быкова Н.И.
Нона,напишите пожалуйста,подр обнее,какое личение,
,дочьке 5 лет ,лечимся 3 года,результата нет.
Читайте также:


