Врожденная цитомегаловирусная инфекция европейский консенсус
В статье проанализированы опубликованные данные по вопросам адекватной диагностики антенатальной и постнатальной цитомегаловирусной инфекции (ЦМВИ), а также лечению острых ЦМВИ у беременной, плода и новорожденного. Представлены отечественные клинические р
The article gives analysis of the data on the issues of relevance of diagnostics of antenatal and postnatal cytomegaloviral infection (CMVI), as well as treatment of acute CMVI in the pregnant, fetus and newborns. National clinical guidelines on diagnostics and treatment of congenital CMVI developed by the Russian Association of antenatal medicine in 2016, were presented; as well as the first unofficial international guidelines on the issues of diagnostics and treatment of congenital CMVI.
Цитомегаловирус (ЦМВ) — чрезвычайно распространенный вирус, поражающий людей всех возрастов и формирующий пожизненную персистенцию в организме инфицированного человека. Считается, что в большинстве случаев персистенция начинается в ранние годы жизни и протекает латентно, не оказывая выраженного патологического влияния на состояние здоровья инфицированного. С другой стороны, доказано, что персистенция вируса может сопровождаться хроническим воспалением, формировать разнообразные многочисленные иммунные дисфункции и определять развитие вторичных иммунных, аутоиммунных и дегенеративных нарушений. Различного рода иммунокомпрометации могут приводить к рецидивам размножения вируса и многообразным клиническим проявлениям с поражением любых органов и систем в любом возрасте.
Особое значение имеют врожденные инфекции детей, которые отличаются высоким риском развития тяжелых генерализованных форм и инвалидизирующих исходов заболевания, таких как потеря слуха, зрения, умственная отсталость, микроцефалия, судорожный синдром и пр. Такие пожизненные проблемы со здоровьем развиваются примерно у каждого пятого ребенка с врожденной цитомегаловирусной инфекцией (ЦМВИ), что определяет потребность в своевременном пренатальном выявлении беременных и плодов с высоким риском развития врожденной ЦМВИ и ранней диагностике и лечении инфекций у новорожденных.
Теоретические дискуссии по вопросам адекватной диагностики антенатальной и постнатальной ЦМВИ, а также лечению острых ЦМВИ у беременной, плода и новорожденного продолжаются с 1990-х гг., но отсутствие единых руководящих принципов затрудняет практическую работу врачей. Российской ассоциацией специалистов перинатальной медицины в 2016 г. выработаны отечественные клинические рекомендации по диагностике и лечению врожденной ЦМВИ. Созданная в рамках 5-й Международной конференции по ЦМВИ (Брисбен, Австралия, 19 апреля 2015) международная группа экспертов на основе консенсусных дискуссий и обзора литературы выработала первые неофициальные международные рекомендации по вопросам диагностики и лечения врожденной ЦМВИ, которые опубликованы в Lancet Infect Dis в марте 2017. Все эти рекомендации будут нуждаться в постоянном обновлении по мере поступления дополнительных данных.
ЦМВ — двухцепочечный ДНК-вирус, член семейства герпес-вирусов (β-герпесвирус человека). Синтез вирусного генома ДНК происходит в ядре клетки-хозяина. Исследования последних лет подтверждают гипотезу о том, что штаммы ЦМВ могут варьировать в их вирулентности, тропизме и патогенном потенциале, который, в свою очередь, вероятно, связан с генетической изменчивостью ключевых для патогенеза генов. Внешняя оболочка вируса содержит множественные гликопротеины, кодируемые вирусом. Гликопротеин B и гликопротеин H, по-видимому, являются основными факторами для формирования гуморального иммунитета — антитела к ним способны нейтрализовать вирус. Эти гликопротеины используют сегодня при разработке анти-ЦМВ-вакцин [3].
Вирус распространяется различными способами: через продукты крови (переливание, трансплантация органов), грудное вскармливание, пролиферацию в местах контактов (кожа, любые слизистые оболочки), перинатально и половым путем. ЦМВИ может протекать в виде первичной инфекции ранее неинфицированных (серонегативных) пациентов, реинфекции или реактивации у инфицированных (серопозитивных) людей; может вызывать острое, латентное и хроническое течение врожденных или приобретенных форм болезни [4].
При острой ЦМВ-инфекции могут поражаться практически все типы клеток человеческого организма — эндотелиальные клетки, эпителиальные клетки, клетки гладкой мускулатуры, фибробласты, нейронные клетки, гепатоциты, трофобласты, моноциты/макрофаги, дендритные клетки и пр. Все типы клеток поражаются и в мозге: нейроны, астроциты, клетки эпендимы, выстилающие желудочки, макроглия, эндотелий капилляров, оболочек, микроглия, сплетения сосудистой оболочки, дендриты и аксоны — т. е. вирус в мозге не имеет избирательной клеточной цели, что объясняет многообразие клинических форм поражения нервной системы у больных [5].
Считается, что ЦМВ реплицируется в эндотелиальных клетках с низкой скоростью, вызывая преимущественно подострые инфекции, однако истинная скорость репликации вируса в клетках определяется эффективностью цитотоксического Т-клеточного иммунитета и степенью иммуносупрессии хозяина. Так, например, на моделях ЦМВИ у животных продемонстрировано, что отсутствие CD4 Т-клеток сопровождалось более тяжелым и стремительным заболеванием ЦМВИ. Известно также, что ВИЧ-инфицированные новорожденные имеют очень высокую частоту врожденной ЦМВИ с высоким риском смерти, неврологических дефектов и прогрессии ВИЧ-инфекции [6–7].
Особое свойство ЦМВИ — способность вызывать депрессию практически всех звеньев иммунитета, резко угнетать продукцию интерферонов (ИНФ), в первую очередь ИНФ-α. Внедрение ЦМВ приводит к иммунной перестройке в виде снижения реакции лимфоцитов на вирусы в связи с угнетением экспрессии антигена макрофагами, подавлением пролиферативной активности лимфоцитов (что коррелирует с тяжестью болезни), угнетением фагоцитарной активности и завершенности фагоцитоза [7].
Доказано, что и первичные и латентные ЦМВИ сами могут индуцировать хронические воспалительные системные реакции с устойчивой иммунной активацией, запускать и поддерживать аутоиммунные процессы, усиливать аллореактивность Т-клеток после трансплантации и, возможно, участвовать в комплексе причин повышения частоты нейродегенеративных состояний с возрастом человека (Jones R. P. The debility cascade in neurological degenerative disease). Установлено также, что ЦМВ-индуцированные иммунные изменения в пожилом возрасте могут отвечать, например, за замедленную элиминацию вируса гриппа из легких, сниженный поствакцинальный иммунитет на гриппозные вакцины, измененную реакцию организма на терапию интерферонами [8].
Многие годы риск развития врожденных инфекций плода ассоциировали преимущественно с первичной инфекцией матери, однако к настоящему моменту не вызывает сомнения, что большая доля врожденных ЦМВИ (до 75%) встречается в условиях рецидивирующей во время беременности материнской инфекции. Допускаются также и экзогенные реинфекции с новыми штаммами ЦМВ — доказательства основываются на молекулярных данных, подтверждающих получение нового штамма вируса.
Вместе с тем степень риска вертикального инфицирования плода в условиях первичной инфекции матери рассматривают по-прежнему как чрезвычайно высокую — в 30–50% случаев острой первичной инфекции беременной развивается врожденная инфекция ребенка. Показано, что ранее существовавший материнский иммунитет хоть и не гарантирует полной защиты, тем не менее обеспечивает снижение риска врожденной ЦМВИ при следующих беременностях на 69% [9].
Недавними исследованиями установлено, что ЦМВ может поражать амниотическую мембрану, ухудшая цитотрофобласт-индуцированный лимфангиогенез и ремоделирование сосудов в плаценте и задерживая правильное развитие клеток — предшественников трофобласта, одновременно вызывает врожденную провоспалительную иммунную реакцию. Это приводит к гипоксии плода, задержке внутриутробного развития и возможным последующим гипоксическим повреждениям головного мозга. Степень поражения плода определяется сроками антенатального инфицирования и вирусной нагрузкой в размножающихся клетках — чем меньше гестационный возраст, тем более выражена альтерация (разрушение) тканей с формированием пороков развития [10]. Особенно быстро ЦМВ достигает максимума в астроцитарных и глиальных клетках, при этом максимальная экспрессия вируса найдена в глиальных клетках развивающегося мозга мышат (что объясняет микрогирию, микроцефалию и другие пороки ЦМВ-инфицированного мозга детей). По мере увеличения срока гестации в клинической картине инфекционного заболевания плода преобладают симптомы системного воспаления с выраженной пролиферацией и экссудацией. У 1/3 умерших от ЦМВИ новорожденных (из них 60% — недоношенные) при морфологическом исследовании выявляют различные пороки развития. У 43% — признаки генерализованной внутриутробной инфекции с геморрагическими и ишемическими инфарктами (в том числе в головном и спинном мозге) [11].
Способность вируса реплицироваться в любых клетках человеческого организма определяет многообразие клинических форм болезни; ЦМВ может вызывать как генерализованные инфекции, так и поражения отдельных органов: печени, головного мозга, сердца, легких, мочеполовых органов, желудочно-кишечного тракта и др.
У беременных острая первичная ЦМВИ протекает чаще бессимптомно (25–50%) или малосимптомно — с неспецифическими проявлениями (обычно лихорадка, астения и головная боль).
Как первичная, так и рецидивирующая ЦМВИ матери может стать причиной антенатальных ультразвуковых признаков поражения плода в результате трансплацентарной инфекции. Самые частые УЗИ-признаки: задержка роста плода, вентрикуломегалия, микроцефалия, перивентрикулярная гиперэхогенность, кальцификаты в мозге, плевральный выпот или асцит, гепатоспленомегалия, гиперэхогенный кишечник и мекониальный илеус и др. Эти УЗИ-аномалии эмбриона прогнозируют тяжелую генерализованную манифестную врожденную ЦМВИ новорожденного с высоким риском формирования инвалидизирующих исходов болезни и смерти. Поэтому первичная острая ЦМВИ во время беременности может являться показанием к ее искусственному прерыванию. Установлено, что около 4% детей с антенатальной ЦМВИ умрут в утробе матери или вскоре после рождения, среди остальных около 60% будут иметь когнитивные дефекты, нейросенсорную потерю слуха и другие неврологические и прочие проблемы [11–12].
Сегодня установлено также, что нейросенсорная тугоухость является прогрессирующим заболеванием и может формироваться в течение 5–6 лет жизни даже у детей, родившихся с бессимптомной ЦМВИ (это связывают с многолетней репликацией ЦМВ в перилимфе), что требует соответствующей длительности наблюдения ребенка.
При инфицировании в поздние сроки гестации ЦМВИ у новорожденного может проявляться и как генерализованная инфекция, и как поражение отдельных органов с нетяжелыми транзиторными симптомами болезни, например, умеренной гепатомегалией, изолированным снижением количества тромбоцитов или повышенным уровнем аланинаминотрансферазы. Возможна и клинически бессимптомная ЦМВИ с изолированной нейросенсорной тугоухостью.
У 10% всех новорожденных в течение первого месяца жизни возникают инфекционные заболевания в результате в основном семейных контактов, в том числе грудного вскармливания. Экскреция ЦМВ с грудным молоком в течение первых недель после родов бывает низкой, достигает максимума к 4–8 неделям, завершается к 9–12 неделям. Считается, что риск трансмиссии вируса коррелирует с вирусной нагрузкой в молоке, передача максимальна при высокой экскреции. У доношенных детей в результате инфицирования ЦМВ через молоко матери формируется, как правило, субклиническое течение инфекции без остаточных явлений; в клинической картине более вероятно развитие энтероколита и транзиторного холестатического гепатита с минимальным цитолизом. Недоношенные дети (вес
И. Я. Извекова 1 , доктор медицинских наук, профессор
М. А. Михайленко
Е. И. Краснова, доктор медицинских наук, профессор
ФГБОУ ВО НГМУ МЗ РФ, Новосибирск
Цитомегаловирусная инфекция в практике врача: современный алгоритм диагностики и лечения/ И. Я. Извекова, М. А. Михайленко, Е. И. Краснова
Для цитирования: Лечащий врач № 4/2018; Номера страниц в выпуске: 90-95
Теги: новорожденные, беременность, инфекция, персистирование
[youtube.player]- КЛЮЧЕВЫЕ СЛОВА: инфекция, легкие, печень, почки, мертворожденные дети, цитомегалия, иммуноглобулин, Виферон
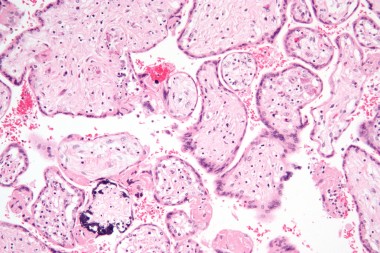
Клетки, пораженные цитомегаловирусом (ЦМВ) и впервые описанные в 1882 г. немецким патологоанатомом Н. Ribbert, были выявлены в эпителии околоушных слюнных желез и мочевых канальцев, имели гигантские размеры и своеобразные внутриядерные включения. Впоследствии такие клетки были обнаружены в легких, печени, почках и других органах мертворожденных детей с цитомегаловирусной инфекцией (ЦМВИ).
В 1921 г. E. Goodpasture и F. Talbot предложили назвать болезнь детской цитомегалией, подчеркнув специфичность гигантоклеточного метаморфоза пораженных клеток. Вирус был выделен в 1956 г. М. Smith.
Цитомегаловирусная инфекция – общее инфекционное заболевание, вызываемое герпесвирусом человека 5-го типа (семейство Herpesviridae, подсемейство Beta-herpesviridae) и характеризующееся многообразием форм – от бессимптомных до генерализованных. Морфологически проявляется образованием в слюнных железах, висцеральных органах и центральной нервной системе цитомегалов – гигантских клеток с типичными внутриядерными и цитоплазматическими включениями. Возбудитель (Cytomegalovirus hominis) относится к медленно размножающимся цитолитическим вирусам, вызывающим цитомегалию клеток и латентную инфекцию в слюнных железах и почках. Вирион содержит дезоксирибонуклеиновую кислоту (ДНК), имеет размер 150–300 нм. Вирус состоит из капсида, вирусной оболочки и слабо характеризованной области под названием tegument.
Вирусный геном представлен двойной молекулой ДНК и несет генетическую информацию о синтезе 100 вирусных протеинов. Капсид, окружающий вирусный геном, состоит из 162 капсомеров – нефосфорилированных протеинов. Область между вирусным геномом и оболочкой (tegument) представлена 20 белками, многие из которых фосфорилированы. Главный фосфорилированный белок pp UL83 (pp65) составляет 95% tegument и вместе с главным структурным белком pp UL32 (pp150) имеет значение в диагностике ЦМВИ.
Вирус цитомегалии обладает строгой видовой специфичностью, термолабилен, инактивируется при температуре 56 °С, но сохраняется при комнатной температуре, быстро теряет инфекционность при замораживании. Оптимальные условия его жизнедеятельности в биологических объектах – рН 7,2–8,0, температура 4 °С. Вирус характеризуется слабым интерфероногенным действием, нечувствителен к антибиотикам.
На сегодняшний день известно шесть штаммов ЦМВИ (Davis, AD 169, Kerr, C-87, Esp, Towne). Не исключена возможность возникновения суперинфекции. Как и все остальные герпесвирусы, ЦМВ после внедрения в организм способен переходить в латентное состояние, которое периодически сменяется реактивацией с возможностью выделения вируса из организма с любыми биологическими жидкостями. Пребывание в детских учреждениях, школах способствует распространению ЦМВИ среди детей разного возраста. При этом инкубационный период при заражении ЦМВ составляет от 15 дней до трех месяцев.
По эпидемиологическим данным, ЦМВИ заболевают на всех континентах, во всех социально-экономических группах. В США процент инфицированных варьируется в пределах 50–80% взрослого населения. Доля сероположительных лиц зависит от возраста: в возрасте от шести лет инфицировано 58,9% индивидов, старше 80 лет – 90,8% 1 .
Основными группами риска по ЦМВИ являются беременные, новорожденные, особенно недоношенные, дети с иммунодефицитными состояниями, ВИЧ-инфицированные, внутривенные наркопотребители, реципиенты гемотрансфузий и трансплантатов, лица пожилого возраста, пациенты, принимающие лекарственные препараты (антибиотики, химиопрепараты, гормоны, рентгенотерапию и др.). Кроме того, к группе риска относится медицинский персонал родильных домов, отделений интенсивной терапии, перинатальных центров.
ЦМВ обнаруживается в различных биологических жидкостях инфицированного человека: грудном молоке, слезной жидкости, носоглоточной слизи, крови, слюне, моче, ликворе, сперме, цервикальном и вагинальном секрете, фекалиях.
Известно несколько путей заражения ЦМВИ: трансплацентарный, интранатальный, контактный, воздушно-капельный, фекально-оральный, контаминационный и половой.
Цитомегалия относится к персистирующим инфекциям, что дает основание рассматривать ее как одну из форм взаимодействия микро- и макроорганизма на клеточном уровне, позволяющих вирусу длительное время находиться в организме человека. Персистенцию рассматривают как разновидность облигатного внутриклеточного паразитизма вирусов в лейкоцитах, системе мононуклеарных фагоцитов, эндотелии сосудов, лимфоидных и других органах.
Основными путями внутриутробного инфицирования ЦМВИ являются гематогенный (трансплацентарный), восходящий и нисходящий. При внутриутробном инфицировании плода, как правило, имеет место трансплацентарный путь передачи ЦМВИ. Находящийся в материнской крови вирус проникает через плаценту к плоду по пупочной вене. Инфицирование возможно и при повреждении плаценты. Плод может инфицироваться от матери с латентной или острой формой ЦМВИ. Для трансплацентарной передачи ЦМВИ решающую роль играют длительная и выраженная вирусемия и синдром плацентарной недостаточности. Вероятность инфицирования плода при латентном течении процесса практически отсутствует, при реактивации и хроническом персистирующем течении она составляет 0,5–0,7%, при первичном инфицировании – 40–50%.
При восходящем (трансцервикальном) пути заражение происходит при наличии вируса в цервикальном и вагинальном секретах, а также через инфицированные околоплодные воды, которые заглатывает плод. Нисходящий (трансовариальный) путь внутриутробного заражения ЦМВИ характеризуется проникновением вируса из брюшной полости по маточным трубам. Нисходящий путь развития внутриутробной инфекции возможен только у женщин с очагами хронического воспаления в яичниках и маточных трубах.
ЦМВИ отличается от большинства внутриутробных инфекций тем, что плод чувствителен к ней на всех этапах развития. В зависимости от срока гестации, на котором произошло инфицирование ЦМВ, различают инфекционные бластопатии, эмбрио- и фетопатии.
Интранатально заражается до 5–7% новорожденных как путем непосредственного контакта с инфицированными тканями родового канала, так и при аспирации околоплодных вод, содержащих ЦМВ.
В постнатальном периоде новорожденный заражается в 30% случаев от выделений матери, содержащих вирус: слюны, мочи, выделений из гениталий, грудного молока, крови. Риск инфицирования новорожденного возникает во время родов или сразу после рождения от медицинского персонала в случае вирусоносительства, а также при переливании компонентов крови 2 .
Характер поражения плода и новорожденного зависит от сроков инфицирования и отличается многообразием проявлений – от серьезных дефектов развития, генерализованных форм до бессимптомного течения.
Врожденная ЦМВИ манифестирует в течение первых двух-трех недель жизни ребенка. При появлении симптомов болезни после третьей недели жизни можно говорить о постнатальном инфицировании.
ЦМВИ относится к группе TORCH-инфекций и чревата серьезными последствиями у новорожденных. Клиническая картина острой формы врожденной ЦМВИ характеризуется наиболее тяжелым течением с признаками гипотрофии второй-третьей степени, длительной желтухой, пневмонией, сиалоаденитом, панкреатитом, поражением почек, микроцефалией, хориоретинитом, петехиями. Нередко наблюдаются тромбоцитопения, прогрессирующая анемия.
У детей, перенесших острую форму заболевания, отмечается волнообразное течение хронической формы ЦМВИ. Часто формируются кальцификаты в головном мозге, имеют место микро- или гидроцефалия, нейросенсорная глухота, церебральный паралич, задержка психомоторного и речевого развития, поражение глаз (атрофия зрительного нерва, катаракта), хронический гепатит, панкреатит, пневмофиброз.
Лабораторная диагностика ЦМВИ основана на выявлении в исследуемых пробах клеток, пораженных цитомегаловирусом, самого вируса и его ДНК, антигенов, а также специфических антител к вирусу.
В настоящее время основными методами лабораторной диагностики ЦМВИ являются цитологический, вирусологический, молекулярно-генетический (полимеразная цепная реакция – ПЦР), иммуноферментный анализ, реакция иммунофлуоресценции.
Характерный патоморфологический признак ЦМВИ – цитомегалические клетки, выявляемые в тканях, слюне, мокроте, осадке мочи и цереброспинальной жидкости. При исследовании в световом микроскопе клетки в слюнных железах имеют вид совиного глаза. В ядре цитомегалических клеток формируется плотное внутриядерное включение, отделенное от оболочки ядра светлой оптически пустой зоной. Эти клетки настолько специфичны, что при их обнаружении не требуется вирусологического подтверждения диагноза ЦМВИ.
Диагностическими критериями острой врожденной ЦМВИ служат клинические проявления, развившиеся в первые три месяца жизни ребенка, обнаружение антигена вируса в моче, крови, наличие иммуноглобулинов М и G в крови, низкоавидных антител (индекс авидности до 30%) и определение ДНК или антигена вируса в лейкоцитах крови.
Цели лечения при ЦМВИ – устранение симптомов острой формы заболевания и удержание вируса в пассивном, неактивном состоянии. В остром периоде ЦМВИ применяют этиотропную и посиндромную терапию. Этиотропная терапия предполагает применение противовирусных препаратов (виростатиков), специфического гипериммунного антицитомегаловирусного иммуноглобулина (Цитотект/Неоцитотект) и интерферонов.
К этиотропной терапии прибегают только в фазе репликации вируса, при наличии клинических симптомов и выявлении специфических низкоавидных иммуноглобулинов G и/или иммуноглобулинов М.
При тяжелой генерализованной форме ЦМВИ используют виростатические препараты – ганцикловир, фоскарнет. Применение ганцикловира имеет возрастные ограничения: детям препарат назначают, если польза от лечения превышает существенный риск.
Особое место в лечении детей с ЦМВИ занимают интерфероны. Противовирусный эффект – одно из основных свойств интерферонов. В невысоких терапевтических дозах они являются модуляторами иммунитета, что позволяет отнести их к семейству регуляторных цитокинов.
Введение экзогенного интерферона обеспечивает элиминацию инфекционного агента задолго до того, как собственные клетки начинают синтезировать интерферон в необходимом количестве. Поступление интерферона помогает разгрузить пораженные клетки и компенсировать недостаток в продукции собственного интерферона в достаточном количестве. При лечении внутриутробной ЦМВИ экзогенный интерферон жизненно необходим в связи с возрастными различиями свойств интерферона у новорожденных, который не обладает противовирусным эффектом и направлен в первую очередь на пролиферацию, а не на борьбу с вирусами. Это показано в фундаментальных работах по изучению системы интерферона в России и за рубежом 3 . Ускоренная элиминация инфекционного агента при введении экзогенного интерферона сокращает сроки инфекционного процесса.
Научными сотрудниками Ярославской государственной медицинской академии в 2016 г. был запатентован способ лечения генерализованной ЦМВИ у детей раннего возраста. Предложена комбинированная схема противовирусного лечения. При вирусной нагрузке 10 5 коп/мл и более применяется ганцикловир (Цимевен) в дозе 5–7,5 мл/кг в течение 14–21 дня. Препарат отменяют при достижении положительной динамики и снижении вирусной нагрузки в крови до 10 4 –10 3 коп/мл. Далее лечение продолжают препаратом ВИФЕРОН® (150 000 МЕ) по схеме: один суппозиторий два раза в сутки в течение десяти дней, затем – по одному суппозиторию три раза в неделю (понедельник, среда, пятница).
Данную схему применяли в клиническом исследовании: 48 детей с ЦМВИ получали ганцикловир (Цимевен) под контролем количества вируса в сыворотке крови на 14-й и 21-й дни от начала лечения. Далее в течение 3–6 месяцев ежемесячно контролировали вирусную нагрузку методом ПЦР. Группа из 22 детей перешла на Виферон®. При достижении полной элиминации вируса из крови (отрицательной ПЦР) лечение препаратом Виферон® завершали. Результаты наблюдения показали, что рецидив ЦМВИ не зафиксирован ни у одного ребенка, получавшего комбинированную терапию. В группе из 26 детей, не принимавших Виферон®, вирусная нагрузка оставалась на прежнем уровне (11 пациентов) или увеличивалась на 10 1–2 коп/мл (15 пациентов), что свидетельствовало о репликации вируса и продолжении инфекционного процесса. Исследователи сделали вывод, что внедрение новой схемы терапии ЦМВИ у детей может приводить к успешной эрадикации инфекции.
Таким образом, ЦМВИ остается актуальной проблемой в педиатрической практике. Эффективный подход к противовирусной терапии ЦМВИ должен включать комбинацию препаратов различных групп разнонаправленного действия.
[youtube.player]
Когда родители слышат от врачей после рождения, что у малыша обнаружена врожденная инфекция – это всегда тревожно. Особенно если название этой инфекции для них неизвестно, они ранее не слышали о подобном. Цитомегаловирусная инфекция среди взрослых встречается не очень часто, обычно имея вид бессимптомного носительства. Но в отношении детей, особенно новорожденных, наличие подобного вируса (а это именно вирусная инфекция), опасно тяжелыми поражениями внутренних органов.
Что это такое – цитомегалия?
Врожденная цитомегалия (а если правильнее – цитомегаловирусная инфекция) это одна из опасных инфекций, развивающихся еще внутриутробно или в период родов, если малыш инфицируется этим вирусом от матери.
Основной характеристикой этой патологии является формирование множественных грубых пороков развития (если кроха заразился в утробе) или поражениями внутренних органов и системными проявлениями инфекции (при заражении перед родами и в их течении).

Нередко нет никаких симптомов болезни у матери, а затем и у крохи, помимо носительства вируса в крови, но могут выявляться и грубые поражения со стороны нервной системы – пороки мозга в виде гидроцефалии или микроцефалии, формирование энцефалопатии. Также поражаются внутренние органы с формированием желтухи, тяжелых пневмоний или нефритов, патологий со стороны органов чувств – слепоты или глухоты. Поставить диагноз подобной врожденной патологии можно по данным анализов, обнаружив антитела к вирусу в крови или моче, мазках с носоглотки и ликворе. Лечить подобную инфекцию трудно, спектр препаратов очень мал.
Как часто развивается врожденная цитомегалия
Считается, что среди всех врожденных инфекций именно цитомегалия относится к одной из лидирующих врожденных патологий. По данным разных авторов, она встречается с частотой от 0.2 до 3%, а если мать до беременности не была знакома с вирусом, и перенесла инфицирование, уже будучи в положении, риски для ребенка возрастают в десятки раз, достигая 30-50%. Это связано с отсутствием защитных антител. При вторичном инфицировании, то есть реактивации имевшейся у матери вирусной инфекции во время беременности, шансы на повреждения плода составляют около 1%.
Сегодня данная инфекция очень актуальная для неонатологии, так как заболеваемость цитомегалией и врожденными инфекциями возрастает, приходя на смену микробным инфекциям, с которыми уже частично научились бороться.
Нередко тяжелые последствия связаны с поздней диагностикой и отсутствием видимых клинических симптомов после того, как ребенок родился. Поэтому сегодня важно как можно раньше начинать профилактику подобных болезней, нужно прицельное и подробное обследование будущих мам на предмет обнаружения у них возбудителей скрытых инфекций, чтобы затем вести этих женщин по особым стандартам. Если своевременно начать лечение, можно снизить количество неблагоприятных исходов и инвалидности среди младенцев. Сегодня также врачи направляют усилия на то, чтобы разработать вакцины против этого вируса, чтобы защитить будущих матерей и их детей.
Причина врожденной цитомегалии

Основная причина, приводящая к развитию врожденной цитомегалии – это заражение особым видом вируса, содержащим в себе ДНК-цепочку. Он относится к группе герпесных, и соответственно обладает свойством, как и его собратья, пожизненно храниться в организме после первичного инфицирования. Возбудитель хорошо сохранятся в условиях комнатной температуры, но не выносит воздействия дезинфицирующих веществ. Внутри пораженных клеток он может выживать на протяжении длительного периода, уходя из-под надзора иммунной системы.
Если женщина ранее не контактировала с вирусом, риск ее инфицирования повышается, если будучи беременной, она контактирует с больными данной инфекцией, по долгу службы посещает места скопления людей или медицинские учреждения, где могут находиться инфицированные. Немалую роль играет сила иммунного ответа у самой женщины, особенно в условиях носительства вируса и его реактивации в последующем.
При активации инфекции при беременности шансы на поражение ребенка невысоки, иммунная система уже знакома с инфекцией и сдерживает ее развитие. Если же женщина ослаблена, имеются проблемы с иммунитетом и патологии, возможен перенос вируса к плоду.
Как происходит заражение?
Малыш может заразиться двумя способами – еще внутриутробно (трансплацентарно) и в период родов (интранатально), проходя через родовые пути мамы, у которой имеется вирус. Именно второй вариант у младенцев отмечается чаще, из-за чего в первые дни после рождения, пока вирус разносится по органам и тканям, нет никаких проявлений. Прежде всего, инфекция обладает тропностью к ткани слюнных желез, в их клетки вирус проникает в первую очередь и фиксируется там. Особенно часто поражаются околоушные железы, а также подчелюстные. В области выводных протоков вирус активно размножается, не выходя за пределы тканей, изменяются клетки, их видно под микроскопом – они приобретают характер цитомегалов. Они значительно разрастаются, внутри них есть скопления вирусных частиц, видимые как патологические включения. По этим клеткам, если они обнаружены, можно точно поставить диагноз. Помимо слюнных желез могут поражаться печень и поджелудочная железа, почки и головной мозг.
По классификации различается две формы врожденной инфекции – локализованная и генерализованная. Но подобное деление относительно условное, так как малейшее подавление иммунитета у плода приводит к переходу из ограниченной формы в распространенные поражения.
По характеру течения инфекция может быть острой, затяжного и хронического течения. При острой и затяжной формах выявляются типичные симптомы, хроническую форму нередко можно обнаружить только по антителам и активности вируса в крови.
Также возможна классификация по преобладающему виду повреждений – со стороны печени и селезенки, легочная или мозговая, кишечная форма, но нередко они могут сочетаться между собой.
Как проявляется цитомегалия у младенцев?
Все зависит от срока заражения или реактивации инфекции. Если это ранний срок беременности, плод может быть инфицирован с тяжелыми пороками развития, что приводит к выкидышу или замиранию беременности. Возможно также заражение на протяжении второго и третьего триместра, что может завершаться внутриутробной гибелью малыша.
Если ребенок рождается инфицированным, у почти 90% младенцев врожденная инфекция протекает без симптомов, и только около 10% детей имеют определенные проявления поражения. Но именно эти дети имеют большой процент остаточных инвалидизирующих повреждений или гибели в первые недели жизни от тяжелых патологий внутренних органов.
Для классической внутриутробной цитомегалии типично три ведущих синдрома:
- Желтуха
- Увеличение печени с селезенкой
- Геморрагические проявления.

У новорожденных проявляется по телу сыпь в виде мелких кровоизлияний, точечных, как укол иголки, а также синяки и кровоподтеки по коже и слизистым. Возможно появление крови в фекалиях. Обычно подобное явление проходит в течение двух недель.
При врожденной цитомегалии типично также поражение головного мозга в виде гидроцефалии (скопление жидкости вокруг мозга), микроцефалии (уменьшен размер головки), энцефалопатии с судорогами, дрожанием конечностей, подбородка. Возможно также формирование острого энцефалита с последующими кальцификатами в ткани мозга. Наряду с этим нередко выявляется врожденная пневмония тяжелого течения, повреждения почек и гепатиты, воспалительный процесс в слюнных железах и поражение сетчатки глаз, слухового нерва с формированием сенсоневральной тугоухости. Реже при цитомегалии могут развиваться пороки сердца с дефектами перегородок между предсердиями либо желудочками, клапанные пороки на легочной артерии, аорте или в зоне митрального клапана.
Одним из характерных симптомов патологии может становиться снижение массы тела ребенка при рождении и около 30% случаев недоношенности. По мере роста формируется гипотрофия (дефицит массы тела), требующая специальной методики коррекции. Серьезные поражения мозга могут приводить в последующем к отставанию в психомоторном развитии и формированию умственной отсталости (олигофрения), возможна в последующем проблема с обучением и усвоением материала, памятью и мышлением. При тяжелом поражении печени может развиваться цирроз в периоде от полугода до года.
Как поставить диагноз?
Если беременная перенесла в период беременности первичное инфицирование цитомегаловирусом, показана подробная пренатальная диагностика. Она позволяет выявить у плода врожденные дефекты, которые могут сопутствовать активности вируса, но не саму инфекцию.
При подозрении на цитомегалию при беременности сразу после родов у младенца берется анализ крови для того, чтобы подтвердить или опровергнуть заражение. Это связано с тем, что симптомы при подобной патологии на начальном этапе отсутствуют.
Поэтому основа диагностики — лабораторные исследования.
Диагноз можно подтвердить при обнаружении в моче или крови самого вируса методом ПЦР или выявить антитела класса IgM и IgG к вирусу методом ИФА.
Сложность ранней диагностики в том, что антитела у новорожденного могут быть как собственными, так и материнскими, если женщина при беременности переносила инфекцию, а плод при этом не был заражен. Чтобы отличить материнские антитела от младенческих исследования проводят последовательно несколько раз, при возрастании титра антител в 4 раза и более при повторных исследованиях можно говорить об инфекции у младенца. Повторяют анализ спустя неделю от первого, и оценивают уровень антител.
Если же по данным ПЦР-анализа вирус выявили, это подтверждает диагноз стопроцентно. Но делается такой анализ длительно, а наличие вируса в крови еще не говорит об активности его и формировании инфекции. Поэтому проводят сразу два этих исследования, которые дополняют данные друг друга. Особенно тщательно нужно обследовать тех детей, чьи матери при беременности переносили острую инфекцию, и у них выявлялись антитела к цитомегалии.
Если ли лечение цитомегаловируса у новорожденных
Специфических препаратов против цитомегалии практически нет, после подтверждения диагноза у младенцев в стационаре применяют только специфический вид иммуноглобулина – анти-цитомегаловирусный. В нем содержатся готовые антитела против инфекции, которые связывают вирусные частицы в крови младенца. Дополняет лечение применение интерфероновых препаратов и его индукторов. При поражении определенных органов назначают специальное лечение, исходя из того, какие симптомы имеют место. Успех в лечении достигается тогда, когда вирус не выявляется в крови.
Парецкая Алена, педиатр, медицинский обозреватель
4,673 просмотров всего, 9 просмотров сегодня
[youtube.player]Читайте также:
- Мази для лечения инфекции в ухе
- Как не занести инфекцию при глубоком бикини
- Системная красная волчанка клюквина
- Должностные обязанности медицинской сестры палатной инфекционного отделения
- Препарат от инфекций эрозии
 Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.
Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.

