Тюрин в п инфекционный эндокардит
ИНФЕКЦИОННЫЕ БОЛЕЗНИ СЕРДЦА
Основные цели и задачи
Координация научных исследований.
Организация научных симпозиумов на федеральных конгрессах.
Участие в подготовке федеральных руководств для врачей.
| Председатель секции | Секретарь секции |
| Демин Александр Аристархович | Дробышева Вера Петровна |
| Члены секции | |||
|---|---|---|---|
| ФИО | Звание | Место работы, должность | Город |
| Н.В. Белобородова | Д.м.н., проф. | Референс-лаборатория по сепсису ДЗ Москвы | Москва |
| В.И. Бурцев | Д.м.н., проф. | ММГУ им. И.М.Сеченова | Москва |
| С.Р. Гиляревский | Д.м.н., проф. | МАПО Росздрава | Москва |
| М. А. Гуревич | Д.м.н., проф. | МОНИКИ Росздрава | Москва |
| А.М. Караськов | Член РАМН | НИИПК МЗ РФ | Новосибирск |
| Е.Н. Николаевский | Д.м.н., проф. | Самарский ВМИ МО РФ | Самара |
| И.И. Резник | Д.м.н., проф. | УГМА Росздрава | Екатеринбург |
| И.И. Скопин | Д.м.н., проф. | НЦССХ им. Н.Н. Бакулева | Москва |
| В.П. Тюрин | Д.м.н., проф. | НМХЦ им. Н.И. Пирогова | Москва |
| Г.Г. Хубулава | Д.м.н., проф. | Российская ВМА МО РФ | Санкт-Петербург |
| Н.А. Шостак | Д.м.н., проф. | РГМУ Росздрава | Москва |
Контакты для сотрудничества
Адрес: Кафедра госпитальной терапии и клинической фармакологии, НГМУ, Красный проспект, 52, Новосибирск, 630091, Россия.
Деятельность в 2011 году
Деятельность на федеральном уровне:
- публикации (федеральные рук-ва) последних лет:
- конференции и выступления:
- подготовка нац. рекомендаций:
- региональные конференции (В.П.Тюрин):
Конференция клинических фармакологов г. Москвы 23 декабря 2011г: Современная антибактериальная терапия инфекционного эндокардита.
Конференция для врачей МСЧ-119 г. Москва: Современная диагностика и лечение инфекционного эндокардита, ноябрь 2011г.
Региональные конференции (И.И.Резник): организация ежемесячных Областных конференций в рамках терапевтического общества Свердловской области.
Деятельность на международном уровне:
Выступление на конгрессе: The role of hemostatic disorders in pathogenesis of kidney disease in infective endocarditis. –A.Demin. Abstr. of 12 th APCN, Seoul, Korea, 2010.
Зарубежные статьи:
Beloborodova N.V., A. Yu. Olenin, A. S. Khodakova. Phenylcarboxylic acids as potential markers for diagnosis of sepsis in cardiac surgery patients // ArchivEuromedica 2011 , №. 1-2, стр. 20-26
Ktsoyan Zh. A, N.V Beloborodova, A.M Sedrakyan, G.A Osipov, Z.A Khachatryan, D.Kelly, G.P Manukyan, K.A Arakelova, A.I Hovhannisyan, A.Y Olenin, A.A Arakelyan, K.Ghazaryan, R. I Aminov. Profiles of microbial fatty acids in the human metabolome are disease-specific. Frontiers in Microbiology Cellular and Infection Microbiology, January 2011, Vol. 1, Article 148.
- сотрудничество с советами и раб. Группами ESC и др. обществ.
- важные публикации в российских журналах:
Тюрин В.П., Белкорей О.С. Инфекционный эндокардит у больных с дисплазией соединительной ткани. Сибирский медицинский журнал, 2011, том 26, № 3, вып. 2, стр. 88-92.
Тюрин В.П., Сидоренко Л.С., Рябов А.Л. и др. Абсцессы селезёнки при инфекционном эндокардите. Вестник Национального медико-хирургического Центра, 2011, № 2, стр. 28-33.
Н.В.Белобородова, И.Т.Байрамов, А.Ю.Оленин, Н.И.Федотчева. Экзометаболиты некоторых анаэробных микроорганизмов микрофлоры человека. Биомедицинская химия, 2011, том 57, вып. 1, с. 95-105.
Черневская Е.А., Дмитриева И.Б., Белобородова Н.В., Диагностическая значимость белка S100B при критических состояниях (обзор). Общая реаниматология 2011. №6 (в печати).
Н.В.Белобородова, И.Т.Байрамов, А.Ю.Оленин, В.В Теплова. Н.И.Федотчева Роль микробных экзометаболитов в гипоксической дисфункции митохондрий при сепсисе. Патогенез. 2011, № 3, с.19.
Виноградова Т.Л. Инфекционный эндокардит: современное течение "Клиницист" 2011, №4, с. 4-8.
Чипигина Н.С. Риск тромбоэмболических осложнений при инфекционном эндокардите Тромбы, кровоточивость и болезни сосудов. 2011, №10, с.13-19.
- выступления с докладами:
Конгресс ВНОК: Перикардиты в терапевтической клинике.
Доклад на секции, посвященной инфекционному эндокардиту, III Всероссийская конференция по некоронарогенной патологии сердца (сентябрь 2011, г. Санкт-Петербург):
- участие в работе редколлегий:
- участие в аттестации специалистов:
член аттестационной комиссии НГМУ по терапии и кардиологии (А.А.Демин)
член Центральных аттестационных комиссий Минздрава по терапии и кардиологии (В.П.Тюрин)
Защита диссертации:
- другие образовательные проекты:
Николаевский Евгений Николаевич
Доктор медицинских наук, Самарский военно-медицинский институт МО РФ (443099, Самара, ул. Пионерская, дом 22)
Электронная почта: nicolaev2@yandex.ru
Ремедиум-Поволжье. - Кардиология (Журнал для практикующих врачей). - 2004. - № 10. - С. 87-91.
Лечебная программа инфекционного эндокардита (ИЭ) включает антибактериальную (АБТ), иммунокорригирующую и глюкокортикоидную терапию, коррекцию сердечно-лёгочной недостаточности, симптоматическое лечение с экстракорпоральной гемокоррекцией (Шевченко Ю.Л., 1995, 1997; Шевченко Ю.Л., Хубулава Г.Г., 1995; Тюрин В.П., 1999).
Комплексная терапия ИЭ должна быть этиотропной, патогенетической и симптоматической. Это подразумевает назначение двух или трёх антибиотиков (АБ) синергидного действия с учётом чувствительности выделенного микроорганизма, применение гипериммунной плазмы и глюкокортикоидов, коррекцию сердечно-лёгочной недостаточности, симптоматическое лечение и экстракорпоральную гемокоррекцию, которая уменьшает резистентность патогенных бактерий к антибиотикам.
В каждом случае лечение индивидуально, с учётом общего состояния больного, изменений в его органах и системах, вида возбудителя, фазы развития и варианта течения болезни, объёма лечебных мероприятий на предыдущих этапах. Основой консервативного лечения ИЭ является антибактериальная терапия. До появления АБ исход ИЭ зависел от развития инфекционного процесса. В настоящее время, купирование инфекции возможно в 50-70% случаев, потому что клапаны сердца кровоснабжаются не полностью и АБ не могут достигнуть бактерий в микробных вегетациях (Дёмин А.А., 1999; Minale et. al., 1997). Контроль за эффективностью АБТ проводится по результатам бактериологических исследований крови. Однако он себя не всегда оправдывает (Muller-Haak., 1998; Labord et al., 1998; Буткевич О.М., Виноградова Т.Л., 1991). Для проведения эффективной антибактериальной терапии ИЭ необходимо:
1.раннее начало АБТ (т.к. при проведении АБТ через 2 недели от начала болезни выживаемость больных составляет 100%, а через 8 недель – 56%);
2.использовать максимальные суточные дозы бактерицидных АБ, их парентеральное введение (Белокриницкая А.М., 1995; Тюрин В.П., 2001);
3.проводить АБТ не менее 4-6 недель при раннем и 2-2,5 месяцев при поздно начатом лечении (Гогин Е.Е., Тюрин В.П., 1998);
4.использовать АБ с учётом чувствительности бактерий (Савицкая К.И. и соавт., 1996; Бэнд Д., 1996; Окороков А.Н., Сапего Л.Г., 1996; Simmons N.A. et al., 1998; Wilson W.R., 1995; Selton-Suty C., 1997);
5.устанавливать in vitro чувствительность патогенных бактерий к антибиотикам, определять их минимальную бактерицидную (МБК) и подавляющую (МПК) концентрацию (Тюрин В.П., 1998);
6.при отрицательных результатах посевов крови начинать эмпирическую АБТ, включающую цефалоспорины 1-3 поколения и аминогликозиды (Белокриницкая О.А., 1995; Окороков А.Н., Сапего Л.Г., 1996);
7.дозы и интервалы введения АБ должны корректироваться в зависимости от состояния выделительной функции почек (Бэнд Д., 1996);
8.при возникновении резистентности бактерий к АБ проводить смену препаратов в течении 3-10 дней (Шутко Г.В., Новиков В.И., 1995).
9.средняя продолжительность лечения при стрептококковом ИЭ должна составлять не менее 4 недель, при стафилококковом и грамотрицательном – 6-8 недель до получения выраженного клинического эффекта.
Для лечения стрептококкового ИЭ вначале используют пенициллин (по 30-40 млн ЕД/сут), гентамицин (по 2-2,5 мг/кг через 6 ч), ванкомицин (40 мг/кг/сут и более). Негемолитические стрептококки в 50% случаев резистентны к пенициллинам и аминогликозидам. Однако применение комбинаций этих АБ позволяет преодолеть вторичную резистентность бактерий. Если выделяется стрептококк с МПК 5 мкг/мл и ниже, применяют ванкомицин (в/в по 1000 мг через 12 ч). В случае выявления пенициллин чувствительных штаммов стрептококка, используют полусинтетические пенициллины (оксациллин по 2-3 г и больше 4-6 раз в день; ампициллин по 0,5 г через 4-6 ч) с гентамицином (в/в, по 60-80 мг 2-3 раза в день). При аллергии, развитии вторичной резистентности к пенициллину используют ванкомицин (в/м, по 500 мг через 6 ч). В случае отсутствия эффекта от подобной АБТ применяют цефалоспорины 1-3 поколения (цефалотин, цефазолин, цефотаксим, цефтриаксон), имипенем (в/м, по 500-750 мг через 12 ч). При отсутствии эффекта от АБТ в течение 4 недель, развитии септических осложнений, прогрессировании сердечной недостаточности (СН) показано хирургическое лечение.
Стафилококки наиболее частые возбудители ИЭ современного течения (Гуревич М.А., Тазина С.Я., 1999; Гуревич М.А.. 1997). Золотистый стафилококк и коагулазонегативные стафилококки в большинстве случаев резистентны к пенициллину (Симоненко В.Б., Колесников С.А., 1999), однако обладают чувствительностью к пенициллиназоустройчивым полусинтетическим пенициллинам (оксациллин и др).
Энтерококковый ИЭ развивается после операций на желудочно-кишечном тракте и органах мочеотделения, длительной катетеризации мочевого пузыря и др. В 45% случаев определяется резистентность энтерококков к цефалоспоринам, полусинтетическим пенициллинам и макролидам (Дёмин А.А., Дробышева В.П., 1988). Большинство штаммов энтерококков (Е. Faecalis, Е. Faecium) сохраняют чувствительность к гентамицину, ванкомицину. Поэтому АБТ начинают с внутривенного введения ампициллина (до 20 г/сут) и гентамицина (240 мг/сут). При аллергии к пенициллину или отсутствии эффекта от применения этих препаратов в течение 3-5 дней проводят внутривенное введение ванкомицина (по 0,5 г 4 раза в день) с гентамицином (по 80 мг 3 раза в день) в течение 4-5 недель. При возникновении резистентности к гентамицину (МПК свыше 2000 мкг/мл) АБТ бесперспективна. В этом случае показано хирургическое лечение.
При проведении антибактериальной терапии ИЭ, вызванного грамотрицательными бактериями, эффективно использование цефалоспоринов 1-3 поколения (цефалотин – 8 г/сут, цефазолин – 8 г/сут, цефотаксим - 8 г/сут, цефтриаксон – 6 г/сут) с гентамицином (5-6 мг/кг/сут) в течение 6-8 недель (Иванов А.С. и соавт., 2001). Грибковый ИЭ чаще вызывают грибы рода Candida и Aspergillus. Для его лечения используют амфотерицин В (от 1 и более мг/кг/сутки) в сочетании с флуцитозином (150 мг/кг/сут) или флуконазолом (200-400 мг/кг/сут). Грибковый ИЭ плохо поддаётся АБТ, в 100% случаев требует проведения хирургического лечения (Хубулава Г.Г., 1995).
До получения результатов бактериологического исследования крови, отрицательных результатах исследования проводят эмпирическую АБТ. Её содержание и продолжительность определяют по варианту клинического течения, выраженности лихорадки и осложнений (Соловьёв В.В. и соавт., 1985) Эффективность лечения устанавливают по изменению в динамике клинико-лабораторных признаков активности инфекционного процесса (Шевченко Ю.Л., 1995).
При остром течении ИЭ с внезапным повышением температуры тела от 39,50С до 41,50С, потрясающими ознобами, иррегулярной лихорадкой, артромиалгиями, профузными потами, увеличением ЧСС до 136, значительным похуданием, гепатоспленомегалией, частым развитием септических и эмболических осложнений, АБТ начинают с применения 2-3 АБ из группы цефалоспоринов 1-3 поколения (цефалотин – 6-8 г/сут, цефазолин – 6-8 г/сут, цефотаксим - 6-8 г/сут, цефтриаксон – 4 г/сут) и АБ резерва (имипенем - 4 г/сут, карбапенем - 3 г/сут, ванкомицин - 2-4 г/сут, ципрофлоксацин – до 4-5 г/сут). Лечение продолжают 6-8 недель до получения выраженного клинического эффекта.
В случае подострого ИЭ с повышением температуры тела от 380С до 38,8-400С, гипертермической лихорадкой, выраженной потливостью, ознобом, артромиалгиями, спленомегалией, частым развитием иммуннокомплексных поражений органов, АБТ начинают с применения 2 АБ синергидного действия: ампициллина (12-16 г/сут) с гентамицином (1 мг/кг веса) или ванкомицина (2-4 г/сут) с гентамицином (1 мг/кг веса) в течение 4-6 недель. В случае отсутствия клинического эффекта в течение 3-5 дней назначают 2-3 АБ из группы цефалоспоринов 1-3 поколения (цефалотин – 6-8 г/сут, цефазолин – 6-8 г/сут, цефотаксим - 6-8 г/сут, цефтриаксон – 4 г/сут) и АБ резерва (имипенем - 4 г/сут, карбапенем - 3 г/сут, ванкомицин – 2-4 г/сут). Лечение продолжают 6-8 недель.
Лечение больных затяжным ИЭ в клинической картине которых присутствуют повышение температуры тела до 37,6-37,80С, субфебрильная лихорадка, озноб, увеличение ЧСС до 110-115 начинают с применения двух АБ: ампициллина (12-14 г/сут) с гентамицином (1 мг/кг веса) или пенициллина (18-20 г/сут) с гентамицином (1 мг/кг веса) в течение 4 недель. При отсутствии клинического эффекта в течение 3-5 дней применяют цефалоспорины (цефтриаксон - 2-4 г/сут, цефотаксим - 4-6 г/сут) в течение 4-6 недель.
Рациональнее проводить эмпирическую АБТ цефалоспоринами 1-3 поколения и антибиотиками резерва. Этот подход позволяет преодолеть вторичную резистентность бактерий к АБ и достичь в 85% случаев клинико-бактериологической ремиссии болезни (Gray L.E., 1997). Содержание алгоритмов эмпирической АБТ инфекционного эндокардита определяется вариантом течения болезни и развитием резистентности бактерий к препаратам.
При адекватной АБТ клинический эффект наступает через 4-6 суток. Гогин Е.Е. и Тюрин В.П. (1996) приводят критерии эффективности АБТ: в первые 48-72 часа лечения улучшается общее состояние больных, появляется аппетит, уменьшается астения, проходят ознобы, потливость и лихорадка. В конце первой недели исчезают или значительно снижаются температура тела, ознобы, петехии, эмболические проявления, прекращается снижение гемоглобина, замедляется СОЭ, определяется стерильная гемокультура. В конце 2-3 недели нормализуется лейкоцитарная формула крови, существенно замедляется СОЭ, уменьшаются размеры печени и селезёнки, нормализуются показатели острофазовых реакций, уменьшаются проявления мочевого синдрома. В конце 4-6 недели СОЭ достигает 10-20 мм/час, происходит нормализация показателей протеинограммы, белой и красной крови, размеры печени и селезёнки приобретают обычные величины, исчезают васкулиты и эмболии. В случае отсутствия этих признаков проводят коррекцию доз или замену АБ.
Эффективность АБТ зависит от возраста пациента, продолжительности болезни, величины, локализации и подвижности микробных вегетаций, изменений иммунной системы, вида бактерий (Шевченко Ю.Л., 1997; Шевченко Ю.Л., Хубулава Г.Г., 1995; Тюрин В.П., 2001). Смертность от ИЭ, вызванного стафилококком, остаётся высокой и составляет 30-90% (Дёмин А.А., Дробышева В.П., 2000; Atkinson J.B., Virmani R., 1997; Minale, 1987). Причина этого заключаются в развитии резистентности бактерий к АБ (Буткевич О.М., 1996). Различают первичную и вторичную резистентность (Буткевич О.М., Виноградова Т.Л., 1991; Буткевич О.М. и соавт., 1986).
При первичной резистентности использование АБ не вызывает ремиссии болезни (синегнойная палочка, грамотрицательные бактерии).
У больных ИЭ происходят значительные изменения иммунной системы (Хубулава Г.Г., 1994; Шихвердиев Н. Н., 1994; Виноградова Т.Л., 1995; Шевченко Ю.Л., Серебряная Н.Б., 1995; Шевченко Ю.Л., Хубулава Г.Г., 1995). Для их коррекции используют лечебный плазмаферез (ПФ), ксеноспленоперфузию (КСП), внутрисосудистое лазерное облучение крови (ВЛОК), ультрафиолетовое облучение крови (УФОК) (Шалаев С.А. и соавт., 1993; Шевченко Ю.Л., Хубулава Г.Г., 1995). Эти методы экстракорпоральной детоксикации оказывают выраженный иммуномодулирующий эффект и уменьшают эндогенную интоксикацию в септической фазе болезни (Татарченко И.П., Комаров В.Т., 2001).
Основным показанием для ПФ при эндокардите является нарастающая эндогенная интоксикация (Хазанов Е.А. и соат., 1990; Шевченко Ю.Л., Хубулава Г.Г., 1995). Для выброса токсических веществ из кровяного депо перед проведением ПФ проводят курс реокорригирующей терапии, включающей внутривенное введение небольших доз реополиглюкина, трентала и дроперидола. После ПФ в результате элиминации бактериальных токсинов уменьшается эндогенная интоксикация, улучшается общее состояние больных и нормализуются показатели центральной гемодинамики (Шевченко Ю.Л., Хубулава Г.Г., 1995; Орлов С.В. и соавт., 1997).
Плазмаферез используют для лечения иммунных осложнений при подостром ИЭ. Удаление из крови избыточного количества ЦИК и иммуноглобулинов снижает вероятность развития и прогрессирования иммунопатологических осложнений болезни (Тюрин В.П., 2001; Воробьёв П.А., 1998). Клиническая эффективность ПФ зарегистрирована у 90% больных эндокардитом: происходило снижение гектической температуры тела до субфебрильной, улучшение общего состояния больных, нормализация показателей свёртывающей системы крови, уменьшение показателей воспаления, коррекция анемии (Костюченко А.Л., 2000; Шихвердиев Н.Н., 1994).
После проведения 2-3 сеансов ксеноспленоперфузии через срезы свежезаготовленной и отмытой ксеноселезёнки уменьшается интоксикация, улучшается общее состояние больных ИЭ (Хубулава Г.Г., 1994). Однако, данный метод обладает недостатком: происходит блокада микроциркуляторного русла ксеноселезёнки при прохождении через неё крови, снижается её функциональная активность и лечебный эффект. Для устранения этого недостатка необходимо проводить перфузию ксеноселезёнки аутоплазмой, полученной при ПФ.
Важным методом гемокоррекции является ВЛОК. Определены основные механизмы его лечебного действия: иммунокорригирующий, антианемический и антитоксический. Под действием лазерного облучения крови происходит нормализация агрегатного состояния крови, увеличение сократительной способности левого желудочка, нормализация электрической стабильности миокарда (Григораш Г.А. и соавт., 1990; Кипшидзе Н.Н. и соавт., 1991; Кожура Л.В. и соавт., 1993; Сиренко Ю.Н. и соавт., 1994). Увеличивается количество и активность иммунокомпетентных клеток, факторов неспецифического иммунитета и иммуноглобулинов, происходит стимуляция фагоцитоза, повышается бактерицидная активность крови (Мешалкин Е.Н., Сергиевский В.С., 1989; Авруцкий М.Я. и соавт., 1991), происходит стимуляция эритропоэза, улучшение кислородтранспортной функции эритроцитов, стабилизация мембран клеток (Авруцкий М.Я. и соавт., 1991; Артамонов В.М., Белоусов С.С., 1991; Родионов Б.В. и соавт., 1991; Зяблицкий В.М. и соавт., 1992). Снижается интенсивность процессов пероксидации липидов и активации антиоксидантной системы организма, уменьшается количество молекул средней массы, нормализуются показатели тканевого метаболизма (Иванов И.И., 1991; Козлов В.И., Буйлин В.А., 1993; Рузов В.И. и соавт., 1991). Гипокоагуляционный и дезагрегационный эффект проявляются стимуляцией фибринолиза и увеличением концентрации естественных антикоагулянтов крови (Кажекин О.А., 1992; Савина Л.В., Зиньковская Т.М., 1992). Иммуномодулирующее действие ВЛОК вызвано нормализацией субпопуляций (Ohshiro T., Calderhead R.G., 1988) и снижением электростатического заряда цитоплазматической мембраны Т-лимфоцитов (Беседнова Н.Н.
Клиническая эффективность УФОК обусловлена иммунорегулирующим действием (Самойлова К.А., 1989). Однако непосредственный эффект УФОК на иммунокомпентные клетки и различные аспекты их функционального состояния изучены недостаточно. По данным Ашинова Н.А. (1999) после УФОК у больных ИЭ происходят изменения экспрессии дифференцировочных рецепторов CD3, CD5 и СD8-рецепторов лимфоцитов, уменьшается экспрессия маркеров активации лимфоцитов CD25 и DR-антигена, увеличивается продукция ИЛ-1, ФНО. Механизм действия УФОК обусловлен стимуляцией иммунитета и действием на бактерии, удалением из организма среднемолекулярных белков, уменьшением артериальной гипоксемии, улучшением кислородтранспортной функции эритроцитов и активацией окислительно-восстановительных процессов (Ветчинникова О.В., 1995; Костюченко А.Л., 2000; Татарченко И.П., Комаров В.Т., 2001). Ультрафиолетовое облучение аутокрови активирует эритро- и лейкопоэз, оказывает регулирующее действие на каликреин-кининовую систему, повышает неспецифическую резистентность организма. Таким образом, положительных результатов в лечении ИЭ можно достигнуть при использовании АБТ и методов экстракорпоральной гемокоррекции (ПФ, КСП, ВЛОК, УФОК).
В клинической картине подострого ИЭ на первый план выступают аутоиммунные осложнения. В такой ситуации встаёт вопрос о применении глюкокортикоидов (ГК). Однако несмотря на полувековой опыт лечения ГК нет единого мнения о их эффективности при ИЭ. Разноречивы мнения о показаниях к применению в зависимости от фазы, варианта течения болезни. Использование ГК позволяет сохранять устойчивость мембран миокардиоцитов, предотвращать неспецифическое повреждение клеток эндотоксинами и протеолитическими ферментами, блокировать проницаемость лизосом и выход кислых гидролаз, обеспечивать супрессирующий эффект на каждую стадию иммунного ответа. Использование ГК на этапе предоперационной подготовки способствует достижению хороших результатов в лечении больных острым ИЭ (Шевченко Ю.Л., 1995; Шевченко Ю.Л., Хубулава Г.Г., 1995).
Тем не менее, использование ГК при подостром ИЭ вызывало активацию инфекционного процесса (9,5%), увеличение смертности и эмболических осложнений в 1,5-2 раза, прогрессирование сердечной недостаточности (СН), снижение активности нейтрофилов, моноцитов и фагоцитарной активности лейкоцитов, депрессию клеточных иммунологических реакций (Тюрин В.П., 2001). Небольшие дозы преднизолона (20-30 мг/сут) применяют у больных подострым ИЭ при развитии полисерозита, гломерулонефрита, миокардита и геморрагического васкулита (Гуревич М.А., 1998).
Клиническая демонстрация доложена на заседании Московского городского научного общества терапевтов 11 ноября 2009 г.
 |  |
 |
Тюрин В.П., Мезенова Т.В., Кирюхина Н.А., Усачева Ю.В.
Летальность при инфекционном эндокардите (ИЭ) остается высокой (15-25%), несмотря на внедрение в диагностику заболевания эхокардиографии, применение новых антибактериальных препаратов широкого спектра действия, хирургического лечения эндокардита. Худшие результаты лечения отмечаются при остром ИЭ, при котором развиваются тяжелые осложнения, препятствующие оказанию помощи в полном объеме. Примером успешного лечения острого ИЭ может быть следующее клиническое наблюдение. Больной А., 16 лет, поступил в ревматологическое отделение НМХЦ 11.03.08г. с жалобами на повышение температуры тела до 38С, умеренную головную боль в затылочной области ,боль в икроножных мышцах, сердцебиение и выраженную общую слабость. Заболел остро 23.02.08, когда ночью появилась выраженная головная боль в затылочной области на фоне повышения температуры тела до 40,5С. В последующие дни сохранялась лихорадка, появились выраженная слабость, артралгии, миалгии, из-за чего не смог самостоятельно передвигаться. 26.02.08 появились геморрагические высыпания на коже правой стопы, ладонных поверхностях кистей, что в сочетании с упорной головной болью было подозрительно на менингококковый менингит. Скорой помощью госпитализирован в инфекционную больницу с диагнозом менингит.
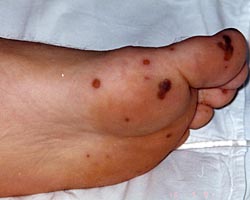
В ан. крови: гем. 134 г/л, л. 16,1х109/л, СОЭ 21 мм/час. В ан. мочи: белок 0,2 г/л, лейкоцитов 12-17 в п/зр, эритроцитов до 25 п/зр. Посев крови и ликвора от 26.02.08 – роста микрофлоры нет. При исследовании спинномозговой жидкости цитоз 288/3, белок 13 г/л. Учитывая слабо выраженный цитоз, заподозрен вторичный характер менингита, предполагался инфекционный эндокардит. Выполнено ЭхоКГ (06.03.08): вегетации на передней створке митрального клапана. Диагностирован инфекционный эндокардит, назначена антибактериальная терапия ванкомицином 2 г/сут, таваником 1 г/сут. Однако сохранялась лихорадка более 38,0С. В связи с этим 11.03.08 переведен в ревматологическое отделение НМХЦ для дальнейшего лечения. При поступлении состояние средней тяжести. Температура тела при осмотре 37,8 С. На коже правой стопы высыпания по типу геморрагических некрозов кожи. В легких дыхание везикулярное, проводилось во все отделы, хрипов нет, ЧДД 16 в мин. Тоны сердца звучные, на верхушке систолический шум, проводящийся в левую подмышечную область. Живот мягкий, безболезненный, печень выступала из-под края реберной дуги на 2см. Селезенка перкуторно увеличена, не пальпировалась. Ан. крови 12.03.08: гем. 129 г/л, л. 10,4х109/л, п-6%, с – 59%, л – 30%, м – 4%, э-1%, тромбоциты 324 тыс., СОЭ 40 мм/час. Посевы крови и ликвора роста микрофлоры не дали. Исследование ликвора от 12.03: прозрачный, без осадка, белок 0,34 г/л, цитоз 10/3, подтвердило положительную динамику течения менингоэнцефалита. Рентгенологическое исследование органов грудной клетки без патологии. УЗИ органов брюшной полости – увеличение селезенки 13х 6 см.
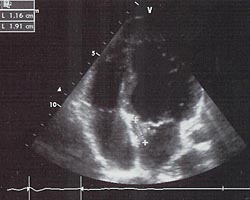
Трансторокальная ЭхоКГ ( 11.03.08): у основания передней створки митрального клапана со стороны левого предсердия конгломерат вегетаций размером 1,9х1,1 см, митральная регургитация 3 ст.
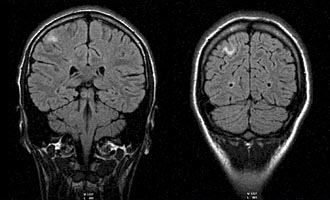
МРТ головного мозга (11.03.08): в белом веществе головного мозга субкортикально в лобно-теменной области справа определяются округлые и линейные очаги с перифокальным отеком размерами от 3 до 10 мм.
У пациента подтвержден диагноз острого инфекционного эндокардита, недостаточность митрального клапана 3 ст, церебральная эмболия с развитием менингоэнцефалита. Была продолжена терапия ванкомицином и таваником, на фоне которой сохранялась фебрильная лихорадка до 38,5С, в связи с чем проведена смена антибактериальной терапии на линезолид 1,2 г/сут. Однако на фоне терапии сохранялась лихорадка 37,8С. Наличие неконтролируемой инфекции, перенесенная эмболия, наличие крупной вегетации на митральном (наиболее эмбологенном) клапане, явились показанием к протезированию клапана. Осмотрен кардиохирургом. На 7 сутки пребывания в стационаре больному выполнена операция (академиком РАН Шевченко Ю.Л.) санации камер сердца, протезирование митрального клапана протезом Мединдж – 25 в условиях искусственного кровообращения и фармакохолодовой кардиоплегии. Интраоперационно у основания передней створки митрального клапана обнаружен абсцесс диаметром до 1 см. В послеоперационном периоде продолжена терапия ванкомицином 2 г/сут, ципрофлоксацином 0,8 г/сут. На фоне терапии сохранялась лихорадка до 37,9С. В связи с этим пациенту выполнена компьютерная томография органов грудной клетки:
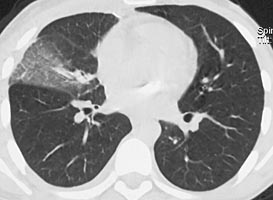 | 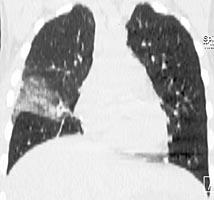 |
В средней доле правого легкого массивный участок снижения воздушности легочной ткани с очагами инфильтрации, занимающий практически весь объем доли. Диагностирована госпитальная пневмония в средней доле правого легкого. Учитывая сохраняющуюся лихорадку, проведена смена комбинированной антибактериальной терапии на тиенам 2 г/сут в сочетании с линдацином 2г/сут. Лишь после назначения авелокса 0,4 г/сут с римфапицином 0,6 г/сут достигнута стойкая нормализация температуры тела, исчезновение инфильтративных изменений в легких. Нормализовались лабораторные показатели: гем. – 126 г/л, лейк. 8,1х109/л, п - 1%, с – 38%, СОЭ 12 мм/час. Контрольная чрезпищеводная ЭхоКГ без патологии. В течение последующих 1,5 лет рецидива инфекции не было. Температура тела, ЭхоКГ, лабораторные показатели в норме. Клиническое наблюдение представлено острым по началу инфекционным эндокардитом, при котором летальность приближается к 100%. Антибактериальная терапия как и в нашем наблюдении, редко бывает эффективной. Обычно в ранние сроки, особенно при поражении митрального клапана, развиваются множественные эмболии. Хирургическое лечение должно выполнятся как можно раньше, промедление с операцией могло привести к развитию новых более грозных осложнений, которые могли стать непреодолимым препятствием к хирургическому лечению. Современная оперативная техника позволяет не дожидаться санации клапана антибиотиками, а провести хирургическую санацию очага внутрисердечной инфекции в ранние сроки заболевания при наличии показаний к операции.
Читайте также:


