Стандартное определение случая инфекции кровотока
Эпидемиологический надзор за инфекциями кровотока проводится в стационарных условиях в виде организации эпидемиологического наблюдения в системе инфекционного контроля.
Эпидемиологическое наблюдение включает в себя систематический сбор данных по специальной программе, учитывающий как регистрацию случаев инфекции кровотока, так и проявления факторов риска, влияющих на их возникновение. Для проведения эпидемиологического наблюдения за инфекциями кровотока необходимо использование стандартного определения случая и информации о количестве всех инвазивных манипуляций, проводимых на сосудистом русле пациентов того или иного отделения, прежде всего в отделениях реанимации.
Необходим сбор количественных данных о ведущих факторах риска возникновения инфекций кровотока, таких как число катетеро-дней и расчет частоты случаев внутрибольничных инфекций на 1000 пациенто-дней с инвазивным устройством.
Поскольку риск возникновения инфекции кровотока, связанной с катетеризацией сосудов, в большой степени зависит от продолжительности катетеризации, частота развития катетер-ассоциированных инфекций кровотока (КАИКР) рассчитывается по формуле показателя плотности инцидентности:

Приведенный выше показатель обеспечивает более надежное сравнение данных.
Общее количество инфекций кровотока может определяться и обычным способом (по формуле показателя кумулятивной инцидентности):

Практические рекомендации по профилактике развития инфекций кровотока основываются на знании современных эпидемиологических тенденций развития этих заболеваний.
Профилактика возникновения инфекций кровотока, основанная на снижении действия факторов риска, сводится к следующим рекомендациям.
- Ежедневно необходимо пальпировать место постановки катетера для определения болезненности и осматривать место катетеризации, если у пациента развивается болезненность в месте постановки, лихорадка
- У пациентов, которые имеют большие, фомоздкие повязки, мешающие пальпации или прямому осмотру места постановки катетера, снимается повязка, визуально осматривается место катетеризации по крайней мере ежедневно, и накладывается новая повязка.
- При выявлении инфекции кровотока необходимо удалить катетер. В случае необходимости продолжения инфузионной терапии катетер устанавливается в другое место.
- Необходимо вымыть руки до и после пальпации, постановки любого внутрисосудистого устройства, замены или наложения повязки.
- Необходимо надеть перчатки при постановке внутрисосудистого устройства и при замене повязки на внутрисосудистом устройстве.
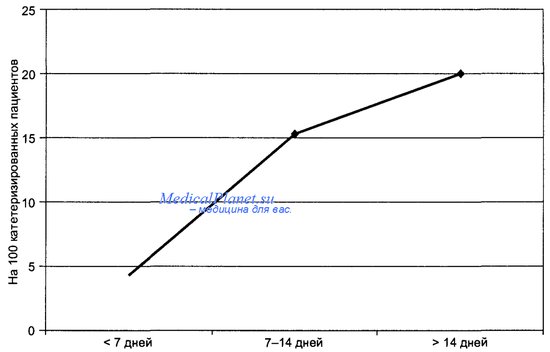
Частота инфекций кровотока, связанных с катетеризацией сосудов, в зависимости от длительности катетеризации
- При постановке центральных венозных и артериальных катетеров необходимо применять стерильное оснащение, включая стерильную одежду и перчатки, маску и большие стерильные салфетки (максимальные барьерные меры предосторожности).
- Все манипуляции с катетером, в том числе и по уходу за ним, должны быть сведены до минимума.
- Место постановки катетера должно содержаться сухим и не травмироваться без крайней необходимости. Необходимо строго соблюдать технику введения катетера (канюли) — она должна быть максимально атравматичной и асептичной.
- Предпочтение должно отдаваться местам постановки катетера с меньшим риском развития инфекции (так, постановка катетера на сосудах нижних конечностей связана с большим риском).
- Приоритетным является выбор катетера с оптимальным диаметром; так, например, центральные катетеры с тремя отверстиями несут в себе больший риск развития инфекции по сравнению с одинарными катетерами.
- Предпочтительным является использование катетеров, изготовленных из полиуретана и тефлона.
- Определение оптимального времени нахождения катетера в сосуде — чем дольше катетер остается в сосудистом русле, тем вероятнее развитие инфузионного тромбофлебита, что в свою очередь повышает риск развития генерализованной инфекции.
- Необходима повышенная настороженность по отношению к возможности возникновения сепсиса, так как в настоящее время его частота увеличилась.
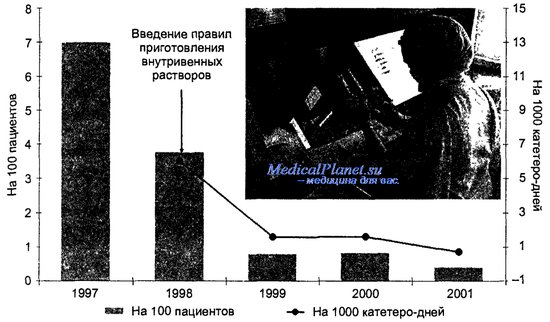
Частота инфекций кровотока, возникших у пациентов реанимации новорожденных до и после внедрения правил приготовления внутривенных растворов
- Все инфузионные растворы должны быть проверены визуально. Флаконы с растворами, изготовленными больничной аптекой, должны проверяться на свет и на темном фоне. Необходимо давать оценку состояния пациента с точки зрения его иммунного статуса и, по возможности, проводить его коррекцию.
- Выбор антибактериальных препаратов должен быть ориентирован на возросшую этиологическую роль грамположительных микроорганизмов при учете повышенной антибиотикорезистентности многих микроорганизмов -— возбудителей сепсиса, в том числе у пациентов с предшествующей химиотерапией.
- Начало эмпирической антибиотикотерапии у больных, имеющих клиническую картину сепсиса, должно быть в максимально ранние сроки.
Опасным в эпидемиологическом отношении является приготовление внутривенных растворов, особенно, когда эта процедура производится непосредственно в клиническом отделении, например, отделении реанимации. Внедрение эпидемиологически безопасных алгоритмов приготовления внутривенных растворов в специально оборудованном для этого помещении, оснащенном шкафом с ламинарным потоком воздуха, позволяет резко сократить число инфекций кровотока, в том числе бактериемии.
На рисунке продемонстрировано снижение частоты инфекций кровотока у пациентов реанимации новорожденных (Любимова А. В., Хрусталева Н. М., 2003 г.).
К противоэпидемическим мероприятиям относится проведение своевременного расследования случаев групповых заболеваний инфекциzvb кровотока.
Похожие темы научных работ по клинической медицине , автор научной работы — Везирова З.Ш.
Журнал Национального научного центра хирургии им. А.Н. Сызганова
Распространенность и критерии диагностики катетер-ассоциированных инфекций кровотока
Национальный центр онкологии, Баку, Азербайджан
Бурное развитие современных технологий в медицине открыло путь к внедрению в ежедневную практику большого числа устройств, обеспечивающих как проведение полного мониторинга, так и целенаправленной терапии тяжелого контингента больных. В то же время, широкое использование инновационных технологий, в большинстве своем инвазивных, является причиной распространения одной из серьезных проблем клиники - нозокомиальных инфекций, увеличивающих продолжительность стационарного лечения, являющихся причиной повышения показателей заболеваемости и смертности, а также несущих за собой значительные экономические последствия.
Средний уровень заболеваемости внутрибольничными инфекциями колеблется в пределах 3,5 - 10,5 % [5]. Нозокомиальные инфекции (НИ) являются четвертой по частоте причиной летальности в США. По данным официальной статистики, госпитальные инфекции (ГИ) ежегодно становятся причиной смерти 90000 человек в США и приводят к экономическим затратам в 4,5 млрд долларов [2,9].
Наиболее остро вопрос госпитальных инфекций стоит в отделениях реанимации и интенсивной терапии (ОРИТ): так частота развития инфекционных осложнений у пациентов этих подразделений увеличивается в 5 раз, составляя в среднем около 20% [2].
В тройку лидирующих ГИ, связанных с применением инвазивных медицинских устройств, наряду с катетер ассоциированной инфекцией мочевых путей и вентилятор ассоциированной пневмонией (ВАП) входят катетер-ассоциированные инфекции кровотока (КАИК).
Частота развития нозокомиальных ангиогенных инфекций колеблется в пределах от 1,3 до 14,5 человек на 1 тыс. поступивших в стационар. Ежегодно в США нозокомиальные ангиогенные инфекции регистрируются у 0,71% госпитализированных больных, более 250 тыс. составляют непосредственно КАИК. Средняя частота встречаемости данной патологии составляет 4-6 случаев на 1000 дней катетеризации, при этом длительность госпитализации возрастает в среднем на семь дней, а стоимость лечения - на 33000-35000 долларов. [3,12,14,17]. Причем, если в отношении иных форм нозокомиальных инфекций (мочевой тракт, раневые инфекции) отсутствуют существенные статистические данные динамического роста их распространенности, то в случае с КАИК - отмечается повышение данных показателей вдвое [9,10,13].
Средняя продолжительность госпитализации выше у пациентов с микробиологически подтверждёнными инфекциями кровотока (ИК) (15,5 дней, 4-67 дней) и клиническим сепсисом (14,0 дней, 3-48 дней) по сравнению с пациентами без ИК (4 дней, 2-134 дня). Госпитальная летальность у пациентов без ИК, с микробиологически
подтверждёнными ИК и с клиническим сепсисом составляет 22,7%, 32,1% и 39,7%, соответственно [19]. Следует отметить непосредственную зависимость уровня летальности от вида возбудителя.На территории России, по данным исследования САЭСАТ, показатель распространения данной патологии составляет 5 случаев на 1000 дней катетеризации (2.2 и 2,8 случаев генерализованной и локальной КАИК на 1000 дней катетеризации со средней длительностью течения 10,0+-4,7 и 6,9+-4,6 суток соответственно) [4]. К сожалению, обобщающие данные по распространению данного вида госпитальной инфекции по республике в настоящее время в доступной литературе не представлены.
Неоспоримым является тот факт, что частота развития и распространенность нозокомиальных инфекций зависят от особенностей пациентов, профиля и оснащенности исследуемого стационара, длительности госпитализации, и, что немаловажно, типа ОРИТ. Факторами риска развития НИ, в том числе КАИК, у пациентов реанимационных отделений соматических стационаров являются в большинстве своем наличие тяжелых сопутствующих хронических заболеваний, длительная госпитализация, а также широкое использование инвазивных устройств, включая дыхательную аппаратуру, сосудистые и мочевые катетеры, гемодиализ. Специфика же распространения госпитальных инфекций в реанимационных отделениях хирургических клиник определяется объемом и характером перенесенного оперативного вмешательства, хирургической агрессией как таковой, влекущей за собой развитие синдрома воспалительной реакции, и, как следствие, необходимостью в проведении полного комплекса интенсивной терапии - тотального парентерального питания, гемотрансфузионной терапии, эфферентных методов детоксикации, заместительной почечной терапии (гемодиализ) и т.д. Дополнительный вклад вносят неадекватно санируемые по ряду причин локусы хирургических инфекций, являющиеся источниками вторичного инфицирования, сепсис, транслокация микроорганизмов из желудочно-кишечного тракта и необходимость в проведении повторных вмешательств.
Особую группу риска представляют онкологические больные. Безусловно, характер основного заболевания, в данном случае неопластического, играет немаловажную роль в развитии катетер ассоциированной инфекции.
По данным различных авторов, в зависимости от локализации опухолевого процесса инфекционные осложнения развиваются у 12-50 % этого контингента пациентов (при лейкозах исследуемый показатель приближается к 75 %), а летальность колеблется от 3 до 60 %. Как сама опухоль, так и методы ее лечения изменяют спектр превалирующих патогенов, клиническое течение инфекций, увеличивают длительность пребывания
больного в стационаре, ухудшают прогноз. Спектр инфекционных осложнений помимо стандартных нозологий (пневмония (39 %), раневые инфекции (31 %), мочевые инфекции (8 %)) включает также лихорадку неясного генеза, в том числе, фебрильную нейтропению (6 %).
Течение послеоперационного периода у пациентов, подвергнутых оперативным вмешательствам по поводу онкологических заболеваний, в особенности торакоабдоминальной зоны, являющихся особо травматичными, имеет ряд особенностей. Прогноз и конечный результат заболевания связаны как с исходными данными (стадия онкологического заболевания, предоперационное снижение функциональных резервов организма, нарушения иммунологического статуса, алиментарная недостаточность, длительность и повреждающий характер предшествовавшего лечебного процесса, антибактериальная терапия), так и с радикальным, агрессивным характером оперативных вмешательств, обширной тканевой травмой, анестезиологическим и реанимационным пособием. Дополнительную лепту вносят непосредственные спутники объемных оперативных вмешательств - анемия и гипоальбуминемия, напрямую ассоциированные с высокой частотой регистрации КАИК [18,20].
Согласно российским данным, катетер-ассоциированная бактеремия у онкогематологических больных равна 32%, общая летальность - 12%, атрибутивная - 9%, причем катетер ассоциированный сепсис, развивающийся в 40% случаев, приводит к повышению общей и атрибутивной летальности до 30 и 22% соответственно [1].
Помимо стандартных факторов риска развития катетер-ассоциированных нозокомиальных инфекций, демографических особенностей, бессистемного использования АБТ и нарушений в соблюдении правил асептики и антисептики, у данного контингента пациентов значимыми компонентами являются технические трудности проведения катетеризации, вид сосудистого доступа, материал и тип катетера, длительность его функционирования (более 30 дней), а также нейтропения свыше двух недель (число нейтрофилов менее 100/мм3). Чаще всего инфекция развивается при катетеризации бедренной вены, наименьшим является риск катетеризации подключичной вены. От 3 до 10% КАИК развиваются при установке катетера на короткое время в подключичную или внутреннюю яремную вену. Использование гемодиализных катетеров ведет к распространению КАИК, по данным различных центров, от 0,31 до 6,6 случаев на 1000 дней катетеризации [8]. Хирургически имплантированные внутрисосудистые устройства для длительного функционирования типа Hickman и Broviak и подкожные центральные венозные порт-катетеры (Port-a-Cath) ассоциированы с меньшей частотой КАИК.
Однако, по мнению ряда авторов, число инфицированных в ряде стран в несколько десятков раз превышает официальные данные вследствие неполноценного учета заболеваемости, а в ряде случаев - сокрытия фактов инфицирования пациентов за время госпитализации [6]. К сожалению, такая недальновидная политика стационаров, а также отсутствие единой системы контроля может привести в конечном итоге к неблагоприятным последствиям. В связи с вышесказанным, наличие четких статистических данных по распространенности, заболевае-
мости и смертности вследствие госпитальной инфекции должно стать неотъемлемой частью анализа деятельности лечебных учреждений.Одним из первых шагов на этом пути является определение критериев выставления данного диагноза во избежание гипердиагностики или же недооценки сложившейся ситуации, четкая регистрация полученных данных, следование общепризнанным рекомендациям. Разработка современных определений НИ началась в США в рамках проведения Comprehensive Hospital Infections Project (CHIP) в 1969-1972 гг. и National Nosocomial Infections Study (NNIS) в 1970-1974 гг. Согласно рекомендациям Центра Контроля Заболеваемости - Centers for Disease Control and Prevention (CDC), на сегодняшний день обшепринятой является следующая классификация катетер-ассоциированных инфекций [7,12,15,16]:
- колонизированный катетер - отсутствие клинической симптоматики; рост >15 КОЕ - при использовании полуколичественного метода оценки колонизации по D.Maki, позволяющей оценить только колонизацию наружной поверхности катетера (прокатывание дис-тального фрагмента извлеченного катетера по поверхности плотной питательной среды); рост >103 КОЕ - при использовании количественного метода для оценки колонизации наружной и внутренней поверхностей катетера (суспендирование и обработка ультразвуком дистального фрагмента удаленного катетера в физиологическом растворе, высев на плотную питательную среду);
- инфекция места введения катетера: гипертермия, болезненность, уплотнение, нагноение кожи в пределах 2 см от места введения катетера при отрицательных результатах гемокультуры;
- карманная инфекция: нагноение и/или некроз в области имплантированного устройства при отрицательных результатах гемокультуры;
- туннельная инфекция: гипертермия, болезненность, уплотнение, нагноение кожи в пределах 2 см от места введения катетера и вдоль туннелированного катетера при отрицательных результатах гемокультуры;
- инфекция, связанная с инфузатом: выделение одного и того же микроорганизма из инфузионного раствора и периферической вены при наличии системных признаков инфекции;
- катетер-ассоциированная инфекция кровотока: первичная бактеремия, выделение одного и того же микроорганизма из удаленного ЦВК и периферической вены у пациента с клинической картиной инфекции кровотока при отсутствии других очагов. КАИК - это первичная инфекция кровотока, развивающаяся не ранее 48 часов от момента установки венозного катетера при отсутствии прочих источников инфекции. CLABSI - инфекция кровотока, связанная с установленным ЦВК - является первичной ИК, развиваюшейся у пациентов с установленным за 48 часов до факта развития ИК центральным венозным катетером. Данная патология в свою очередь подразделяется на CLRBSI, CABSI, CRBSI, ритю^ BSI (последний вариант применим к новорожденным в возрасте менее 30 дней и детям до года).
Вторичные ИК - микробиологически (культурально) подтвержденные ИК при установленной ГИ иной области. При этом на основании микробиологических методов исследования выделяется идентичный возбудитель, аналогичной является и антибиотикограмма. Причем
Журнал Национального научного центра хирургии им. А.Н. Сызганова
- выявление возбудителя из крови более, чем в одном образце гемокультуры и возбудителя, не относящегося к инфекции в другом локусе,
- или наличие более одного клинического симптома (лихорадка, озноб или гипотензия) и сочетание с любым из перечисленных далее признаков:
а) контаминат кожного покрова, выделенный, по меньшей мере, из двух различных гемокультур;
б) контаминат кожного покрова, выделенный из гемо-культуры пациента с сосудистым катетером после назначении адекватной антибактериальной терапии;
в) положительный результат теста для выявления антигенов микроорганизма в крови, при условии, что возбудитель не вызывает инфекцию в любом другом локусе. (В случае выделения CNS необходимо проведение повторного исследования спустя сутки).
С целью изучения распространённости КАИК в отделениях интенсивной терапии различного профиля в настоящее время нами проводится мониторинг госпитальных инфекций на базе Центральной Больницы Нефтяников и Национального Центра Онкологии г. Баку. В исследование включены пациенты в возрасте от 18 лет с различными соматическими и хирургическими патологиями, находящиеся в ОРИТ >48 ч. Диагноз нозокомиальной инфекции выставляется в соответствии с критериями Центров по контролю и профилактике заболеваний (CDC), Атланта, США. Исследуемыми параметрами являются все нозокомиальные инфекции, связанные с использованием инвазивных устройств, демографические характеристики пациентов, клинический диагноз при поступлении и выписке, наличие инвазивного оборудования (сосудистые катетеры, зонды, искусственная вентиляция лёгких), антибактериальная терапия, а также выживаемость в ОРИТ и стационаре.
Образцы крови для исследований получены методом раздельных венопункций ( без использования сосудистого катетера) в стерильных условиях специально обученным персоналом отделения интенсивной терапии. Согласно отработанному протоколу, сбор и учет показателей по числу катетерных дней проводится средним медицинским персоналом из группы по инфекционному контролю ежедневно. Обязательными для регистрации являются данные историй болезни и листов назначений, микробиологических и рентгенологических методов исследования. Полученные по каждому конкретному случаю данные заносятся в разработанные карты учета ГИ и передаются в комитет по инфекционному контролю. Совместно с этим подразделением, а также службой микробиологической лаборатории в настоящее время проводится анализ и обработка полученных данных и текущего материала. По истечении запланированного времени нами планируется представление к печати собственных данных по распространению НИ в целевых стационарах и локальных данных микробиологического
пейзажа. Несмотря на определенные успехи в разработке руководств по микробиологическому мониторингу и программ по инфекционному контролю, на сегодняшний день актуальными остаются проблемы выявления и учета случаев нозокомиальных инфекций, в том числе гипердиагностики, запоздалого и неадекватного назначения эмпирической антибактериальной терапии и, связанных с ними увеличением длительности госпитализации и повышением летальности, ростом резистентности и экономических затрат. Необходима дальнейшая разработка стратегий мониторинга данной нозологии для профилактики, оценки распространённости и улучшения качества лечения.
На сегодняшний день контроль за распространением НИ возможен лишь при условии соблюдения общепризнанных критериев данной патологии. Являясь проблемой мультидисциплинарной, свое решение она может найти при условии слаженной и правильно организованной совместной работе заинтересованных подразделений стационара.
1. Багирова Н.С. Микробиологическая диагностика и рациональные подходы к терапии сепсиса у онкоге-матологическихбольных. Автореф.дисс. . докт. мед.наук.-М.2003.-54с.
2. Белобородов, В.Б. Антимикробная терапия тяжелых инфекций в стационаре. Антибактериальная терапия инфекций в отделениях реанимации и интенсивной терапии. -2003. -Т № 2. -С 4 21.
3. Белобородов, В.Б. Проблема инфекций, связанных с катетеризацией. Антимикробная терапия тяжелых инфекций в стационаре. -2003. -Т № 2. -С 82-91.
4. Бережанский Б.В. Оптимизация фармакотерапии и профилактики инфекций, связанных с центральным венозным катетером в отделениях реанимации
и интенсивной терапии. Автореф. дис. канд. мед. наук. Смоленск. 2008. 22с
5. Козлов Р.С. Нозокомиальные инфекции: эпидемиология, патогенез, профилактика, контроль. КМАХ - 2000. Том 2, № 1.
8. Betjes M. Prevention of catheter-related bloodstream infection in patients on hemodialysis, Nat Rev Nephrol 2011.7; 27-65
9. CDC NNIS System. National Nosocomial Infection Surveillance (NNIS) Semiannual Report. 2010.
10. CDC NNIS System. National Nosocomial Infection Surveillance (NNIS) Semiannual Report. 2012.
11. Guide to the Elimination of Catheter-Related Bloodstream Infections. An APIC Guide 2009
12. M. Hentrich, E Schalk, M. Schmidt-Hieber. Central venous catheter-related infections in hematology and oncology: 2012 updated guidlines on diagnosis, management prevention by the infectious Diseases Working Party of the German Societyof Hematology and Medical Oncology. Annals of Oncology 00;1-12, 2014.
13. Maki D.G. Infections caused by intravascular devices used for infusion therapy: pathogenesis, prevention, management in infections associated with indvelling medical devices//Eds.A.L.Bisno, F.A.Waldvogel.- ASM PRESS. Washington,D.C.- 1994.-Chapter 8.-P. 155-212
14. Mermel L.A., Allon M., Bonza E. Et al. Clinical practice guidelines for the diagnosis and management of intravascular catheter-related infection:2009 update by the infection diseases society of America. CID 2009:49:1-45
15. Mermel L.A., Farr B.M., Sherertz R.J., et al. Guidelines for the management of intravascular catheter-related infections. Clin Infect Dis 2001:32:1249-1272
16. O'Grady N, Alexander M.,Dellenger E, et al. Guidelines for the prevention of intravascular catheter-related infections. Clin Infect Dis 2002:35:1281-1307
17. Pittet D, Tarara D, Wenzel R.P. Nosocomial bloodstream infections in critically ill patients. Exess length of stay, extra cost and attributable mortality// JAMA.-1994-Vol.207.-p.1598-1601
18. Powe N.R., Jaar B., Furth S.L., Hermann J., Briggs W. Septicemia in dialysis patients: incidence, risk factors and prognosis. Kidney Int. 1999:55:1081-90., Tanriover
B, Carlton D, Saddekm S., et al. Bacteremia associated with tunneled dialysis catheters: comparison of two treatment strategies. Kidney Int. 2000:57:2151-5
19. Rosenthal VD, Pawar M, Leblebicioglu H. Impact of the International Nosocomial Infection Control Consortium (INICC) multidimensional hand hygiene approach over 13 years in 51 cities of 19 limited-resource countries from Latin America, Asia, the Middle East, and Europe. Infect Control Hosp Epidemiol. 2013 Apr;34(4):415-23. doi: 10.1086/669860. Epub 2013 Feb 14.
20. Tanriover B., Carlton D., Saddekm S., et al. Bacteremia associated with tunneled dialysis catheters: comparison of two treatment strategies. Kidney Int. 2000:57:2151-5
21. Teresa C Horan, M. Andrus. CDC/NHSN surveillance definition of health care-associated infection and criteria for specific types of infections in acute care setting. Am J Infect Control 2008:36:309-32.
Результаты проведения эпидемиологического наблюдения, выполненного на добровольной основе в ряде стационаров США, позволили составить представление о частоте возникновения инфекций кровотока. Общее число случаев инфекций кровотока за 9-летний период составило 2 570 ООО. Таким образом, в среднем, ежегодно регистрируется около 200000 случаев инфекций кровотока.
Основное число случаев возникновения сепсиса связано с использованием вну- трисосудистых устройств. С 1986 г. по 1990 г., по данным NNIS, велось наблюдение за катетер-ассоциированными инфекциями кровотока в отделениях интенсивной терапии. Частота их возникновения имела уровень от 2,1 на 1000 катетеро-дней (в респираторных отделениях интенсивной терапии) до 30,2 катетеро-дней в палатах интенсивной терапии ожоговых центров.
Инфекции кровотока в значительной степени утяжеляют состояние пациента, приводя к смерти в 10-20% случаев.
Определение инфекций кровотока
При постановке диагноза ВБИ кровотока учитывают:
- наличие у пациента клинических признаков инфекции кровотока, развившейся не ранее чем через 48 ч после поступления больного в лечебное учреждение;
- положительный результат высева микроорганизмов из крови пациента, взятой не ранее 48 ч после госпитализации.
Различают первичную и вторичную ИКР.
Первичная ИКР возникает у пациента при отсутствии других очагов инфекции той же этиологии. Чаще всего первичная ИКР связана с использованием внутрисо- судистых устройств.
Вторичная ИКР развивается у пациента при наличии очага инфекции другой локализации той же этиологии.
Диагноз выставляется при наличии нижеприведенных клинических и лабораторных признаков.
При первичной ИКР:
- Лабораторно подтвержденная инфекция без клинических признаков. Источник неизвестен: обнаружение в одном или нескольких посевах крови патогенного или условно-патогенного микроорганизма и микроорганизмов, выделенных из крови, НЕ связано с инфекцией иной локализации.
- Лабораторно подтвержденная инфекция с клиническими признаками.
- Источник неизвестен: у пациента имеется по крайней мере ДВА из следующих признаков или симптомов в пределах 24 ч (до или после) получения положительной культуры крови: температура > 38°С или 90 уд./мин, частота дыхания > 20 дых./мин или РаС2 12 000/мм 3 , 3 , или > 10% незрелых форм и обнаружение УПМ из числа обычно наблюдаемых на поверхности кожного покрова ( Corynebacterium spp., Bacillus spp., Propionibacterium spp., coagulase-negative Staphylococci spp., alpha haemolytic Streptococci spp., или micrococci) в двух или более анализах крови, взятых в разные сроки в течение 48 ч, и если эти признаки и симптомы не связаны с инфекцией иной локализации.
Б. Катетер-ассоциированная ИКР: имеется по крайней мере одна положительная культура крови, полученная из периферийной вены, и у пациента выявлено по крайней мере ДВА из следующих признаков или симптомов в пределах 24 ч (до или после) получения положительной культуры крови: температура > 38°С или 90 уд./мин, частота дыхания > 20 дых./мин или РаС2 12000/мм 3 , 3 , или > 10% незрелых форм и пациент имеет устройство сосудистого доступа, которое заканчивается недалеко от сердца или крупных сосудов (катетер пупочной вены или артерии рассматривается как центральная линия) и врач назначает соответствующую терапию или симптомы исчезают через 48 ч после удаления катетера. Признаки и симптомы не связаны с инфекцией иной локализации.
ИКР является связанной с центральной линией, если линия использовалась в течение 48 ч до развития ИКР. Если интервал между началом инфекции и использованием устройства > 48 часов, должны быть представлены доказательства, что инфекция связана с центральной линией.
Связанная с наличием катетера ИКР: по крайней мере имеется одна положительная культура крови, полученная из периферийной вены, и у пациента выявлено по крайней мере ДВА из следующих признаков или симптомов в пределах 24 ч (до или после) получения положительной культуры крови: температура > 38°С или 90 уд./мин, частота дыхания > 20 дых./мин или РаС2 12000/мм 3 , 3 , или > 10% незрелых форм и положительный полуколичественный (>15 колониеобразующих единиц на сегмент катетера) или количественный (>10 3 колониеобразующих единиц на сегмент катетера) высев одного и того же микроорганизма (вид и антибиотикограмма) с сегмента катетера и периферической крови и одновременный высев положительных культур с центрального венозного катетера (ЦВК) и периферической крови в соотношении > 5:1 или > 2 ч между положительными посевами ЦВК и периферической крови, признаки и симптомы не связаны с инфекцией иной локализации.
У пациента выявлено по крайней мере ДВА из следующих признаков или симптомов: температура > 38°С или 90 уд./мин, частота дыхания > 20 дых./мин или РаС2 12000/мм 3 , 3 , или > 10% незрелых форм и микробиологическое исследование крови НЕ проводилось или в крови НЕ обнаружены никакие микроорганизмы или антигены и признаки и симптомы не связаны с инфекцией иной локализации и врач назначает соответствующую терапию сепсиса.
- Подтвержденная вторичная бактериемия : лабораторно подтвержденная ИКР (положительная культура крови) и положительный высев одного и того же вида микроорганизма (с одинаковой антибиотикограммой) из другого биосубстрата. Положительная культура должна быть получена из другого биосубстрата помимо крови в пределах 48 ч до или после положительной культуры крови.
- Вероятная вторичная бактериемия: положительная культура крови и подозрение на инфекцию другой локализации, но посев отрицательный или не делался. Исключение: бактериемия, вызванная обычной микрофлорой кожи, рассматривается как вторичная, только если имеются доказательства инфекции другой локализации.
- Лабораторно подтвержденная с клиническими признаками: по крайней мере имеется одна положительная культура крови, полученная из периферийной вены, и у пациента выявлено по крайней мере ДВА из следующих признаков или симптомов в пределах 24 ч (до или после) положительной культуры крови: температура > 38°С или 90 уд./мин, частота дыхания > 20 дых./мин или РаС2 12000/мм 3 , 3 , или > 10% незрелых форм и признаки или симптомы связаны с инфекцией иной локализации, выявленной до положительной культуры крови, или положительный высев одного и того же вида микроорганизма (с одинаковой антибиотикограммой) из другого биосубстрата. Положительная культура должна быть получена из другого биосубстрата помимо крови в пределах 48 ч до или после положительной культуры крови.
- Клинический сепсис: у пациента имеется по крайней мере ДВА из следующих признаков или симптомов: температура > 38°С или 90 уд./мин, частота дыхания > 20 дых./мин или РаС2 12 000/мм 3 , 3 , или > 10% незрелых форм и микробиологическое исследование крови НЕ проводилось или в крови НЕ обнаружены никакие микроорганизмы или антигены и признаки и симптомы связаны с инфекцией иной локализации и врач назначает соответствующую терапию сепсиса.
Тяжесть заболевания определяется по следующим критериям:
Сепсис — системный ответ, проявляющийся двумя или более нижеперечисленными признаками, возникшими в результате инфекции:
- температура > 38°С или 90 уд./мин;
- частота дыхания > 20 дых./мин или РаС2 12000/мм 3 , 3 , или >10% незрелых форм.
Тяжелый сепсис — сепсис, связанный с органной недостаточностью, гипоперфузией или гипотензией. Гипоперфузия или нарушение перфузии могут характеризоваться лактатацидозом, олигурией или острым нарушением психического статуса, но не ограничиваются этими признаками.
Септический шок — сепсис с артериальной гипотензией, несмотря на адекватную коррекцию гиповолемии, с явлениями нарушения перфузии, которые могут включать лактатацидоз, олигурию или острое нарушение психического статуса, но не ограничиваются этими признаками. У пациентов, получающих терапию инотропными или вазопрессорными препаратами, гипотонии может и не быть, в то время когда регистрируются нарушения перфузии.
Читайте также:


