Современная диагностика дисбактериоза кишечника
Что понимают под дисбактериозом? Какие методы диагностики являются современными и достоверными? Какие лекарственные препараты применяются при дисбактериозе? Вкишечнике человека находится свыше 500 различных видов микробов, общее количество которых
Вкишечнике человека находится свыше 500 различных видов микробов, общее количество которых достигает 10 14 , что на порядок выше общей численности клеточного состава человеческого организма. Количество микроорганизмов увеличивается в дистальном направлении, и в толстой кишке в 1 г кала содержится 10 11 бактерий, что составляет 30% сухого остатка кишечного содержимого.
В тощей кишке здоровых людей находится до 10 5 бактерий в 1 мл кишечного содержимого. Основную массу этих бактерий составляют стрептококки, стафилококки, молочнокислые палочки, другие грамположительные аэробные бактерии и грибы. В дистальном отделе подвздошной кишки количество микробов увеличивается до 10 7 –10 8 , в первую очередь за счет энтерококков, кишечной палочки, бактероидов и анаэробных бактерий. Недавно нами было установлено, что концентрация пристеночной микрофлоры тощей кишки на 6 порядков выше, чем в ее полости, и составляет 10 11 кл/мл. Около 50% биомассы пристеночной микрофлоры составляют актиномицеты, примерно 25% — аэробные кокки (стафилококки, стрептококки, энтерококки и коринеформные бактерии), от 20 до 30% приходится на бифидобактерии и лактобациллы.
Количество анаэробов (пептострептококки, бактероиды, клостридии, пропионобактерии) составляет около 10% в тонкой и до 20% в толстой кишке. На долю энтеробактерий приходится 1% от суммарной микрофлоры слизистой оболочки.
До 90-95% микробов в толстой кишке составляют анаэробы (бифидобактерии и бактероиды), и только 5-10% всех бактерий приходится на строгую аэробную и факультативную флору (молочнокислые и кишечные палочки, энтерококки, стафилококки, грибы, протей).
Кишечные палочки, энтерококки, бифидобактерии и ацидофильные палочки обладают выраженными антагонистическими свойствами. В условиях нормально функционирующего кишечника они способны подавлять рост несвойственных нормальной микрофлоре микроорганизмов.
Площадь внутренней поверхности кишечника составляет около 200 м 2 . Она надежно защищена от проникновения пищевых антигенов, микробов и вирусов. Важную роль в организации этой защиты играет иммунная система организма. Около 85% лимфатической ткани человека сосредоточено в стенке кишечника, где продуцируется секреторный IgA. Кишечная микрофлора стимулирует иммунную защиту. Кишечные антигены и токсины кишечных микробов значительно увеличивают секрецию IgA в просвет кишки.
Расщепление непереваренных пищевых веществ в толстой кишке осуществляется ферментами бактерий, при этом образуются разнообразные амины, фенолы, органические кислоты и другие соединения. Токсические продукты микробного метаболизма (кадаверин, гистамин и другие амины) выводятся с мочой и в норме не оказывают влияния на организм. При утилизации микробами неперевариваемых углеводов (клетчатки) образуются короткоцепочечные жирные кислоты. Они обеспечивают клетки кишки энергоносителями и, следовательно, улучшают трофику слизистой оболочки. При дефиците клетчатки может нарушаться проницаемость кишечного барьера вследствие дефицита короткоцепочечных жирных кислот. В результате кишечные микробы могут проникать в кровь.
Под влиянием микробных ферментов в дистальных отделах подвздошной кишки происходит деконъюгация желчных кислот и преобразование первичных желчных кислот во вторичные. В физиологических условиях от 80 до 95% желчных кислот реабсорбируется, остальные выделяются с фекалиями в виде бактериальных метаболитов. Последние способствуют нормальному формированию каловых масс: тормозят всасывание воды и тем самым препятствуют излишней дегидратации кала.
В понятие дисбактериоза кишечника входит избыточное микробное обсеменение тонкой кишки и изменение микробного состава толстой кишки. Нарушение микробиоценоза происходит в той или иной степени у большинства больных с патологией кишечника и других органов пищеварения. Следовательно, дисбактериоз является бактериологическим понятием. Он может рассматриваться как одно из проявлений или осложнение заболевания, но не самостоятельная нозологическая форма.
Крайней степенью дисбактериоза кишечника является появление бактерий желудочно-кишечного тракта в крови (бактериемия) или даже развитие сепсиса.
Состав микрофлоры кишечника нарушается при болезнях кишечника и других органов пищеварения, лечении антибиотиками и иммунодепрессантами, воздействиях вредных факторов внешней среды.
Клинические проявления дисбактериоза зависят от локализации дисбиотических изменений.
При дисбактериозе тонкой кишки численность одних микробов в слизистой оболочке тонкой кишки увеличена, а других уменьшена. Отмечается увеличение Eubacterium (в 30 раз), α-стрептококков (в 25 раз), энтерококков (в 10 раз), кандид (в 15 раз), появление бактерий рода Acinetobacter и вирусов герпеса. Уменьшается от 2 до 30 раз количество большинства анаэробов, актиномицетов, клебсиелл и других микроорганизмов, являющихся естественными обитателями кишечника.
Причиной дисбактериоза могут быть: а) избыточное поступление микроорганизмов в тонкую кишку при ахилии и нарушении функции илеоцекального клапана; б) благоприятные условия для развития патологических микроорганизмов в случаях нарушения кишечного пищеварения и всасывания, развития иммунодефицита и нарушений проходимости кишечника.
Повышенная пролиферация микробов в тонкой кишке приводит к преждевременной деконъюгации желчных кислот и потере их с калом. Избыток желчных кислот усиливает моторику толстой кишки и вызывает диарею и стеаторею, а дефицит желчных кислот приводит к нарушению всасывания жирорастворимых витаминов и развитию желчнокаменной болезни.
Бактериальные токсины и метаболиты, например фенолы и биогенные амины, могут связывать витамин В12.
Некоторые микроорганизмы обладают цитотоксическим действием и повреждают эпителий тонкой кишки. Это ведет к уменьшению высоты ворсинок и углублению крипт. При электронной микроскопии выявляется дегенерация микроворсинок, митохондрий и эндоплазматической сети.
Состав микрофлоры толстой кишки может меняться под влиянием различных факторов и неблагоприятных воздействий, ослабляющих защитные механизмы организма (экстремальные климатогеографические условия, загрязнение биосферы промышленными отходами и различными химическими веществами, инфекционные заболевания, болезни органов пищеварения, неполноценное питание, ионизирующая радиация).
В развитии дисбактериоза толстой кишки большую роль играют ятрогенные факторы: применение антибиотиков и сульфаниламидов, иммунодепрессантов, стероидных гормонов, рентгенотерапия, хирургические вмешательства. Антибактериальные препараты значительно подавляют не только патогенную микробную флору, но и рост нормальной микрофлоры в толстой кишке. В результате размножаются микробы, попавшие извне, или эндогенные виды, устойчивые к лекарственным препаратам (стафилококки, протей, дрожжевые грибы, энтерококки, синегнойная палочка).
Клинические проявления чрезмерного роста микроорганизмов в тонкой кишке могут полностью отсутствовать, выступать в качестве одного из патогенетических факторов хронической рецидивирующей диареи, а при некоторых болезнях, например, дивертикулезе тонкой кишки, частичной кишечной непроходимости или после хирургических операций на желудке и кишечнике, приводить к тяжелой диарее, стеаторее и В 12 -дефицитной анемии.
Особенностей клинического течения заболевания у больных с различными вариантами дисбактериоза толстой кишки, по данным бактериологических анализов кала, в большинстве случаев установить не удается. Можно отметить, что больные хроническими заболеваниями кишечника чаще инфицируются острыми кишечными инфекциями по сравнению со здоровыми. Вероятно, это связано со снижением у них антагонистических свойств нормальной микрофлоры кишечника и, прежде всего, частым отсутствием бифидобактерий.
Особенно большую опасность представляет псевдомембранозный колит, развивающийся у некоторых больных, длительно лечившихся антибиотиками широкого спектра действия. Этот тяжелый вариант дисбактериоза вызывается токсинами, выделяемыми синегнойной палочкой Clostridium difficile, которая размножается в кишечнике при угнетении нормальной микробной флоры.
Очень редко наблюдается молниеносное течение псевдомембранозного колита, напоминающее холеру. Обезвоживание развивается в течение нескольких часов и заканчивается летальным исходом.
Таким образом, оценка клинической значимости дисбиотических изменений должна основываться прежде всего на клинических проявлениях, а не только на результатах исследования микрофлоры кала.
Диагностика дисбактериоза представляет собой сложную и трудоемкую задачу. Для диагностики дисбактериоза тонкой кишки применяют посев сока тонкой кишки, полученного с помощью стерильного зонда. Дисбактериоз толстой кишки выявляют с помощью бактериологических исследований кала.
Микробная флора образует большое количество газов, в том числе водорода. Это явление используют для диагностики дисбактериоза. Концентрация водорода в выдыхаемом воздухе натощак находится в прямой зависимости от выраженности бактериального обсеменения тонкой кишки. У больных с заболеваниями кишечника, протекающими с хронической рецидивирующей диареей и бактериальным обсеменением тонкой кишки, концентрация водорода в выдыхаемом воздухе значительно превышает 15 ppm.
Для диагностики дисбактериоза применяют также нагрузку лактулозой. В норме лактулоза не расщепляется в тонкой кишке и метаболизируется микробной флорой толстой кишки. В результате количество водорода в выдыхаемом воздухе повышается (рис. 1).
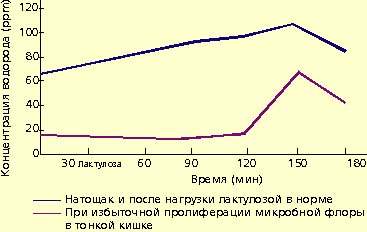 |
| Рисунок 1. Концентрация водорода в выдыхаемом воздухе |
Наиболее частыми бактериологическими признаками дисбактериоза толстой кишки являются отсутствие основных бактериальных симбионтов — бифидобактерий и уменьшение количества молочнокислых палочек. Увеличивается количество кишечных палочек, энтерококков, клостридий, стафилококков, дрожжеподобных грибов и протея. У отдельных бактериальных симбионтов появляются патологические формы. К ним относятся гемолизирующая флора, кишечные палочки со слабо выраженными ферментативными свойствами, энтеропатогенные кишечные палочки и т. д.
Углубленное изучение микробиоценоза показало, что традиционные методы не позволяют получить истинную информацию о состоянии микрофлоры кишечника. Из 500 известных видов микробов в целях диагностики обычно изучаются лишь 10-20 микроорганизмов. Важно, в каком отделе — в тощей, подвздошной или толстой кишках — исследуется микробный состав. Поэтому перспективы разработки клинических проблем дисбактериоза в настоящее время связывают с применением химических методов дифференциации микроорганизмов, позволяющих получить универсальную информацию о состоянии микробиоценоза. Наиболее широко для этих целей используются газовая хроматография (ГХ) и газовая хроматография в сочетании с масс-спектрометрией (ГХ-МС). Этот метод позволяет получить уникальную информацию о составе мономерных химических компонентов микробной клетки и метаболитов. Маркеры такого рода могут быть определены и использованы для детектирования микроорганизмов. Главным преимуществом и принципиальным отличием этого метода от бактериологических является возможность количественного определения более 170 таксонов клинически значимых микроорганизмов в различных средах организма. При этом результаты исследования могут быть получены в течение нескольких часов.
Проведенные нами исследования микробиоценоза в крови и биоптатов слизистой оболочки тонкой и толстой кишок у больных с синдромом раздраженного кишечника позволили обнаружить отклонения от нормы до 30-кратного увеличения или уменьшения многих компонентов. Существует возможность оценки изменений микрофлоры кишечника на основании данных анализа крови методом ГХ-МС-микробных маркеров.
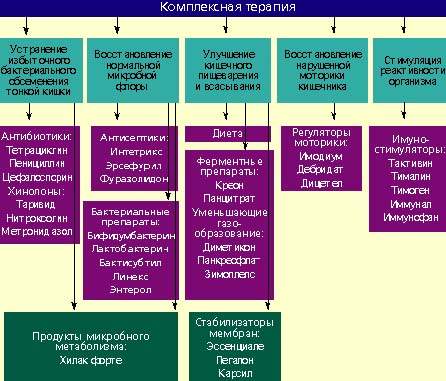 |
Лечение дисбактериоза должно быть комплексным (схема) и включать в себя следующие мероприятия:
- устранение избыточного бактериального обсеменения тонкой кишки;
- восстановление нормальной микробной флоры толстой кишки;
- улучшение кишечного пищеварения и всасывания;
- восстановление нарушенной моторики кишечника;
- стимулирование реактивности организма.
Антибактериальные препараты необходимы в первую очередь для подавления избыточного роста микробной флоры в тонкой кишке. Наиболее широко применяются антибиотики из группы тетрациклинов, пенициллинов, цефалоспорины, хинолоны (таривид, нитроксолин) и метронидазол.
Однако антибиотики широкого спектра действия в значительной степени нарушают эубиоз в толстой кишке. Поэтому они должны применяться только при заболеваниях, сопровождающихся нарушениями всасывания и моторики кишечника, при которых, как правило, отмечается выраженный рост микробной флоры в просвете тонкой кишки.
Антибиотики назначают внутрь в обычных дозах в течение 7–10 дней.
При заболеваниях, сопровождающихся дисбактериозом толстой кишки, лечение лучше проводить препаратами, которые оказывают минимальное влияние на симбионтную микробную флору и подавляют рост протея, стафилококков, дрожжевых грибов и других агрессивных штаммов микробов. К ним относятся антисептики: интетрикс, эрсефурил, нитроксолин, фуразолидон и др.
При тяжелых формах стафилококкового дисбактериоза применяют антибиотики: таривид, палин, метронидазол (трихопол), а также бисептол-480, невиграмон.
Антибактериальные препараты назначают в течение 10–14 дней. В случае появления в кале или кишечном соке грибов показано применение нистатина или леворина.
У всех больных с диареей, ассоциированной с антибиотиками, протекающей с интоксикацией и лейкоцитозом, возникновение острой диареи следует связывать с Cl. difficile.
В этом случае срочно делают посев кала на Cl. difficile и назначают ванкомицин по 125 мг внутрь 4 раза в сутки; при необходимости доза может быть увеличена до 500 мг 4 раза в день. Лечение продолжают в течение 7-10 суток. Эффективен также метронидазол в дозе 500 мг внутрь 2 раза в сутки, бацитрацин по 25 000 МЕ внутрь 4 раза в сутки. Бацитрацин почти не всасывается, в связи с чем в толстой кишке можно создать более высокую концентрацию препарата. При обезвоживании применяют адекватную инфузионную терапию для коррекции водно-электролитного баланса. Для связывания токсина Cl. difficile используют холестирамин (квестран).
Живые культуры нормальной микробной флоры выживают в кишечнике человека от 1 до 10% от общей дозы и способны в какой-то мере выполнять физиологическую функцию нормальной микробной флоры. Бактериальные препараты можно назначать без предварительной антибактериальной терапии или после нее. Применяют бифидумбактерин, бификол, лактобактерин, бактисубтил, линекс, энтерол и др. Курс лечения длится 1-2 месяца.
Возможен еще один способ устранения дисбактериоза — воздействие на патогенную микробную флору продуктами метаболизма нормальных микроорганизмов. К таким препаратам относится хилак форте. Он создан 50 лет назад и до настоящего времени применяется для лечения больных с патологией кишечника. Хилак форте представляет собой стерильный концентрат продуктов обмена веществ нормальной микрофлоры кишечника: молочной кислоты, лактозы, аминокислот и жирных кислот. Эти вещества способствуют восстановлению в кишечнике биологической среды, необходимой для существования нормальной микрофлоры, и подавляют рост патогенных бактерий. Возможно, продукты метаболизма улучшают трофику и функцию эпителиоцитов и колоноцитов. 1 мл препарата соответствует биосинтетическим активным веществам 100 млрд. нормальных микроорганизмов. Хилак форте назначают по 40–60 капель 3 раза в день на срок до 4 недель в сочетании с препаратами антибактериального действия или после их применения.
Совсем недавно появились сообщения о возможности лечения острой диареи, ассоциированной с антибактериальной терапией и Cl. difficile, большими дозами пре- и пробиотиков.
У больных с нарушением полостного пищеварения применяют креон, панцитрат и другие панкреатические ферменты. С целью улучшения функции всасывания назначают эссенциале, легалон или карсил, т. к. они стабилизируют мембраны кишечного эпителия. Пропульсивную функцию кишечника улучшают имодиум (лоперамид) и тримебутин (дебридат).
Для повышения реактивности организма ослабленным больным целесообразно применять тактивин, тималин, тимоген, иммунал, иммунофан и другие иммуностимулирующие средства. Курс лечения должен составлять в среднем 4 недели. Одновременно назначаются витамины.
Первичная профилактика дисбактериоза представляет очень сложную задачу. Ее решение связано с общими профилактическими проблемами: улучшением экологии, рациональным питанием, улучшением благосостояния и прочими многочисленными факторами внешней и внутренней среды.
Вторичная профилактика предполагает рациональное применение антибиотиков и других медикаментов, нарушающих эубиоз, своевременное и оптимальное лечение болезней органов пищеварения, сопровождающихся нарушением микробиоценоза.
Дисбактериоз – клинические проявления

Как правило, устанавливают диагноз дисбактериоз на основе клинической картины развития заболевания. Основными клиническими проявлениями заболевания, которые общие, как и для взрослых, так и детей, являются:
- нарушение общего самочувствия (обезвоживание, интоксикация);
- снижение веса;
- симптомы поражения слизистых желудочно-кишечного тракта;
- нарушение процессов пищеварения в любом из отделов ЖКТ.
Однако для того чтобы был установлен точный диагноз необходима лабораторная диагностика дисбактериоза.
Современные методы диагностики дисбактериоза
В современной медицине существует множество методов диагностики нарушения микрофлоры кишечника. Разделяют два типа диагностики дисбаланса флоры: прямые и косвенные.
Прямые способы диагностики дисбактериоза
Сегодня самым распространенным лабораторным методом исследования выступает бактериологический анализ кала на дисбактериоз (посев). Однако общую картину состояния пациента данный анализ не дает, так как он показывает лишь состояние тех микробов, что расположены в толстой кишке, а точнее в его конечно отделе. К сожалению, о состоянии микрофлоры тонкого кишечника данный анализ рассказать абсолютно не сможет.
Более того, бактериологическая диагностика дисбактериоза кишечника представляет заключение минимум 14, а максимум 25 видов бактерий, несмотря на то, что в кишечнике обитает их более четырех сотен.
Получение достоверных результатов посева на дисбактериоз возможно лишь при условии полной стерильности, правильной транспортировке материала (соблюдение необходимого температурного режима), а также проведение анализа фекалий спустя не более трех часов после их забора. К огромному сожалению, в наши дни такими условиями могут располагать лишь единицы лабораторий и именно по этой причине, как правило, получаемые результаты анализов уже искажены.
Однако, несмотря на это данный метод диагностики дисбактериоза имеет явное преимущество. В сравнении с другими видами анализов, проводимых при установлении дисбаланса кишечника, он самый дешевый и при его помощи можно определить количество и вид микробов. Правда, длительность проведения составляет одну неделю.
О состоянии флоры тонкого кишечника можно получить информацию после посева биоптата стенок кишечника либо аспирата, который содержится в нем. Правда, данные исследования довольно сложные с технической стороны и их проводят исключительно в крайних случаях.
В последние годы все больше используют ПЦР-диагностику дисбактериоза (полимеразная цепная реакция). Популярен метод тем, что он весьма универсален, а именно для проведения данного исследования нет четких требований к материалу.
При исследовании кала на дисбактериоз при помощи ПЦР-диагностики в применяемом материале выделяют фрагмент ДНК либо РНК возбудителя. При этом стоит отметить, что выделенный фрагмент характерен лишь определенного возбудителя. В дальнейшем его достраивают до тех размеров, которые будут достаточны для визуальной регистрации.
Еще одной особенностью данного метода лабораторного исследования выступает его быстрота проведения. К тому же, при его помощи определяется наличие бактерии, если она даже присутствует только в одной клетке и расположена не рядом с просветом кишечника. Правда, данный анализ может быть точным при условии, что патогенные вирусы и бактерии известны. Другими словами круг исследования достаточно ограничен. В связи с этим ПЦР-диагностику проводят с целью определения проявившей себя инфекции.
Косвенные способы диагностирования дисбактериоза кишечника

- газожидкостной хроматографии, которая помогает определить в фекалиях наличие жирных летучих кислот;
- масс-спектрометрие.
Такая диагностика дисбактериоза кишечника позволяет определить от 35 до 40 показателей. К преимуществам косвенного химического исследования баланса микрофлоры относят:
- диагностирование анаэробной инфекции, которая на открытом воздухе погибает;
- одновременное оценивание живых и мертвых организмов;
- малые концентрации клеток вирусов и бактерий независимо от их происхождения;
- короткие сроки проведения анализа, так как максимальное время его проведения составляет всего три часа.
Однако, несмотря на положительные стороны данного исследования, существуют его и отрицательные, а именно:
- для анализа различных видов бактерий требуется проведения неоднократных исследований;
- высокая цена оборудования;
- сложность исследования с технической стороны.
Еще одни, правда, не популярные методы диагностики дисбактериоза выступают дыхательные тесты, при помощи которых возможно определить наличие патогенных микроорганизмов у человека, не прибегая к забору фекалий. Исследования проводятся выдыхаемого воздуха. Однако данный метод предполагает высокую вероятность ошибки. В связи с этим проведение дыхательного исследования используется для установления предварительных результатов.
Напоследок стоит подчеркнуть, что в наши дни диагностика дисбактериоза кишечника весьма сложная процедура. Причиной тому выступает отсутствие подлинной информации о нормальном составе микрофлоры кишечника, так как его изменения возможны из-за перемен погоды и климата. На кишечный баланс также влияет и смена рациона питания. В связи с этим результатов, которые дают возможность сделать однозначный вывод, современные методы диагностики не имеют. Все лаборатории руководствуются существующими условными данными, поэтому многие анализы на дисбактериоз обнаружат наличие заболевание даже при временных отклонениях.



Поиск
Современные методы диагностики дисбактериоза кишечника
В статье представлен современный взгляд на проблему дисбактериоза кишечника у детей, методы диагностики и их трактовка. Представлены собственные исследования характера микрофлоры кишечника по содержанию Ig-расщепляющей (протеолитической) активности фекалий у 133 детей с хронической гастродуоденальной патологией. Показано, что метод может быть полезным для характеристики кишечной микробиоты.
The article presents a modern approach to the problem of intestinal dysbiosis in children, methods of diagnosis and treatment. Presented own research into the nature of intestinal microflora on the content of Ig-cleaving (proteolytic) activity of fаeces in 133 children with chronic gastroduodenal pathology. It is shown that the method may be useful for the characterization of intestinal microbiota.
В настоящее время не вызывает сомнений тот факт, что изменение количественного и качественного состава микрофлоры кишечника практически всегда сопровождает любое неблагополучие в пищеварительной системе. Не отвечая критериям самостоятельной нозологической единицы, дисбактериоз кишечника является как следствием, так и одним из звеньев патогенеза патологии желудочно-кишечного тракта. С одной стороны, дисбактериоз кишечника всегда вторичен, поскольку возникает при любом изменении внутренней среды кишки вследствие действия патогенных факторов или прямого влияния на кишечную микрофлору. С другой стороны, дисбактериоз кишечника сам может приводить к повреждению кишечного эпителия, тем самым нарушая процессы пищеварения и усугубляя клиническое течение заболеваний желудочно-кишечного тракта.
В настоящей статье мы коснемся преимущественно диагностики нарушений микроэкологии толстого кишечника.
Толстая кишка представляет собой биотоп с высокой степенью обсемененности. В ней обнаружено более 400 видов микроорганизмов. Показано преобладание анаэробной микрофлоры, представленной на 90% бактероидами и бифидобактериями (главная флора). Аэробы составляют 10% — кишечные палочки, лактобациллы, энтерококки и др. (сопутствующая флора). Остаточная флора, составляющая менее 1% от общего количества микроорганизмов, представлена клебсиеллами, протеем, дрожжами, клостридиями, энтеробактером и цитробактером и др. Необходимо отметить одну особенность микрофлоры толстого кишечника — по мере продвижения от проксимальных отделов к дистальным увеличивается ее обсемененность. В проксимальном отделе общее число микроорганизмов составляет 10 8 -10 9 , а в прямой кишке — 10 11 -10 12 в 1 г кала. Более 90% массы кала приходится на бактерии. Нормальная микрофлора кишечника колонизирует как просвет кишечного тракта, так и поверхность слизистой оболочки кишки, формируя при этом пристеночную или мукозную микрофлору (М-микрофлора) и полостную микрофлору (П-микрофлора). Основную защитную функцию выполняет мукозная микрофлора [1, 2, 3, 4].
На сегодня существуют следующие методы лабораторной диагностики дисбактериоза кишечника [2, 4]:
1. Бактериологический анализ (определение состава фекальной микрофлоры, отражающей микробный состав лишь дистальных отделов кишечника — наиболее доступный метод, однако недостаточно точный).
2. Биохимический экспресс — метод определения протеолитической активности супернатантов фекалий.
3. Высоковольтный электрофорез на бумаге для обнаружения β-аспартилглицина, β-аспартиллизина, β-аланина, 5-аминовалериановой и γ-аминомасляной кислот и др.
4. Ионная хроматография, определяющая в фекалиях биогенные амины, желчные и карбоновые кислоты, ароматические соединения.
5. Газожидкостная хроматография для определения в фекалиях летучих жирных кислот.
6. Микроскопия фекального мазка.
В результате многолетнего изучения кишечной микрофлоры Р.В. Эпштейн-Литвак и Ф.Л. Вильшанская (1970) разработали методы лабораторной диагностики дисбактериоза, основанные на бактериологическом исследовании кала. Эти методы до сих пор существуют практически в неизмененном виде и широко применяются. Но у данного метода есть недостатки. Бактериологическое исследование кала отражает микробный состав полостной флоры лишь дистальных отделов кишечника. Обычно метод предоставляет информацию о 15-20 видах микробов. Число культивируемых кишечных анаэробных бактерий не превышает 7-50% от предполагаемого их истинного количества. В тени остается около 500 видов анаэробов и состав тонкокишечной микрофлоры. Невозможно идентифицировать бактериологическим методом простейших, грибы и вирусы. К тому же данный метод не дает качественной характеристики микробиоценоза. Хочется отметить, чтобы выделить всеми доступными современной медицине методами все возможные виды микрофлоры и составить их развернутую бактериологическую характеристику, потребовалось бы не менее одного года [5, 6]. В литературе также имеются сообщения, подтверждающие низкую диагностическую ценность исследования кала на дисбактериоз [7].
Ниже приведена классификация дисбактериоза кишечника, предложенная И.Б. Куваевой и К.С. Ладодо в 1991 году [8]. Данная классификация базируется на данных бактериологического исследования кала и клинической симптоматике, которая, как правило, неспецифична.
Классификация дисбактериоза кишечника по И.Б. Куваевой и К.С. Ладодо (1991)
| Первая степень | Латентная фаза дисбиоза: проявляется только в снижении на 1-2 порядка количества защитной микрофлоры — бифидобактерий, лактобацилл, а также полноценных кишечных палочек — до 80% от общего количества. Остальные показатели соответствуют физиологической норме (эубиозу). Как правило, начальная фаза не вызывает дисфункций кишечника и возникает как реакция организма практически здорового человека на воздействие неблагоприятных факторов, таких как, например, нарушение режима питания и др. В этой фазе возможно вегетирование в кишечнике незначительного количества отдельных представителей условно-патогенной флоры. Клинических проявлений дисбактериоза в этой фазе нет. |
| Bторaя степень | Пусковая фаза более серьезных нарушений характеризуется выраженным дефицитом бифидобактерий на фоне нормального или сниженного количества лактобацилл или сниженной их кислотообразующей активности, дисбалансом в количестве и качестве кишечных палочек, среди которых нарастает доля лактозонегативных или цитрат-ассимилирующих вариантов. При этом на фоне дефицита защитных компонентов кишечного микробиоценоза происходит размножение либо плазмокоагулирующих стафилококков, либо протеев, либо грибов рода Candida. Вегетирование в кишечнике протеев или плазмокоагулирующих стафилококков в этой фазе развития дисбактериоза чаще транзиторное, чем постоянное. Функциональные расстройства пищеварения выражены неотчетливо — спорадически жидкий стул зеленоватого цвета с неприятным запахом, со сдвигом рН в щелочную сторону, иногда, напротив, задержка стула, иногда отмечается тошнота. |
| Третья степень | Фаза агрессии аэробной флоры характеризуется отчетливым нарастанием содержания агрессивных микроорганизмов — при этом размножаются до десятков миллионов в ассоциации золотистые стафилококки и протеи, гемолитические энтерококки, наблюдается замещение полноценных эшерихий бактериями родов Klebsiella, Enterobacter и др. Эта фаза дисбактериоза проявляется дисфункциями кишечника с расстройствами моторики, секреции ферментов и всасывания. У больных отмечается учащенный разжиженный стул, часто зеленого цвета, снижение аппетита, ухудшение самочувствия, дети становятся вялыми, капризными. |
| Четвертая степень | Фаза ассоциативного дисбиоза характеризуется глубоким разбалансированием кишечного микробиоценоза с изменением количественных соотношений основных групп микроорганизмов, изменением их биологических свойств, накоплением токсических метаболитов. Характерно вегетирование энтеропатогенных серотипов E.coli, сальмонелл, шигелл и других возбудителей острых кишечных инфекций. Возможно размножение клостридий. Эта фаза дисбиоза характеризуется функциональными расстройствами пищеварительной системы и нарушениями общего нутритивного статуса, дефицитом массы тела, бледностью кожных покровов, снижением аппетита, частым стулом с примесью слизи, зелени, иногда крови, с резким гнилостным или кислым запахом. |
Несмотря на введение в микробиологическую практику новых усовершенствованных методов исследования, до сих пор четкой границы между микробиоценозом кала здоровых и больных лиц так и не выявлено. Каловый микробиоценоз является сложным и динамичным. Состав и количество бактерий широко варьируют.
В последних исследованиях, посвященных анализу микробиоценоза кала, используется метод флуоресцентной гибридизации ДНК in situ (FISH). Количественный анализ бактериального состава и интенсивности свечения в центральных участках образца фекалий, на поверхности и в слизи позволили различить особенности биологической структуры кала здоровых и больных. Особенностью данных исследований является то, что исследуются не гомогенизированные образцы, а цилиндрические образцы кала, полученные от больных, так как при гомогенизации бактерии равномерно распределяются в образце, чего не бывает в естественных условиях [9].
Существуют и другие методы диагностики дисбактериоза кишечника, основанные на определении метаболитов кишечной микрофлоры [2]. Эти соединения разделены на 4 группы. В первую группу входят индикан, n-крезол, фенол. Индикан расщепляется индол-положительными микробами, n-крезол, фенол — анаэробными и аэробными микроорганизмами. Вторая группа включает H2, СН4, СО2, С2-С6 жирные кислоты. Это метаболиты строгих анаэробов. Третью группу составляют деконъюгированные желчные кислоты — метаболиты бактероидов, бифидобактерий, клостридий, стрептококков и энтеробактерий. Аммиак входит в четвертую группу, является метаболитом грамположительных и грамотрицательных анаэробов, энтеробактерий и стрептококков.
Для определения метаболитов кишечной микрофлоры используются такие методы, как газо-жидкостная, высокоэффективная жидкостная хроматография, к сожалению, не всегда доступные в повседневной клинической практике.
В настоящее время идентифицирован ряд факторов кишечной микрофлоры, обеспечивающих персистенцию и колонизацию симбионтной и условно-патогенной микрофлоры. К таким факторам относятся ферменты, которые формируют устойчивость некоторых представителей кишечной микрофлоры к действию секреторных антител [10]. Накоплены данные о том, что ферменты, способные расщеплять секреторные иммуноглобулины слизистых оболочек, способствуют колонизации эпителия патогенными бактериями. В связи с этими фактами в последнее время были предложены и апробированы скрининговые биохимические методы оценки состояния микробиоценоза кишечника по уровню протеолитической, Ig-расщепляющей активности супернатантов фекалий [6, 11, 12]. Эти методы диагностики дисбиоза основаны на том, что различные таксономические виды бактерий, колонизирующие разные отделы кишечника, обладают неодинаковой протеолитической способностью. Как правило, индигенная микрофлора кишечника человека и его фекалий, в частности бифидо- и лактофлора, обладает выраженной сахаралитической, нежели протеолитической активностью. Возрастание суммарной протеолитической активности супернатантов фекалий тесно связано с увеличением количественного содержания многих видов условно-патогенных бактерий в кишечнике или с возрастанием доли бактерий, продуцирующих протеолитические энзимы, колонизирующих стенку кишечника. IgА-протеазы — секретируемые факторы бактериальной природы. Они представляют собой специфические энзимы, расщепляющие IgА на классические Fab- и Fc-фрагменты, лишая его тем самым антительных свойств [10].
Протеолитическая активность, в том числе иммуноглобулин-расщепляющая активность, выявлена у многих видов патогенных и условно-патогенных бактерий, грибов и простейших, способных колонизировать кишечник. Выделены IgA-протеиназы у представителей семейства энтеробактерий: Proteus spp, Serratia marcescens, Klebsiella ozaenae, Klebsiella pneumonie, E. Coli, Shigella spp., Salmonella spp. Грамположительная кокковая микрофлора кишечника — S. aureus, S. epidermidis, Enterococcus faecalis — также способна к продукции Ig-расщепляющих протеиназ [12, 13]. IgA-протеиназы индуцируют грибы рода Candida. Изучены протеолитические ферменты, являющиеся факторами вирулентности, у таких простейших, как Lamblia intestinalis [14]. Некоторые представители фекальной микрофлоры здоровых людей: Streptococcus faecalis, Staphyloccocus spp. Propionibacterium acnes, Cl. perfringens, Cl. bifermentas, Cl. sporogenes, Cl. ramnosum, Bacteroides spp. Bifidobacterium spp. — также обладают протеолитической активностью [12, 13]. Вероятно, эта способность вносит свой вклад в вирулентность нормальной микрофлоры, которая, как известно, появляется при дисбактериозе кишечника наряду со снижением антагонистических свойств.
Возрастание суммарной протеолитической активности тесно связано с увеличением количественного содержания многих видов условно-патогенных бактерий в кишечнике и/или с возрастанием доли бактерий, продуцирующих протеолитические энзимы, колонизирующих стенку кишечника [11, 12].
Способность продуцировать IgА протеиназы характерна в основном для патогенных микроорганизмов и является тем условием, которое обеспечивает существование микробов на слизистых поверхностях [10].
Патогенность микробных протеиназ обусловлена не только их деградирующей активностью в отношении антител, но и способностью непосредственно повреждать эпителиальные клетки слизистых оболочек и активировать гемокоагуляционные механизмы в очаге воспаления [15, 16, 17]. Некоторые из бактериальных протеиназ способны снижать жизнеспособность энтероцитов кишечника и повреждать защитный барьер слизистых [18, 19]. Протеолитическая активность исследовалась при патологических состояниях. Так, изучен протеолитический потенциал фекалий при колитах, болезни Крона, в детском возрасте — при кишечной инфекции и дисбактериозах [11, 12, 20, 21, 22, 23]. Было показано, что положительные протеолитические (казеинолитические) пробы, причем высокой степени активности, чаще выявлялись в группе детей с превалирующим выделением различных видов условно-патогенных бактерий и выраженными изменениями микроэкологии кишечника [11]. Протеолитическая активность фекалий нарастала с увеличением содержания в фекалиях гемолитических E. Coli, бактерий рода Proteus, Staphyloccocus и их ассоциаций с псевдоманадами, клебсиеллами, серрациями, гафниями и грибами рода Candida. Во всех случаях, когда в микрофлоре находили бактерии рода Proteus в количестве 5 lg КОЕ/г и выше, протеолитическая активность супернатантов была высокой.
Особый интерес представляет исследование, в котором изучалась Ig-расщепляющая активность микрофлоры кишечника по профилю протеиназ в норме и при патологических состояниях [12]. Выявлено, что условно-патогенная микрофлора обладает более выраженным агрессивным потенциалом, обусловленным Ig-протеолитической активностью по сравнению с бифидофлорой. Уровень иммуноглобулин — расщепляющей активности фекалий у детей с нарушениями микроэкологии кишечника — был выше, чем у детей с эубиозом.
Таким образом, методы, позволяющие оценить уровень протеолитической активности фекалий, косвенно характеризуют возникающий дисбаланс в составе не только фекальной, но и пристеночной тонко- и толстокишечной микрофлоры, показывают ее качественные изменения.
Нами проведено исследование Ig-расщепляющей (протеолитической) активности фекалий у 133 детей с хронической гастродуоденальной патологией. Для изучения активности протеиназ, дети были разделены на 3 группы. Первую группу (55 больных) составили дети с неэрозивными гастродуоденитами, вторую группу (31 больной) — больные эрозивными гастродуоденитами, третью — дети с язвенной болезнью двенадцатиперстной кишки (33 человека). Результаты представлены в таблице 2.
Активность протеолитических ферментов у детей с гастродуоденальной патологией
Протеоли-тическая активность ферментов
Группы детей с гастродуоденальной патологией
Читайте также:


