Резистентность при инфекционных заболеваниях

В статье обсуждается проблема затяжного осложненного течения острой респираторной инфекции, несмотря на проводимую в соответствии с имеющимися на сегодняшний день рекомендациями терапию. Описан случай неэффективности противовирусной и стандартной антибакт
The article covers the issue of clinical course of prolonged, acute respiratory infection, in spite of the therapy conducted according to the current guidelines. A case of antiviral and standard antibacterial therapy inefficiency in a patient was described. The clinical case demonstrates that community-acquired pneumonia may develop if there is no estimated effect in the relevant scheme of treatment, and the repeated course of etiotropic drug combination is required, as well as mucolytic and disintoxication therapy.
Острые респираторные инфекции (ОРИ) на сегодняшний день остаются самой распространенной патологией среди всех категорий населения [1, 2]. Многочисленные данные свидетельствуют о значительном влиянии возбудителей на сердечно-сосудистую систему, что напрямую определяет исход заболевания. Наибольшее число осложнений, сопровождающихся летальными исходами, регистрируется при гриппе и пневмококковой инфекции. Были проведены экспериментальные исследования, доказавшие неблагоприятное действие на миокард токсинов Streptococcus pneumoniae у лабораторных животных [3]. Результаты работы подтвердили ранее известные данные о значительном числе случаев нарастания сердечной недостаточности и появления различных вариантов нарушений ритма у пациентов с пневмококковой этиологией внебольничных пневмоний. У зараженных животных в миокарде были обнаружены участки поражения клеток, сопровождавшиеся нарушениями ритма и проводимости, повышением тропонина в сыворотке крови и отложением коллагена в местах повреждений после начала антибактериальной терапии. Отсутствие эффективного лечения приводит к распространенному поражению сердечной мышцы и/или прогрессированию аритмии, что может провоцировать неблагоприятный исход.
В этих ситуациях, безусловно, необходимо применение надежного антибактериального препарата и дезинтоксикационной терапии. На сегодняшний день чрезмерное использование антибиотиков привело к росту устойчивости возбудителей. Ранее проведенные исследования указывали на высокую, по ряду данных, абсолютную чувствительность пневмококка к амоксициллину и левофлоксацину, что позволяло их рекомендовать в группах риска тяжелого течения пневмоний [4, 5].
Однако в настоящее время ситуация изменилась, что иллюстрирует следующий клинический пример.
Пациентка К., 60 лет, обратилась к терапевту с жалобами на слабость, першение в горле, насморк с небольшим количеством водянистых выделений, сухой кашель.
Из анамнеза: заболела 3 дня назад, когда появились указанные жалобы. Температура тела за эти дни не повышалась, однако симптомы усиливались. Контакты с инфекционными больными отрицает. Вакцинирована против гриппа 2 месяца назад (в октябре), других вакцин за последние 10 лет не получала. Аллергических реакций ранее не отмечала. За предшествующий заболеванию год получила 6 курсов антибактериальной терапии, из них — за 1 месяц до настоящего заболевания — амоксициллина клавуланат для лечения пульпита.
Сопутствующая патология: гипертоническая болезнь 2-й стадии, ишемическая болезнь сердца, остеохондроз, артрозо-артрит. Постоянно принимает валсартан 80 мг в сутки, лерканидипин 10 мг в сутки, ацетилсалициловую кислоту (ТромбоАСС) 100 мг в сутки, розувастатин 10 мг в сутки. Дополнительно, почти ежедневно в течение года, употребляет ибупрофен 400 мг или парацетамол 500 мг для купирования болевого синдрома в области коленных и плечевых суставов, в сумме 5–10 таблеток за неделю.
При осмотре: состояние удовлетворительное. Дыхание через нос затруднено. Зев умеренно гиперемирован, миндалины не визуализируются. При аускультации в легких дыхание жесткое, проводится равномерно, хрипов нет. Тоны сердца звучные, ритмичные, 75 ударов в минуту. Стул, мочеиспускание — в норме.
Диагноз: острая респираторная вирусная инфекция.
Назначено: имидазолилэтанамид пентандиовой кислоты (Ингавирин) 90 мг в сутки, полоскания горла и промывания носа солевыми растворами — 4 раза в сутки. Режим — домашний.
Через 3 суток (7-й день болезни/2-й осмотр) на фоне лечения состояние с некоторым ухудшением: появились осиплость голоса, потливость. Дополнительных контактов с инфекционными больными не было. Температура тела по-прежнему в норме.
При осмотре: состояние удовлетворительное. Дыхание через нос слегка затруднено. Аускультативно в легких жесткое дыхание с единичными рассеянными сухими хрипами, в остальном — без существенной динамики.
Диагноз: острое респираторное заболевание, острый бронхит.
К терапии добавлены левофлоксацин 500 мг в сутки, амброксол 90 мг в сутки.
Через 7 суток от начала лечения (11-й день болезни/3-й осмотр) на фоне лечения отмечена отрицательная динамика: отмечает усиление сухого кашля, осиплости голоса. Новые контакты с инфекционными больными отрицает. Температура тела сохраняется в норме.
При осмотре: состояние удовлетворительное. Дыхание через нос свободное. Зев слегка гиперемирован. В легких — дыхание жесткое, сухие, в нижних отделах обструктивные хрипы. Тоны сердца звучные, ритмичные, 84 удара в минуту.
Диагноз: острый обструктивный бронхит, аллергическая реакция.
Терапия: Беродуал, Пульмикорт — ингаляторно, Супрастин. Ранее назначенные препараты отменены.
Через 9 суток от начала лечения (13-й день болезни/4-й осмотр). На фоне лечения — отрицательная динамика: отмечает усиление слабости, кашля с отхождением желтовато-зеленоватой мокроты, осиплость голоса сохраняется; температура тела устойчиво в норме.
При осмотре: состояние средней тяжести. Дыхание через нос свободное. Зев гиперемирован. В легких — дыхание жесткое, ослаблено в нижних отделах, там же выслушиваются влажные и сухие хрипы. ЧСС — 95 ударов в мин.
По данным лабораторной диагностики, методом полимеразной цепной реакции в мокроте выявлены S. pneumoniae, а также вирусы парагриппа 4-го типа и коронавирус NL-63, 229E. По результату анализа крови: лейкоциты — 12,5 × 10 9 /л, нейтрофилы — 70%, палочкоядерные — 3%, сегментоядерные — 67%, лимфоциты — 21%, моноциты — 7%, СОЭ — 18 мм/ч.
Диагноз: двусторонняя пневмония (подтвержден рентгенологически).
Терапия: цефтриаксон 1,0 внутримышечно 1 раз в сутки, кларитромицин 0,5 перорально — 2 раза в сутки, инозина пранобекс 1,0–3 раза в сутки, ацетилцистеин 0,6 в сутки, пробиотик, биологически активная добавка (БАД) Зостерин-Ультра 60 (0,5 г) 2 раза в сутки. На фоне терапии со вторых суток отмечена положительная динамика, через 7 дней антибактериальная терапия завершена, через 21 день отмечено выздоровление.
По-видимому, отсутствие одного из основных клинических симптомов острой респираторной инфекции — повышения температуры тела — стало следствием регулярного приема нестероидных противовоспалительных препаратов. С одной стороны, эта терапия нивелирует лихорадочный синдром, а с другой, безусловно, способствует затяжному течению с развитием осложнений, что является прямым следствием подавления закономерных воспалительных реакций, способствующих элиминации возбудителей. Учитывая клиническую картину в начале заболевания и имеющиеся на сегодняшний день данные об эффективности противовирусной терапии, Ингавирин был назначен правильно [6]. Однако последующие результаты обследования пациентки свидетельствовали о сохранении вирусовыделения, несмотря на проведенный 7-дневный курс. Добавление к схеме при отсутствии эффекта антибиотика из группы резерва, с учетом недавних повторных курсов антибактериальной терапии в анамнезе, также не противоречит общепринятой тактике ведения пациентов. Широкий спектр бактерицидной активности левофлоксацина позволяет его относить к достаточно надежным лекарственным средствам. Добавление муколитика амброксола при таких симптомах, как правило, повышает эффективность антибактериальных средств. Отсутствие положительного результата на этом этапе, наиболее вероятно, связано с развитием резистентности пневмококка (S. pneumoniae). Устойчивость возбудителя может быть обусловлена повторными короткими курсами антибактериальной терапии при бактерионосительстве. На этом фоне отмена этиотропной терапии с назначением препаратов с бронхолитическим и активным противовоспалительным действием способствовала активному размножению микроорганизмов и распространению их по нижним дыхательным путям с развитием пневмонии.
Последующее лечение проведено по схемам, принятым для ситуаций с неэффективной стартовой терапией. Противововирусный препарат инозина пранобекс имеет широкий спектр действия против большого числа ДНК- и РНК-содержащих вирусов, в том числе против коронавирусов и вирусов парагриппа, выявленных у пациентки. Препарат имеет дополнительное иммуномодулирующее и антиастеническое действие, помогающее в лечении таких больных.
При ведении пациентов с затяжными инфекционно-воспалительными процессами на фоне хронической патологии с применением комплекса лекарственных средств базисной и дополнительной терапии, сочетанной этиологии, обусловленной наличием двух и более возбудителей, необходима активная дезинтоксикационная терапия. В отсутствие адекватной коррекции возможно ухудшение состояния, в первую очередь сердечно-сосудистой системы, с последующей декомпенсацией фонового заболевания вплоть до летального исхода. При этом введение избыточного количества жидкости, как парентерально, так и перорально, нередко сопровождается нарастанием отечного синдрома, застойными явлениями по малому кругу кровообращения и возможным развитием отека легких. В таких ситуациях необходимо ориентироваться на терапию с помощью энтеросорбентов. Выбранная группа БАД Зостерин-Ультра, помимо этого действия, имеет и свойства гемосорбента. Это действие обусловлено наличием в его составе рамногалактуронана, обладающего низкой степенью метоксилирования. Известно, что неметоксилированные участки соединяются с положительно заряженными молекулами тяжелых металлов, радионуклидов, токсинов, забирая их из окружающей среды, в том числе из крови или из содержимого кишечника. Дополнительное разветвление молекулы в области ксилогалактуронана позволяет образовывать сетчатую ячеистую структуру, в которой захватываются и прочно удерживаются токсичные вещества. В то же время эта молекула является естественной для человека, присутствующей в ежедневном питании. Особая технология изготовления группы БАД Зостерин-Ультра из морской травы без применения каких-либо химических веществ позволяет во много раз повысить концентрацию действующего вещества и получить контролируемый результат лечения пациентов [7]. Помимо рамногалактуронана, группа БАД Зостерин-Ультра содержит апиозу, арабинозу, рамнозу, рибозу, галактозу и маннозу. Апиоза отсутствует в наземных растениях, обладает свойством устойчивости к действию ферментов желудочно-кишечного тракта, что сохраняет макромолекулу в ее неизмененном виде на протяжении всего желудочно-кишечного тракта.
Таким образом, в настоящее время наблюдается нарастание резистентности возбудителей острых респираторных инфекций к проводимой этиотропной терапии. При этом растет риск развития осложнений и неблагоприятных исходов, особенно среди пациентов пожилого возраста с хронической коморбидной патологией. В лечении таких больных необходимо учитывать стертость клинической симптоматики на фоне постоянного приема противовоспалительных препаратов, что способствует затяжному и тяжелому течению. Активный инфекционно-воспалительный процесс, в особенности при неэффективности стартовой терапии и необходимости продолжения приема препаратов по хроническому заболеванию, требует включения в схемы терапии сорбентов. Наибольший результат может быть достигнут при назначении средств комплексного энтеро- и гемосорбирующего действия, которыми обладает группа БАД Зостерин-Ультра.
Литература
Т. А. Руженцова 1 , доктор медицинских наук, профессор
Д. С. Левицкая, кандидат медицинских наук
Е. К. Шушакова
ФБУН ЦНИИЭ Роспотребнадзора, Москва
Резистентность возбудителей острых респираторных инфекций в клинической практике/ Т. А. Руженцова, Д. С. Левицкая, Е. К. Шушакова
Для цитирования: Лечащий врач № 11/2019; Номера страниц в выпуске: 29-31
Теги: респираторная инфекция, осложнения, этиотропная терапия
Неспецифическая резистентность организма при инфекции. Фагоцитоз и гуморальные факторы неспецифической устойчивости. Их недостаточность в динамике инфекционного процесса.
Определение: под неспецифической резистентностью понимают так называемый врожденный иммунитет. Это конституциональные факторы, определяющие восприимчивость или невосприимчивость того или иного вида к тому или иному агенту (механизмы неясны) и неспецифические антимикробные системы, активность которых не зависит от предварительного контакта с антигеном.
К этим системам относятся:
* кожа и слизистые организма, а также их секреты.
* системы внеклеточного уничтожения - естественные киллеры (НК) и эозинофилы.
* гуморальные факторы - система комплемента и белки острой фазы.
Кожа и слизистые организма и их секреты.
Следует отметить, что первыми барьерами на пути инфекции являются контактные поверхности (кожа, слизистые) и естественные секреты:
1. неповрежденная кожа непроницаема для большинства инфекционных агентов
2. пот и секрет сальных желез имеет низкий рН за счет молочной кислоты и жирных кислот
3. слизь, выделяемая слизистыми, препятствует прикреплению бактерий к эпителиальным клеткам, которые затем удаляются механическим путем - движение ресничек эпителия, кашель, чихание.
4. многие секреты содержат бактерицидные компоненты (кислота желудочного сока, спермин и цинк в сперме, лактопероксидаза в молоке и лизоцим в слезах, носовых выделениях и слюне)
5. нормальная бактериальная флора человека конкурирует с патогенными микроорганизмами за питательные в-ва, а также продуцирует колицины и кислоты.
Если же микробы все-таки проникли в организм, то в действие вступают клеточные и гуморальные звенья неспецифической резистентности.
Захват и переваривание микроорганизмов осуществляются двумя типами клеток, которые И.И. Мечников определил как микро- и макрофаги.
Микрофаги - ПЯЛ, или нейтрофил, неделящаяся короткоживущая клетка. Локализация: кровь ( основная) и очаги острого воспаления. Имеют 3типа гранул:
1. первичные азурофильные гранулы (миелопероксидаза, лизоцим и набор катионных белков)
2. вторичные “специфические” гранулы (лактоферрин, лизоцим , белок, связывающий витамин В12)
3. третичные гранулы (похожи на обыкновенные лизосомы - содержат кислые гидролазы)
Макрофаги образуются из промоноцитов костного мозга, которые после дифференцировки в моноциты крови в конце концов задерживаются в тканях в виде зрелых макрофагов, где и формируют систему мононуклеарных фагоцитов (СМФ: гистиоциты соединительной ткани, клетки Купфера, микроглия, МФ лимфатических узлов, альвеолярные МФ, остеокласты, МФ селезенки, синовиальные МФ, мезангиальные клетки почечных клубочков).
Механизм и стадии фагоцитоза:
2) Адгезия микроба, инвагинация клеточной мембраны, захват частицы и ее погружение в протоплазму.
Адгезия микроба на поверхности фагоцита происходит, видимо, за счет взаимодействия углеводных остатков. Считают, что в отличие от пиноцитоза, протекающего постоянно, фагоцитоз - это явление индуцируемое. Сигналом являются мембранные взаимодействия фагоцитоза и микроба, при этом происходит активация актин-миозиновой сократительной системы, что приводит к образованию вокруг частички псевдоподий. Считается, что втяжение мембраны и образование пузырька происходит за счет взаимодействия клатрина с другими мембранными белками. После образования пузырька эти белки отщепляются и возвращаются в цитоплазматическую мембрану для образования новых окаймленных ямок. Показано, что цитоплазматическая мембрана надвигается на частичку подобно застежке-молнии за счет рецепторных взаимодействий. Затем происходит слипание бислоев и объединение бислоев мембраны. Механизм этого процесса также до конца неясен. Известно, что для того, чтобы мембраны слились требуется вытеснение молекул воды и сближение мембран до расстояния 1,5нм. Это энергетически очень невыгодный процесс. Поэтому вероятно, что слияние катализируется особыми гидрофобными белками слияния. Эти соединения у человека не идентифицированы. У мембраносодержащих вирусов подобные соединения играют ключевую роль в проникновении в инфицируемую ими клетку. Если встроить гены, кодирующие вирусные белки слияния в эукариотические клетки, то после инкубации при низких рН клетки сливаются между собой.
3) Образование фагосомы.
4) Слияние фагосомы с лизосомой фагоцита и образование фаголизисомы.
5) Уничтожение и переваривание.
Уничтожение микробного агента происходит благодаря кислородзависимым и кослороднезависимым механизмам. С того момента, когда инициируется фагоцитоз происходит резкая активация гексозомонофосфатного шунта, генерирующего НАДФН. НАДФН используется для восстановления молекулярного кислорода, связанного с cyt b-245 (содержится только в фагоцитирующих клетках). Это вызывает бурное потребление кислорода, происходит “дыхательный взрыв”.
гексозомонофосфатный шунт вспышка выделения О2
Глюкоза +НАДФ --------------------------> пентозофосфат +НАДФН + образование
cyt b-245 надпероксидных
спонтанная дисмутация спонтанное образование
Н2О2 + Сl - --------------------------->ОСl - +Н2О генерирует образование
надпероксид-дисмутаза защитные механизмы,
каталаза хозяином при больших
Катионные белки Повреждение мембран у Gr- бактерий.
Лизоцим Расщепление мукопептидов клеточной стенки бактерий.
Лактоферрин Лишение пролиферирующих бактерий железа.
Гидролитические ферменты Переваривание убитых микроорганизмов
Нейтральные протеазы Разрушение поверхностных белков у некоторых видов.
Молочная кислота Снижение рН в фагосомах. Прямая бактерицидность.
Жирные кислоты Повреждение мембран ( накапливаются при внутрифагосомальной
6) Выброс продуктов дегидратации.
Система комплемента - одна из пяти протеолитических систем крови. Это - каскадная система. В принципе непосредственно микробными агентами система комплемента активируется по наиболее древнему альтернативному пути. В норме С3 при контакте с незначительными количествами протеолитических ферментов переходит в С3b. Образующийся С3b в присутствии ионов Mg присоединяет фактор В (С3bB).Имеющийся в крови в активном состоянии фактор D превращает этот комплекс в С3bBb, который в свою очередь является С3-конвертазой. С3bBb -конвертаза в растворах нестабильна и фактор В легко замещается другим компонентом - фактором Н. Комплекс С3bH доступен для атаки фактора I, который инактивирует С3b. Полисахариды бактерий препятствуют этой инактивации и приводят к тому, что из С3 под действием С3-конвертазы образуется С3b. C3b быстро связывается с мембраной-мишенью и присоединяет С5. Комплекс C3C5 похож на С3 и подвергается атаке C3Bb,который становится С5-конвертазой. С5b временно приобретает способность присоединять С6, а затем С7. Комплекс С567 прочно связывается с мембраной. К этому комплексу присоединяется С8. Дальнейшее связывание этого комплекса с С9 индуцирует в С9 конформационные изменения, что приводит к обнажению гидрофобной области и встраиванию С9 в липидный бислой рядом с С8. Это инициирует цепную реакцию конформационных изменений других молекул С9 (от 8 до 18 молекул) - формируется трансмембранный канал. Комплексы С5678 сами по себе образуют небольшие трансмембранные поры. Микробная клетка погибает от осмотического лизиса. Комплексы могут разрушать даже мембраносодержащие вирусы, видимо, за счет дезорганизации мембраны.
Система комплемента обладает несколькими биологическими функциями:
1. фагоциты имеют рецепторы к С3b и C3bi, что облегчает адгезию микроорганизмов, нагруженных C3b.
2. С3а и С5а действуют на фагоциты, особенно на нейтрофилы, вызывая “дыхательный взрыв”, являются мощными хемоаттрактантами для нейтрофилов, увеличивает проницаемость капилляров и вызывает вазодилатацию (этот эффект пролонгируется ЛТВ4, который выделяют тучные клетки и активированные нейтрофилы).
3. Повреждение мембран (система комплемента малоэффективна в отношении мембран аутологичных клеток: нестабильность активированных компонентов, блок активации альтернативного пути (см. выше), наличие белков-ингибиторов).
Т.о., активацией системы комплемента опосредована острая воспалительная реакция (гиперемия, экссудация компонентов плазмы, накопление нейтрофилов).
Белки острой фазы.
Концентрация некоторых белков плазмы крови, имеющих общее название белки острой фазы, резко увеличивается в ответ на инфекцию или повреждение тканей. К этим белкам относятся: ЦРБ, сывороточный амилоидный А-белок, альфа1-антитрипсин, альфа2-макроглобулин, фибриноген, церулоплазмин, С9 и фактор В. Выделение МФ ИЛ-1 приводит к повышению температуры тела (усиление фагоцитоза) и усилению синтеза и секреции печенью ЦРБ.
ЦРБ филогенетически достаточно стар. У человека состоит из 5 идентичных нековалентно связанных полипептидных цепей, формирующих замкнутый пентамер. ЦРБ при участии Са связывается с фосфорилхолином мембран микроорганизмов и активирует комплемент по классическому пути. Видимо, каким-то образом данный комплекс связывается с головками Clq (известно, что для его активации необходимо связать более одной из 6 головок). Активация субкомпонента Clq активирует Clr, который в свою очередь, приобретая протеолитическую активность, активирует Cls. Активированный Cls активирует С4. С4b сразу же ковалентно пришивается к мембране и затем связывает С2. С2 в комплексе C4bC2 активируется Cls. Комплекс C4bC2b представляет собой С3-конвертазу классического пути.
Интерфероны играют роль в борьбе с вирусной инфекцией (g-ИФ относятся к лимфокинам и активируют Мф), ограничивая распространение вируса. При вирусной инфекции клетки синтезируют ИФ, который проникает в межклеточное пространство и взаимодействует со специфическими рецепторами незараженных клеток. Видимо, происходит дерепрессия по меньшей мере 2 генов, кодирующих:
1. протеинкиназу , которая фосфорилирует рибосомальный белок и фактор инициации, таким образом, снижая трансляцию вирусной мРНК.
2. фермента , катализирующего образование короткого полимера адениловой кислоты. Этот полимер в свою очередь активирует латентную эндонуклеазу , что приводит к деградации мРНК вируса и хозяина.
Система внеклеточного уничтожения.
Нормальные киллеры (НК).
НК - клетки способы уничтожать клетки, инфицированные вирусом. Цитотоксичность НК усиливается ИФ, которые продуцируются пораженными вирусами клетками. НК- это большие зернистые лимфоциты с характерной морфологией. В их гранулах содержатся перфорин ( похож на С9) и 2 сериновые протеиназы. Хондроитинсульфат А при низких значениях рН внутри гранул связан с перфорином, предотвращая аутолиз клетки. Видимо, инфицированная вирусом клетка экспрессирует на мембране определенные гликопротеины, которые и узнаются НК. За счет рецепторного взаимодействия НК активируются и содержимое гранул выбрасывается во внеклеточное пространство. Перфорин при повышении рН отщепляется от хондроитинсульфата А и встраивается в мембрану клетки, вызывая ее осмотический лизис.
Эозинофилы осуществляют внеклеточное уничтожение крупных паразитов типа гельминтов. Гранулы эозинофилов содержат главный основный белок (в ядре гранул), катионный белок и пероксидазу (в матриксе гранул), арилсульфатазу В, фосфолипазу D, гистиминазу, белок типа С9. Имеют рецепторы для C3b. Большинство гельминтов способны активировать комплемент по альтернативному пути, однако они устойчивы к действию С9. На мембранах паразита фиксируются С3b, которые через специфический рецептор активируют эозинофилы, что приводит к выделению главного основного белка и катионного белка, а также “дыхательному взрыву”, сопровождающемуся выработкой активных форм кислорода. Все это приводит к повреждению мембраны гельминта.
НЕДОСТАТОЧНОСТЬ ВРОЖДЕННОГО ИММУНИТЕТА, ЕЁ РОЛЬ В ДИНАМИКЕ ИНФЕКЦИОННОГО ПРОЦЕССА.
Динамика инфекционного процесса - это результат взаимодействия макро- и микроорганизма во временном контексте. Иммунодефицит приводит к нарушению баланса инфекционные агенты - защитные силы организма, что дает начало развитию инфекционного процесса и / или усугубляет его течение. Рассматривая недостаточность врожденного иммунитета, следует выделять недостаточность фагоцитов и недостаточность гуморальных факторов (системы комплемента).
Недостаточность системы фагоцитов.
| Дефект | Заболевание | Инфекционный агент |
| cyt b-245 | хронический грануломатоз | бактерии, содержащие каталазу |
| лизосомы | болезнь Чедиака - Хигаси | гнойные инфекции |
| Недостаточность миелопероксидазы | - | системные кандидозы |
| Отсутствие хемотаксиса ПМЯЛ | синдром “ленивых лейкоцитов” | гнойные инфекции |
Недостаточность системы комплемента.

Дата публикации: 27.12.2019 2019-12-27
Статья просмотрена: 23 раза
В данной статье представлены актуальные данные по резистентности и чувствительности к антибиотикам у пациентов клинической базы городской клинической инфекционной больницы. В Городской Централизованной Бактериологической Лаборатории нами были изучены 1327 мазков, полученных от пациентов, обратившихся за помощью, в Городскую клиническую инфекционную больницу. Целью проведенной работы был анализ данных о чувствительности и резистентности к антибиотикам микрофлоры ротоглотки при различных инфекционно-воспалительных заболеваниях. А также осветить, в чем необходимость исследования микрофлоры больного, прежде чем назначать антибиотикотерапию.
Ключевые слова: чувствительность к антибиотикам, антибиотикорезистентность, микрофлора, инфекционно-воспалительные заболевания.
This article presents current data on antibiotic resistance and sensitivity in patients of the clinical base of the city clinical infectious diseases hospital. In The city Centralized Bacteriological Laboratory we studied 1327 smears received from patients who asked for help in the City clinical infectious diseases hospital. The aim of the work was to analyze data on the sensitivity and resistance to antibiotics of the oropharyngeal microflora in various infectious and inflammatory diseases. And also to highlight the need to study the microflora of the patient before prescribing antibiotic therapy.
Key words: antibiotic sensitivity, antibiotic resistance, micro flora, infectious and inflammatory diseases
Актуальность. Вследствие открытия антибиотиков был совершен революционный переворот в лечении инфекционных патологий у людей. Между тем, широкое и не всегда корректное применение привело к возникновению и распространению устойчивости к антибиотикам. Устойчивость к противомикробным препаратам является важнейшей проблемой современной медицины. Полвека назад начали появляться штаммы золотистого стафилококка, устойчивые к антибиотику метициллину (MRSA). Инфекции, вызванные метициллинрезистентным золотистым стафилококком, ассоциированы с большим количеством смертей, чем инфекции, вызванные метициллинчувствительным стафилококком (MSSA). Большинство из MRSA также устойчиво и к другим антибиотикам. В современной врачебной практике имеет место факт, что от широкой лекарственной устойчивости летальность достигает больших величин нежели от проявлений таких заболеваний как ВИЧ/СПИД, болезнь Паркинсона, эмфизема легких и пр. Так же развивается лекарственная устойчивость и у микробов, отнесенных CDC к третьему классу опасности (два штамма стрептококков, устойчивых к эритромицину и клиндамицину, и штамм золотистого стафилококка, устойчивый к ванкомицину). К сожалению, чем дольше антибиотики широко спектра действия используются нерационально, тем хуже ситуация становится с каждым днем. В нашем государстве это проблема также не является последней, и вопрос о некорректном назначении антибиотиков, а также бесконтрольном отпуске препаратов стоит остро на повестке дня.
Материалы иметоды. На базе Городской Централизованной Бактериологической Лаборатории в период с января по октябрь 2019 года, использовался метод ретроспективного исследования, где было изучено 1327 микробиологических мазков из зева с определением чувствительности к антибиотикам выделенных микроорганизмов у пациентов с различными инфекционно-воспалительными заболеваниями ротоглотки (ОРВИ, острый тонзиллит, гнойно-некротическая ангина), обратившихся за медицинской помощью в Городскую Клиническую Инфекционную Больницу имени Изатимы Жекеновой.
Результаты иобсуждения: Выбранные микроорганизмы демонстрировали условно-патогенные и патогенные штаммы стафилококка (St. saprophyticus; St. aureus; St. epidermidis; St. hyicus; St. intermedius) и стрептококка (Str. viridans; Str. pneumonia; Str. haemolyticus). Мониторинг вариаций чувствительности выявленных бактерий к антибиотикам показало, что чувствительность выделенных штаммов по большому счету остается стабильной по отношению к таким антибиотикам как фторхинолоны. В свою очередь чувствительность микроорганизмов к этим антибиотикам гораздо выше, чем у других. Опираясь на данные исследования предыдущих лет, можно сказать, что чувствительность к пенициллинам ежегодно убывает почти на два порядка. Если чувствительность к пенициллинам в 2016 году составляло 77 %, то к 2019 году процент чувствительности резко снизился до 44 %. У цефалоспоринов также отмечаются негативные результаты. Так в 2016 году чувствительность микроорганизмов составляет 97 %, а в 2018 и 2019 годах соответственно 67 % и 62 %, что показывает нам неважную динамику различий чувствительности к цефалоспоринам.
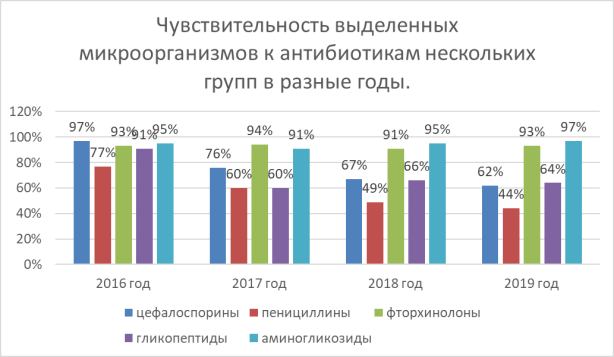
Рис. 1. Чувствительность к антибиотикам нескольких групп выделенных штаммов в разные годы
По итогам таблицы 1 в 2019 году все группы изучаемых антибиотиков показали резистентность к исследуемым микробам. А Streptococcus Viridans и Streptococcus Pneumonia, Streptococcus Haemolyticus проявили пиковый результат устойчивости среди других кокков.
Устойчивость выделенных штаммов к антибиотикам
2019
St.sahrophyticus
St.epidermidis
St.intermidius
Читайте также:
- Что можно после кесарево инфекция
- Ротовирусная кишечная инфекция симптомы и лечение у детей что можно есть
- Инструкция по вакцинации против гемофильной инфекции
- Свечи виферон при герпетической инфекции
- Стоит ли делать прививку от клещевого энцефалита взрослым
 Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.
Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.

