Реферат на тему инфекционный токсический шок
Тяжелые пневмонии иногда заканчиваются летальными исходами. Смерть чаще наступает от острой сердечно-сосудистой недостаточности. Смертельные поражения легких у больных пневмонией встречаются сравнительно редко.
Практически во всех случаях при пневмониях в той или иной степени выражены симптомы интоксикации. Крайняя степень токсемии возникает вследствие всасывания продуктов жизнедеятельности микроорганизмов, либо бактерий, что проявляется ИНФЕКЦИОННО-ТОКСИЧЕСКИМ ШОКОМ - одним из тяжелых осложнений пневмоний, при котором летальность составляет 30-50%.
Патогенез шока при пневмонии.
Вначале несколько общих понятий о шоке. Шок - это острое нарушение гемодинамики, характеризующееся критическим расстройством тканевой перфузии, которое ведет к дефициту кислорода в тканях, повреждению клеток и органов. Одним из важнейших патофизиологических звеньев шока является нарушение капиллярного кровообращения, приводящее к дефициту кислорода, нарушениям обмена веществ и в конечном итоге - к необратимому состоянию.
Следует подчеркнуть, что МОС при шоке не может быть показателем перфузии тканей, о чем свидетельствуют наблюдения высокого выброса при септическом шоке. Дело в том что, при выраженной вазоконстрикции и артерио-венозном шунтировании минутный кровоток может быть распределен так, что большая часть органов и тканей пострадает от дефицита перфузии при относительно нормальной или даже увеличенной работе сердца как насоса. Следовательно, при шоке может наблюдаться как низкий, так и высокий МОС.
Инфекционно-токсический шок - развивается в результате воздействия эндотоксинов и бактериальных продуктов на клеточные мембраны, компоненты свертывания крови и комплемент, что приводит к повышению свертываемости, повреждению клеток и нарушению кровотока, особенно микроциркуляции.
Система комплемента состоит не менее чем из 20 различных самоустанавливающихся протеинов и может быть активирована каким-либо одним из по меньшей мере двух пусковых факторов. Во время активации ранее синтезированные биологически активные протеины превращаются в гуморальные медиаторы воспаления и альтерации тканей. Активация комплемента происходит ступенчато, наподобие каскада свертывания крови. Образование полного комплемента приводит к лизису мембраны клеток бактерий, эритроцитов и других тканей. Высвободившиеся во время активации комплемента фрагменты пептидов активируют другие клеточные и гуморальные эффекторные системы. Известны два пути активации системы комплемента: классический и альтернативный. Альтернативная активация (называемая также пропердиновой) может произойти под влиянием неиммунологических факторов, независимо от антител. В литературе имеются данные об активации комплемента липополисахаридами (эндотоксины). Активация комплемента приводит к образованию низкомолекулярных пептидов - факторов комплемента С3,С4 и С5, опосредующих клеточные и гуморальные реакции. Фрагменты С3а, С4а и С5а называют анафилотоксинами. Они стимулируют высвобождение гистамина из тучных клеток и базофилов, вызывают сокращение гладких мышц и увеличивают проницаемость сосудов. Считается, что фрагмент С2 обладает кининовой активностью, вызывая увеличение проницаемости сосудов. Фрагмент С5а, взаимодействуя со специфическими высокоаффинными рецепторами гранулоцитов и тромбоцитов, вызывает агрегацию клеток, усиление прилипания, хемотаксис и активацию клеток. Активированные таким образом нейтрофилы высвобождают метаболиты арахидоновой кислоты, бескислородные радикалы и лизосомальные ферменты, вызывающие воспалительные изменения в тканях и увеличивающие проницаемость капилляров. Данный механизм может иметь определенное значение в возникновении дыхательной недостаточности и вазодилатации при септическом состоянии, вызванном грамотрицательными микроорганизмами.
Литературные данные, полученные в последнее время свидетельствуют также о том, что под влиянием эндотоксинов и других бактериальных продуктов выделяются эндогенные цитокины, основными мишенями для которых являются лейкоциты, эндотелий и сердце. Появляющиеся медиаторы воспаления и сами эндогенные цитокины оказывают большое воздействие на вазомоторный тонус, проницаемость мелких сосудов и агрегацию лейкоцитов и тромбоцитов. Происходит перестройка в терминальном отделе системы кровообращения. В результате этого возникает утрата тонуса как сосудов сопротивления (артериальных), так и объемных (венозных). Кровь может скапливаться в капиллярном русле, а белки плазмы пропотевают в интерстициальную жидкость. В венозной системе также отмечается депонирование крови. В результате стимуляции b-рецепторов открываются артериовенозные шунты конечной части кровотока.
Достаточно важное значение в патогенезе инфекционно-токсического шока в настоящее время придается также образованию в организме нитратов. При воспалительной реакции в организме ключевую роль в образовании нитратов играют макрофаги. Специфический фермент макрофагов - NO-синтаза (макрофагальная, которая локализуется в макрофагах, миокарде и гладкой мускулатуре) превращает аргинин в NO, из которого затем могут образовываться нитриты и нитраты. Главная функция NO, который синтезируется макрофагами, состоит в обеспечении их цитотоксического действия. При активации бактериальными эндотоксинами или Т-лимфоцитами макрофаги усиливают синтез NО-синтазы, которая превращает аргинин в NO. Выделяясь из макрофагов, NO быстро проникает в бактерии и клетка погибает. Таким образом, NO играет важную роль в иммунной защите организма. Кроме того NO способствует снижению активности пограничных воспалительных клеток, тормозит агрегацию тромбоцитов и улучшает местное кровообращение. Патогенное же влияние образования NO в организме при воспалении может заключаться в следующем. При воспалительных процессах в организме могут образовываться активные формы кислорода, которые являются одной из важных молекулярных мишеней для NO. NO связывается с кислородом, образуя пироксинитриты, по токсичности во много раз превосходящие NO. Они то и играют важную роль во многих патофизиологических процессах, включая септический шок, а также ишемические и язвенные поражения органов. Пироксинитрит вызывает повреждение белков и липидов клеточных мембран, повреждает сосудистый эндотелий, увеличивает агрегацию тромбоцитов, участвует в процессах эндотоксемии. Сама NO, избыточно накапливаясь в клетке, может вызывать повреждение ДНК и обладать провоспалительным действием при септическом шоке.
Механизм сосудорасширяющего действия NO
| TNF, IL-1, LPS | ||
| Активация ГЦ | NO | NO-синтаза |
| Накопление цГМФ | Расслабление мышечной клетки | |
| Мышечная клетка |
Принципиальная схема патогенеза инфекционно-токсического шока
| ИНФЕКЦИЯ | ||
| макрофаги, Т клеточные медиаторы, ИЛ-1, 2; ТНФ; МДФ, макрофагальная NO- синтаза | ||
| депрессия миокарда | действие на эндотелий | активация ПМЯ лейкоцитов |
| снижение сосудистого сопротивления, гипотензия | ||
| МНОЖЕСТВЕННАЯ ОРГАННАЯ НЕДОСТАТОЧНОСТЬ, СМЕРТЬ | ||
Примечание: ТНФ - туморнекротизирующий фактор; ИЛ-1,2 -интерлейкин 1, 2; ПМЯ - полиморфноядерные лейкоциты; МДФ - циркулирующий миокардиально-депрессирующий фактор.
Последовательность событий, ведущая к агрегации гранулоцитов и лейкостазу в легких и нарушению функций сердечно-сосудистой системы
| ГРАНУЛОЦИТЫ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Активация комплемента | Лейкоагглютинины | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| АГРЕГАЦИЯ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ЛЕЙКОСТАЗ В ЛЕГКИХ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Грам отрицательные микроорганизмы | Эндотоксин | Туморнекротизирующий фактор | Грам положительные микроорганизмы | |
| Патологический липополисахарид | Активация полиморфно-ядерных лейкоцитов | |||
| Активация XII фактора | Повышение адгезии эндотелиальных клеток | |||
| Формирование капиллярных тромбов | Синтез макрофагальных изоформ NO-синтазы на действие инфектагента с синт-м в клетке NO | |||
| Повышенная проницаемость сосудов | Повышенный выброс радикалов О2 | NO связ-ся с акт. формами О2 , | Миокардиально-депрессирующий фактор | |
| Истощение системы свертываемости крови | Выброс энзимов | образуя пироксинитриты | ||
| ДВС-синдром | Пропотевание крови | Активация фосфолипазы клеточной мембраны | ||
| Геморрагии и кровотечения | Увеличение синтеза арахидоновой кислоты | Снижение силы выброса и гипоксия миокарда | ||
| Увеличение содержания ПГЕ; ИЛ-1; ИЛ-2. | ||||
| Бронхоспазм | ||||
| Острая дыхательная недостаточность | Централизация кровообращения | |||
| Артериальная гипотензия | ||||
| Острая почечная недостаточность | ||||
| Адгезия тромбоцитов | ||||
| СМЕРТЬ | Нарушение тканевого метаболизма | Снижение периферического сопротивления | Тканевая гипоксия | |
Таким образом, на начальном этапе развития заболевания под воздействием эндотоксинов происходит в первую очередь расширение стенок мелких сосудов (в основном венул), а также значительно повышается проницаемость сосудистой стенки. В результате всего вышеизложенного, несмотря на отсутствие абсолютного дефицита объема, венозный возврат к сердцу уменьшается (относительная гиповолемия). В ответ на это происходит рефлекторное симпатическое сужение вен. Но активное сужение вен эффективно уменьшает венозное кровенаполнение только в том случае, если вены хорошо наполнены и растянуты. Если же трансмуральное давление достаточно низко, чтобы привести вены в полуспавшееся состояние, даже сильные сокращения гладкой мышцы вен оказывают только незначительное влияние на количество крови в них. При такой ситуации сужение вен может даже несколько увеличить местную емкость вен, так как оно делает стенку более жесткой, в результате чего просвет становится большим и приобретает более круглую форму, несмотря на то, что просвет окружности уменьшается. В результате снижения венозного возврата повышается активность симпатической нервной системы, что наряду с непосредственным влиянием эндотоксинов ведет к сокращению пре- и посткапиллярных сфинктеров (стимуляция a-рецепторов). В результате кровоснабжение тканей становится недостаточным, минутный объем сердца в эту фазу большей частью нормальный или даже повышенный (т. е. МОС нормальный или увеличенный, ЧСС увеличивается, общее периферическое сопротивление уменьшается и снижается АД). Артерио-венозная разница по кислороду и обеспечение периферии кислородом понижены.
В дальнейшем по мере дальнейшего развития шока происходит формирование рокового порочного круга. Прекапиллярные артериальные сфинктеры более чувствительны к токсическим влияниям (в том числе ацидозу), поэтому их спазм быстро сменяется парезом. Посткапиллярные (венулярные) сфинктеры более устойчивы к метаболическим нарушениям и длительное время остаются в состоянии тонического напряжения. Таким образом, кровь, притекающая в капиллярное русло депонируется, в связи с чем нарастает тканевая гипоксия, усугубляется метаболический ацидоз, пропотевает плазма с нарастающей компрессией капилляров, что наряду с застоем крови в венозном русле, способствует дальнейшему уменьшению венозного возврата и увеличению относительной гиповолемии.
В результате возникает следующая причинно-следственная связь: стаз в капиллярах - висцеральный застой - уход воды - повышение вязкости крови - агрегация красных и белых кровяных телец, образование красного и белого тромба - истощение факторов свертывания и тромбоцитов вследствие диссеминированного внутрисосудистого свертывания - возникновение изнуряющей коагулопатии с повышенной предрасположенностью к кровотечению.
В пораженных областях аэробные энергетические пути переключаются на анаэробный гликолиз. Переключение окислительного обмена на гликолитический путь значительно увеличивает потребление глюкозы при одновременном уменьшении выхода АТФ. Это снова ведет к снижению уровня глюкозы. Биосинтез белка при шоке ограничен. Это особенно быстро влияет на синтез тех белков, которые имеют короткое время полужизни, например, факторы свертывания. Таким образом, нарушение свертывания крови еще более усиливается. При шоке начинается выход калия из клеток. Метаболический ацидоз возникает в результате увеличенной продукции лактата, а также пирувата, a-кетоглутарата и кетоновых тел. Ацидоз частично компенсируется усиленным дыханием. В результате повышения концентрации Н + в плазме наблюдается следующее: отрицательное инотропное действие на сердце; снижение чувствительности прекапиллярных сфинктеров в смысле вазомоторных реакций с образованием отеков; повышение выброса катехоламинов; активирование свертывающей системы в качестве одной из причин диссеминированного внутрисосудистого свертывания. Некоторые вещества, образующиеся при шоке (в частности и сами цитокины), обладают отрицательным инотропным действием. Длительное действие этих факторов ведет к расширению сердца и сердечной недостаточности, тем самым, к уменьшению МОК.
Особенно чувствительна к недостатку кислорода РЭС. Токсические вещества, например, эндотоксины кишечника, перестают улавливаться РЭС (главным образом печени) и с кровотоком попадают в сердце и легкие. Этот механизм считается одним из главных, способствующих переходу шока в необратимую фазу частично в связи с развитием необратимого коллапса периферических сосудов.
Почки. По причине эфферентного сокращения сосудов при шоке уменьшается давление гломерулярной фильтрации, в результате чего развивается олигурия (4-20 мл/ч) или анурия (4 мл/ч). Сужение почечных сосудов сохраняется еще долгое время после нормализации давления крови. Ишемия вызывает прогрессирующий некроз канальцев вследствие гломерулярной, а затем тубулярной недостаточности с образованием цилиндров в дистальных канальцах. Признаком почечной недостаточности является увеличение содержания в крови таких, обычно выделяющихся с мочой соединений, как мочевина и креатинин.
Взаимосвязь между макро- и микроциркуляцией при шоке.
| Уменьшение объема крови, острая сердечная недостаточность, нарушения в периферических сосудах | |||
| Свертывание | |||
| Шокогенные медиаторы | Повышенная проницаемость | Отек, некроз, освобождение ферментов | Сниженный венозный рефлюкс |
| Повышение вязкости | |||
| Повреждение шокогенных органов | Сосудистые реакции | Изнуряющая коагулопатия | Сниженный минутный объем сердца |
| Молочнокислый ацидоз | Гипоксия | ||
| Метаболический ацидоз | Гипотензия | ||
Таким образом, одним из основных патофизиологических механизмов в развитии инфекционно-токсического шока при пневмониях следует считать развитие гиповолемии вследствие секвестрации крови в микроциркуляторном русле и выхода ее в ткани из-за повышения проницаемости капилляров.
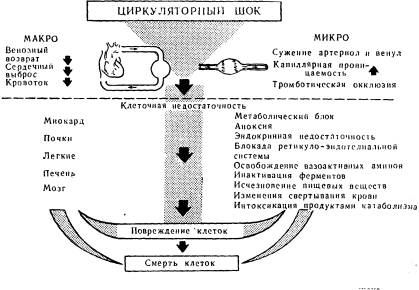
Нарушения гемодинамики и их связь с общими нарушениями при шоке
Клиническая картина : шок развивается на фоне нарастания интоксикации: у больного появляется озноб, за которым следует резкий подъем температуры, часто наблюдается тошнота, рвота, диарея, состояние прострации.
В клиническом плане выделяют следующие группы симптомов, определяющих степень тяжести и прогноз.
| № | Критерии септического синдрома |
| 1. | Клинические признаки инфекции |
| 2. | Температура тела выше 38 о С или ниже 36 о С |
| 3. | Частота дыхания > 20 в минуту |
| 4. | Число сердечных сокращений > 90 в минуту |
| 5. | Количество лейкоцитов больше 12,0х10 9 /л или меньше 4,0х10 9 /л или при 10% незрелых форм |
| 6. |


