Пробиотики при хеликобактерной инфекции
А. И. Хавкин, С. Ф. Блат
Московский НИИ педиатрии и детской хирургии Росздрава
Проводилось открытое контролируемое рандомизированное исследование с целью оценки эффективности пробиотической терапии препаратом Линекс ® (Lek, Словения) антибиотикассоциированных нарушений кишечной микрофлоры, развившихся на фоне антихеликобактерной терапии. Наблюдались 38 детей в основной и 21 ребенок в контрольной группах в возрасте от 6 до 17 лет. Показано, что назначение препарата пробиотика (Линекса ® ) снижает риск осложнений антихеликобактерной терапии, способствует нормализации состава микрофлоры кишечника и восстановлению ее метаболической активности. Ключевые слова: Helicobacter pylori, антихеликобактерная терапия, пробиотики, Линекс ® , микрофлора кишечника, дети
Khavkin A. I. and Blat S. F.
Moscow Research institute of pediatrics and infantine surgery Ministry of Public Health of Russian Federation
The researchers have carried out an open controlled randomized study with the aim of assessing the efficiency of probiotic treatment, with the use of the Lynex preparation (Lek, Slovenia), of the antibiotic-associated disturbances in the intestinal microflora that developed against the antihelicobacter therapy background. Kept under observation were thirty eight children/infants belonging to the main group and twenty one children/infants who belonged to the group of controls, all aged six to seventeen. It has been found that the prescribed probiotic preparation Lynex reduces the risk of occurrence of complications caused by antihelicobacter therapy, encourages normalization of the intestine microflora composition and promotes restoration of the metabolic activity of intestine microflora. Key words: Helicobacter pylori, antihelicobacter therapy, probiotics, Lynex, intestine microflora, children/infants
Вот уже более 20 лет сохраняется интерес клиницистов к микроорганизму Helicobacter pylori, открытому Marshall В. и Warren R. в 1983 году. Как известно, недавно это открытие было отмечено Нобелевской премией. Однако по-прежнему остаются спорными ряд вопросов, касающихся степени патогенности Helicobacter pylori, путей реализации его болезнетворного действия, эпидемиологии, особенностей патогенеза и течения ассоциированных с этим микроорганизмом заболеваний. Важное место занимает исследование данной патологии удетей [1, 2].
Инфекция Helicobacter pylori распространена во всем мире. Проводимые во многих странах исследования показали, что около 60% населения земного шара инфицировано этим микроорганизмом, который является основной причиной хронического гастрита, язвенной болезни. Так, Н. pylori определяется у 95% больных с язвенной болезнью 12-перстной кишки (12 п. к.), у 70-80% больных с язвенной болезнью желудка, у 50% больных с неязвенной диспепсией. Кроме того, показана взаимосвязь инфекции Н. pylori и рака желудка, а именно аденокарциномы и мальтлимфомы 2.
Частота хеликобактерассоциированных заболеваний варьирует в зависимости от страны (чем ниже экономический уровень страны, тем чаще встречается хеликобактериоз) и возраста (наиболее часто заражаются Н. pylori в возрасте 18-23 лет в развитых странах и в возрасте 5-10 лет - в экономически не благополучных странах) [2, 5, 6]. Заражение хеликобактериозом происходит от человека к человеку орально-оральным и фекально-оральным путем, наиболее часто Н. pylori передается внутри семьи. Колонизация ЖКТ хеликобактером не всегда приводит к развитию патологического процесса. Ответ организма на Н. pylori зависит от состояния иммунитета человека, состава желудочной слизи, количества рецепторов на поверхности желудка, способствующих адгезии микроорганизма, вирулентности Н. pylori.
Негативное влияние на организм человека обусловлено наличием у Н. pylori большого числа факторов патогенности. К ним относятся: уреаза, защищающая Н. pylori от действия соляной кислоты, связывающая антихеликобактерные антитела, способствующая повреждению эпителия и усилению воспалительной реакции; подвижность бактерии; адгезины, взаимодействующие с эпителиальными клетками и оказывающие влияние на секрецию соляной кислоты париетальными клетками; способность к инвазии эпителиальных клеток; токсины - цитотоксин A (VacA), вызывающий вакуолизацию эпителия, гемолизин (RibA); липополисахарид наружной мембраны, способствующий образованию микродефектов слизистой оболочки; поверхностные белки, играющие роль в аутоиммунных реакциях [4].
У детей наиболее часто встречаемым патологическим состоянием, вызванным Н. pylori, является хронический гастрит (гастродуоденит). Хронический активный хеликобактерный гастрит - следствие хронической воспалительной реакции на Н. pylori. Это воспаление имеет комплексный характер и основными компонентами его являются: инфильтрация собственной пластинки слизистой, а также эпителия желудка нейтрофилами (в острой стадии или при активизации хронического процесса) и инфильтрация собственной пластинки слизистой лимфоцитами, плазматическими клетками, макрофагами с формированием несвойственных для желудка лимфоидных фолликулов. Установлено, что инфильтрация стимулируется как непосредственно бактериями Н. pylori, которые выделяют водорастворимый белок, активизирующий нейтрофилы, так и опосредовано - путем стимуляции секреции интерлейкина-8 эпителиоцитами желудка, а затем и запуском всего воспалительного каскада с секрецией различных цитокинов [3, 7]. В ответ на повреждение хеликобактером эпителия желудка развивается воспалительный процесс различной степени активности, происходит выработка специфических IgA, IgG в слизистой оболочке, активизируется фагоцитоз. Однако невовлеченность Н.pylori во внутреннюю среду организма не дает возможности иммунным механизмам защиты полностью элиминировать микроб. Инфекция характеризуется хроническим волнообразным многолетним течением с тенденцией к прогрессированию и распространению процесса [4, 7].
Клинически хронический хеликобактерный гастрит проявляется очень разнообразно - от резких частых болей в животе с выраженными диспепсическими явлениями (тошнота, рвота, тяжесть в желудке после еды и т. п.) до бессимптомного носительства. При пальпации живота типична болезненность в эпигастрии и пилородуоденальной зоне. При эндоскопическом исследовании обычно обнаруживают очаговую или диффузную гиперемию слизистой оболочки, отек, гипертрофию складок, может выявляться лимфофолликулярная гиперплазия, плоские или приподнятые эрозии. У большей части детей гастрит протекает без атрофии слизистой оболочки на фоне нормальной или повышенной секреции желудка [1, 2, 6].
В диагностике инфекции H. pylori следует выделить 2 основные задачи: первичную диагностику и диагностику после проведенной антихеликобактерной терапии. В этом случае ее необходимо проводить не ранее, чем через 4-6 недель после окончания приема антисекреторных средств и антибиотиков, во избежание искажения результатов. Адекватную диагностику обеспечивает комбинация различных методов. Выделяют эндоскопические инвазивные (гистологический, иммуногистологический, бактериологический, полимеразная цепная реакция, уреазные тесты) и неинвазивные методы (серологический, дыхательные тесты, выявление H. pylori в анализах кала, слюны, зубном налете методами ПЦР и ИФА). Среди инвазивных методов стандартами для диагностики являются сочетание гистологического и уреазного методов или ПЦР-диагностики. Из неинвазивных методов по 3-му Маастрихтскому соглашению для скрининговой диагностики Н. pylori предпочтительными методами были признаны иммуноферментный анализ кала и слюны 10. Высокой чувствительностью и специфичностью обладает и дыхательный тест, однако из-за высокой стоимости С13/14-меченой мочевины он не получил массового применения. Аналогом данного теста является разработанный в России дыхательный Хелик-тест, основанный на кинетической оценке концентрации аммиака в воздухе полости рта после приема пациентом порции мочевины обычного углеродного состава. Высокая чувствительность и специфичность Хелик-теста обусловливают перспективным его применение, особенно в педиатрии [1]. Степень корреляции ПЦР-диагностики в кале с другими методами оказалась очень слабой, поскольку в кале в значительной концентрации присутствуют полисахариды - ингибиторы ПЦР. Серологический тест целесообразен при эпидемиологических исследованиях или при невозможности осуществления неинвазивной или биопсийной диагностики, однако данный метод не информативен в качестве контроля эрадикации.
Показания и схемы лечения хеликобактериоза определены международным соглашением в Маастрихте, последнее 3-е соглашение состоялось в 2005 году [9, 10]. В педиатрии обследование и лечение инфекции H. pylori показано детям с выраженной клинической симптоматикой, при наличии родственников, больных раком желудка, язвенной болезнью, возможно проведение терапии по информированному согласию родителей. Эрадикационная схема первой линии, применяемая у детей, включает однонедельную тройную терапию: ингибитор Н + , К + АТФ-азы, амоксициллин и кларитромицин (или нифуратель/фуразолидон). Возможно применение тройной терапии с коллоидным субцитратом висмута: субцитрат висмута + амоксициллин и кларитромицин (или нифуратель/фуразолидон). Квадротерапия рекомендуется для проведения эрадикации антибиотикорезистентных штаммов Н. pylori, при неудачном предыдущем лечении. В ее состав входят: ингибитор Н + , К + АТФ-азы, амоксициллин или кларитромицин, нифуратель/фуразолидон и субцитрат висмута. К препаратам, рекомендованным для использования в схемах антихеликобактерной терапии, относятся также рокситромицин и азитромицин. Метронидазол исключен из существующих схем, поскольку в России количество штаммов Н. pylori, резистентных к метронидозолу, превышает 40%. Если не удалось достичь успеха после двух адекватных курсов эрадикационной терапии, необходимо определить чувствительность штамма Н. pylori ко всему спектру используемых антибиотиков. При проведении эрадикационной терапии следует учитывать возраст ребенка и внутрисемейное инфицирование, поскольку именно от этого зависит возникновение реинфекции Н. pylori. Чем старше ребенок, тем меньше процент возникновения реинфекции.
Необходимо отметить, что антихеликобактерная терапия сопровождается развитием антибиотикассоциированных нарушений кишечной микрофлоры у большинства пациентов, что значительно ухудшает переносимость и приверженность терапии. Поэтому перспективным направлением в лечении хеликобактерной инфекции является применение пробиотиков. В целом ряде экспериментов было показано, что лактобактерии (Lactobacillus acidophylus, Lactobacillus salivarius) могут подавлять адгезию Н. pylori к мембранам эпителиоцитов и размножение Н. pylori, и добавление этих препаратов в стандартные схемы терапии позволяет улучшить частоту эрадикации и уменьшить частоту возникновения побочных явлений 12.
В настоящее время широко используются препараты, содержащие в том или ином виде различные штаммы бифидо- и/или лактобактерий. Многочисленными исследованиями была показана эффективность использования препаратов на основе перечисленных микроорганизмов для лечения гастроинтестинальных осложнений антибиотикотерапии как изолированно, так и в сочетании с пребиотиками и энтеросорбентами.
Материалы и методы исследования
С целью оценки эффективности пробиотической терапии антибиотикассоциированных нарушений кишечной микрофлоры, развившихся на фоне антихеликобактерной терапии, было проведено открытое контролируемое рандомизированное исследование на базах Российского государственного медицинского университета (Российская детская клиническая больница), Московского НИИ педиатрии и детской хирургии Росздрава и Московской медицинской академии им. И. И. Сеченова (Москва). В исследование вошли 59 детей, которым проводилась антихеликобактерная терапия. Критериями исключения и прекращения исследования были непереносимость препарата, отказ от приема препарата, необходимость дополнения лечения назначением других препаратов, влияющих на состав кишечной микрофлоры. В окончательный расчет были включены 38 детей в основной и 21 ребенок в контрольной группах в возрасте от 6 до 17 лет (средний возраст - 11,8 лет). В ходе исследования анализировались клинические данные, а также результаты исследования состава кишечной микрофлоры и летучих жирных кислот.
В качестве лекарственного препарата пробиотика в работе был использован Линекс ® (Lek, Словения). Особенностями препарата являются содержание не менее 1,2 X 10 7 живых лиофилизированных бактерий Bifidobacterium infantis v. liberorum, Lactobacillus acidophilus и Streptococcus faecium, устойчивость штаммов микроорганизмов к антибиотикам и химиотерапевтическим средствам, а также их кислотоустойчивость.
Обследуемые дети, получавшие антибактериальные препараты, случайным образом были разделены на две группы - контрольная и основная. Всем детям перед началом исследования были проведены клинический осмотр и лабораторная диагностика (1-й осмотр). В дальнейшем дети основной группы получали препарат Линекс® в течение 3-х недель в возрастной дозировке. После окончания курса антихеликобактерной терапии в течение 1-й недели дети обеих групп были обследованы повторно (2-й осмотр), а спустя 1 месяц обследованы в третий раз (3-й осмотр). При первом осмотре дети обеих групп были сопоставимы по основным параметрам состояния здоровья.
Результаты и их обсуждение
В ходе исследования были отмечены следующие изменения стула у обследуемых детей. В основной группе увеличилось количество пациентов, имеющих оформленный стул с 63,16% при первом осмотре до 84,38% к третьему осмотру, тогда как в контрольной группе оформленный стул наблюдался примерно у половины детей (52,38, 42,86, 47,06% (p В ходе клинических осмотров живота у обследуемых детей отмечалась положительная динамика, как в основной, так и в контрольной группах, характеризующаяся значительным уменьшением болевого синдрома и урчания в животе.
При оценке численности бифидо- и лактобактерий было отмечено в основной группе увеличение их числа ко 2-му осмотру и некоторое снижение к третьему (средние значения соответствовали 10 6 КОЕ/мл, 10 8 КОЕ/мл, 10 7 КОЕ/мл в 1-й, 2-й и 3-й осмотры). В контрольной группе первоначально низкое среднее значение содержания лакто- и бифидобактерий еще больше снижалось ко 2-у осмотру, а к 3-у осмотру происходило увеличение среднего значения до нижней границы нормы -10 5 КОЕ/мл.
Из патогенной микрофлоры высевались различные микроорганизмы: E. coli лактозонегативная, E. coli гемолизирующая, E. coli со слабо выраженными ферментирующими свойствами; Bacillus spp. без гемолиза, Bacillus spp. Р-гемолитическая; кокковые формы в общей сумме микроорганизмов, Staph. spp. негемолитический, Staph. коагулазонегативный, энтерококки, протей, цитробактер, энтеробактер, псевдомонады, Ps. аeruginosa, клебсиелла, другие неферментирующие грамотрицательные микроорганизмы; дрожжеподобные грибы. Количественные характеристики условно-патогенной микрофлоры в основной группе были значительно меньше, чем в контрольной.
Метаболическая активность микрофлоры оценивалась по следующим параметрам: общий уровень летучих жирных кислот (ЛЖК), средние абсолютные значения масляной, валериановой и капроновой кислот, соотношение ЛЖК, среднее значение индекса изокислот. Значения этих показателей в контрольной группе оставалось ниже нормального либо по отдельным параметрам имелась небольшая тенденция к росту. Так общий уровень ЛЖК составлял 6,83 при 1-м осмотре, 4,3966 - при 2-м, 6,48 - при 3-м (при норме 10,63). Среднее значение индекса изокислот в контрольной группе в ходе всего исследования составило 0,3005 при 1-м осмотре, 0,2929-при 2-м, 0,3211 - при 3-м.
В основной группе при первом осмотре значения показателей метаболической активности были на нижней границе или ниже нормы, ко второму осмотру возрастали до нормальных, и к третьему осмотру по отдельным показателям отмечалась тенденция к уменьшению значений. При 1-м осмотре общий уровень ЛЖК был ниже нормы и составлял 7,61, ко 2-у осмотру он достигал нормальных показателей (10,63; p На основании полученных данных можно сделать следующие выводы: антихеликобактерная терапия сопровождается развитием антибиотикассоциированных нарушений кишечной микрофлоры у большинства пациентов; назначение препарата пробиотика (Линекса ® ) снижает риск развития осложнений антихеликобактерной терапии; эффект Линекса ® проявляется клиническим улучшением, нормализацией состава микрофлоры кишечника, а также восстановлением ее метаболической активности.
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Читайте в новом номере
Микробиота желудка разнообразна. Инфекция Helicobacter pylori (HP) меняет ее состав в целом, что может способствовать более быстрому прогрессированию хронического гастрита. Пробиотики могут быть эффективны в коррекции микробиома желудка.
Цель исследования: изучить эффективность использования Lactobacillus reuteri DSMZ17648 (Lr) при лечении HP-ассоциированного гастрита у детей и эрадикации HP.
Материал и методы: проведено двойное слепое рандомизированное плацебо-контролируемое исследование эффективности применения убитых Lr как в виде монотерапии, так и на фоне эрадикационной схемы (омепразол + амоксициллин + метронидазол + висмут в течение 10 дней) у 103 HP(+) пациентов от 9 до 17 лет. Курс применения Lr в подгруппах А составил 28 дней, в подгруппах В – 56 дней. Для контроля проводили эндоскопическое, гистологическое исследование, быстрый уреазный тест, дыхательный аммиачный тест (АВТ), подсчитывали количество HP в биоптате, определяли воспалительный и атрофический индексы.
Результаты исследования: при значительной обсемененности HP в желудке отмечалось снижение микробного разнообразия. Это сопровождалось более выраженным воспалением, очаговой атрофией слизистой оболочки. При слабой обсемененности HP окружающая микробиота сохраняла разнообразие, воспаление было выражено минимально. Эрадикация HP была достигнута при монотерапии Lr у 50% детей через 28 и у 60% — через
56 дней, при адъювантном назначении Lr — у 60% через 28 и у 77,8% через 56 дней, в группе плацебо — у 68,8% через
28 и 56 дней.
Заключение: клиническое улучшение на фоне применения Lr было более ранним, снижение показателей АВТ — стабильным, достоверно снизились воспалительные и атрофические изменения слизистой оболочки желудка.
Монотерапия с применением Lr сравнима по эффективности со стандартной схемой, включающей 2 антибиотика. Пробиотики могут быть альтернативой традиционной терапии HP.
Ключевые слова: Helicobacter pylori, HP-ассоциированный гастрит, нехеликобактерная микробиота желудка, рак желудка, пробиотики, Lactobacillus reuteri.
Для цитирования: Корниенко Е.А., Паролова Н.И., Иванов С.В., Полев Д.С., Зыкин П.А., Кондратенко Ю.Д. Возможности использования пробиотиков в эрадикации Helicobacter pylori. РМЖ. Медицинское обозрение. 2018;7(II):51-58.
Possibilities of using probiotics in Helicobacter pylori eradication
E.A. Kornienko 1 , N.I. Parolova 1 , S.V. Ivanov 2 , D.S. Polev 3 , P.A. Zykin 3 , Yu.D. Kondratenko 3
1 St. Petersburg State Pediatric Medical University
2 Pavlov First St. Petersburg State Medical University
3 St. Petersburg State University
A gastric microbiota is diverse. Helicobacter pylori (HP) infection changes its composition as a whole, which may contribute to the more rapid progression of chronic gastritis. Probiotics can be effective in correcting the gastric microbiome.
Aim: to study the effectiveness of the use of Lactobacillus reuteri DSMZ17648 (Lr) in the treatment of HP-associated gastritis in children and HP eradication.
Patients and Methods: a double-blind, randomized, placebo-controlled study of the effectiveness of treatment with killed Lr both as monotherapy and on the background of the eradication scheme (omeprazole + amoxicillin + metronidazole + bismuth —
10 days) in 103 patients from 9 to 17 years old with HP(+), Lr course in subgroups A was 28 days, in subgroups B — 56 days.
For the control, endoscopic, histological studies, rapid urease test, ammonia breath test (ABT) were performed, the number of HP
in the biopsy, inflammatory and atrophic indices were calculated.
Results: with significant HP contamination in the stomach, there was a decrease in microbial diversity, the suppression of other microbes. This was accompanied by a more pronounced inflammation, focal atrophy of the mucous membrane. With low HP contamination, the surrounding microbiota preserved diversity, inflammation was minimal. HP eradication was achieved with Lr monotherapy in 50% of children after 28 days and 60% — after 56 days, with adjuvant Lr prescribing, in 60% — after 28 days and 77.8% — after 56 days, in the placebo group 68.8% — after 28 days and 56 days.
Conclusion: clinical improvement on the background of Lr was earlier, the decline in ABT indications was stable, inflammatory and atrophic changes in the gastric mucosa decreased significantly. According to the effectiveness, Lr monotherapy
is comparable to the standard dual antibiotic regimen, probiotics can be an alternative to traditional HP therapy.
Key words: Helicobacter pylori, HP-associated gastritis, non-Helicobacter gastric microbiota, gastric cancer, probiotics, Lactobacillus reuteri.
For citation: Kornienko E.A., Parolova N.I., Ivanov S.V. et al. Possibilities of using probiotics in Helicobacter pylori eradication //
RMJ. Medical Review. 2018. № 7(II). P. 51–58.
Статья посвящена возможностям использования пробиотиков в эрадикации Helicobacter pylori. Представлены результаты исследования эффективности использования Lactobacillus reuteri DSMZ17648 (Lr) при лечении Helicobacter pylori-ассоциированного гастрита у детей и эрадикации Helicobacter pylori.

Только для зарегистрированных пользователей
По материалам статьи “Клиническое применение пробиотиков в лечении инфекции Helicobacter pylori” Ами Патель, Нихир Шах, Дж. Б. Праджапати
Хроническое воспаление в желудке чаще всего вызывается жгутиковой бактерией Helicobacter pylori. Инфекция обычно приобретается в детстве и может сохраняться долго, если ее не лечить. Уровень распространенности инфекции H. pylori среди взрослого населения в развитых странах составляет 20–50%, а в развивающихся странах этот показатель достигает 80%. У 10–20% зараженных H. pylori в конечном итоге могут развиться гастрита и язвы желудка и двенадцатиперстной кишки.
Ученые все чаще находят доказательства, что пробиотики можно использовать при лечении желудочно-кишечных инфекций в качестве альтернативы антибиотикам или дополнения к ним. Это позволяет уменьшить случаи нерационального использования антибиотиков и снизить частоту их побочных эффектов.
Новое в лечении хеликобактерной инфекции
Хотя антибактериальное лечение Helicobacter pylori в комбинации с препаратами подавляющими кислотность эффективно в 90%, оно является дорогостоящим. Кроме того, терапия вызывает ряд побочных эффектов, таких как диарея, тошнота, вздутие живота и нарушение вкуса. Из-за них пациенты часто самостоятельно прекращают прием лекарств, как только симптомы стихают, при этом бактерия сохраняется в желудке и приобретает устойчивость к противомикробным препаратам.
В настоящее время врачи и исследователи считают, что нужно рассмотреть альтернативные способы лечения хронического гастрита. Один из возможных способов лечения включает применение пробиотических культур. ВОЗ рекомендует для поддержания здоровья 8 живых пробиотиков, из которых чаще всего используют лактобактерии и бифидобактерии.
Как действует пробиотик на H. pylori?
Пробиотические бактерии могут подавлять H. pylori с помощью иммунных или неиммунных механизмов. Согласно исследованиям, 10 различных пробиотических штаммов могут вызывать различные иммунные ответы, в зависимости от иммунного статуса человека.
14 пробиотиков могут модифицировать иммунологический ответ хозяина следующим образом:
- Иммуномодуляция. Пробиотики восстанавливают баланс между провоспалительными и противовоспалительными цитокинами и хемокинами (вещества, необходимые для межклеточного взаимодействия). В результате снижается воспаление в слизистой желудка.
- Активация врожденного иммунитета. Пробиотики могут связываться с рецепторами распознавания “чужого”, которые имеются на поверхности клеток слизистой оболочки желудка. Это запускает каскад защитных механизмов иммунной системы
- Влияние на иммуноглобулины. После приема пробиотиков наблюдалось снижение специфических IgG-антител к инфекции H. pylori параллельно уменьшению выраженности гастрита (антитела повышаются при хроническом воспалении). Также пробиотики увеличивают продукцию секреторного IgA в кишечном эпителии, который защищает слизистую от патогенных микроорганизмов и укрепляет защитный барьер слизистой оболочки.
Неиммунные механизмы действия пробиотиков включают:
- Выделение антимикробных веществ - органические кислоты, перекись водорода, диоксид углерода;
- Конкуренцию с H. pylori за рецепторы - большое количество полезных бактерий прикрывает места на слизистой оболочке, к которым прикрепляется H.pylori.
- Стимуляцию продукции муцина, который создает защитный барьер слизистой оболочки.
Что говорят исследования?
С 2000 года было проведено около 12 исследований на людях для оценки эффективности лечения инфекции H. pylori комбинацией антибиотиков и пробиотиков и 16 исследований, в которых применяли только пробиотик в качестве альтернативы антибиотикам. Большинство исследований показало улучшение течения хеликобактерного гастрита и снижение колонизации H. pylori после введения пробиотиков. Тем не менее, ни одно исследование не продемонстрировало полную эрадикацию (удаление) инфекции H. pylori при лечении только пробиотиками.
В ходе исследований оценивали влияние на частоту эрадикации и частоту побочных эффектов.
Клинические опыты с использованием пробиотиков как дополнение к эрадикационному лечения хеликобактерной инфекции

В указанный исследованиях штаммы бактерий благоприятно влияли на частоту эрадикации и побочные эффекты от основной терапии у взрослых и детей. Причем у взрослых с резистентной и трудно поддающейся лечению хеликобактерной инфекцией добавление пробиотика снизило уреазную активность (определяет количество бактерий желудке) и увеличило частоту эрадикации.
Было проведено также несколько исследований, чтобы выяснить, можно ли использовать пробиотики вместо антибиотиков для уменьшения количества хеликобактер в желудке и ускорения темпов эрадикации.
Влияние пробиотиков на хеликобактерный гастрит измеряли с помощью:
- Дыхательного уреазного теста (UBT);
- Отношения пепсиногенов I/II в сыворотке (чем они ниже, тем выраженнее воспаление);
- Уровня антигена H. pylori в кале (HpSA);
- Степени колонизации H.pylori;
- Выраженности воспаление и гастрита по данным гастроскопии;
- Влияния на эрадикацию.

Выводы
- Комбинация пробиотика + антибиотик может уменьшить побочные эффекты, вызванные эрадикационной терапией H. pylori, и, таким образом, оказывать благоприятное воздействие на людей, инфицированных H. pylori.
- Добавление пробиотика к эрадикационной терапии H.pylori увеличивает частоту полного удаления возбудителя.
- Пробиотики способны уменьшать выраженность гастрита, несмотря на то, что не уничтожают хеликобактер напрямую, в отличие от антибиотиков.
- Механизм действия пробиотиков связан со стимуляцией иммунного ответа, восстановлением барьерной функции слизистой оболочки и конкурентным нарушением процесса прикрепления H.pylori к клеткам желудка и двенадцатиперстной кишки.
- Длительное употребление продуктов, содержащих пробиотические штаммы, может оказывать благоприятное воздействие на течение гастрита, в частности, за счет снижения риска развития осложнений (образование язв).
- Регулярное употребление пробиотических продуктов со специфическими штаммами в качестве альтернативы антибиотикам в некоторой степени подавляет инфекцию, вызванную H. pylori.
- Пробиотики полезны для профилактики хеликобактерной инфекции у взрослых и детей, поскольку заражение бактерией происходит в детском возрасте и не всегда проявляется симптомами.
В России – Унибактер. Особая Серия
Как научиться решать несколько проблем со здоровьем одновременно и просто?
Нас уже приучили, что от каждого отдельного симптома имеется свое лекарство. И это правильно, когда Вы находитесь в больнице или толкнулись с острым заболеванием. Но если Ваша задача - укрепление здоровья и повышение работоспособности все будет ровно наоборот. В организме все связано и устранение симптомов не приводит к решению проблем со здоровьем, а только маскирует их. Реальные изменения дает воздействие на причины плохого самочувствия.
Хотите чувствовать себя лучше - влияйте на организм с помощью глубоких универсальных механизмов, которые одновременно позволяют устранить однотипные нарушения в разных органах: исправления питания, разумного образа жизни, детокса, питания и защиты нервных клеток, восстановления микрофлоры, нормализации пищеварения, природных противовоспалительных средств и антиоксидантов.
"Система Соколинского" предлагает системный натуропатический подход, основанный на глубоком понимании физиологии, современных исследованиях, проверенный на практике более чем 10 000 человек с 2002 года.
НЕ ЯВЛЯЮТСЯ ЛЕКАРСТВОМ!
Система разработана известным российским нутрициологом, доктором натуропатии (ND), MSc, Владимиром Соколинским, Вице-президентом Европейской Академии доказательной натуропатии, автором 11 книг о натуральной медицине, членом Национальной ассоциации нутрициологов и диетологов, Научного общества медицинской элементологии, Американской ассоциации практикующих нутриционистов.
Неэффективность традиционного лечения
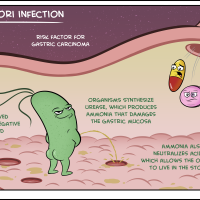
В последние годы отмечается снижение эффективности лечения хеликобактерной инфекции, связанной с несколькими причинами:
- нечувствительность хеликобактера к антибиотикам,
- большое количество побочных эффектов на прием ИПП и антибиотиков,
- активное нежелание пациентов принимать антибиотики.
Стандарты лечения регламентируются международными и российскими соглашениями, в основе которых лежит курс лечения с назначением препаратов, снижающих кислотность желудочного сока (антисекреторные препараты – ИПП, например, Омез, Париет и др.), двух антибиотиков (например, Клацид и Амоксициллин).
Лечение хеликобактерной инфекции в любой возрастной категории сопровождается большим количеством побочных, нежелательных реакций на применяемые препараты и то, что их применение не исключает повторения инфекции или повторного заражения препараты-ИПП).
Почему при лечении хеликобактера отказываются от антибиотиков
Наличие хеликобактера — не всегда хроническая инфекция.
Нечувствительность хеликобактера к антибиотикам приводит к уменьшению эффективности лечения – отмечено снижение эффективности с 80-90% до 30-60%, что является характерным для многих стран, для различных регионов в России.
Сегодня стоит еще раз напомнить о побочных эффектах применения антисекреторных препаратов и антибиотиков.
Так, при приеме антисекреторных препаратов (ИПП) нарушаются процессы переваривания пищи и всасывания кальция, железа, цинка, лекарственных препаратов при приеме внутрь. При длительном применении ИПП существует риск развития инфекций желудочно-кишечного тракта и легких, т. к. в желудок попадают микроорганизмы из ротовой полости, носоглотки, кишечника. Если они не инактивируются в условиях сниженной желудочной секреции, то некоторые из них могут вырабатывать вещества (канцерогены), которые могут вызывать онкологические заболевания. Длительный прием препаратов, снижающих желудочную секрецию, может привести к
- поносам, вызванным микроорганизмом клостридией,
- грибковому поражению желудочно-кишечного тракта,
- воспалению легких,
- перелому шейки бедра.
Применение антибиотиков в лечении различных заболеваний и, в том числе, хеликобактериозе, несколько ограничено при наличии заболеваний печени, почек, нарушений микрофлоры кишечника, аллергии на антибиотики
Лечение антибиотиками может привести к развитию антибиотико-ассоциированного поноса, ухудшению пищеварения, вызвать дисепсические жалобы – тошноту, рвоту, изменение вкуса, нередко головную боль. Особенно это характерно для пожилых людей. Кроме того, могут развиваться аллергические реакции, вплоть до формирования поливалентной аллергии. Эти побочные эффекты, знакомые нашим пациентам, заставляют многих отказаться от приема антибиотиков из-за риска их развития.
К сожалению, официальные стандарты-IV Маастрихтского соглашения продолжают рекомендовать применение этих схем, однако…
Лечение хеликобактер пилори по-новому
В последние годы официальные стандарты-IV Маастрихтского соглашения пополнились применением препаратов висмута (Денол), пробиотиком Saccharomyces boulardii (препарат Эстерол) – тропического штамма дрожжевых грибов, выделенных из сока личи и манго.
Наиболее перспективным направлением оптимизации лечения хеликобактериоза желудка являлось использование пробиотиков, в первую очередь, лактобацилл в виде монотерапии. Исследования, проведенные российскими, зарубежными учеными и собственные данные подтверждают эффективность пробиотиков для эрадикации хеликобактер пилори. Опыт показал, что применение молочно-кислых бактерий, лактобацилл ацидофилюс, сочетание нескольких штаммов лактобацилл (Трилакт), позволило получить достаточно высокий процент положительных результатов, (39 — 54%) у детей и взрослых. При таком подходе к лечению встает вопрос, какой пробиотик выбрать, при каких заболеваниях желудка и других ситуациях применить, в каком возрасте, какова продолжительность курса.
Как выбрать пробиотик для лечения хеликобактера
Важным условием применения пробиотика является кислотоустойчивость штамма живых микроорганизмов, которая доказана в отношении группы лактобацилл (L.rbamnosus, L.reuteri, L.plantarum, L.acidophilus, способных оказывать прямое действие на хеликобактер пилори. Эти штаммы лактобацилл вырабатывают вещества (метаболиты), которые подавляют рост, обладают антибактериальным действием, снижают активность ферментов хеликобактерий и других микроорганизмов, уменьшают воспаление слизистой оболочки желудка.
Кому показано лечение пробиотиками
Лечение хеликобактерной инфекции с применением только пробиотиков показано:
- лицам, у кого в анамнезе аллергия к антибиотикам,
- при категорическом отказе пациента от приема антибиотиков,
- лицам при выявленном хеликобактериозе без клинических проявлений и жалоб,
- членам семьи пациентов, инфицированных хеликобактером,
- пациентам с хроническим гастродуоденитом, язвенной болезнью вне обострения,
- пожилым людям,
- детям,
- лицам, имеющим поражения печени и почек.
Дальнейшие исследования показали, что положительно действуют не только пробиотики на основе живых микроорганизмов, но и продукты их метаболизма (обмена). На основе этого открытия был разработан в 2014 году в России новый препарат с уникальным антихеликобактерным действием.
Хелинорм – инновационное антихеликобактерное средство из группы метаболиков

Хелинорм содержит в своем составе субстанцию Pylopass – специфический штамм Лактобациллы реутери, обладающий уникальной способностью специфически связываться с клетками хеликобактера, не влияя на нормальную флору.
Связывание снижает подвижность хеликобактерий — бактерии перестают связываться со слизистой оболочкой желудка и вымываются из желудка, что приводит к уменьшению бактерий в слизистой оболочке и снижают риск развития гастрита, язвенной болезни.
Хелинорм – разумная альтернатива антибиотикотерапии при хеликобактериозе.
Курс лечения Хелинормом составляет 4 недели, по 1 капсуле во время еды 1 раз в день.

Курс пробиотиков занимает месяц, например, жидкий пробиотик Трилакт для взрослых 5 мл утром натощак, детям по возрасту, и далее короткими курсами по разработанной много лет назад методике — прием пробиотика по 10 дней каждого месяца, с контролем анализов на хеликобактерную инфекцию и дисбактериоз кишечника.
С профилактической целью в дальнейшем возможно использовать закваски Эвиталия или Нарине, которые позволяют готовить лечебный кисломолочный продукт в домашних условиях, в котором оптимальное сочетание и живых бактерий – лактобацилл, и продуктов их жизнедеятельности. Использовать его в натуральном виде, с добавлением растительных компонентов (овощи, фрукты, отруби), заправлять им разнообразные салаты.
Читайте также:


