Правила работы с инфицированным материалом в лаборатории
При работе с вируссодержащим материалом необходимо выполнять следующие требования:
· не допускать рассеивания вирусов во внешней среде;
· предотвратить контаминацию (загрязнение) вируссодержащего vатериала посторонней микрофлорой;
· обеспечить личную безопасность.
Режим работы вирусологической лаборатории регламентируется законами Российской Федерации, международными правилами проведения диагностических лабораторных исследований, правилами внутреннего распорядка. Весь персонал лаборатории проходит инструктаж и обучение безопасным методам труда, обеспечивается спецодеждой, спецобувью, средствами санитарной защиты и защитными приспособлениями в соответствии с действующими нормами. Вход в производственные помещения посторонним лицам категорически запрещен. Сотрудники вирусологической лаборатории обязаны соблюдать правила работы, предупреждающие загрязнения бактериями и грибами исследуемого материала, возможность заражения персонала и распространения инфекции.
Запрещено выходить за пределы лаборатории в халатах и спецобуви или надевать верхнюю одежду на халат, курить, принимать пищу в производственных помещениях и хранить в них продукты питания. В боксе работают в стерильном халате, маске, шапочке, в некоторых случаях надевают очки и перчатки. Обязательно меняют обувь. Не допускаются хождение и разговоры во время работы.
Весь материал, поступающий в лабораторию на исследование, должен рассматриваться как инфицированный!
С инфекционным материалом следует обращаться крайне осторожно. При распаковке его банки необходимо протирать снаружи дезинфицирующим раствором и ставить их на поднос или в кювет. Рабочее место на столе покрывают несколькими слоями марли, увлажненной 3 – 5 % раствором хлорамина. Жидкости, содержащие вирусы, переливают над кюветами с дезинфицирующим раствором. При работе с пипеткой пользуются грушей. Пипетки, предметные стекла, стеклянную посуду и резиновые изделия, задействованные в работе с инфекционным материалом, обеззараживают погружением в 5 % раствор хлорамина или растворы фенола, лизола, серной кислоты. Запрещается выносить из лаборатории оборудование, инвентарь, материалы и т. д. без предварительной их дезинфекции. По окончании работы рабочее место приводят в порядок и дезинфицируют. Вируссодержащий материал, необходимый для дальнейшей работы, ставят на хранение в холодильник и опечатывают. Руки в перчатках промывают в банке с 5 % раствором хлорамина, затем перчатки снимают, обеззараживают вторично, дезинфицируют и моют.
ТРЕБОВАНИЯ К РАБОЧИМ ПОМЕЩЕНИЯМ И ОБЕСПЕЧЕНИЕ УСЛОВИЙ РАБОТЫ
Современные требования к лабораторным диагностическим комплексам и отдельным составляющим (полы, стены, потолки, системы отопления, вентиляции, водоснабжения и канализации) изложены в правилах лабораторной практики GLP.
Вирусологические отделы лабораторий и научно-исследовательских ветеринарных станций призваны осуществлять лабораторную диагностику вирусных инфекций, контролировать заболеваемость животных, вызываемую вирусами в межэпизоотический период, а также учитывать состояние и напряженность специфического постинфекционного и поствакцинального противовирусного иммунитета, участвовать в организации и проведении профилактических мероприятий в борьбе с вирусными и хламидийными заболеваниями животных в обслуживаемом регионе.
Структура вирусологической лаборатории определяется задачами и особенностями ее деятельности. Размещать лабораторию желательно в двухэтажном здании или в изолированном отсеке. Боксы предпочтительнее располагать с северной, теневой стороны здания, чтобы избежать попадания в них прямых солнечных лучей, или следует застеклить окна боксов молочным или матовым стеклом. Полы в коридорах и комнатах для сотрудников могут быть паркетными, покрытыми лаком; в остальных – из плотного, влагонепроницаемого, устойчивого к дезинфектантам материала. Деревянные полы покрывают пластиком. Стены и потолки лаборатории должны быть также устойчивыми к дезинфектантам, легко подвергаться мойке. В боксах всю площадь целесообразно отделывать кафельной плиткой. Двери боксов должны быть раздвижными. Это позволяет сэкономить площадь и избежать колебания воздуха. В плоскости двери устраивают окошко с небольшой площадкой Целесообразно иметь боксы следующего назначения: для получения и культивирования клеток – 1–2 бокса; для заражения культуры клеток – 1–2, для заражения куриных эмбрионов – 1–2 бокса; для заражения подопытных животных – 1 бокс; для вскрытия подопытных животных – 1 бокс; для склада стерильного стекла – 1 помещение.
Основные диагностические работы должны проводиться в настольных или стационарных ламинарных боксах (разного класса) с системой защиты оператора, предупреждения контаминации исследуемого материала, защиты окружающей среды от вредных и опасных выбросов.
Помещения несколько больших размеров (примерно 4х4 м) выделяют для серологических исследований, уничтожения инфекционного материала, приготовления и стерилизации лабораторной посуды и других материалов, приготовления питательных сред и растворов, а также для сотрудников.
Лаборатория (отдел) вирусологии должна быть обеспечена холодной и горячей водой, желательны подача пара и газа, наличие централизованного вакуум-провода и подачи воздуха под давлением.
Каждый бокс комплектуют соответствующей мебелью и оборудованием. Примерная схема размещения оборудования и приборов представлена на рисунке 1. Наиболее важен стол, размер которого зависит от выполняемых на нем работ. В связи с тем, что многие работы приходится выполнять вдвоем, стол рекомендуется располагать параллельно стене, чтобы два работника сидели друг против друга, или ставить его к стене в виде буквы Т, что позволяет более экономно использовать площадь стола. Шкафчики для стеклянной посуды и мелкого инвентаря можно устроить под столом или повесить на стену. Покрытие лабораторного стола должно быть устойчивым к действию дезинфицирующих веществ. Лабораторные стулья лучше всего металлические, так как они легко очищаются и дезинфицируются. Над рабочим местом устанавливают бактерицидные лампы (БУВ-30). У входа в бокс кладут резиновый губчатый коврик, пропитанный дезраствором. В предбокснике находятся стерильные халаты, колпаки, косынки, маски и тапочки, перчатки, которые надевают перед работой в боксе, и, в зависимости от назначения бокса, соответствующее оборудование (термостат, холодильник, водяная баня, центрифуга и пр.).
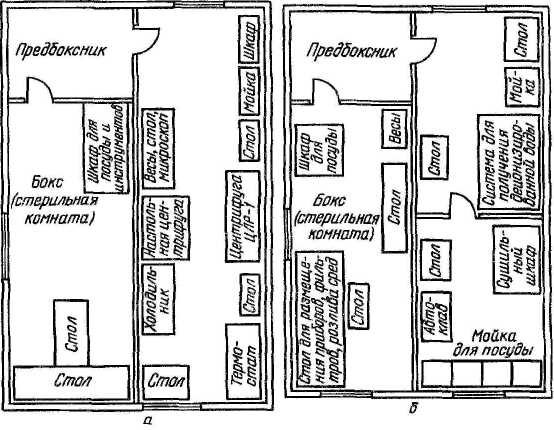
Рисунок 1 - Схема размещения оборудования: а – для работы с культурами клеток, б – для изготовления сред и растворов для культур клеток

Рисунок 2 - Микробиологический защитный бокс I класса:1 – вытяжной вентилятор; 2 - высокоэффективный воздушный фильтр; 3 - смотровая стеклянная панель; 4- открытый проем для рук работающего; 5 - штуцера для подводок воды, воздуха

Рисунок 3 - Бокс с ламинарной подачей стерильного воздуха:1 – газовая горелка, 2 – матрас, 3 – резиновая груша
Ограничить численность бактерий можно с помощью бактерицидных лампБУВ-15 и БУВ-30. Значительного снижения количества бактерий в воздухе боксов и предбоксников, на поверхности столов и другого оборудования можно достигнуть обработкой аэрозолем перекиси водорода и некоторых других веществ. Уборку помещений проводят влажным способом: полы, стены, мебель протирают марлей, увлажненной дезраствором.
Для вирусологической лаборатории любого типа обязательной частью оборудования должен быть настольный бокс, содержащий бактерицидную лампу, еще лучше – ламинарный шкаф с подачей стерильного воздуха (рис. 2, 3).
При работе в вирусологической лаборатории необходимо строго соблюдать методы и правила асептики и антисептики!
Асептика – система мероприятий и приемов работы, предупреждающих попадание микроорганизмов и вирусов из окружающей среды в организм человека, а также в исследуемый материал. Она предусматривает использование стерильных инструментов и материалов, обработку рук сотрудников, соблюдение особых санитарно-гигиенических правил и приемов работы.
Антисептика – комплекс мероприятий, направленных на уничтожение микроорганизмов и вирусов, способных вызвать инфекционный процесс при попадании на поврежденные или интактные участки кожи и слизистых оболочек. В качестве антисептиков используют различные химические вещества: 70%-ный этиловый спирт, 5%-ный спиртовой раствор йода, 0,5–3%-ный раствор хлорамина, 0,1%-ный раствор перманганата калия, 0,5–1%-ный раствор формалина, 1-2%-ные спиртовые растворы метиленового синего или бриллиантового зеленого.
Дезинфекция – обеззараживание объектов окружающей среды путем уничтожения патогенных для человека и животных микроорганизмов и вирусов физическими способами и с помощью химических веществ: растворами хлорной извести (0,1–-10%-ным), формалина, хлорамина (0,5-5%-ным), фенола (3–5%-ным), лизола (3–5%-ным), едкой щелочи (2–3%-ным) и др. Выбор дезинфицирующего вещества и его концентрации зависит от материала, подлежащего дезинфекции.
В лабораториях для дезинфекции боксов чаще всего применяют пары формалина (30–35 мл 40%-ного раствора формальдегида на 1 м 3 помещения), ß-пропиолактон (1,1 л на 100 м 3 помещения) или испаряют карболовую кислоту (не реже одного раза в неделю) и ежедневно делают влажную уборку с применением растворов хлорамина, гидроксида натрия и др.
Стерилизация – обеспложивание, т. е. полное уничтожение микроорганизмов и вирусов в различных материалах. Стерилизацию проводят физическими (воздействием высокой температуры, путем ультрафиолетового облучения, фильтрацией жидкостей через бактериальные фильтры) и химическими методами.
Физические методы стерилизации:
а) прокаливание в пламени спиртовки или горелки. Данный способ применяют для стерилизации препаровальных игл, петель из аппарата Такачи, пинцетов, горловин культуральных сосудов и т. д.;
б) стерилизация кипячением. Этим методом стерилизуют шприцы, мелкий хирургический инструмент, предметные и покровные стекла и другие предметы. Кипятят не менее 30 мин. Однако данный метод не обеспечивает полной стерилизации, так как некоторые вирусы, например вирус гепатита, и споры бактерий могут остаться при этом жизнеспособными;
в) стерилизация сухим жаром в сушильном шкафу. Метод основан на действии нагретого до 165–180°С воздуха. Сухим жаром стерилизуют стеклянную посуду;
г) стерилизация в автоклаве паром под давлением. Это один из наиболее эффективных методов стерилизации, поэтому он широко применяется;
д) стерилизация в аппарате Коха или автоклаве текучим паром (давление 100–150 кПа (1–1,5 атм.), экспозиция 30 мин). Применяют для стерилизации материалов, не выдерживающих воздействия высокой температуры, например питательных сред с витаминами и углеводами;
е) стерилизация ультрафиолетовыми лучами. Метод основан на бактерицидном действии УФ-лучей с длиной волны 260– 300 мкм. Для стерилизации воздуха в боксах используют лампы БУВ-15, БУВ-30. Обычно облучение проводят 1–2 ч;
ж) фильтрование жидкостей через бактериальные фильтры. Этим методом пользуются для освобождения питательных сред, сыворотки крови, витаминов и т. д. от бактерий, но не от вирусов.

Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ - конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой.

Папиллярные узоры пальцев рук - маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни.

Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰).
Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим.
[youtube.player]В-лимфоциты.
Составляют 15-20% от всех лимфоцитов в перефирической крови, Отвечают за развитие гумморального иммунитета. Созревание происходит в костном мозге из полипотентной стволовой клетки. Дальнейшая дифференцировка под влиянием костномозгового гормоноподобного пептида идет образование в К-клетки и НК-клетки (антигено-зависимые и антиген не зависимые) тоансформируется в плазматическую клетку, способную.
Профилактика профессиональных заражений, связанных с работой с инфицированным материалом, является одной из важнейших задач в работе лаборанта. Меры профилактики сводятся к максимальному предотвращению контактов кожи и слизистых оболочек с кровью и другими биологическими жидкостями, для чего необходимо придерживаться следующих правил:
1. Работать в спецодежде: халате, шапочке, сменной обуви, резиновых перчатках. При угрозе разбрызгивания крови работать в очках, маске, клеенчатом фартуке.
2. Повреждения на коже (порезы, царапины) перед работой нужно обязательно заклеить лейкопластырем.
3. Запрещается пипетирование биологического материала ртом. Обязательно использовать автоматические пипетки или резиновые груши.
4. Запрещается есть, пить, курить и пользоваться косметикой на рабочем месте.
5. В случае загрязнения рук кровью их следует немедленно обработать
тампоном, смоченным 1 % раствором хлорамина или 70 % раствором спирта в течение 2 минут, а затем вымыть проточной водой с мылом и протереть индивидуальным полотенцем.
6. При загрязнении кровью перчаток, их протирают тампоном, смоченным в 3 % растворе хлорамина или 6 % перекисью водорода.
7. При загрязнении стола кровью, его немедленно протирают дезраствором дважды с интервалом 15 минут.
8. После работы перчатки дезинфицируют в течении 60 минут в одном из дезинфицирующих растворов.
9. После работы поверхность рабочего стола обязательно продезинфицировать промыть ветошью смоченной в одном из дезрастворов.
10. Лабораторный инструментарий, иглы, капилляры, предметные стекла, кюветы ФЭКа, пипетки, резиновые груши и т.д. после работы должны подвергаться дезинфекции и стерилизации.
11 .Для дезинфекции можно применять следующие растворы:
• Перекись водорода 6 %
• Моющий раствор (0,5 % раствор СМС и 6 % перекись водорода)
• Осветленный раствор хлорной извести 0,6 %
• Дезоксон-1 0,5% и т.д.
• В настоящее время в лаборатории могут применяться другие, более современные дезинфицирующие средства.
В лаборатории нужно соблюдать следующие общие требования:
1. Работать только в спецодежде - халате, колпачке и сменной обуви, при необходимости пользоваться резиновыми перчатками, защитным клеенчатым фартуком, очками или масками.
2. Приступать к работе только после вводного инструктажа и первичного инструктажа на рабочем месте. Повторный инструктаж проводится не реже 1 раза в 6 месяцев.
3. Перед работой внимательно ознакомиться с методикой проведения анализа и в соответствии с этим подготовить свое рабочее место.
4. Перед работой следует убедиться в том, что:
• правильно уяснена методика,
• правильно подготовлены приборы и оборудование,
• взятые вещества соответствуют методике анализа,
• все расставлено так, чтобы было удобно достать, не вставая с места, и самое необходимое находится в пределах оптимальной рабочей зоны, соответствующей размаху согнутой в локтевом суставе руки.
5. Работать только на закрепленном месте.
6. Рабочее место содержать в чистоте, не загромождать его не нужными предметами.
7. Во время работы соблюдать тишину, порядок и чистоту.
8. Не допускать торопливости, невнимательности, беспорядочности и неряшливости.
9. Не покидать рабочее место во время проведения анализа, не оставлять без присмотра включенные приборы.
10. Запрещается выполнять работы не связанные с непосредственной работой
11 .Соблюдать правила ТБ при работе с кислотами, щелочами, летучими и ядовитыми веществами, инфицированным материалом, нагревательными приборами.
12. Соблюдать правила противопожарной безопасности.
13. Не наклоняться близко над склянками реактивами (правильно их нюхайте!).
14.Работать с реактивами только над столом.
15.Пипетировать вещества только пипеткой с грушей или дозатором.
16. Запрещено выливать вещества в канализацию, для этого предусмотрены специальные банки.
17.Не пробовать на вкус в лаборатории любые вещества, даже если они кажется вам знакомыми.
18.В лаборатории запрещается принимать пищу!
19.После работы обязательно вымыть руки с мылом!
20.После работы убрать все приборы и реактивы по местам, выключить все электроприборы, закрыть форточки, краны водоснабжения и протереть рабочий стол.
21. Уметь оказывать первую медицинскую помощь.
| | | следующая лекция ==> | |
| Лимфоциты | | | Управление* - это интегрированный процесс планирования, организации, координации, мотивации и контроля, необходимый для достижения целей организации |
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
[youtube.player]Правила по охране труда и ТБ направлены на предупреждение опасных и вредных производственных факторов, связанных с особенностями работы в лаборатории, основные из них следующие:
1. Химические факторы – возникают при работе с реактивами.
2. Физические факторы – возникают при работе с приборами и аппаратами.
3. Биологические факторы – возникают при работе с инфицированным биологическим материалом.
В лаборатории нужно соблюдать следующие общие требования:
1. Работать только в спецодежде – халате, колпачке и сменной обуви.
2. Приступать к работе только после вводного инструктажа и первичного инструктажа на рабочем месте. Повторный инструктаж проводится не реже 1 раза в 6 месяцев.
3. Перед работой внимательно ознакомиться с методикой проведения анализа и в соответствии с этим подготовить свое рабочее место.
4. Перед работой следует убедиться в том, что:
· правильно уяснена методика,
· правильно подготовлены приборы и оборудование,
· взятые вещества соответствуют методике анализа,
· все расставлено так, чтобы было удобно достать, не вставая с места, и самое необходимое находится в пределах оптимальной рабочей зоны, соответствующей размаху согнутой в локтевом суставе руки.
5. Работать только на закрепленном месте.
6. Рабочее место содержать в чистоте, не загромождать его не нужными предметами.
7. Во время работы соблюдать тишину, порядок и чистоту.
8. Не допускать торопливости, невнимательности, беспорядочности и неряшливости.
9. Не покидать рабочее место во время проведения анализа, не оставлять без присмотра включенные приборы.
10. Запрещается выполнять работы не связанные с непосредственной работой в лаборатории.
11. Соблюдать правила ТБ при работе с кислотами, щелочами, летучими и ядовитыми веществами, инфицированным материалом, нагревательными приборами.
12. Соблюдать правила противопожарной безопасности.
13. Не наклоняться близко над склянками с реактивами (правильно нюхайте!).
14. Работать с реактивами только над столом.
15. Пипетировать вещества только пипеткой с грушей или дозатором.
16. Запрещено выливать вещества в канализацию, для этого предусмотрены специальные банки.
17. Не пробовать на вкус в лаборатории любые вещества, даже если они кажется вам знакомыми.
18. В лаборатории запрещается принимать пищу!
19. После работы обязательно вымыть руки с мылом!
20. После работы убрать все приборы и реактивы по местам, выключить все электроприборы, закрыть форточки, краны водоснабжения и протереть рабочий стол.
21. Уметь оказывать первую медицинскую помощь.
Профилактика профессиональных заражений, связанных с работой с инфицированным материалом, является одной из важнейших задач в работе лаборанта. Меры профилактики сводятся к максимальному предотвращению контактов кожи и слизистых оболочек с кровью и другими биологическими жидкостями, для чего необходимо придерживаться следующих правил:
1. Работать в спецодежде: халате, шапочке, сменной обуви, резиновых перчатках. При угрозе разбрызгивания крови работать в очках, маске, клеенчатом фартуке.
2. Повреждения на коже (порезы, царапины) перед работой нужно обязательно заклеить лейкопластырем.
3. Запрещается пипетирование биологического материала ртом. Обязательно нужно использовать автоматические пипетки или резиновые груши.
4. Запрещается есть, пить, курить и пользоваться косметикой на рабочем месте.
5. В случае загрязнения рук кровью их следует немедленно обработать тампоном, смоченным 1 % раствором хлорамина или 70 % раствором спирта в течение 2 минут, а затем вымыть проточной водой с мылом и протереть индивидуальным полотенцем.
6. При загрязнении кровью перчаток, их протирают тампоном, смоченным в 3 % растворе хлорамина или 6 % перекисью водорода.
7. При загрязнении стола кровью, его немедленно протирают дезраствором дважды с интервалом 15 минут.
8. После работы перчатки дезинфицируют в течении 60 минут в одном из дезинфицирующих растворов.
9. После работы поверхность рабочего стола обязательно продезинфицировать – промыть ветошью смоченной в одном из дезрастворов.
10. Лабораторный инструментарий, иглы, капилляры, предметные стекла, кюветы ФЭКа, пипетки, резиновые груши и т.д. после работы должны подвергаться дезинфекции и стерилизации.
11. Для дезинфекции можно применять следующие растворы:
· Перекись водорода 6 %.
· Моющий раствор (0,5 % раствор СМС и 6 % перекись водорода).
· Осветленный раствор хлорной извести 0,6 %.
· Дезоксон-1 0,5% и т.д.
· В настоящее время в лаборатории могут применяться другие, более современные дезинфицирующие средства.
Практическая работа
Цели практической работы:
· изучить особенности техники безопасности при работе в биохимической лаборатории;
· закрепить умения работать химической пипеткой, мерным цилиндром и др. лабораторной посудой;
· закрепить умения готовить растворы приблизительной концентрации.
Задания для самостоятельной работы:
1. Законспектируйте в тетрадь правила техники безопасности при работе в биохимической лаборатории и правила работы с биологическим материалом в КДЛ.
2. Оборудуйте рабочее место для практической работы согласно методике работы.
3. Выполните практическую работу.
4. Оформите результаты работы в тетради по плану:
· Задание к работе.
· Наблюдения, расчеты, уравнения реакций и т.д.
5. Сделайте вывод по работе.
6. Ответьте на предложенные вопросы.
| Реактивы: 1. Сульфат меди (сухой). 2. Гидроксид натрия (сухой). 3. Серная кислота (конц). 4. Дистиллированная вода. | Оборудование: 1. Пипетки на 1 и 2 мл. 2. Пробирки – 5 шт. 3. Баночка для воды. 4. Мерный цилиндр. 5. Химический стаканчик. 6. Весы и разновесы. 7. Стеклянная палочка. 8. Колба. 9. Фильтр. 10. Воронка. |
Задание № 1. Работа с пипетками.
· Подготовьте пипетки с резиновой грушей на 1 мл или на 2 мл.
· Вспомните, как определяется цена деления мерной посуды.
· Подготовьте 5 пробирок и баночку с водой.
· Налейте в каждую пробирку по 4 мл воды, используя груши на 1 или 2 мл. Работайте медленно. Помните, в работе лаборанта очень важна аккуратность и точность!
· Слейте всю воду из пробирок в мерный цилиндр, и измерь количество воды.
· Если воды в цилиндре меньше или больше, чем 20 мл, то повторите всю операцию с самого начала.
· Если воды в цилиндре ровно 20 мл, то приступайте к выполнению следующего задания.
Задание № 2. Приготовление растворов.
· Произведите расчеты, необходимые для приготовления следующих растворов:
1. 20 мл 5 % раствора сульфата меди.
2. 25 мл 10 % раствора гидроксида натрия.
3. 25 мл 5 % раствора серной кислоты.
· Приготовьте один из предложенных растворов.
· Напишите алгоритм приготовления растворов приблизительной концентрации.
Ответьте на вопросы:
1. Какой биологический материал можно использовать для биохимических исследований?
2. Чем отличается цельная кровь, сыворотка и плазма крови?
3. Как определить цену деления мерной полсуды (на примере цилиндра или пипетки).
4. Как правильно работать со спиртовкой и другими нагревательными приборами.
5. Фильтрование: приборы, правила проведения, промывание осадков.
6. Правила приготовления растворов приблизительной и точной концентрации.
7. Правила приготовления и хранения растворов кислот, щелочей и солей.
8. *На чем основаны методы лабораторных исследований (расскажите с использованием примеров).
9. *Перечислите основные этапы лабораторных исследований. Какие ошибки возможны на каждом из них? Почему?
10. *Перечислите правила хранения и транспортировки биологического материала.
11. *Единицы измерения в лабораторной диагностике. Что обозначает запись: гликемия 5,2 ммоль/л, общий белок 65 г/л.
[youtube.player]( ГБОУ ВПО ТюмГМА Минздрава России)
Кафедра микробиологии
УЧЕБНО-МЕТОДИЧЕСКИЙ КОМПЛЕКС
Дисциплинарный модуль 1
(Общий курс)
Принятые сокращения и условные обозначения
БАК - бактерицидная активность кожи
БАСК - бактерицидная активность сыворотки крови
БГКП - бактерии группы кишечная палочка
ВИЧ - вирус иммунодефицита человека
ВОЗ - Всемирная организация здравоохранения
ВСА - висмут-сульфит агар
ГНТ - реакция гиперчувствительности немедленного типа
ГЗТ - реакция гиперчувствительности замедленного типа
ДРТ - доза рабочего титра
ЖСА - желточно-солевой агар
ИФА - иммуноферментный анализ
ЛС - лекарственное сырьё
М.Е. - международная единица
МПА - мясопептонный агар
МПБ - мясопептонный бульон
ОМЧ - общее микробное число
РА - реакция агглютинации
РИФ - реакция иммунной флюоресценции
РН - реакция нейтрализации
РПГА - реакция пассивной гемагглютинации
РП - реакция преципитации
РСК - реакция связывания комплемента
СПИД - синдром приобретенного иммунодефицита
ЦНС - центральная нервная система
ЦПМ - цитоплазматическая мембрана
Модульная единица 1.1
Морфология и физиология микроорганизмов
ЗАНЯТИЕ 1.1.1
Правила организации и оборудования микробиологической лаборатории(техника безопасности). Морфология эукариотов (грибы)
Цель занятия:
Ознакомиться с принципами организации и оборудования бактериологической лаборатории, правилами работы и соблюдением техники безопасности при работе с патогенными микробами; методами изучения морфологии грибов.
Студент должен знать:
1. Предмет и задачи микробиологии в их историческом развитии.
2. Связь микробиологии с другими дисциплинами.
3. Принципы организации, назначение микробиологической лаборатории. Аппаратура, используемая в микробиологической лаборатории .
4. Типы современных микроскопов.
5. Грибы, их морфология и особенности биологии. Принципы систематики.
Студент должен уметь:
· обеззараживать отработанный инфицированный материал и контаминированные патогенными микробами объекты внешней среды;
· проводить антисептическую обработку рук;
· работать с иммерсионной системой микроскопа.
Студент должен владеть:
методами микробиологических исследований с использованиеммедико-технической аппаратуры.
Работа №1.Структура бактериологической лаборатории, ее оборудование. Техника безопасности
Цель работы: ознакомиться со структурой бактериологической лаборатории и правилами техники безопасности.
Теоретическая справка
Структура бактериологической лаборатории
Работа на кафедре микробиологии и в бактериологической лаборатории требует соблюдения специальных правил, так как исследования проводятся с использованием культур патогенных микроорганизмов и заразного материала от больных и экспериментальных животных. Соблюдение этих правил необходимо для обеспечения не только личной безопасности, но и безопасности окружающих.
Микроорганизмы по степени опасности заражения работающих с ними лиц подразделяют на 4 групп(Классификация, действующая на территории Российской Федерации.В России приняты Санитарные Правила, устанавливающие требования к организационным, санитарно-противоэпидемическим (профилактическим) мероприятиям, направленным на обеспечение личной и общественной безопасности, защиту окружающей среды при работе с патогенными биологическими агентами (Г.Г.Онищенко Санитарно-эпидемиологические правила СП 1.3.2322-08. — ПОСТАНОВЛЕНИЕ РОССИЙСКОЙ ФЕДЕРАЦИИ, 2008):
СП 1.3.2322-08 регламентирует работу с III-IV группой патогенности в соответствии с классификатором патогенов
СП 1.3.1285-03 для работы с I-II группой патогенности
I. Возбудитель чумы, возбудители геморрагических лихорадок Эбола и Марбург (филовирусы), Ласса, Хунин, Мачупо, Себиа, Гуанарит(аренавирусы), натуральной оспы человека и обезьян (поксвирусы).
Ш. Возбудители коклюша, возвратного тифа, столбняка, дифтерии, лепры, ботулизма, брюшного тифа, дизентерии, некоторых микозов, гриппа, полиомиелита, гепатитов А, Е, хламидиозов (трахомы, урогенитального хламидиоза, пневмонии).
IV. Возбудители пневмонии, ОРВИ, конъюнктивитов, пищевых токсикоинфекций, газовой гангрены, септицемии, кандидозов; микробы - показатели санитарного состояния объектов окружающей среды.
Работа с особо опасными микроорганизмами регламентируется специальной инструкцией и проводится в режимной лаборатории.
Работа с возбудителями З и 4 групп проводится в соответствии с правилами устройства, техники безопасности, производственной санитарии в лабораториях СЭС и других бактериологических лабораториях.
Классификация, принятая в США, Канаде, Японии, а также используемая Всемирной организацией здравоохранения, отличается от существующей в России обратным порядком: микроорганизмы наиболее высокой степени патогенности у них отнесены к IV группе.
Группа риска I.Отсутствие или низкая индивидуальная и общественная опасность. Микроорганизмы, потенциально не являющиеся возбудителями заболеваний человека или животных.
Группа риска II.Умеренная индивидуальная опасность, низкая общественная опасность. Патогенные микроорганизмы, которые могут вызвать заболевание, но не представляют серьёзного риска для персонала, населения, домашнего скота или окружающей среды. Неосторожность в лаборатории может вызвать инфекцию, однако существуют доступные лечебные и профилактические меры. Риск распространения ограничен.
Группа риска III.Высокий индивидуальный и низкий общественный риск. Патогенный агент, который обычно вызывает серьёзное заболевание человека или животных, но, как правило, не распространяется от больного к здоровому. Существуют эффективные лечебно-профилактические процедуры.
Группа риска IV.Высокий индивидуальный и общественный риск. Патогенный агент вызывает обычно серьёзное заболевание у человека или животных и легко распространяется от больного к здоровому или опосредованно. Эффективных мер в большинстве случаев не существует.
В структуру любой бактериологической лаборатории входят:
· производственные помещения с ламинарными шкафами или боксами для работы с патогенным биологическим материалом в асептических условиях;
· специально оборудованное помещение для стерилизации питательных сред, посуды, обеззараживания отработанного инфицированного материала;
· моечная, оборудованная для мытья посуды;
· помещение для приготовления питательных сред;
· виварий – помещение, предназначенное для содержания лабораторных животных.
Все помещения лаборатории должны иметь высоту не менее 3 м, быть обеспечены вентиляцией, водопроводом, канализацией, электроэнергией и, по возможности, газом. Стены должны быть окрашены масляной краской или покрыты кафельной плиткой, пол – линолеумом или кафельной плиткой.
Оборудование рабочего стола бактериолога:
· емкость с водой и ванна для промывки препаратов
· предметные стекла и салфетки
· штатив для пробирок с культурами
· пинцет для извлечения стекол
· фильтровальная бумага для высушивания препаратов
· банка для отработанных стекол
· дезинфицирующий раствор (3% хлорсодержащий или др. растворы)
На рабочем месте не допускается наличие посторонних предметов!
Внимательно прочитать!
Студент обязансоблюдать правила работы с инфицированным материалом!
Категорически запрещается:
• находиться в учебной, микробиологической лаборатории без спецодежды (халат, шапочка, сменная обувь); выпускать из-под одежды волосы, воротнички; класть на столы портфели, сумки;
• принимать пищу в учебных лабораториях кафедры;
• оставлять открытыми чашки Петри с культурами микроорганизмов;
• оставлять открытыми пробирки с инфицированным материалом;
• переливать исследуемый материал из одной ёмкости в другую;
• насасывать жидкость в Пастеровскую пипетку ртом;
• разводить дезинфицирующие растворы без перчаток и маски;
• выносить из лаборатории микробные культуры.
Во время работы необходимо:
• при проведении посевов – не разговаривать и не ходить по лаборатории;
• на всех пробирках и чашках с посевами написать название культуры и дату.
По окончании работы необходимо:
• привести в порядок рабочее место;
• использованные пипетки, предметные и покровные стекла, шпатели, ватные тампоны поместить в сосуд с дезинфицирующим раствором;
• пинцеты, бактериологические петли, иглы после работы с исследуемым материалом прожигать в пламени горелки;
• все засеянные пробирки и чашки сдать по счету дежурному студенту для помещения в термостат;
• отработанный материал (культуры, микробный материал) сдать дежурному лаборанту для стерилизации;
• привести в порядок микроскоп.
В случае загрязнения заразным материалом поверхности стола и других предметов, кожи рук и лица – обработать дезинфицирующим раствором, вымыть руки с мылом и немедленно сообщить о случившемся преподавателю.
Методы антисептической обработки рук лабораторных работников, контаминиро-ванных патогенными и условно-патогенными микроорганизмами:
• по окончании работы – руки обрабатывают дезинфицирующим раствором, используют ватные тампоны или марлевые салфетки, смоченные в 70% этиловом спирте;
• первоначально обрабатывают левую, а потом правую кисть руки с учетом менее, а потом более загрязненных мест в следующей последовательности: тыл кисти, ладонная поверхность, межпальцевые пространства и ногтевые ложа;
• при загрязнении рук культурой патогенного микроба или патологическим материалом сразу же обрабатывают данный участок кожи, покрывая его на 3-5минут ватой, смоченной в дезинфицирующем растворе, после обработки рук раствором их моют теплой водой с мылом.
Студент обязан соблюдать правила противопожарной безопасности!
Категорически запрещается:
• зажигать одну спиртовку от другой;
• переносить горящую спиртовку;
• оставлять спиртовку горящей после окончания работы.
Дата добавления: 2018-04-04 ; просмотров: 501 ;
[youtube.player]Читайте также:


