Пцр диагностика орнитоза у

Орнитоз – хламидийная инфекция, протекающая с преимущественным поражением дыхательной системы. Клинические проявления орнитоза включают лихорадочно-интоксикационный синдром, пневмонию, конъюнктивит, гепатолиенальный синдром, признаки нейротоксикоза и менингизма. Диагноз орнитоза подтверждается данными серологических исследований (РСК, РТГА, РИФ, ИФА), микроскопии мокроты, рентгенографии легких. Этиотропная терапия орнитоза проводится антибактериальными препаратами из группы макролидов, фторхинолонов и тетрациклинов; дополнительно используются бронхолитики, противокашлевые препараты, витамины.
Общие сведения
Орнитоз (респираторный хламидиоз, пситтакоз, болезнь попугаев) – зоонозная инфекция, специфическими возбудителями которой выступают хламидии, а источником – птицы. Орнитоз является повсеместно распространенным заболеванием, что обусловлено миграцией птиц. В структуре острых пневмоний, регистрируемых в различных регионах мира, 10-20% случаев имеют орнитозную этиологию. Этот факт требует повышения уровня эпидемической настороженности в отношении орнитоза со стороны специалистов в области пульмонологии. В большинстве случаев регистрируются спорадические случаи орнитоза; реже – семейные, групповые и производственные вспышки. Среди заболевших орнитозом преобладают пациенты среднего и старшего возраста; у детей инфекция развивается сравнительно нечасто.

Причины орнитоза
Заболевание вызывается облигатным внутриклеточным паразитом Chlamydophila psittaci. Особенности жизнедеятельности хламидий обусловливают специфику течения орнитоза. К таким особым свойствам относятся способность возбудителя к размножению внутри клеток, образованию L-формы и сохранению вирулентности в различных условиях, выделению экзо- и эндотоксина, тропизм к клеткам респираторного тракта и системы мононуклеарных фагоцитов и т. д. Возбудитель орнитоза проявляет относительную устойчивость во внешней среде, хорошо переносит низкие температуры. Вместе с тем, быстрая инактивация хламидий наступает при нагревании, воздействии хлорсодержащих дезинфицирующих средств, ультрафиолета, антисептиков.
Природным источником и резервуаром орнитозной инфекции выступают дикие и домашние, в т. ч. декоративные птицы, которые являются бактерионосителями или переносят заболевание в форме ринита или острой кишечной инфекции. Носителями Chlamydophila psittaci могут являться свыше 150 видов птиц, чаще - попугаи, канарейки, утки, куры, индюшки, вороны, голуби (в городах зараженность голубей орнитозом достигает 50-80%). Птицы могут передавать возбудителя потомству на протяжении 2-х и более поколений. В окружающую среду возбудитель орнитоза попадает вместе с носовым секретом и фекалиями птиц. Заражение человека может происходить различными путями: аэрогенным (при вдыхании возбудителя с пылью), контактно-бытовым (через загрязненные возбудителем перья, яйца, предметы обихода) и фекально-оральным (при употреблении инфицированной пищи или занесении возбудителя в рот с грязных рук). В группу повышенного риска по заболеваемости орнитозом входят работники птицеферм, и птицефабрик, зоомагазинов, заводчики голубей и декоративных птиц, а также сельские жители, содержащие на своем подворье домашнюю птицу.
Основной мишенью возбудителя орнитоза в организме человека служат клетки цилиндрического эпителия дыхательных путей, лимфоидные и ретикулогистиоцитарные клетки, в которых происходит размножение и накопление хламидий. Через 2-3 суток пораженные клетки разрушаются, а хламидии, их токсины и продукты жизнедеятельности попадают в кровь, вызывая симптомы аллергизации и интоксикации. Гематогенное распространение возбудителей по организму приводит к поражению легких, миокарда, головного мозга, печени. Патоморфологические изменения во внутренних органах при орнитозе включают очагово-сливную бронхопневмонию, увеличение перибронхиальных и бифуркационных лимфоузлов, гепато- и спленомегалию, дистрофические изменения в паренхиматозных органах. Поскольку хламидии склонны к длительной внутриклеточной персистенции, орнитоз нередко принимает затяжное рецидивирующее течение с образованием ателектазов легких и развитием очагового фиброза или диффузного пневмосклероза.
Симптомы орнитоза
Клиническое течение орнитоза проходит инкубационный период (1-3 недели), продромальный период, период клинических проявлений и период выздоровления. Заболевание может протекать в респираторной, гриппоподобной, тифоподобной, менингеальной и генерализованной форме, а также в остром или хроническом варианте.
Перед манифестацией специфических симптомов острого орнитоза в течение 3-5 дней отмечаются продромальные явления, характеризующиеся недомоганием, общей слабостью, тошнотой, потерей аппетита, субфебрилитетом. Вслед за этим развивается лихорадка с температурой до 39-40°С, которая через несколько суток снижается литически. В лихорадочный период выражены жажда, сухость во рту, миалгии и артралгии. Отмечаются слабо выраженные катаральные явления: першение и боль в горле, насморк, гиперемия слизистой глотки, ларингит. Вследствие тропности возбудителя орнитоза к эндотелию сосудов возникает конъюнктивит, инъекция сосудов склер, носовые кровотечения, кожная сыпь пятнисто-папулезного или розеолезного характера.
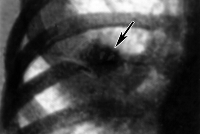
На 3-5 сутки к общеинфекционным симптомам присоединяются признаки поражения легких: боли в грудной клетке, сухой, а затем продуктивный кашель со слизисто-гнойной мокротой. Рентгенологически определяются признаки интерстициальной, мелко- или крупноочаговой, долевой орнитозной пневмонии. К исходу первой недели заболевания увеличивается печень. Для орнитоза характерно поражение нервной системы с признаками нейротоксикоза: головной болью, адинамией, бессонницей, депрессией, при тяжелом течении – галлюцинациями, бредом, эйфорией. Возможно развитие серозного менингита с доброкачественным течением.
Гриппоподобная форма орнитоза характеризуется, главным образом, симптомами общей интоксикации. Тифоподобный вариант инфекции протекает с лихорадкой ремитирующего типа, гепатоспленомегалией и нейротоксическими проявлениями. При менингеальной форме орнитоза на первый план выходят симптомы менингизма. При любой из клинических форм орнитоза реконвалесценция растягивается на 2-3 месяца; в этот период сохраняется астенизация, быстрая утомляемость, снижение трудоспособности, артериальная гипотония, признаки вегето-сосудистой дистонии (акроцианоз, ладонный гипергидроз, тремор, зябкость конечностей). У 10-12% пациентов орнитоз принимает хроническое течение, чаще в виде хронического бронхита или пневмонии с длительным субфебрилитетом, увеличением печени и селезенки, астеновегетативным синдромом.
К редким осложнениям орнитоза относятся: гепатит, нефрит, миокардит, полиневрит, иридоциклит, тиреоидит и др. У беременных орнитоз может вызывать самопроизвольное прерывание беременности.
Диагностика и лечение орнитоза
Основу для постановки клинического диагноза представляют данные эпиданамнеза (тесное контактирование с птицами, групповая заболеваемость) и характерная симптоматика (лихорадка, пневмония, гепатолиенальный синдром и др.). Для лабораторного подтверждения орнитоза проводится микроскопическое исследование мокроты, серологическая диагностика (РИФ, РСК, РТГА, ИФА), исследование биоптатов бронхов, полученных в ходе бронхоскопии, биопроба на куриных эмбрионах.
Орнитозная пневмония диагностируется с помощью физикального обследования и рентгенографии легких. При менингеальных симптомах проводится спинномозговая пункция с исследованием цереброспинальной жидкости. Возможно проведение и анализ внутрикожной аллергической пробы с инактивированной культурой возбудителя орнитоза. Дифференциальная диагностика направлена на исключение ОРВИ, гриппа, атипичной пневмонии, инфекционного мононуклеоза, бруцеллеза, лихорадки Ку, туберкулеза, легионеллеза, глубоких микозов (аспергиллеза, гистоплазмоза, нокардиоза, кокцидиоидоза).
Комплексное лечение орнитоза складывается из этиотропной, патогенетической и симптоматической терапии. Базовыми препаратами для специфической терапии орнитоза служат антибиотики тетрациклинового ряда, макролиды, фторхинолоны, обладающие антихламидийной активностью. При острой форме орнитоза длительность антибактериального курса составляет 10-14 дней; при хроническом течении проводится 2-3 курса антибиотикотерапии с интервалом 7-10 дней и сменой препарата. Патогенетическая терапия орнитоза включает назначение иммуномодуляторов, иммуностимуляторов, поливитаминов, проведение дезинтоксикационных мероприятий. Симптоматическую направленность носит прием жаропонижающих, противокашлевых средств, муколитиков.
Прогноз и профилактика орнитоза
Исход орнитоза, как правило, благоприятный. Однако примерно у четверти больных в ранние (2-4 недели) или поздние сроки (4-6 месяцев) развиваются рецидивы заболевания. При своевременном лечении осложнения орнитоза возникают редко. К числу наиболее опасных из них, сопряженных с риском летального исхода, относятся острая сердечная недостаточность, ТЭЛА. Иммунитет после перенесенного орнитоза нестойкий, возможны повторные случаи заражения.
Неспецифические профилактические мероприятия предусматривают ограничение контакта с птицами, усиление ветеринарного контроля за содержанием птиц на птицефермах и в зоопарках, уничтожение инфицированного поголовья. В очагах орнитоза проводится дезинфекция; лица, подвергшиеся контакту с больными птицами, подлежат медицинскому наблюдению в течение 30 дней с проведением химиопрофилактики инфекции.








ВОЗБУДИТЕЛИ И ЛАБОРАТОРНАЯ ДИАГНОСТИКА ОРНИТОЗА
Целью работы явилось изучить возбудителя и лабораторную диагностику орнитоза.
Задачи исследований:
1. Изучить характеристику заболевания;
2. Изучить лабораторную диагностику заболевания;
3. Изучить профилактику и методы лечения заболевания.
1.Характеристика заболевания.
Орнитоз (респираторный хламидиоз, пситтакоз, болезнь попугаев) – зоонозная инфекция, специфическими возбудителями которой выступают хламидии, а источником – птицы (Рисунок 1). Орнитоз является повсеместно распространенным заболеванием, что обусловлено миграцией птиц. В структуре острых пневмоний, регистрируемых в различных регионах мира, 10-20% случаев имеют орнитозную этиологию.
Рисунок 1. Голубь, болеющий орнитозом
Возбудитель орнитоза попадает в организм человека во время вдыхания пыли. Пыль содержит микроскопические частички испражнений птиц, в которых присутствуют хламидии. Известны случаи орнитоза у людей после вдыхания частиц пуха зараженных особей. Хламидии проникают в организм через слизистые оболочки органов верхних дыхательных путей. После того они попадают в мелкие бронхи и бронхиолы, часто достигая альвеол (конечный отдел респираторного тракта). В результате этого в органах начинается воспалительный процесс. Возбудитель орнитоза размножается в клетках.
2.Характеристика возбудителя.
2.1.История открытия возбудителя. Впервые О. описан в 1875 г. Юргенсеном , наблюдавшим двух больных с атипичной пневмонией, которые имели контакт с больными попугаями. В 1879 г. Риттер и в 1882 г. Финклер сообщили о семейных вспышках заболевания, связанных с болезнью попугаев.В 1892 г. Дюжарденом (Dujardin) описана крупная вспышка подобного заболевания в Париже, связанная с завезенными из Буэнос-Айреса попугаями. Заболело 49 человек, из к-рых 16 умерло. Моранж ( 1895) предложил называть болезнь, возникающую у человека при контакте с попугаями, пситтакозом.В последующие годы вспышки заболевания регистрировались во многих странах (Германия, Англия, Италия и др.).В 1929—1930 гг. в Европе возникла эпидемия пситтакоза — заболело от 500 до 800 человек, летальность доходила до 20—40%. В дальнейшем в разных странах стали выявлять заболевания, связанные с заражением от голубей, чаек, снегирей, кур, уток, индеек и др. Заболевания протекали нетяжело, смертность была редкой. Эту болезнь Мейер в 1942 г. предложил назвать орнитозом.
2.2. Chlamydophila psittaci— вид бактерий из семейства Chlamydiaceae, внутриклеточный паразит, имеет сферическую форму, содержит ДНК и РНК. Возбудитель имеет овоидную или округлую форму диаметром 200—300 нм. Встречаются более крупные частицы возбудителя, имеющие неравномерную плотность и состоящие из рассеянных зерен.
Рис.1 Возбудители орнитоза под микроскопом.
3. Лабораторная диагностика заболевания.
3.1 Культуральные свойства. Хламидии, являясь облигатными паразитами, на искусственных питательных средах не размножаются, их можно культивировать только в живых клетках. Возбудитель хорошо размножается в культурах тканей, на 7-дневных эмбрионах и в организме белых мышей. В культуре ткани микроорганизм не проявляет специфического цитопатического действия. После 3—4 сут культивирования его обнаруживают по цитоплазматическим тельцам. Они являются энергетическими паразитами, так как не способны самостоятельно аккумулировать энергию и используют АТФ клетки-хозяина.
3.2. Биохимические свойства. Способны самостоятельно синтезировать нуклеиновые кислоты, некоторые белки и липиды. Являются энергетически зависимыми от хозяина эндопаразитами. Chlamydia trachomatis обладает гликоген - синтетазной системой (гликоген содержится и выявляется при определенных методах окраски во включениях), синтезирует предшественники фолиевой кислоты и соответственно биохимической активности чувствителен к сульфаниламидам. [8]
3.4. Культуральные свойства. Выделяют поверхностный родоспецифический антиген (ЛПС), локализующийся на наружной мембране клеточной стенки. ЛПС имееи две антигенные детерминанты, одна из них специфична для всего рода, другая перекрестно реагирует с некоторыми другими грамотрицательными бактериями (сальмонеллы серовара minnesota), термостабилен.
3.5. Серологическая диагностика . Методы серологической диагностики основаны на выявлении специфических антител в сыворотке крови, а также в секретах больных и переболевших. Для серодиагностики обычно используют реакцию связывания комплемента (РСК), непрямой иммунофлуоресценции (РНИФ) и реакцию непрямой гемагглютинации (РНГА). Учитывая низкую иммуногенность "урогенитальных штаммов" хламидий при локализованных формах инфекции, возможность наличия антител, связанных с ранее перенесенной хламидийной инфекцией, необходимо исследовать несколько проб сыворотки в динамике заболевания с интервалом в 2 - 3 недели. Первую пробу забирают в момент обращения больного к врачу. Интерпретацию результатов серологического обследования следует проводить в совокупности с анализом клинико-эпидемиологических данных, а также с учетом особенностей использованного серологического теста. Оптимальным является параллельное применение нескольких серологических реакций. Эти серологические тесты могут быть также использованы для проведения эпиднадзора за хламидиозами.
3.6. Антигенное строение возбудителя. Возбудитель мелиоидоза имеет сложное антигенное строение (5 антигенов) и родство с возбудителем сапа, что устанавливается РСК, РА и МФА.
К высокой температуре и действию дезинфицирующих средств возбудитель мелиоидоза неустойчив. Нагревание до 56 °С убивает его через 10—15 мин; 1%-ный раствор фенола, 0,5%-ный раствор формалина — через 10 мин. На холоде ( -4°С) погибает через 2—3 недели. Устойчив к высушиванию. В воде сохраняет жизнеспособность до 44 дней, в фекалиях—до 27 дней, в моче — до 17 дней.
3.7. Серологическая диагностика. Для серодиагностики применяют реакции агглютинации, гемагглютинации и связывания комплемента. Ни одна из них не позволяет дифференцировать мелиоидоз от сапа. Наиболее достоверные результаты дает реакция гемагглютинации. У больного рекомендуется проводить все три реакции парными сыворотками, взятыми с десятидневным интервалом. Для аллергической диагностики применяют аллерген(мелиоидин). Для постановки проб используется уайт-морин (препарат, аналогичный маллеину) или капсульный антиген.
3.8. Биопроба. Исследуемый материал вводят белым мышам массой 6 - 7 г в мозг или внутрибрюшинно, соответственно, по 0,03 мл и 0,2 мл. Слепые пассажи проводят через 6 - 7 дней, используя для этого 10% взвеси мозговой ткани или селезенки и печени - в зависимости от способа заражения. Мазки-отпечатки тканей биопробных животных (белых мышей), соответствующих пути заражения, окрашивают аналогично по Маккиавелло либо по Романовскому-Гимзе. Элементарные тельца имеют фиолетово-синюю окраску.[3]
4. Устойчивость возбудителя. К физическим и химическим влияниям хламидии обнаруживают значительную устойчивость. Возбудитель относительно устойчив во внешней среде. Хорошо переносит низкие температуры, но не выдерживает высокие температуры( при 60 0 С гибнет через 10 минут, при более высокой практически мгновенно). Так же не устойчив к химическим веществам, таким как эфиры, формальдегиды, УФИ.
5.Особенности специфической профилактики и иммунитет. В промышленном птицеводстве лечение не проводят. Прежде чем начать лечение домашней птицы, необходимо учесть ее ценность и степень развития процесса, в запущенных случаях лечение неэффективно.
Для лечения больной птицы применяют антибиотики широкого спектра действия, в особенности тетрациклин, окситетрациклин, байтрил, кол-мик-Е, эриприм и другие и их комбинации. Иногда голуби, подвергшиеся длительному лечению, по-прежнему вьщеляют возбудитель и загрязняют окружающую среду.Для лечения и медикаментозной профилактики при добавлении препаратов к питьевой воде целесообразно применять водорастворимые антибиотики вместе с витаминами.В птицеводческих хозяйствах после подтверждения диагноза больная птица подлежит уничтожению независимо от ее ценности.
Библиографический список:
Безденежных, И. С. Орнитозы: Эпидемиология и профилактика [Текст] / А. Я. Батраков. - Л. : Колос, 2008. - 136 с. : ил. - Библиогр.:с.134-135.
Казанцев, А. П. Орнитоз [Текст] / Казанцев А. П. О// Ветеринария. - 2008. - № 5. - С. 41-43.
Ильинский, Ю. А. Орнитоз. Клиника, диагностика, лечение [Текст] / Ильинский Ю. А. - М. : Колос, 2007. - 376 с. : ил. - Библиогр.в конце разд.
Ильина, А. И. Инфекционные болезни животных [Текст] / А. И. Ильина, А. И. Поспелов. - Л. : Колос, 2006. - 143 с.
Колос, А. Справочник ветеринарного врача [Текст] / А. Колос // Сельское хозяйство. - 2010. - № 12. - С. 25-26.
Лебедев, П. Т. Справочник ветеринарного врача [Текст] / П. Т. Лебедев, А. Г. Обухова. - 2-е изд.,перераб.и доп. - М. : Россельхозиздат, 2008. - 192 с. : ил. - Библиогр.:с.190.
Полянцев, Н. И. Эпизоотология с микробиологией [Текст] / Н. И. Полянцев. - М. :Росагропромиздат, 2007. - 240 с. : ил. - ISBN 5-260-00033-1
Бессарабов , Б. Ф. Болезни певчих и декоративных птиц [Текст] / Б.Ф. Бессарабов // Зоотехния. - 2012. - № 3. - С. 24-25.
Вяянанен, В. И. Диагностика хламидийных инфекций [Текст] / В. И. Вяянанен// Ветеринария. - 2006. - № 9. - С. 36-39.
За звучной аббревиатурой ПЦР скрывается сложная и не слишком понятная для рядового пациента расшифровка — полимеразная цепная реакция. Что же такое ПЦР-диагностика, на чем она основана и почему в последнее время ее стали считать самой перспективной технологией в постановке диагнозов, касающихся инфекционных и вирусных заболеваний? Мы расскажем о преимуществах ПЦР-метода, его особенностях и этапах проведения.
ПЦР-диагностика: что это такое?
Диагностика методом ПЦР существует чуть более 30 лет. Значительно эволюционировав за это время, она зарекомендовала себя как один из наиболее точных способов выявления инфекций. В основе метода лежит принцип многократного увеличения микроскопических концентраций фрагментов ДНК возбудителя в биологической пробе пациента в искусственных условиях. В результате сложного процесса, называемого амплификацией, под воздействием ферментов и изменения температуры (от 50 до 95°С) из одной молекулы ДНК образуется две. При этом происходит копирование участка ДНК, который присутствует только у того вида патогенного микроорганизма, который интересует врача.
Цикл образования новой молекулы ДНК занимает всего около 3 минут, а тридцати-сорока циклов вполне достаточно, чтобы получить количество молекул, необходимое для достоверного визуального определения методом электрофореза.
Кроме амплификации, то есть простого увеличения числа копий молекулы ДНК, с помощью ПЦР можно производить и другие манипуляции с генетическим материалом, например, сращивать фрагменты ДНК, вводить мутации и т.д. Это позволяет использовать ПЦР не только для диагностики инфекционных и генетических заболеваний, но и для установления отцовства, клонирования и выделения новых генов.
ПЦР-диагностика проводится в специальных лабораториях с помощью амплификационного оборудования. На сегодня существует множество различных модификаций ПЦР, включая технологии с использованием не только ДНК, но и фрагментов рибонуклеиновой кислоты (РНК). В некоторых из них амплификация осуществляется при постоянной температуре, и для их проведения специальное оборудование не требуется.
Еще одна популярная модификация ПЦР — мультиплексная амплификация (МПА), которая позволяет проводить исследование сразу нескольких изучаемых фрагментов в одной пробирке. Это не только ускоряет и удешевляет проведение анализа, но и позволяет рассматривать одни фрагменты, получившиеся в результате реакции, в качестве положительных маркеров для других, что еще больше увеличивает точность исследования методом ПЦР.
В клинической медицине ПЦР-диагностика является одним из наиболее востребованных методов анализа в самых разных сферах:
- Прямое определение возбудителя инфекции. Некоторые традиционные методы, такие как иммуноферментный анализ (ИФА), выделяют только белки-маркеры, которые являются продуктом жизнедеятельности возбудителей инфекции, а потому только косвенно указывают на присутствие микроорганизмов. Наличие специфического участка в ДНК, выявленное с помощью ПЦР, безошибочно или почти безошибочно указывает на присутствие конкретной инфекции.
- Высокая специфичность метода . Она обусловлена тем, что в исследуемом материале выявляется фрагмент ДНК, характерный только для конкретного возбудителя инфекции. Специфичность исключает возможность ложных результатов анализа, тогда как в иммунологических методах исследований ошибки вполне вероятны из-за перекрестной реакции антигенов.
- Высокая чувствительность . При помощи ПЦР-диагностики можно выявить присутствие в организме даже единичных клеток вирусов или бактерий в тех случаях, когда обычными методами сделать это практически невозможно. ПРЦ определяет наличие всего 10–100 клеток в пробе, тогда как иммунологическими и микроскопическими тестами можно определить наличие инфекции при количестве клеток не менее 103–105.
- Универсальность . Сходство состава всех ДНК или РНК дает возможность применять универсальные методы лабораторных исследований, диагностируя сразу несколько возбудителей из одной биологической пробы.
- Скорость получения результатов . Поскольку для проведения ПЦР-диагностики не нужен посев и выделение культуры возбудителя, то и большого количества времени на нее не требуется. Весь цикл — от забора биоматериала до получения результатов — занимает 4–5 часов.
- Диагностика латентных инфекций . ПЦР-методом диагностируются трудно культивируемые и некультивируемые формы микроорганизмов, встречающиеся в тех случаях, когда заболевание протекает в скрытой форме.
Методом ПЦР можно выявлять возбудителей инфекции не только в организме человека, но и в почве, воде, продуктах питания.
Тем не менее не стоит думать, что ПЦР-диагностика не имеет недостатков. У нее есть свои ограничения, но их количество настолько незначительно, что не может отрицательно повлиять на популярность и эффективность метода:
- Вероятность амплификации ДНК не только живого, но и погибшего микроорганизма . При проведении ПЦР-диагностики для контроля эффективности лечения необходимо соблюдать определенные требования. В частности, проводить ПЦР нужно после определенного промежутка времени (1–2 месяца), за который происходит полное исчезновение возбудителя инфекции в организме.
- Возможность возникновения перекрестной реакции . Подбор фрагментов ДНК (праймеров) осуществляется на основе знаний о генетическом строении конкретного микроорганизма. Но теоретически такой же фрагмент может присутствовать и у других микроорганизмов, геном которых на сегодняшний день еще не расшифрован. Их присутствие в пробе может привести к ложноположительному результату анализа.
- Изменчивость микроорганизмов . Эта способность возбудителей к мутации иногда приводит к тому, что некоторые их штаммы становятся неуловимыми в процессе ПЦР-анализа.
Чтобы уменьшить риски, разработаны стандарты объемов испытаний тест-систем ПЦР-диагностики, включающие проверку на перекрестные реакции и тестирование всех известных штаммов конкретного возбудителя.
ПЦР-диагностика проводится в специальной лаборатории в несколько этапов.
- Забор биоматериала . Процедура, предшествующая непосредственному анализу, которая осуществляется в процедурном кабинете соответствующего профиля. Забор делается с помощью стерильного оборудования только в стерильные пробирки. Материалом для исследования могут быть:
- Эпителиальные соскобы со слизистых оболочек: из уретры, из цервикального канала, со слизистой дыхательных путей и зева, из конъюнктивы. Забор проводится с помощью специального ершика, при этом недопустимо попадание в материал следов крови.
- Моча . Собираются первые 50 г утренней мочи в стерильную емкость. Материал используется для диагностики мочеполовых инфекций.
- Мокрота . Используется для ПЦР-диагностики туберкулеза и респираторных форм микоплазмоза и хламидиоза. Мокроту собирают в стерильный флакон в количестве 15–20 мг.
- Кровь, сыворотка, плазма . С их помощью диагностируются гепатиты, герпес, ВИЧ-инфекция. Для анализа используется венозная кровь (1–1,5 мл), собранная у пациента натощак в стерильную пробирку. Хранить биоматериал можно не более суток при температуре 4°С. Замораживать кровь категорически запрещается.
- Биологические жидкости . К ним относятся слюна, сок простаты, околоплодная, плевральная, спинномозговая, суставная жидкости. Собираются при помощи пункции с использованием стерильного инструментария в количестве 0,1–1,5 мл в стерильные пробирки.
- Биоптаты , т.е. материалы, полученные путем биопсии. Обычно на анализ отправляют биоптаты двенадцатиперстной кишки или желудка, чтобы выявить хеликобактерную инфекцию. Объем материала 2–3 мм 3 .
- Хранение и транспортировка биоматериала . Хранить образцы можно при комнатной температуре не более 2 часов. Если необходимо длительное хранение, то пробы помещают в холодильник с температурой 2–8°С на срок не более одних суток. Допустимо хранение некоторых биоматериалов в течение двух недель в замороженном виде при температуре -20°С. Оттаивание и повторное замораживание проб запрещено. Транспортировка, если она необходима, должна проводиться в специальных термоконтейнерах или термосах с соблюдением всех правил хранения и перевозки биоматериалов.
- Выделение ДНК из образца . Способ выделения зависит от вида определяемого микроорганизма и от вида биологического образца. Если, например, анализируется соскоб эпителиальных клеток, используется так называемый метод твердофазной сорбции, заключающийся в добавлении в образец специального вещества, концентрации ДНК на сорбенте и его многократной отмывке буферным раствором.
- Проведение ПЦР . Некоторое количество образца из биологической пробы переносится в специальную микроцентрифужную пробирку. Туда же добавляется амплификационная смесь, имеющая сложный состав, в объеме 25 мл. Пробирки устанавливают в программируемый термостат, и автоматическом режиме проводится амплификация. Время ее проведения зависит от заданной программы и составляет 2–3 часа. Одновременно с опытными пробами проводятся контрольные — положительные , включающие в себя контрольный препарат ДНК исследуемого возбудителя, и отрицательные , не содержащие исследуемую ДНК. Количество циклов амплификации варьирует от 30 до 40, более 40 циклов проводить не рекомендуется, так как это способствует увеличению количества неспецифических продуктов в пробе.
- Регистрация результатов . Фрагмент ДНК, характерный для возбудителя инфекции, выделяют методом электрофореза в присутствии специального вещества — бромистого этидия. Его соединение с фрагментами ДНК дает светящиеся полосы при облучении ультрафиолетовым излучением. Образец помещают в камеру для электрофореза и в течение 35–40 минут проводят разделение продуктов амплификации. После этого образец просматривают в ультрафиолетовом свете — наличие оранжевой светящейся полосы свидетельствует о положительном результате.
- Интерпретация результатов исследования . Результат ПЦР-диагностики может быть либо положительным, либо отрицательным. Положительный результат говорит о том, что в организме человека обнаружены следы инфекции, причем именно в данный момент времени. Количественный результат ПЦР-анализа оценить может только врач, они индивидуальны для разных типов инфекций. На основании количественного результата можно сделать вывод о степени активности заболевания и определить характер лечения.
Цена ПЦР-диагностики зависит от того, на какую конкретно инфекцию пациент планирует проверяться, от вида анализируемого материала, методики тестирования — качественной или количественной. Цена за определение одной инфекции составляет от 200 до 800 рублей в разных клиниках. Кроме того, к стоимости анализа добавится и плата за забор биоматериала — около 400 рублей. Средняя стоимость ПЦР-диагностики разных видов приведена в таблице 1.
Таблица 1 . Примерные цены на анализы ПЦР в Москве
| Название анализа | Цена, руб. |
| Определение ДНК хламидия | 750 |
| Определение ДНК микоплазмы хоминис | 540 |
| Определение микоплазмы гениталиум | 350 |
| Определение ДНК уреаплазмы | 350 |
| Гонококк, определение ДНК | 350 |
| Определение ДНК герпеса (разные типы) | 350–600 |
| Определение ДНК кандиды | 570 |
| Вирус краснухи, определение РНК | 800 |
| Дифференцированное определение ДНК ВПЧ (разные типы) | 350–1900 [1] |
Читайте также:


