Папилломавирусная инфекция лечение препараты cin 1
Рассмотрено лечение влагалищного дисбиоза у пациенток с папилломавирусной инфекцией с учетом международных рекомендаций. Состояние микробиоценоза влагалища и его своевременная коррекция с дополнительным применением иммуномодуляторов положительно может вли
The study was performed on the treatment of sheathed disbiosis in patients with the papyloma virus infection taking into account international recommendations. The state of micro biocenosis of sheath and its timely correction with the additional application of immune modulators can positively influence the flow of papyloma virus.
.jpg)
За последнее десятилетие установлено, что критическим фактором в патогенезе цервикальных интраэпителиальных неоплазий (ЦИН) и рака шейки матки (РШМ) является инфицирование вирусом папилломы человека (ВПЧ). Особое значение имеют так называемые онкогенные типы ВПЧ (16-й, 18-й, 31-й, 33-й). Особую актуальность этой проблеме придает широкое распространение папилломавирусной инфекции. На сегодняшний день по данным различных авторов распространенность ВПЧ среди населения в возрасте 15–49 лет составляет от 5% до 20%, а среди сексуально активных женщин 16–25 лет от 10% до 40%. При этом отмечается рост заболеваемости раком шейки матки, особенно среди женщин репродуктивного возраста [6].
Вероятность инфицирования ВПЧ при половом контакте достигает 60–67%. Риск инфицирования выше у молодых женщин, особенно у подростков, т. к. эпителий шейки матки в этом возрасте более восприимчив к трансформирующему действию инфекций, что связано с его незрелостью и, по мнению ряда авторов, отсутствием специфического иммунитета [3–5].
Однако установлено, что ВПЧ является ведущим, но не единственным фактором цервикального канцерогенеза. Влагалище и шейка матки представляют собой единую анатомо-функциональную систему, поэтому патология этих локализаций редко бывает изолированной. Важными кофакторами канцерогенеза считаются влагалищный дисбиоз и цервикальное воспаление.
ВПЧ, попадая в нижние отделы генитального тракта женщины, вызывает папилломавирусную инфекцию (ПВИ), которая может протекать в различных формах: латентной (отсутствие клинических и морфологических изменений при обнаружении ДНК ВПЧ), субклинической (плоские кондиломы, малые формы поражения многослойного плоского эпителия) и клинической (экзофитные кондиломы, вирусные вульвовагиниты и цервициты, а также ЦИН и РШМ).
Следует отметить и то, что ПВИ часто встречается с другими заболеваниями, передающимися половым путем, и как микст-инфекция выявляется в 71% случаев. При этом с генитальным кандидозом ПВИ сочетается в 33,3% случаев, с бактериальным вагинозом (БВ) — в 66,7% случаев, генитальным герпесом и цитомегаловирусной инфекцией — в 37% случаев, хламидийной и микоплазменной инфекцией — в 46,3% случаев [1, 7]. Сочетание ПВИ с другими инфекциями оказывает заметное влияние на клинические проявления, особенности течения, прогноз и устойчивость к терапии. При ПВИ могут наблюдаться различные типы влагалищного мазка по классификации Е. Ф. Кира (1995 г.) — промежуточный, дисбиоз влагалища, вагинит (воспалительный тип мазка).
При наличии кофакторов канцерогенеза — влагалищного дисбиоза и цервикального воспаления присоединяются дополнительные механизмы.
Так, при влагалищном дисбиозе на эпителий шейки матки воздействуют нитрозамины, выделяющиеся в процессе жизнедеятельности анаэробных бактерий, а также другие факторы агрессии, выделяющиеся грибами рода Candida на фоне усиленной адгезии к эпителиоцитам при сочетании БВ и вульвовагинального кандидоза, вызывающие патологические изменения в тканях. Кроме того, влагалищный дисбиоз и ВПЧ ведут к снижению выработки SIgA, что также способствует персистенции ВПЧ, увеличению площади атипичного со сниженной концентрацией гликогена эпителия шейки. Это еще больше снижает секрецию SIgA и усугубляет влагалищный дисбиоз. При хроническом цервикальном воспалении происходит миграция натуральных киллеров и фагоцитов, которые высвобождают медиаторы воспаления, ассоциированные с ЦИН и РШМ, а также происходит повышенная продукция антимикробных оксидантов, которые могут вызвать окислительные повреждения ДНК хозяина (Минкина Г. Н., Манухин И. Б., 2001).
Интересно, что при эктопии на фоне ПВИ и влагалищного дисбиоза выявлен более высокий, чем без эктопии, уровень пролиферативной активности базальных и парабазальных клеток, при этом отмечен дисбаланс иммунной системы по показателям клеточного иммунитета (CD4, CD8, CD3) интерферонового статуса, содержания цитокинов и SIgA, что можно связать с высоким онкогенным потенциалом изменений шейки матки на фоне ПВИ и влагалищного дисбиоза (Вотрина И. Р., Рудакова Е. Б., 2004).
Изменения на шейке матки при ПВИ проходят несколько этапов: от ЦИН различной степени выраженности до РШМ. Существует представление о следующих вариантах развития изменений эпителия шейки матки при ЦИН: регресс-спонтанное без лечения исчезновение признаков неоплазии в пласте экзоцервикса, дальнейшее прогрессирование изменений, персистенция ЦИН, полное отсутствие каких-либо изменений в течение длительного времени. При ЦИН 1-й степени (ЦИН 1) вероятность этих событий составляет: регресс — от 40% до 75% случаев, прогрессирование от 5% до 10% случаев, персистенция — от 29% до 43% [4, 6].
В настоящее время не существует этиотропной терапии и практически отсутствует системное лечение пациенток с ВПЧ-ассоциированной патологией шейки матки. Тем не менее сформулированы два принципа лечения этой группы пациенток [5, 8, 9]:
- использование различных деструктивных методов (хирургические и физические методы, цитотоксические вещества, химические средства);
- применение иммуномодулирующих препаратов преимущественно с противовирусной активностью: Изопринозин, Гроприносин, а также Галавит ® .
Безусловно, такой подход оправдан при всех субклинических и клинически выраженных формах ПВИ. Исключение составляет группа пациенток с ЦИН 1 без гиперпластических проявлений ПВИ. Алгоритм ведения таких пациенток четко не определен. В связи с высокой вероятностью регресса при ЦИН 1 в качестве тактики выбора может применяться наблюдение с цитологическим контролем через 6–12 месяцев или ВПЧ-тестирование через 12 месяцев [6].
С учетом всей вышеизложенной информации нами совместно с Лазаревой О. В., Мозговым С. И., Редькиным Ю. В., Батуровой О. Г. (Омская государственная медицинская академия) проведено исследование по изучению влияния нормализации влагалищного микробиоценоза (при бактериальном вагинозе, специфическом и неспецифическом вагините и цервиците) и иммуномодулирующей терапии у 76 пациенток в возрасте от 18 до 35 лет с ЦИН 1 на фоне ПВИ (без гиперпластических разрастаний) и влагалищного дисбиоза на течение ПВИ и ЦИН при их информированном согласии [8].
Лечение бактериального вагиноза, специфического и неспецифического вагинита и цервицита проводилось в соответствии с принятыми стандартами, с учетом международных рекомендаций CDC (Centers for Disease Control and Prevention). Системная терапия дополнялась местным применением комбинированного препарата Полижинакс. Выбор препарата для местного применения определялся его широким спектром действия за счет двух антибиотиков и антимикотика, а также возможностью быстрого достижения противовоспалительного клинического эффекта без применения кортикостероидов, что является принципиальным при лечении пациенток с генитальной вирусной инфекцией, так как не имеет побочных эффектов на местный и общий иммунитет. Важным компонентом в составе Полижинакса является диметикон, который позволяет быстро и равномерно распределить лекарство в складках влагалища, обладает защитным, противозудным действием, усиливает местное действие компонентов препарата, полностью исключая системные эффекты входящих в состав лекарств. Экципиентный состав, в который входят соевый лецитин, фосфолипиды, аминокислоты, витамины А, Е, Д, также обладает трофическим, восстанавливающим и противовоспалительным действием. Важно, что Полижинакс не влияет отрицательно на лактобациллы. Препарат применялся вагинально 1 раз в сутки в течение 6 дней.
Иммуномодулирующая и противовоспалительная терапия проводилась препаратом Галавит ® (аминодигидрофталадизион натрия) по следующей схеме: 5 дней по 1 ректальному суппозиторию 1 раз в день, далее по 1 ректальному суппозиторию через день. На курс — 20 суппозиториев. Выбор препарата обусловлен тем, что Галавит ® — единственный препарат, в инструкции которого зарегистрировано сочетание противовоспалительного и иммуномодулирующего действия (коды АТХ: L03, G02). Препарат доказал хорошую терапевтическую эффективность в лечении целого ряда вирусных и бактериальных инфекций и вторичных иммунодефицитных состояний в гинекологической практике [2, 9].
Противовоспалительное действие препарата реализуется за счет направленного торможения выброса активными макрофагами избыточного количества цитокинов воспаления (ИЛ-1, ИЛ-6, ФНО-альфа). Галавит ® также обладает иммуномодулирующими свойствами (нормализует функциональную активность иммунокомпетентных клеток, стимулирует выработку собственного интерферона), чем способствует формированию эффективного иммунного ответа.
Галавит ® проявляет как антиоксидантные свойства, так и прооксидантные свойства, поскольку стимулирует клеточное дыхание, увеличивая продолжительность жизни и функциональную работоспособность иммунокомпетентных клеток в экстремальных условиях (воспаление, гипоксия, интоксикация и прочее). Выраженное противовоспалительное действие препарата Галавит ® выгодно отличает его от других иммуномодуляторов, для которых характерно, как правило, провоспалительное действие. Кроме того, в отличие от кортикостероидов и нестероидных противовоспалительных препаратов, Галавит ® не только не оказывает повреждающего воздействия на желудочно-кишечный тракт, но, напротив, обладает репаративными и противоязвенными свойствами.
Контрольное изучение влагалищного микробиоценоза проводилось сразу после окончания лечения, РАР-мазки (тест Папаниколау) и ВПЧ- тестирование — через 6 и 12 месяцев.
Результаты исследования показали, что нормализация влагалищного микробиоценоза произошла у всех женщин. Через 6 месяцев ДНК ВПЧ не определялась в шейке матки у 22 пациенток (28,9%), а ЦИН 1 — у 16 пациенток (20,5%). Через 12 месяцев ДНК ВПЧ не определялась еще у 24 пациенток, а ЦИН 1 — еще у 19 пациенток. В целом без применения деструктивных методов при наблюдении в течение года у пациенток репродуктивного возраста на фоне ПВИ и нарушенного микробиоценоза влагалища (бактериального вагиноза, специфического и неспецифического вагинита и цервицита) в общей сложности элиминация ВПЧ произошла в 58,9% случаев, а регрессия ЦИН — в 44,9% случаев.
Таким образом, результаты нашего предварительного несравнительного когортного исследования подтверждают литературные данные о том, что состояние микробиоценоза влагалища и его своевременная коррекция с дополнительным применением препаратов иммуномодулирующего и противовоспалительного действия положительно влияет на течение папиломавирусной инфекции (ПВИ и ЦИН 1) у женщин.
Литература
Е. Б. Рудакова, доктор медицинских наук, профессор
ГУЗ Московский областной перинатальный центр, Балашиха
Е.В. Файзуллина
Казанский государственный медицинский университет
Генитальная папилломавирусная инфекция является распространенным заболеванием, передающимся половым путем. Вирус папилломы человека (ВПЧ) — высокоспецифичная в отношении человека инфекция, обладающая способностью инфицировать эпителиальные клетки, вызываемая вирусом из семейства Papovaviridea. Инфицирование ВПЧ половых органов, так же как и кожных покровов, происходит при наличии микротравм, при этом резервуаром ВПЧ-инфекции служат уретра, бартолиниевы железы, семенная жидкость. Идентифицировано более ста видов ВПЧ, из которых 35 инфицируют урогенитальный тракт человека, вызывая поражение покровного эпителия кожи и слизистых оболочек половых органов. ВПЧ-инфекция является наиболее распространенной инфекцией, передаваемой половым путем (ИППП), которой инфицирована большая часть сексуально активного населения. Кроме этого, папилломавирусы — единственная группа вирусов, для которых доказана индукция опухолей у человека. Число инфицированных в мире за последнее десятилетие увеличилось в 12 раз (Молочков В.А., 2004).
МКБ X пересмотра, раздел А 63. Аногенитальные бородавки.
Этиология
Вирус, относящийся к роду А семейства Papovaviridea, сохраняется при температуре 50?С в течение 30 минут. В процессе репликационного цикла геном вируса экспрессирует от 8 до 10 белковых продуктов; за онкогенные свойства вируса ответственны онкопротеины Е6 и Е7. По онкогенной активности различают ВПЧ низкой степени риска — HPV6, 11,42,43,44; средней – HPV31,33,35, 51,52, 58 и высокой — HPV16, 18,45,56 степени риска. Одним или более типами ВПЧ инфицировано не менее 50% взрослого населения, живущего активной половой жизнью, в большинстве случаев генитальная ВПЧ-инфекция у них является нераспознанной, протекающей субклинически или асимптомно. Генитальная ВПЧ-инфекция имеет высокую контагиозность; заражение при однократном половом контакте происходит примерно в 60% случаев.
Патогенез
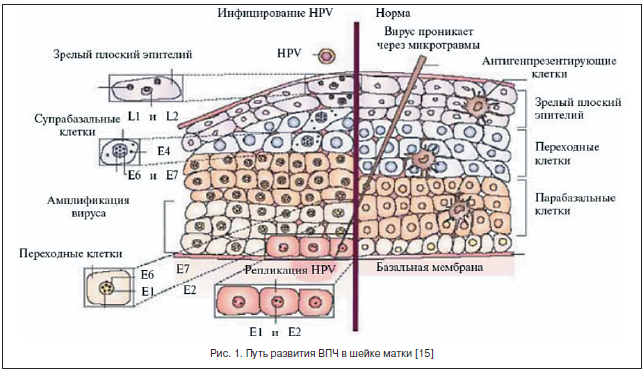
Инвазия вируса происходит через микроповреждения тканей. ВПЧ инфицирует стволовые клетки базального слоя, которые затем являются постоянным источником инфицирования эпителиальных клеток. Вирусы инфицируют делящиеся незрелые клетки базально-клеточного слоя, находящиеся близко к поверхности, что во многом объясняет частоту инфицирования шейки матки и нижней трети влагалища и вульвы.
Вирусная ДНК включается в ядерный материал клетки хозяина. Интегрированная форма ВПЧ способна к злокачественной трансформации, поскольку вирусная ДНК начинает контролировать клеточный генетический материал для воспроизводства ВПЧ-кодированных белков. Интеграция ВПЧ высокого риска в клеточный геном хозяина усиливает продукцию двух онкопротеинов — Е6 и Е7, взаимодействующих с эндогенными клеточными регуляторными белками, ведущими к дерегуляции цикла клеточной прогрессии, что является разрешающим моментом в формировании цервикальной неоплазии, образованию плоских кондилом, невидимых вооруженным глазом (Прилепская В.Н., 1997).
Однако по мнению В.А. Молочкова и соавт. (2004), инфицирование эпителиальных клеток ВПЧ является необходимым, но не достаточным событием для развития рака. Для формирования необратимой неоплазии необходимы следующие факторы: во-первых, активная экспрессия генов Е6 и Е7, причем высокоонкогенных типов ВПЧ-16 и 18; во-вторых, индукция метаболических механизмов конверсии эстрадиола в 16-ОН; в третьих, индукция множественных повреждений хромосомной ДНК в инфицированной клетке, которая завершает процесс перерождения.
Первая стадия неоплазии CIN I характеризуется активной репликацией вируса и его бессимптомным выделением. Опухолевая трансформация возникает с большей вероятностью при взаимодействии ВПЧ с другими инфекционными агентами (цитомегаловирусы, вирус простого герпеса 2 типа, С. trachomatis, микоплазма и уреаплазма).
Факторы риска
ВПЧ является необходимым, но не достаточным фактором цервикальной неоплазии. Предрасполагающими факторами риска для развития заболевания могут быть: неблагополучный социально-экономический статус и сексуальное поведение, нарушения клеточного и гуморального иммунитета, сопутствующие сексуально-трансмиссивные заболевания (гонорея, сифилис герпес, трихомониаз хламидиоз и т.д.), молодой возраст, курение, беременность, дисбиоз вагинального биотопа, гипо- и авитаминозы (Марченко Л.А., 2001).
Риск ВПЧ-инфекции наиболее высок у гомосексуалистов. Не исключены случаи перинатальной передачи инфекции младенцам, рожденным от инфицированных матерей во время родоразрешения через естественные родовые пути, за счет аспирации околоплодных вод, цервикального или вагинального секрета; случаи папилломатоза гортани, трахеи, бронхов у детей, рожденных с применением операции кесарева сечения, что, по мнению ряда авторов, свидетельствует о возможности трансплацентарной передачи инфекции и нецелесообразности применения кесарева сечения с единственной целью — предупреждения заражения новорожденного ВПЧ (Koutsky L.A., Kiviar N.B.,1999).
Течение заболевания и клинические разновидности
Инкубационный период при аногенитальных бородавках составляет от 1 до 3 месяцев. В большинстве случаев ВПЧ-инфекция не манифестирует сразу, оставаясь некоторое время асимптомной. Прогрессия ВПЧ-инфекции высокого онкогенного риска в цервикальную интраэпителиальную неоплазию и рак in situ обычно происходит в сроки от 5 до 30 лет.
1. Клинические формы (видимые невооруженным взглядом):
1.1. Экзофитные кондиломы (остроконечные типичные, паппилярные, папуловидные);
1.2. Вестибулярный паппиломатоз ( мелкие паппиломовидные образования преддверья влагалища).
2. Субклинические формы (не видимые невооруженным глазом и бессимптомные, выявляемые только при кольпоскопии и/ или цитологическом или гистологическом исследовании):
Плоские кондиломы (типичная структура с множеством койлоцитов);
Малые формы (различные поражения метапластического эпителия с единичными койлоцитами);
Кондиломатозный цервицит/вагинит.
3. Латентные формы (отсутствие клинических, морфологических или гистологических изменений при обнаружении ДНК ВПЧ);
4. Цервикальная интраэпителиальная неоплазия (плоскоклеточные интраэпителиальные поражения):
CIN - CIN 1 — слабо выраженная дисплазия +/- койлоцитоз, дискератоз;
4.2 CIN II — выраженная дисплазия +/- койлоцитоз, дискератоз;
4.3 CIN III или CIS - тяжелая дисплазия или карцинома in situ+/- койлоцитоз, дискератоз;
4.4 Микроинвазивная плоскоклеточная карцинома.
Поверхность покрыта многослойным плоским эпителием по типу дискератоза. В подлежащей строме имеются атипичные сосуды, явления воспаления. Локализация ОК различна, в основном, в местах возможной мацерации: клитор, малые половые губы, устье уретры, влагалище, шейка матки, анус.
Манифестация генитальной ВПЧ-инфекции сопровождается появлением генитальных бородавок. Экзофитные формы остроконечных кондилом представляют из себя типичное проявление инфекции, обусловленной доброкачественными типами вируса ВПЧ6 и ВПЧ11. Эндофитные кондиломы могут быть плоскими и инвертированными, располагаются на шейке матки и имеют вид плоских или слегка возвышающихся бляшек, определяются при расширенной кольпоскопии.
Субклиническая форма болезни обнаруживается только при кольпоскопии в виде мелких плоских бородавок или устанавливается на основании характерной гистологической картины в виде койлоцитоза. Отсутствие клинических и гистологических признаков инфекции при выявлении ДНК ВПЧ свидетельствует о латентной или асимптомной инфекции.
Наружное отверстие уретры у женщин поражается в 4-8% случаев, более глубокое поражение мочеиспускательного канала вызывает явления вялотекущего уретрита.
Анальные бородавки чаще встречаются у лиц, практикующих анальный секс, и редко располагаются выше зубчатой линии прямой кишки. У лиц, практикующих орально-генитальные контакты, генитальные бородавки могут поражать губы, язык, небо.
Генитальные бородавки, как правило, бессимптомны, и часто случайно выявляются при осмотре или на основании Pap-мазка. В связи с этим вначале больные не предъявляют жалоб на связанный с ними дискомфорт. Однако, крупные, травмированные, изъязвленные или подвергшиеся вторичной инфекции бородавки сопровождаются зудом, болью, неприятным запахом. Уретральные бородавки у мужчин могут вызывать раздвоение струи мочи, обструкцию уретрального отверстия.
У больных с нарушением клеточного иммунитета (ВИЧ-инфекция, иммуносупрессивная терапия, беременность), — развиваются очень крупные генитальные бородавки — гигантская кондилома Бушке-Левенштейна, инвазивная и деструирующая опухоль, ассоциирующаяся с ВПЧ 6 и 1 1 типа.
ВПЧ-инфекция, обусловленная типами вируса высокого онкогенного риска (ВПЧ-16 и 18), является этиологическими агентами довольно гетерогенной группы заболеваний: бовеноидный папулез, цервикальная интраэпителиальная неоплазия, рак шейки матки, реже - рак влагалища, вульвы, ануса (Баткаев Э.А. с соавт., 2001; Киселев В.И., Киселев О.И., 2003).
Бовеноидный папулез ассоциируется с ВПЧ-16, а также с другими типами ВПЧ - 1, 6, 11, 18, 31-35, 39, 42, 48, 51-54 и проявляется плоскими папулами и пятнами с гладкой, бархатистой поверхностью. Заболевание обычно развивается у мужчин, имеющих много половых партнеров. У партнерш таких пациентов выявляется инфекция ВПЧ шейки матки и цервикальной интраэпителиальной неоплазии. Течение бовеноидного папулеза обычно доброкачественное. У некоторых больных бовеноидный папулез может персистировать годами, трансформируясь (особенно у лиц пожилого возраста) в плоскоклеточный рак.
Диагностика папилломавирусной инфекции
Лабораторная диагностика ВПЧ-инфекции проводится на основании цитологического, гистологического исследования биоптатов, определения антител к ВПЧ, обнаружения ДНК ВПЧ и онкобелка Е7.
Клинический осмотр наружных половых органов, вульвы, влагалища следует проводить при хорошем освещении. Для выявления субклинической генитальной ВПЧ-инфекции проводится расширенная кольпоскопия. Ложноположительные результаты при этом методе обычно являются следствием воспалительных и дискератических процессов вульвы и влагалища.
Кольпоскопия и биопсия показаны всем женщинам с цервикальной интраэпителиальной неоплазией класса II (CIN II) или класса III (CINIII), независимо от подтверждения у них наличия ВПЧ-инфекции.
Наиболее простые методы для идентификации ВПЧ — иммунологические методы: РСК, ИФА, ПИФ.
Диагностика ВПЧ-инфекции шейки матки включает тестирование по Папониколау (РАР-тест). Молекулярно-биологические методы реакция гибридизации in situ, ПЦР, ДНК-зонд. Гистологическое исследование биоптатов тканей эпителия и эпидермиса используются и при малосимптомных или асимптомных формах вирусных заболеваний гениталий. Использование молекулярно-биологических методов исследования целесообразно для доказательства наличия ВПЧ с его типированием, так как и ДНК-гибридизация, и полимеразная цепная реакция позволяют выявить онкогенные типы вируса 16 и 18.
Основным методом диагностики ВПЧ является цитологический — обнаружение койлоцитарных клеток в биоптате эпителия шейки матки (клетки МПЭ промежуточного и поверхностного типа с многоядерным строением), патогномоничные для ВПЧ.
При гистологическом исследовании генитальных бородавок обнаруживается умеренное утолщение рогового слоя с папилломатозом, паракератозом и акантозом; могут присутствовать фигуры митоза. Диагностически важным считается наличие в глубоких участках мальпигиева слоя койлоцитов — больших эпителиальных клеток с круглыми гиперхромными ядрами и выраженной перинуклеарной вакуолизацией.
Лечение
При выборе метода лечения ВПЧ-инфекции учитывается анамнез, соматический статус, предшествующая противовирусная терапия, локализация, количество, размеры остроконечных и плоских кондилом. Тактика лечения должна быть индивидуальной с учетом переносимости тех или иных методов лечения. Местное лечение АБ направлено на удаление кондилом и атипически измененного эпителия, с применением различных видов химических коагулянтов, цитостатиков и физиохирургических методов лечения. После удаления папилломатозных разрастаний для профилактики рецидива АБ необходима местная и общая терапия противовирусными препаратами, индукторами интерферона, неспецифическими иммуномодуляторами. Больных с папилломавирусной инфекцией следует предупредить, что данное заболевание является сексуально трансмиссивным, поэтому обследование и лечение необходимо проводить обоим партнерам, а на период терапии и ближайшие 6-9 месяцев рекомендовать барьерные методы контрацепции.
Местное лечение ВПЧ (данные приведены по Подзолковой Н.М. с соавт, 2007).
В течение трех лет (2006-2008 гг.) нами были обследованы и пролечены 650 женщин с аногенитальными бородавками (АБ). Данные представлены в таблице 1.
Таблица 1.
Группы пациенток по локализации и распространенности АБ
| Группа | Локализация ОК | Количество пациенток | % |
|---|---|---|---|
| 1. | Влагалище | 17 | 2,6 |
| 2. | Вульва | 173 | 23,6 |
| 3. | Влагалище + вульва | 258 | 39,7 |
| 4. | Влагалище + большие половые губы | 126 | 19,4 |
| 5. | Влагалище + вульва + большие половые губы | 76 | 11,7 |
| Всего | 650 | 100 | |
Таблица 2.
Число сеансов радиоволновой деструкции АБ, требующихся для достижения стойкой ремиссии заболевания у женщин
| Группа | 1 сеанс | 2 сеанс (10-12 дней) | 3 сеанс (14-21 день) | Более 3 сеансов | Всего | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| Чел. | % | Чел. | % | Чел. | % | Чел. | % | Чел. | % | |
| 1 | 7 | 41,2 | 10 | 58,82352941 | 0 | 0 | 0 | 0 | 17 | 100 |
| 2 | 121 | 69,9 | 41 | 23,69942197 | 11 | 6,4 | 0 | 0 | 173 | 100 |
| 3 | 118 | 45,7 | 112 | 43,41085271 | 25 | 9,7 | 3 | 1,2 | 258 | 100 |
| 4 | 13 | 10,3 | 77 | 61,11111111 | 29 | 23,0 | 7 | 5,6 | 126 | 100 |
| 5 | 0 | 0,0 | 23 | 30,26315789 | 41 | 53,9 | 12 | 15,8 | 76 | 100 |
| Итого: | 650 | |||||||||
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.

Читайте в новом номере
В статье приведена тактика ведения пациенток с цервикальными интраэпителиальными неоплазиями и рассмотрена необходимость применения противовирусной терапии
Для цитирования. Зароченцева Н.В., Логутова Л.С., Джиджихия Л.К. Тактика ведения пациенток с цервикальными интраэпителиальными неоплазиями и необходимость применения противовирусной терапии // РМЖ. 2016. No 5. С. 305–311.
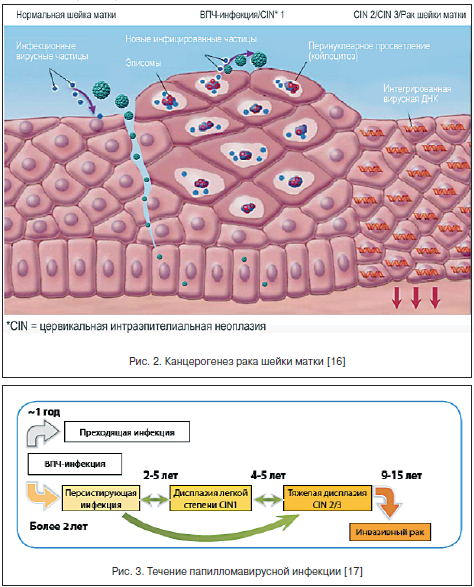
Поздние гены кодируют структурные белки вириона. Гены Е-6 и Е-7 всегда выявляются в опухолевых клетках, зараженных ВПЧ, в то время как другие фрагменты вирусного генома могут быть утеряны в процессе его длительной персистенции в организме.
ВПЧ инфицирует пролиферирующие эпителиальные клетки базального слоя эпителия и отличается высоким тропизмом именно к этому типу клеток. Инфицирование многослойного плоского эпителия происходит через микроповреждения (механические, бактериальные и др.), когда глубина их достигает базального слоя, где и обнаруживается эписомальный вирусный геном (рис. 2). При этом репликация ДНК ВПЧ происходит только в клетках базального слоя, эти клетки являются постоянным источником инфицирования эпителиальных клеток, а в клетках других слоев вирусные частицы лишь персистируют.
Папилломатозные разрастания формируются в роговом слое в локусах максимальной репродукции вируса (рис. 3). В зараженных клетках вирусный геном может существовать в 2-х формах: эписомальной (вне хромосом) и интегрированной в клеточный геном [16, 17].
Репликация ДНК вируса и синтез связанных с ней капсидных белков изменяют клеточный цикл и приводят к клеточной атипии, что занимает от 1 до 3-х лет.
Пока вирус находится в эписомальном состоянии, наблюдаются доброкачественные процессы. После инфицирования ВПЧ в эпителиальных клетках нарушается нормальный процесс дифференцировки, особенно в клетках шиповатого слоя, в котором наблюдается клональная экспансия инфицированных ВПЧ-клеток базального слоя, прошедших только первичную стадию дифференцировки. Эта клональная экспансия связана с их трансформацией и последующей малигнизацией. В стадии развитой инфекции наблюдается синтез вирусной ДНК в клетках шиповатого слоя при переходе в зернистый слой. Причем экспрессия поздних генов L1 и L2 на этом этапе отсутствует. Она наступает только на конечной стадии дифференцировки, где и наблюдаются активная сборка зрелых вирусных частиц, их выделение из клеток и почкование прямо на поверхности при формировании кондилом. Именно эти участки инфекционно опасны в отношении контактного заражения.
Однако многие авторы приходят к выводу, что инфицирование эпителиальных клеток ВПЧ – необходимое, но недостаточное событие для ракового перерождения. Для формирования необратимой неоплазии дополнительно необходимы:
– активная экспрессия генов Е-6 и Е-7 вируса;
– индукция метаболических механизмов конверсии эстрадиола в 16,2-гидроксистерон (16,2-ОН);
– индукция множественных повреждений хромосомной ДНК в инфицированной клетке, которая завершает процесс перерождения.
Крайне неблагоприятна сочетанная персистенция ВПЧ с вирусом простого герпеса 2-го типа, цитомегаловирусом, вирусом Эпштейна – Барр, вирусом иммунодефицита человека, хламидиями и микоплазмами.
Развитие РШМ – не молниеносный процесс, он занимает 10–15 лет. Из всех факторов риска РШМ огромное значение имеет возраст сексуального дебюта. По данным D.R. Brown et al. (2005) [18], раннее начало половой жизни в сочетании с ВПЧ-инфекцией увеличивает риск РШМ в 22 раза. По результатам исследований F.X. Bosh et al. (2006) [19], 13% женщин с РШМ начали половую жизнь ранее 14 лет против 3,5% женщин с РШМ, имевших коитархе в возрасте 20 лет.
Несмотря на то что лица 15–19 лет составляют лишь 25% сексуально активного населения, более 50% сексуально-трансмиссивных заболеваний, в т. ч. ВПЧ, возникают именно в этой возрастной группе. ВПЧ-инфекция чаще встречается среди лиц 15–19 лет с кумулятивной частотой заболевания 17% в течение 1 года и 35,7% – в течение 3-х лет с момента коитархе.
По результатам нескольких современных эпидемиологических исследований изучена распространенность ВПЧ-инфекции в подростковой популяции. У лиц в возрастной группе от 13 до 21 года частота инфицирования равна 38,2%, причем пациентки 13–18 лет приблизительно в 2 раза чаще инфицированы ВПЧ, чем в возрасте 19–21 года [20].
Пути передачи и инфицирования ВПЧ
1. Половой путь. Инфицирование ВПЧ происходит при генитально- генитальном половом акте, мануально-генитальном и орально-генитальном контактах.
2. Вертикальный путь. Доказаны повышенная чувствительность эпителия шейки матки к ВПЧ в период беременности, а также возможность внутриутробного инфицирования плода и новорожденного.
3. Бытовой путь. Возможна передача вируса через нижнее белье, хирургические перчатки, хирургический инструментарий для биопсии и другие предметы, обсемененные ВПЧ. Медперсонал может инфицироваться ВПЧ во время лазерной деструкции генитальных бородавок, вдыхая образующийся дым.
Инкубационный период составляет 1–6 мес., максимальное содержание вируса в пораженных тканях обнаруживается на 6-й мес.
Частота передачи ВПЧ от матери к плоду, по данным разных исследователей, различается весьма существенно – от 4 до 87%. При этом ВПЧ в течение многих лет может персистировать в клетках слизистой оболочки рта ребенка и являться причиной участившегося в последнее время рецидивирующего респираторного папилломатоза гортани.
Течение ПВИ
Большинство случаев выявления ПВИ и характерные изменения, наблюдаемые при цитологическом исследовании, нередко разрешаются самостоятельно в течение 1 года (преходящая, или латентная, инфекция), не оставляя повреждений и присутствия ПВИ [16, 21–23].
При наличии ВПЧ в организме более 2-х лет развивается персистирующая инфекция, которая приводит к развитию CIN [24].
По мнению L.G. Koss (1987), патология шейки матки подобна айсбергу: лишь незначительная часть процессов находится на поверхности и может быть замечена глазом [25, 26]. Рутинный осмотр шейки матки в зеркалах далеко не всегда позволяет выявить наличие патологии. Принципы диагностики давно изучены и не представляют сложностей. Основными методами обследования являются цитологический метод (РАР-тест), расширенная кольпоскопия, проведение ВПЧ-тестирования (качественного и количественного), гистологическое исследование биоптата шейки матки и выскабливание цервикального канала шейки матки. Обследование на урогенитальную инфекцию (УГИ): микроскопия мазка, посев на условно-патогенную флору, ПЦР-диагностика ИППП также включены в перечень необходимых исследований при патологии шейки матки.
Тактика ведения женщин с CIN I в биоптате
CIN I характеризуется высоким уровнем спонтанной регрессии и низким уровнем прогрессии этих поражений. Алгоритм ведения пациенток с CIN I четко не определен. Ведение пациенток с CIN I требует активного наблюдения с использованием цитологического исследования и кольпоскопии, однако хирургическое лечение, как правило, можно не проводить в течение 1,5–2 лет ввиду возможной спонтанной регрессии у молодых женщин [36].
Существуют два тактических варианта, выбор одного из них основан на предпочтениях пациентки и врача:
1. Наблюдение CIN I с цитологическим контролем через 6 и 12 мес. или ВПЧ-тестированием через 12 мес. После 2-х последовательных отрицательных цитологических результатов или негативного ВПЧ-теста пациентка подлежит рутинному скринингу, в случае повторного результата цитологического исследования, соответствующего >ASC-US, или положительного ВПЧ-теста – направлению на кольпоскопию.
Проводятся лечение УГИ, бактериального вагиноза, обязательное восстановление микробиоценоза влагалища. Назначается Изопринозин по 2 таблетки 3 р./сут в течение 10 дней, далее проводят 2–3 аналогичных курса с интервалом 10–14 дней.
Лечение CIN I проводится с использованием методов аблации или эксцизии. Оба метода приемлемы при удовлетворительной кольпоскопии (ЗТ I или II типа).
2. В случае неудовлетворительной кольпоскопии (ЗТ III типа), при наличии поражения в эндоцервикальном образце и у женщин с рецидивом CIN рекомендуется диагностическая эксцизия.
Активное ведение пациенток с CIN I с применением аблации или эксцизии рекомендовано при:
– неудовлетворительных результатах кольпоскопии;
– обширном поражении;
– персистенции CIN I > 18 мес.;
– возрасте пациентки > 35 лет;
– нежелании женщины посещать врача регулярно.
Тактика ведения женщин с CIN II–III в биоптате
Поражения эпителия тяжелой степени (HSIL) сопровождаются значительным риском трансформации в РШМ, поэтому требуют активного лечения.
CIN II–III считаются предраковыми поражениями, они чаще персистируют и прогрессируют, чем регрессируют, и поэтому должны подвергаться лечению (исключение составляют CIN II–III у беременных и CIN II у юных женщин).
Предпочтение, безусловно, следует отдавать эксцизионным методам лечения (петлевая эксцизия или конизация), а не деструктивным, поскольку конизация позволяет, как уже упоминалось, получить биоматериал, пригодный для гистологического исследования, что гарантирует врачу объективные данные о стадии патологического процесса [37].
Эксцизия необходима при:
– большой площади поражения;
– несовпадении цитологического и кольпоскопического заключений;
– рецидиве заболевания;
– неудовлетворительной кольпоскопии (ЗТ III типа, когда поражение локализуется внутри цервикального канала и недоступно визуализации при кольпоскопии); лечение пациенток с CIN III проводят онкогинекологи.
Особенности тактики ведения CIN у девочек-подростков и юных женщин
У юных женщин с CIN I предпочтительна тактика наблюдения, только при наличии CIN III – лечение. Девочки-подростки и юные женщины с CIN I наблюдаются в течение 2-х лет с повторными цитологическими исследованиями через 12 и 24 мес. Кольпоскопическое исследование необходимо, если в мазке через 12 мес. >HSIL или через 24 мес. >ASC-US (атипичные изменения клеток плоского эпителия неясного значения).
Особенности ведения пациенток с CIN в постменопаузе
Наибольший уровень заболеваемости РШМ наблюдается у женщин старше 45 лет. В то же время диагностика заболевания шейки матки в постменопаузе может быть затруднена. Эстрогенная недостаточность приводит к развитию атрофии слизистой цервикса и втягиванию зоны стыка эпителия в эндоцервикс. До наступления менопаузы только 8% CIN находятся эндоцервикально, после менопаузы 48% CIN располагаются в цервикальном канале. Поэтому при кольпоскопическом выявлении ЗТ III и наличии аномального цитологического мазка необходимо проведение кюретажа эндоцервикса (тестирование на ВПЧ) и конизации шейки матки. При подозрении на поражение низкой степени CIN I необходимо проведение санации и гормонального лечения до повторного исследования. При получении аномального мазка высокой степени проводятся санация и кюретаж эндоцервикса, конизация. Рекомендуется применение Изопринозина по 2 таблетки 3 р./сут в течение 10 дней, далее проводят 2–3 аналогичных курса с интервалом 10–14 дней или без перерыва курсом 30 дней.
Использование эстрогенной терапии – наиболее простой способ улучшить эффективность кольпоскопии. Эстрогены способствуют вывороту эндоцервикальной слизистой оболочки, расширению цервикального канала с образованием слизи, которая благодаря своей прозрачности улучшает визуализацию эндоцервикса. Маленькие дозы эстрогенов достаточны для коррекции атрофии, исчезновения небольших атипий CIN I–II, связанных с атрофией. Предварительная санация влагалища и местная гормональная терапия в течение 15 дней улучшают условия обследования женщин в постменопаузе и облегчают интерпретацию проведенного цитологического исследования мазков и кольпоскопического исследования.
Наблюдение после лечения CIN
Уровень остаточных поражений и рецидивов после лечения CIN составляет 5–15%, большинство из них обнаруживают в течение первых 2-х послеоперационных лет.
В период наблюдения после лечения используют те же методы, что и для диагностики перед лечением: цитологию, кольпоскопию и ВПЧ-тестирование. Чувствительность ВПЧ-теста в идентификации остаточных или рецидивных CIN II–III и прогностическая ценность его негативного результата превосходят аналогичные показатели цитологического исследования.
Отрицательный ВПЧ-тест через 6 мес. после лечения CIN II–III или 3 последовательных негативных цитологических результата, полученных с 6-месячным интервалом, позволяют перевести пациентку на ежегодное цитологическое исследование. При положительном ВПЧ-тесте или цитологии >ASC-US необходимо кольпоскопическое исследование.
Если CIN II–III присутствует в краях иссеченного конуса или в материале, полученном из оставшейся части канала сразу после эксцизии, необходимо цитологическое исследование с получением эндоцервикального образца через 4–6 мес., для женщин старшего возраста предпочтительна повторная процедура эксцизии. У женщин с гистологически верифицированной остаточной или рецидивной CIN II–III допустимы повторная процедура эксцизии или гистерэктомия.
Профилактика – вакцинация
Международная организация по исследованиям в области рака (IARC) определила, что ПВИ – вакциноуправляемая инфекция, а предотвращение заражения и персистенции ВПЧ однозначно можно считать профилактикой РШМ [6, 18, 20, 37, 38].
В настоящее время в мире и, в частности, в России зарегистрировано 2 вакцины против ВПЧ: бивалентная и квадривалентная.
Профилактическая вакцина зарегистрирована в 117 странах мира. Национальные программы ВПЧ-вакцинации рекомендованы в 60 странах, причем в 6 странах рекомендуется и вакцинация мальчиков.
Обе вакцины в установленном порядке зарегистрированы Министерством здравоохранения РФ, в 2007 г. в России вакцинация против РШМ одобрена правительством страны. ВОЗ рекомендует проведение массовой вакцинации от ВПЧ для первичной профилактики ВПЧ- ассоциированных раков.
Читайте также:


