Mrsa инфекция что это такое чем лечить
Российская медицинская академия последипломного образования, Москва
Введение
К резистентной грамположительной флоре в настоящее время относят резистентные к метициллину или оксациллину стафилококки, энтерококки – резистентные к ампициллину и ванкомицину, пневмококки – со сниженной чувствительностью или резистентные к пенициллину и цефалоспоринам III генерации. В плане хирургических инфекций наиболее актуальными возбудителями являются резистентные стафилококки.
Колонизация
MRSA способны колонизировать слизистую оболочку носа, кожу, реже их обнаруживают в моче и кале. Перенос MRSA руками персонала является главным путем распространения флоры от одного пациента к другому. Колонизация секрета дыхательных путей у пациентов, которым проводится искусственная вентиляция легких (ИВЛ), и в ожоговых отделениях может возникать в результате попадания из воздуха контаминированных капель от медицинского персонала и колонизовать или инфицировать пациентов. Добиться эрадикации MRSA при колонизации кожи и слизистых оболочек существенно сложнее, чем вылечить инфекцию. Это связано с относительно небольшим количеством антибиотиков, активных в отношении MRSA, которые могут попадать в секрет слизистой оболочки носа в концентрации, необходимой для элиминации микробов. В соответствии с основными принципами лечения инфекционных болезней колонизация не нуждается в лечении, лечение должны получать только пациенты с признаками инфекции.
Применение некоторых антибиотиков может приводить к увеличению колонизации MRSA, например цефтазидима. Колонизация пациентов в первую очередь зависит от строгости мер по контролю инфекций. Одни и те же методы применяются для ограничения распространения MSSA и MRSA [2, 4–7, 14,15].
Области наиболее частого развития инфекций и колонизации
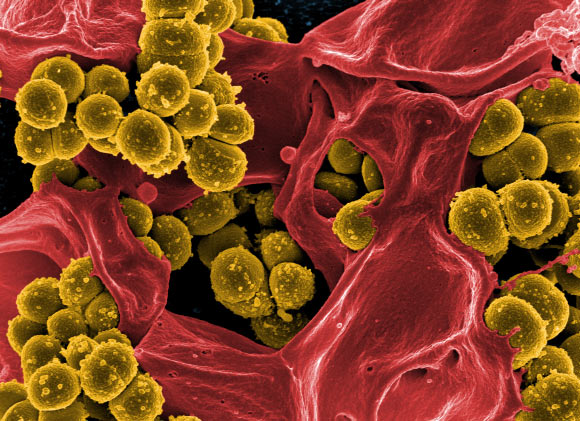
В табл. 2 представлен спектр инфекций, вызванных MRSA. Кожа и мягкие ткани являются наиболее частой локализацией инфекций, вызванных MRSA. Инфекции могут быть ограничены верхними слоями дермы (целлюлит) или вовлекать более глубокие структуры (абсцессы мягких тканей). Инфекции, вызванные стафилококками, отличаются от инфекций, вызванных стрептококками группы А, наличием булл и отсутствием генерализованного воспаления. Высокая лихорадка, озноб, лимфангит более характерны для инфекций, вызванных стрептококками группы А. Стафилококковые абсцессы мягких тканей могут развиваться в результате тупой или открытой травмы, могут быть вызваны MSSA или MRSA. Эти абсцессы чаще возникают у пациентов с сахарным диабетом, сопровождаются высокой лихорадкой и ознобом. При стафилококковом целлюлите озноб наблюдается редко в отличие от стрептококкового. MRSA может быть причиной возникновения синдрома токсического шока у пациентов, колонизированных или инфицированных токсигенными штаммами [1, 11].
Инфекции костей и суставов
S.aureus – наиболее частая причина инфекций костей и суставов, в том числе септического артрита и острого остеомиелита. В зависимости от географических особенностей возбудителями могут быть и MSSA, и MRSA. Клинические проявления не отличаются от таковых, вызванных другими возбудителями. Возбудителями инфекций искусственных суставов бедра и колена наиболее часто бывают коагулазонегативные стафилококки (CNS), S.aureus (в том числе MRSA) занимает второе место. Из-за низкой вирулентности CNS S.aureus чаще является причиной остро развивающейся инфекции искусственных суставов [2, 12, 16].
Ангиогенные инфекции
Стафилококковый эндокардит обычно протекает в виде острого инфекционного эндокардита (ОИЭ). Увеличение роли MRSA в развитии ОИЭ объясняется расширением географического распространения. Обычно стафилококковые ОИЭ поражают нормальные клапаны в результате стафилококковой бактериемии. Нозокомиальные случаи ОИЭ могут возникать после применения внутрисердечных устройств для мониторинга. Стафилококковый эндокардит может быть результатом катетеризации сосудов, внутрисердечной установки электрода водителя ритма, может сопровождаться поражением нативного или искусственного клапана. Стафилококковый ОИЭ часто наблюдается у внутривенных наркоманов, для которых характерно поражение клапанов правого отдела сердца. Прогноз эндокардита у этой категории пациентов лучше, чем у нормальных пациентов с аналогичной локализацией инфекции [2, 11].
Катетеризация центральных вен необходима для проведения современного лечения. Однако эти устройства лишены нормальных защитных механизмов и создают туннель через кожу и мягкие ткани, достигающий центральных вен. Кожа человека обычно колонизована стафилококками, которые могут распространяться вдоль катетеров и достигать кровотока. Стафилококковая бактериемия может прекращаться самостоятельно, но может быть причиной локальной или метастатической инфекции. У некоторых пациентов развивается тяжелый сепсис и летальный исход. Клинические проявления стафилококковой бактериемии зависят от области входных ворот, количества флоры и состояния резистентности макроорганизма. У пациентов со стрептококковой бактериемией или эндокардитом обычно можно обнаружить источник в виде инфекции кожи и мягких тканей или костей и суставов. В отсутствие определенного источника инфекции обязательно необходимо иметь в виду высокую вероятность эндокардита. У некоторых пациентов источник инфекции вообще может быть не обнаружен. Для эффективного лечения стафилококковой бактериемии всегда необходимо исключить вероятность инфекции, связанной с внутривенными устройствами, которые должны быть удалены или заменены [7, 12].
Остеомиелит позвоночника
Обычно бывает осложнением бактериемии S.aureus. Стафилококки, попадающие в кровоток, обычно инфицируют те кости и суставы, которые до этого имели повреждения. Стафилококковые инфекции и абсцессы часто наблюдаются в телах позвонков или дисках, поврежденных артритом. У пожилых пациентов могут возникать паравертебральные или эпидуральные абсцессы с признаками остеомиелита позвоночника [2, 11, 17].
Выбор адекватной терапии MRSA
Основным препаратом для лечения инфекций, вызванных MRSA, долгие годы являлся ванкомицин, который был внедрен в клиническую практику в 1956 г., однако интенсивно не использовался примерно до середины 70-х годов [18]. Возрастание применения ванкомицина было связано с появлением необходимости лечения инфекций, вызванных MRSA, с 2% (1974 г.) до более чем 50% (2000 г.) [18, 19]. Ванкомицин в основном применяли для лечения пациентов с инфекциями, вызванными MRSA, пациентов с инфекциями, вызванными грамположительными бактериями, при наличии противопоказаний к применению бета-лактамных антибиотиков и пациентов с инфекциями, связанными с имплантацией искусственных материалов или катетеризацией центральных вен.
Эффективность ванкомицина были доказана, и в настоящее время он применяется с целью профилактики эндокардита в результате транзиторной бактериемии, возникающей у пациентов с аллергией на пенициллин, которым проводятся инвазивные диагностические и лечебные процедуры, у пациентов с абдоминальной, гинекологической или урологической патологией [20]. Тем не менее в последнее время обсуждаются серьезные проблемы, связанные с его применением. Во-первых, быстрая инфузия ванкомицина приводит к выделению гистамина (синдром “красного человека”), которое обычно отсутствует при более медленном введении препарата. У 3–4% пациентов выявляются аллергические реакции немедленного типа в виде крапивницы, а у небольшого количества пациентов развивается обратимая миелосупрессия [19, 21]. Во-вторых, ванкомицин не может применяться внутрь для лечения тяжелых инфекций из-за низкого всасывания, поэтому он вводится только внутривенно в виде медленной инфузии (не менее 60 мин) 2 раза в сутки. В-третьих, у клиницистов возникает вопрос об адекватности применения ванкомицина в определенных обстоятельствах из-за недостаточной клинической эффективности и высокой частоты рецидивов инфекции [22–26]. И последнее, много вопросов возникает по клинической эффективности в отношении штаммов со сниженной чувствительностью к ванкомицину (VISA), уже не говоря о штаммах, резистентных к ванкомицину [27–30].
Несмотря на то что клиническая эффективность в отношении VISA пока недостаточно изучена, появление этих микроорганизмов является индикатором высокой вероятности появления резистентных штаммов [29–31], что стало реальностью в 2002 г., когда было опубликовано сообщение о 2 пациентах с инфекциями, вызванными резистентными к ванкомицину S.aureus (VRSA) [27, 32]. В обоих случаях изоляты имели ген vanA, который определяет резистентность к ванкомицину и который, предположительно, мог быть получен от энтерококков, резистентных к ванкомицину (VRE), в процессе лечения полимикробных инфекций. В апреле 2004 г. был описан третий клинический штамм VRSA, который был выделен от пациента, длительно находящегося в доме престарелых [33]. В марте 2003 г. при изучении этого штамма оказалось, что он имеет и mecA, и vanA гены, однако этот случай не был эпидемиологически связан с двумя другими выделенными ранее VRSA. Хотя этот штамм содержал ген vanA, минимальная подавляющая концентрация (МПК) к ванкомицину была низкой при тестировании автоматическим методом. Резистентность к ванкомицину была выявлена референтным методом (серийным разведением). Поэтому было сделано заключение, что такие инфекции, вызванные VRSA, могли быть еще, однако не были подтверждены лабораторно. Поэтому рекомендуется все клинические штаммы проверять ручными методами (серийным разведением, диско-диффузионными методами). Альтернатива ванкомицину
В последние 5 лет в мире применяется 3 альтернативных ванкомицину препарата для лечения инфекций, вызванных MRSA: хинупристин/дальфопристин, линезолид и даптомицин. Основные сравнительные характеристики препаратов, активных в отношении MRSA, представлены в табл. 3. Однако в РФ в настоящее время из всех этих препаратов для клинического применения доступен только линезолид. Поэтому целесообразно провести сравнение ванкомицина и линезолида.
Линезолид – первый препарат класса оксазолидинонов, который может вводиться внутривенно или назначаться внутрь. Препарат при приеме внутрь обладает очень высокой биодоступностью (около 100%) и сывороточная концентрация сопоставима с таковой при парентеральном введении [34]. Линезолид показан для лечения инфекций, вызванных резистентными к ванкомицину E. faecium; нозокомиальной пневмонии, вызванной S.aureus (штаммами, чувствительными и резистентными к метициллину) и Streptococcus pneumoniae (штаммы, резистентные к пенициллину); осложненных инфекций кожи и подкожной клетчатки, в том числе диабетической стопы и остеомиелита, вызванных S.aureus, S.pyogenes, S.agalactiae; внебольничной пневмонии, вызванной S.pneumoniae или S.aureus.
При проведении рандомизированного многоцентрового двойного слепого исследования одна группа пациентов (n=400) получала линезолид по 600 мг внутривенно через 12 ч, а затем по 600 мг внутрь через 12 ч, а другая группа (n=419) получала оксациллин по 2 г внутривенно через 6 ч с последующим переходом на диклоксациллин по 500 мг внутрь через 6 ч. Клиническая эффективность линезолида составила 90%, а препаратов сравнения – 85%. Наиболее частыми побочными эффектами оказались тошнота, рвота, диарея и головная боль; случаи резистентности к линезолиду уже описаны в литературе.
В многоцентровом исследовании, проведенном в Северной Америке, Латинской Америке и Европе, проведено сравнение линезолида (внутривенно с переходом на прием внутрь) и ванкомицина (только внутривенно) у 460 пациентов с подозрением или подтвержденной инфекцией, вызванной резистентными к метициллину стафилококками. Средняя продолжительность стационарного лечения оказалась достоверно короче у пациентов с осложненными инфекциями кожи и мягких тканей, которые получали линезолид. При этом пациенты в основном были выписаны в течение первой недели лечения, внутривенная терапия продолжалась только несколько дней. Пациенты, которых лечили ванкомицином, вынуждены были до конца лечения получать внутривенные инфузии препарата, что и привело к их более поздней выписке. Одним из положительных моментов являлось снижение потребления медицинских ресурсов в группе пациентов, получавших линезолид, в результате раннего перехода на прием препарата внутрь с более короткой продолжительности стационарного лечения [35].
Высокая эффективность линезолида по сравнению с ванкомицином позволила сократить общую продолжительность лечения c 14 до 9 дней (p=0,052) в целом, а у пациентов, оценка которых проводилась только клинически, – с 16 до 8 сут (p=0,0025) [36].
Бактерицидные и бактериостатические препараты
До настоящего времени в клинической среде обсуждается проблема преимуществ и недостатков применения для лечения инфекций антибактериальных препаратов, обладающих бактерицидным и бактериостатическим действием. Первая публикация, разделившая антимикробные препараты на бактерицидные и бактериостатические, была сделана в 70-е годы [37]. Имелось в виду, что бактерицидные препараты убивают бактерии, а бактериостатические – только ингибируют их рост. Это простое разделение препаратов по их активности было очень привлекательным для клиницистов, так как интуитивно приводило к заключению о том, что бактерицидная активность имеет существенные преимущества. Однако, несмотря на 30-летнюю историю обсуждения этой проблемы, до настоящего времени нет согласованного мнения по поводу клинической значимости этих различий.
К группе препаратов с бактериостатическим эффектом относят макролиды, тетрациклины, сульфаниламиды, клиндамицин, линезолид и левомицетин. Антимикробные препараты считаются бактериостатическими в том случае, если отношение минимальной бактерицидной концентрации (МБК) и минимальной ингибирующей концентрации в отношении определенного микроорганизма равно или выше 16. Если это отношение меньше или равно 4, препарат считается бактерицидным. Согласно общепринятым стандартам лабораторной диагностики (NCCLS) препарат считается бактерицидным в том случае, если он снижает количество колониеобразующих единиц в миллилитре более чем на 3 десятичных логарифма (99,9%) после 18–24-часовой инкубации в жидкой питательной среде [38]. Для того чтобы быть уверенным в точности оценки киллинга, соответствующего 99,9%, количество микробов для проведения исследования МБК должно составлять не менее 5 ґ 10 5 КОЕ/мл.
К группе бактерицидных препаратов относят бета-лактамные антибиотики, аминогликозиды, ванкомицин, фторхинолоны, даптомицин, метронидазол. Традиционно определение бактерицидной активности основано на исследовании in vitro, когда активность препарата должна быть достаточной для подавления роста 99,9% микроорганизмов. Обычно применяется стандартная лабораторная методика (in vitro) – метод определения чувствительности к антибиотикам с помощью последовательных разведений антибиотика в питательной среде (бульон) с определением МПК и МБК. Если МБК превышает МПК в 32 раза или более, микроб определяется как толерантный. Литература по клиническому значению толерантных штаммов S.aureus обширна, однако данные очень сложно интерпретировать из-за того, что методы и определения слишком вариабельны [39, 40].
Изучение кривой зависимости гибели микробов от времени является другим методом определения киллинга бактерий. В этих исследованиях измерение микробного киллинга оценивали в зависимости от времени и концентрации [41]. Имеется сомнение в возможности проведения этого теста в обычной лаборатории, так как он является достаточно сложным, дорогим и не имеет однозначной интерпретации результатов. Данный метод (исследование кривой бактериального киллинга) позволяет изучить взаимодействие препаратов, оценить синергичное действие пенициллина и аминогликозидов в лечении эндокардита, вызванного энтерококками. Исследование бактерицидности сыворотки, или тест Schlichter, который является модификацией метода разведения бульона, применяется более 40 лет для определения бактерицидной активности [42]. Особенностью этого метода является то, что сыворотка, полученная из области инфекции (точно так же, как суставная жидкость или ликвор), может быть использована для определения бактерицидной активности, однако это тест используется очень редко из-за сложности стандартизации и интерпретации результатов.
Таблица 1. Сравнительная характеристика нозокомиальных и внебольничных MRSA
В статье рассмотрим, что это такое - MRSA инфекция.
При выраженных симптомах гнойного поражения кожи у взрослого и ребенка врачи не исключают стафилококк, который требуется в срочном порядке лечить. Эта опасная инфекция может стать основной причиной многих заболеваний внутренних органов и систем. При возникновении главного вопроса, как избавиться от недуга, требуется обратиться к компетентному специалисту. В противном случае в патологический процесс будет вовлечено все больше и больше здоровых тканей.
Стафилококк является бактерией, которая может жить в носу и на коже человека, не причиняя ему вреда. Его носителями может быть практически треть населения. В некоторых случаях из-за стафилококка появляются разные инфекции.
Что это?
Метициллин-резистентный золотистый стафилококк (то есть MRSA) – это обозначение любого его штамма, устойчивого к большому количеству антибиотиков – бета-лактамов. В них входят цефалоспорины и пенициллины. Поэтому такие инфекции могут нуждаться в длительном лечении.
В случае MRSA (methicillin resistant staphylococcus aureus) в основном идет речь о носительстве микроба, бактерии при нем живут в человеческом организме наряду с другими микробами, и патология возникает нечасто. В большей степени инфекции появляются у тех людей, которые уже имеют определенные проблемы со здоровьем, к примеру, у лиц, пребывающих на стационарном лечении при тяжелых болезнях.
Не все знают, что это такое - MRSA инфекция.
Бактерия может спровоцировать патологии у пациентов, которые только что перенесли хирургическое вмешательство, химиотерапию, имеют раны на коже или которым установили искусственный сердечный клапан, катетер мочевого пузыря, суставной протез или венозную канюлю.
Клинические проявления
Рассмотрим клинические проявления золотистого стафилококка.
Особенно часто он персистирует в верхних отделах дыхательных путей и носовых ходах, в мочевыводящих путях и открытых ранах. У здоровых людей болезнь может проходить без симптомов не просто несколько недель, а даже много лет. Если у пациентов значительно нарушена иммунная система, они больше подвергаются симптоматической инфекции.
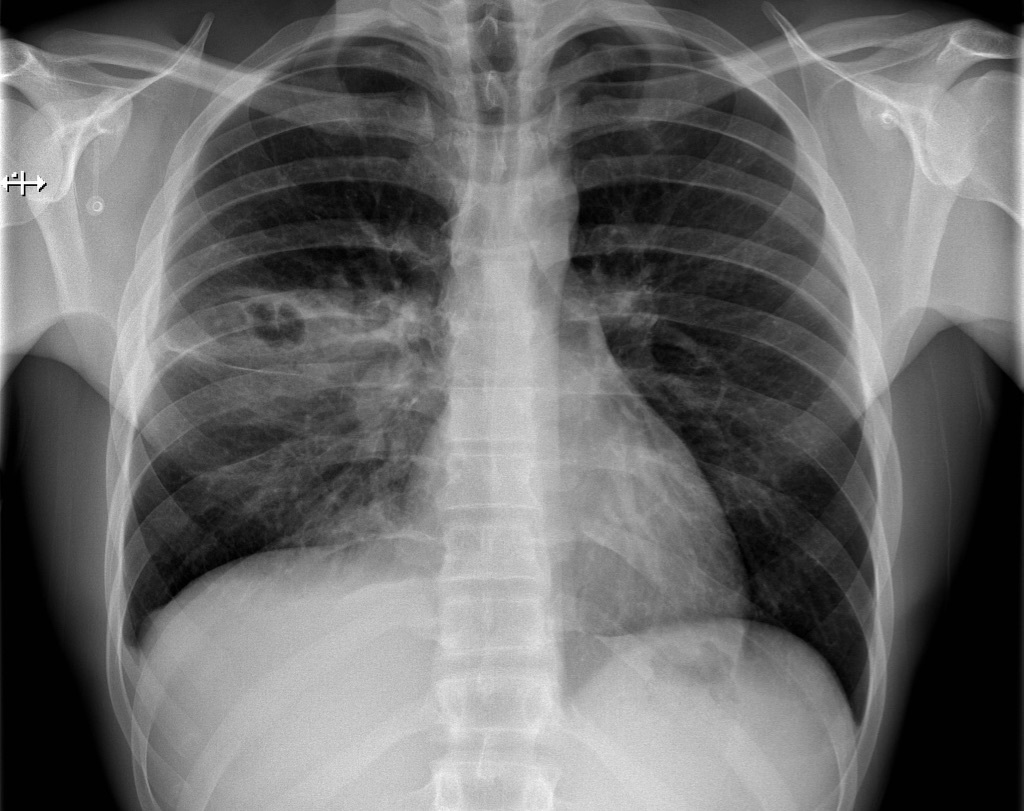
Принимаются дополнительные санитарные меры для людей, которые контактируют с инфицированными пациентами: медицинский персонал, родственники. Они признаются эффективными для сведения к минимуму инфекционного распространения в больницах Дании, Соединенных Штатов, Нидерландов и Финляндии.
Существенное прогрессирование процесса инфекции наблюдается на протяжении 1-2 суток после первичной актуальной симптоматики. Когда проходит трое суток, бактерии могут попасть в ткани организма и стать устойчивыми к влиянию лекарственных веществ. Вначале возникают небольшие красные шишки, напоминающие укусы пауков, прыщи, что может сопровождаться лихорадкой, а в некоторых случаях – сыпью. Шишки через несколько дней увеличиваются, становятся более болезненными и могут заполняться гноем. Примерно 75 % стафилококков метициллин-резистентных локализуются на мягких тканях, коже, могут эффективно лечиться. Но штаммы обладают высокой вирулентностью и провоцируют более серьезные заболевания, чем традиционные стафилококковые инфекции. Они могут воздействовать на жизненно необходимые органы и вызывать сепсис (обширное распространение инфекции), некротическую пневмонию и синдром токсического шока. Считается, что связано это с токсинами штаммов. Не установлено, почему у некоторых здоровых людей формируются инфекции кожи, поддающиеся лечению, а у других пациентов с тем же штаммом возникает тяжелая инфекция, способная привести к летальному исходу.
Самыми распространенными проявлениями инфекции, вызванной MRSA, становятся инфекции кожи, пиомиозит, некротический фасциит, инфекционный эндокардит (воздействует на сердечные клапаны), некротические пневмонии. Инфекция часто приводит к формированию абсцессов, которые нуждаются во вмешательстве хирурга.
Группы риска
В группу высокого риска входят:
- люди со слабой иммунной системой (пациенты со СПИД/ВИЧ-инфекцией, после пересадки органов, больные раком, тяжелые астматики и др.);
- пациенты с сахарным диабетом;
- дети;
- пациенты, которые принимают антибиотики хинолоны;
- люди, использующие наркотические инъекции;
- пожилые пациенты;
- студенты, которые живут в общежитиях;
- люди, работающие или пребывающие в медицинских учреждениях на протяжении длительного периода времени;
- лица, которые проводят время на пляжах и в прибрежных водах;
- люди, проводящие время с другими людьми в замкнутом пространстве, в том числе спортсмены, солдаты, заключенные.
Инфекции, вызванные золотистым стафилококком, в основном наблюдаются в медицинских учреждениях и больницах, в домах престарелых. Но нужно отметить, что инфекция может находиться и вне больниц, например, в закрытых учреждениях, таких, как тюрьмы, если постоянно принимаются новые заключенные с плохим состоянием здоровья, не придерживающиеся правил личной гигиены. Количество случаев инфицирования повышается в животноводстве – заболевают чаще всего свиньи, птица и крупный рогатый скот, от них возможна передача возбудителя людям.
Например, в США увеличилось количество сообщений об инфекционных вспышках, когда возбудитель передавался через кожу в спортивных залах и раздевалках, даже среди здоровых людей. Кроме того, проблемой в области педиатрии является MRSA инфекция. Что это такое, интересно многим.
Далее выясним, какова диагностика таких патологий.
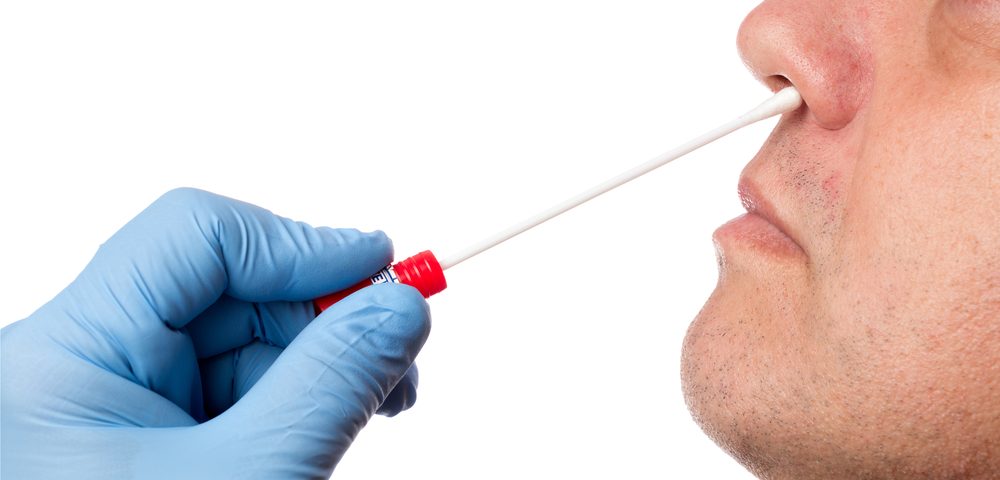
Диагностический тест на выявление MRSA
Определение вспышек метициллин-резистентной стафилококковой инфекции осуществляется диагностическими референтными и микробиологическими лабораториями. Есть экспресс-методы, которые позволяют установить тип и описать штамм возбудителя. Например, такие методы, как количественная ПЦР или ПЦР в реальном времени, все чаще используются в клинических лабораториях для скорейшего выявления и идентификации штаммов метициллин-резистентного стафилококка.
Еще один лабораторный тест, нашедший широкое применение, - это тест латекс-агглютинации, который позволяет диагностировать PBP2a (β-лактам-резистентный пенициллин-связывающий белок), придающий устойчивость стафилококку к оксациллину и метициллину.
Лечение MRSA инфекции
Носитель лечится с помощью ликвидации с тела бактерий MRSA. Терапевтический курс назначается лечащим врачом. Обычно выписывается антисептическое средство для гигиены головы и тела, мазь, содержащая антибиотики, для смазывания носа внутри, так как бактерии преимущественно располагаются там. Дополнительно к этому нужно менять одежду и постельное белье ежедневно. Стирка одежды и белья производится как минимум при 60 градусах Цельсия. Если бактерии были найдены в горле, то нужно его полоскать средством, назначенным врачом, по утрам и вечерам.
Лечебный курс полностью продолжается от пяти до десяти суток. После завершения лечения через одну, две и три недели берут контрольные пробы. Рекомендуется сдавать пробы повторно через три месяца, полгода и год. В некоторых случаях требуется повторное проведение лечения до полного избавления от бактерий.
Гигиена рук
Лучшим способом предотвращения распространения штаммов MRSA и в домашних условиях, и в больнице является тщательная гигиена рук. Руки нужно вымыть водой с мылом либо протереть их специальным антисептиком. Антисептик для рук представляет собой раствор, в котором содержится спирт, и он примерно в течение тридцати секунд справляется с большей частью микробов. Руки нужно протирать этим средством и дать им высохнуть, не вытирая и не смывая его.
Способы предотвращения бактериального распространения в домашних условиях
При здоровой коже носительство MRSA – это не помеха для общения с другими людьми. Можно посещать магазины, сауны, бассейны. Избегать совместного использования с посторонними одежды, гигиенических средств, полотенец и т. д. Регулярно нужно менять постельное и нижнее белье, полотенца, стирать их разрешается при высокой температуре, соблюдая инструкции, указанные на этикетке. Отдельно стирать белье людей с носительством MRSA нет необходимости. Следует придерживаться правил личной гигиены.
Если есть кожные раны или воспаление, нельзя посещать общественные сауны и бани. Дома нужно поддерживать чистоту, во время уборки хватает применения обычных чистящих средств. Среди дезинфицирующих средств нужно выбирать вещества, которые уничтожают стафилококк. Обычно спектр влияния дезинфицирующих растворов указывается на этикетке.
Рекомендации членам семьи
Если кто-то из домочадцев, вместе с которым живут люди, работает в животноводстве или здравоохранительной сфере, либо собирается лечь в дом инвалидов/больницу, то ему нужно провериться на MRSA. При назначении лечения рекомендуется в первую очередь пройти обследование всем тем, кто проживает вместе с инфицированным. Если кто-либо из членов семьи тоже является носителем, можно заразиться повторно. Именно поэтому всем членам семьи с обнаруженным MRSA нужно одновременно проходить лечение.
Есть ли ограничения по работе?
Человек может работать, исключая те случаи, когда он собирается в сферу здравоохранения (дома инвалидов и больницы) или заниматься животноводством. Он не обязан сообщать ни работодателю, ни в детском саду, ни в школе (исключая сферы труда в животноводстве/домах инвалидов/больницах) о том, что является носителем стафилококка. Такие пациенты могут спокойно социально взаимодействовать с другими людьми.
Мы рассмотрели, что это такое - MRSA инфекция.
MRSA News: Infection Rate on the Rise in Kids (Апрель 2020).
MRSA не являются организмами VRE (VRE означает резистентные к ванкомицину виды Enterococcus ). Энтерококки - это бактерии, которые встречаются в кишечнике. Однако штамм MRSA может быть устойчивым к антибиотику vancomycin (Lyphocin, Vancocin HCl, Vancocin HCl Pulvules), и эти штаммы называются VRSA (устойчивый к ванкомицину Staphylococcus aureus ). Плазмиды (экстрахромосомный генетический материал), которые кодируют устойчивость к антибиотикам, могут переноситься между этими двумя бактериальными типами и другими типами бактерий, таких как Escherichia ( E. coli ). Кроме того, лейбл неоднократно помещал MRSA в качестве вируса. Это ошибка, но люди все время сообщают об этом время от времени. Не путайте, если снова появится термин MRSA-вирус, поскольку он будет исправлен в большинстве случаев.
Даже без резистентности к антибиотикам S. aureus имеет эффективные средства для заражения. Бактериальные штаммы S. aureus могут продуцировать протеолитические ферменты (ферменты, которые разрушают белки, приводящие к образованию гноя), энтеротоксины (белки, вызывающие рвоту, диарею, а в некоторых случаях и шок), эксфолиативный токсин (белок, вызывающий нарушение кожи, волдыри) и экзотоксин TSST-1 (белок, который может вызвать синдром токсического шока). Добавление устойчивости к антибиотикам к этому длинному списку патогенных механизмов (способы заражения) делает MRSA грозным супербугом.
Менее 2% населения США колонизировано MRSA, и эти люди называются носителями MRSA. Доля связанных со здравоохранением стафилококковых инфекций, вызванных MRSA (известная как больница, связанная с MRSA или HA-MRSA), быстро увеличилась с 2% в отделениях интенсивной терапии в 1974 году до 64% в 2004 году. Примерно 126 000 госпитализаций связаны с MRSA ежегодно. Недавние данные свидетельствуют о том, что MRSA вызывает большой процент всех инфекций кожи и мягких тканей. Инвазивные (серьезные) инфекции MRSA встречаются примерно у 94 000 человек каждый год и связаны с примерно 19 000 случаев смерти, как сообщается, больше смертей, чем ВИЧ в год. Из этих инфекций MRSA, которые вызывают смерть, около 86% составляют HA-MRSA, а 14% - CA-MRSA (также называемый MRSA, приобретенный у сообщества, поскольку эти инфекции MRSA приобретаются за пределами медицинских учреждений). Недавно CDC сообщила об уменьшении зарегистрированных случаев MRSA; HA-MRSA снизилась примерно на 28%, а CA-MRSA снизилась на 17%. Эти капли могут быть вызваны повышением осведомленности общественности и использованием методов, чтобы избежать передачи этих бактерий другим людям.
Бактерии MRSA могут передаваться прямыми (хотя и с жидкостями кожи и тела) и косвенным контактом (от полотенец, подгузников и игрушек) до неинфицированных людей. Кроме того, некоторые люди имеют MRSA на своем теле (на коже или в носу или горле), но не проявляют никаких симптомов инфекции; эти люди называются носителями MRSA (см. выше) и могут передавать MRSA другим. Статистика показывает, что CA-MRSA является преобладающим MRSA-типом, обнаруженным у населения. Большинство носителей лучше всего обнаруживают путем культивирования MRSA из носовых тампонов.
MRSA заразительна как напрямую (по личному контакту), так и косвенно (когда зараженный человек касается предметов, таких как полотенца, игрушки или другие поверхности, и оставляет бактерии MRSA, которые могут быть переданы неинфицированным людям). Некоторые бактерии MRSA могут выживать в течение нескольких недель на поверхностях, таких как дверные ручки, полотенца, мебель и многие другие предметы. Хотя бактерии MRSA могут быть включены в капли для секреции, выделенные инфицированными индивидами, прямой контакт является обычным способом распространения MRSA (передаются) другим. Инкубационный период для MRSA варьируется от примерно одного до десяти дней; контагиозный период может включать инкубационный период и время, необходимое для устранения инфекции MRSA человека. Некоторые люди, которые являются носителями бактерий MRSA, могут быть слабо заразительными (это означает, что это возможно, но гораздо реже передавать MRSA другим людям, чем людям с активной инфекцией) до тех пор, пока они несут бактерии.
Факторы риска для получения MRSA включают в себя участие в спортивных состязаниях, совместное использование полотенец или других личных вещей, наличие каких-либо условий, которые подавляют функцию иммунной системы (например, ВИЧ, рак или химиотерапию), антисанитарные или переполненные условия жизни (общежития или военные казармы) медицинский работник, а также молодой или старости. Почти все, что приводит к разрыву на коже (например, царапины, ссадины или проколы), повысит риск заражения. Транспортеры MRSA (люди, колонизированные бактериями MRSA, но не являющиеся симптоматическими) могут передавать бактерии, не зная об этом. Госпитализированные пациенты рискуют, что медицинские работники случайно передают MRSA между пациентами. К сожалению, у госпитализированных пациентов обычно есть сайты (например, линии IV, места хирургического разреза), которые легко заражаются MRSA. Следовательно, прямой контакт с организмами MRSA на поверхностях или инфицированных людей является самым высоким фактором риска заражения MRSA.
Симптомы инфекций MRSA являются переменными; однако, гнойная продукция часто встречается в зараженной области. Классические примеры гнойных участков у пациентов - кипения (гной в волосяных фолликулах), абсцессы (коллекции гноя), карбункулы (большие абсцессы с дренированием гноя), стирола (гной в вековой железе) и импетиго (гной в блистерах на кожа). Целлюлит (инфекция под кожей или жировой тканью) обычно не имеет гноя, но начинается с небольших красных ударов на коже, иногда с зудом, а также может быть вызвано MRSA. У детей и взрослых есть те же симптомы. Такие группы, как члены семьи, близкие друзья, дети в дневном отделении или члены спортивной команды, могут разработать эти симптомы в течение короткого промежутка времени. Вышеупомянутые симптомы чаще всего встречаются в CA-MRSA, но также могут быть обнаружены в HA-MRSA. Когда какая-либо антибиотикотерапия терпит неудачу, CA- и HA-MRSA следует рассматривать как потенциальную причину инфекции.

Инфекции HA-MRSA, как правило, подозреваются, когда больной пациент развивает признаки сепсиса (лихорадка, озноб, низкое кровяное давление, слабость и психическое ухудшение), даже если к пациенту обращаются с антибиотиком. Пациенты CA-MRSA, у которых развивается сепсис или пневмония (инфекция легких), нуждаются в немедленной госпитализации. Тем не менее, госпитализированные пациенты не должны иметь первичный сайт инфекции MRSA, только сайт, где MRSA может вторгнуться (инвазивная или серьезная MRSA) и пролиферировать (например, любой хирургический сайт, сайт IV или сайт имплантированного устройства). Следовательно, симптомы гнойного действия или признаки сепсиса у любого госпитализированного пациента, особенно с иммунным компромиссом (например, ВИЧ, рак или пожилые люди), могут быть вызваны MRSA.
Следовательно, симптомы и признаки инфекции MRSA на коже или на ней следующие:
- Покраснение и / или сыпь
- припухлость
- Боль на месте
- Лихорадка или теплота на месте
- Гной и / или дренирующий гной
- У некоторых пациентов может быть зуд
- У некоторых пациентов может развиться лихорадка
- Сайт может проявляться в виде болячек, кипения, абсцесса, карбункула, целлюлита, стирола или импетигообразных хрустальных поражений на лице или других областях
- Лечение антибиотиками, не снижающее симптомов
- Более серьезные инфекции могут иметь красные полосы, которые продвигаются с сайта
- Изъязвление с дренирующим гноем
- Некротический фасцит (быстро прогрессирующая инфекция, которая разрушает ткань под кожей)
Резюме возможных симптомов заражения MRSA, полученных в больнице, выглядит следующим образом:
- Любая из перечисленных кожных инфекций (ранние признаки и симптомы)
- Пневмония
- Инфекция сайта
- Инфекция хирургической раны
- Симптомы растут или не улучшаются даже при применении антибактериальной терапии
- Некротический фасциит
- Сепсис
- гипотония
- Тахикардия
- кома
- Смерть
Диагноз MRSA устанавливается культурой бактерий из зараженной области. Любая область кожи с гнойными, абсцессами или волдырями должна быть культивирована для MRSA. Пациенты с сепсисом или пневмонией должны иметь культуры крови. Пузырь из хирургических мест, костного мозга, суставной жидкости или почти любого участка тела, который может быть инфицирован, должен быть культивирован для MRSA. К сожалению, инфекции MRSA похожи на почти любую инфекцию стафилококка, поэтому идентификация штаммов MRSA важна для пациента и врача. Что делает инфекцию подозрительной, как MRSA, когда симптомы ухудшаются и кажутся невосприимчивыми к лечению антибиотиками.
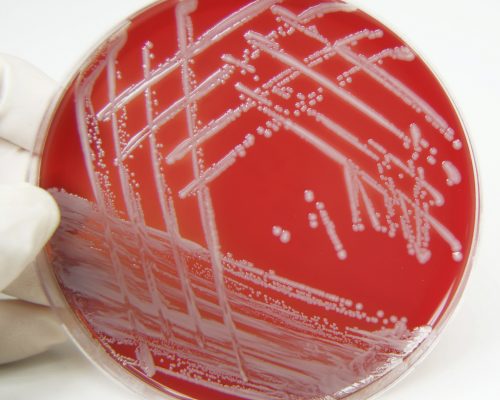
Окончательные лабораторные исследования для диагностики MRSA просты. S. aureus изолирован и идентифицирован у пациента стандартными микробиологическими методами (рост на чашках агара Baird-Parker и положительный тест на коагулазу). Тест на коагулазу представляет собой лабораторный тест, основанный на способности S. aureus вырабатывать фермент коагулазу, который в конечном итоге приводит к образованию сгустка крови. После выделения бактерий S. aureus бактерии затем культивируют в присутствии метициллина (и обычно других антибиотиков). Если S. aureus растет в присутствии метициллина, бактерии называются MRSA. Метод Кирби-Бауэра (показан ниже) показывает четкие области, где различные антибиотики убивают бактерии; Бактерии MRSA проявляют мало или вообще не имеют четких областей для большинства тестируемых антибиотиков.

Носители MRSA обнаруживаются путем вытирания кожи, носовых ходов (наиболее вероятная область положительной) или горла бессимптомных людей и выполнения описанных выше методов культивирования.
Читайте также:


