Лабораторная диагностика ротавирусной инфекции у взрослых
В высокоразвитых странах более 60% острых гастроэнтеритов вызывают вирусы из семейства Reoviridae. Среди них доминируют ротавирусы. Род Rotavirus включает ротавирусы человека и вирусы, вызывающие диареи у животных. Последние для человека непатогенные. Ротавирусы человека вызывают, в основном, гастроэнтериты у детей до трех лет и пожилых людей. Возбудитель передается фекально-оральным способом при бытовых контактах. Высокая устойчивость вирусов во внешней среде способствует развитию вспышек гастроэнтеритов особенно в зимний период (до 90%). За белковыми антигенами ротавирусы разделяют на 4 серовариантив.
Материал для лабораторной диагностики
Материалом для лабораторной диагностики служат стул и кровь. Пробы кала принимают в первые часы и дни болезни в стерильные пенициллиновые флаконы и направляют в вирусологической лаборатории в контейнерах со льдом. Готовят 10-20% суспензию в растворе Хэнкса, центрифугируют 30 мин при 3000 об / мин. Центрифугат переносят в стерильный флакон, добавляют фреон 113 или 1000 ЕД / мл пенициллина и 500 ЕД / мл стрептомицина, помещают в холодильник на 10-12 часов. Кровь для серологических реакций принимают в первые 2-3 дня болезни и через 12-14 дней. Лабораторная диагностика вирусных диарей основывается на быстром обнаружении вирусов в кале с помощью электронной и иммунной электронной микроскопии, реакции непрямой гемагглютинации с антительным эритроцитарным вирусных диагностикумом. Используют также иммуноферментный анализ в твердофазном варианте реакцию коаглютинации, метод клонированных РНК-зондов и полимеразной цепной реакции. В первые дни болезни содержание ротавирусов в копроматериалах достигает 106-108 в 1 г, поэтому их обнаружение при прямой электронной микроскопии возможно без дополнительной концентрации. Каплю исследуемого материала наносят на специальные пленки из нитроцеллюлозы и микроскопируют при увеличении 50000. Метод чувствительный и надежный, позволяет быстро обнаружить вирус и исследовать его морфологию. При обнаружении 5-6 вирионов практически в каждом поле зрения можно достоверно подтвердить диагноз ротавирусного гастроэнтерита. Еще большее диагностическое значение имеет метод имуноелектроннои микроскопии. Принцип ее заключается в том, что иммунную противовирусную сыворотку добавляют к освещенной низкоскоростным центрифугированием суспензии фекалий, выдерживают 60 мин при комнатной температуре и еще 12 ч при 4 ° С, затем центрифугируют при 15000 об / мин для осаждения вирусных частиц и иммунных комплексов. Осадок ресуспендируют в 2-3 каплях дистиллированной воды, контрастируют в фосфорно-вольфрамовой кислоты и исследуют под электронным микроскопом. В препаратах обнаруживают характерные скопления ротавирусов. Высокая эффективность метода практически не зависит от исходной концентрации вирусов в исследуемых пробах.
Вирусологические исследования с целью выделения ротавирусов в культурах клеток или на лабораторных животных в рутинных вирусологических лабораториях не проводится. Наиболее широко в диагностике вирусных гастроэнтеритов используют иммуноферментный анализ. Принцип его заключается в том; что лунки полистироловых планшет сначала сенсибилизують антителами против ротавирусов, а затем добавляют в них освещенную суспензию фекалий, инкубируют 1 ч в термостате. Образован в лунках комплекс антиген-антитело после трехкратного промывания фосфатным буфером проявляют внесением антиглобулиновои сыворотки, конъюгированных с ферментом. После инкубации в термостате добавляют хромогенных субстратов до появления окрашенного продукта реакции. Учет результатов проводят с помощью иммуноферментного анализатора. В небольших лабораториях достаточно часто проводят реакцию обратной непрямой гемагглютинации с использованием антительного ротавирусного эритроцитарного диагностикума. Она проста по методике постановки, хотя и менее чувствительна по сравнению с реакцией ензиммичених антител. В практику лабораторной диагностики вирусных инфекций вводят также тест коаглютинации для индикации ротавирусного антигена в кале больных. На предметное стекло наносят каплю взвеси стафилококков (штамм Cowan 1), сенсибилизированных ротавирусной сывороткой, и добавляют каплю освещенного центрифугированием копроматериалу. При наличии ротавирусов через 30-60 с возникает агглютинация нагруженных антителами стафилококков. Очень чувствительным способом быстрой диагностики вирусных гастроэнтеритов является метод выявления вирусоспецифические РНК с помощью молекулярной гибридизации. Он основан на гибридизации меченых РНК-зондов, фиксированных на нитроцеллюлозные фильтрах. Мечение осуществляют биотином или ферментом, что значительно упрощает и удешевляет метод по сравнению с радиоизотопными метками.
Анализ ротавирусной РНК
Анализ ротавирусной РНК, несмотря на его дороговизну, все шире внедряется в практику, особенно после разработки метода полимеразной цепной реакции. Последняя является чувствительным и специфическим методом диагностики, который, безусловно, является диагностическим тестом нового поколения, так называемым "золотым стандартом". Однако постановка этой реакции все еще требует высокой квалификации исследователя, дорогих реактивов и сложной аппаратуры.
Серологическая диагностика направлена на выявление специфических антител в парных сыворотках, взятых с двухнедельным интервалом. Для этой цели используют различные нейтрализационных или преципитацийни тесты и непрямую реакцию иммунофлюоресценции. Но в последнее время широко применяют иммуноферментный анализ. Раньше для серодиагностики широко ставили РСК с использованием в качестве антигена предварительно отобранные фекалии больных гастроэнтерит или ротавирусы телят. Но по своей чувствительностью и специфичностью она значительно уступает метода иммуноферментного анализа. Для выявления специфических антител к ротавирусов ставят также реакцию торможения непрямой гемагглютинации с парными сыворотками. Гастроэнтериты у детей могут также вызвать калицивирусы, астровирусы и вирусы Норволк. Все они выделяются с испражнениями в первые 2-3 дня заболевания, не размножаются в культурах клеток или слабо репродуцируются без цитопатического действия. Для лабораторной диагностики гастроенетеритив, вызванных данными вирусами, используют, в основном, метод иммунной электронной микроскопии. Других методов диагностики, доступных для вирусологических лабораторий, пока нет.
[youtube.player]Внешний вид вирусных частиц напоминает колесо с широкой ступицей, короткими спицами и четко очерченным ободком, поэтому их стали называть ротавирусами (лат. rotа — колесо). Рисунок 1. Слизистая оболочка толстой кишки при ротавирусном гаст
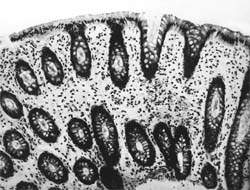 |
| Рисунок 1. Слизистая оболочка толстой кишки при ротавирусном гастроэнтерите. Минимально выраженный катаральный колит. х 100. |
Ротавирусы представляют собой род семейства Reoviridae, который объединяет большое количество сходных по морфологии и антигенной структуре вирусов, вызывающих гастроэнтерит у человека, млекопитающих и птиц. Систематическое изучение ротавирусов человека началось с 1973 года, когда они были обнаружены при электронной микроскопии ультратонких срезов биоптатов слизистой оболочки двенадцатиперстной кишки, полученных от больных острым гастроэнтеритом детей Австралии (Р. Бишоп и соавторы). В том же году Т. Флеветт обнаружил сходный вирус в копрофильтратах больных гастроэнтеритом методом электронной микроскопии при негативном контрастировании препаратов.
Вирусные частицы имеют диаметр от 65 до 75 нм. При проникновении контрастирующего вещества в вирион выявляется электронно-плотный центр диаметром 38 — 40 нм, который представляет собой так называемую сердцевину, окруженную электронно-прозрачным слоем. Внешний вид вирусных частиц напоминает колесо с широкой ступицей, короткими спицами и четко очерченным ободом, поэтому их стали называть ротавирусами (лат. rota — колесо).
Ротавирусы имеют две белковые оболочки — наружный и внутренний капсиды. Сердцевина содержит внутренние белки и генетический материал, представленный двунитчатой фрагментированной РНК. Геном ротавирусов человека и животных состоит из 11 фрагментов, которые могут быть разделены при электрофорезе в полиакриламидном геле (ПААГ) или агарозе. В составе ротавирусов обнаружено четыре антигена; основной из них — это групповой антиген, обусловленный белком внутреннего капсида. С учетом группоспецифических антигенов все ротавирусы делятся на пять групп: A, B, C, D, E. Ротавирусы одной группы имеют общий групповой антиген, который выявляется иммунологическими реакциями: иммуноферментный анализ, иммунофлюоресценция, иммунная электронная микроскопия и др. Большинство ротавирусов человека и животных относятся к группе A.
| Источником инфекции при ротавирусном гастроэнтерите является инфицированный человек — больной манифестной формой заболевания или бессимптомно выделяющий ротавирусы с фекалиями |
Источником инфекции при ротавирусном гастроэнтерите является инфицированный человек — больной манифестной формой заболевания или бессимптомно выделяющий ротавирусы с фекалиями. Вирусы в фекалиях заболевших появляются одновременно с развитием клинических симптомов, наибольшая концентрация их в кале (до 109 — 1011 вирусных частиц в 1 г) регистрируется в первые 3 — 5 дней болезни. В эти дни больные представляют наибольшую эпидемиологическую опасность для лиц, контактирующих с ними. Наиболее частым источником заболевания для детей первого года жизни являются инфицированные ротавирусом матери; для взрослых и детей более старшего возраста — дети, в основном из детских коллективов. Возможность заражения человека от животных не доказана.
Патогенез ротавирусной инфекции характеризуется проникновением вируса в эпителиоциты слизистой оболочки желудочно-кишечного тракта, преимущественно тонкой кишки, что приводит к их повреждению и отторжению от ворсинок. Вследствие этого на ворсинках тонкой кишки появляются функционально и структурно незрелые энтроциты с низкой способностью синтезировать пищеварительные ферменты. При ротавирусном гастроэнтерите это проявляется снижением уровня дисахаридаз, развивается вторичная дисахаридазная недостаточность, при которой в просвете тонкой кишки накапливаются нерасщепленные дисахариды, что создает повышенное осмотическое давление и приводит к выводу в просвет кишечника воды и электролитов из тканей организма. Это является основной причиной диареи и дегидратации и определяет основные клинические проявления болезни.
Ротавирусный гастроэнтерит как инфекционное заболевание имеет циклическое течение. Инкубационный период продолжается чаще всего от 12 — 24 часов до двух суток. Клиническая картина ротавирусного гастроэнтерита характеризуется в основном острым началом, однако в ряде случаев может иметь место продромальный период длительности от 12 до 48 — 72 часов. В этот период больные отмечают недомогание, общую слабость, повышенную утомляемость, снижение аппетита, головную боль, познабливание, урчание и неприятные ощущения в животе, умеренно выраженные катаральные явления: заложенность носа, першение в горле, легкий кашель.
В клинической картине ротавирусного гастроэнтерита в период развернутых клинических проявлений ведущими являются синдромы гастроэнтерита и интоксикации. Выраженность диареи и обусловленной ею той или иной степени дегидратации организма, а также токсикоза, продолжительность этих симптомов в значительной мере определяет тяжесть течения заболевания.
Синдром гастроэнтерита характеризуется развитием диареи, снижением аппетита, появлением урчания и болей в животе, тошноты и рвоты. Наиболее типичен для ротавирусного гастроэнтерита обильный водянистый пенистый стул желтого или желто-зеленого цвета. У больных с легким течением заболевания стул может быть кашицеобразным. Как правило, патологические примеси в стуле отсутствуют. Боль локализуется преимущественно в верхней половине живота или является диффузной, она может быть разной интенсивности. Почти всегда она сопровождается громким урчанием в животе.
Синдром интоксикации появляется в самом начале заболевания. Слабость, зачастую резкая, является наиболее частым проявлением этого синдрома; реже отмечается головная боль. При более тяжелом течении имеют место головокружение, обморочное состояние, коллапс. Обращает на себя внимание следующая особенность ротавирусного гастроэнтерита: два ведущих в клинической картине болезни синдрома развиваются в процессе заболевания не всегда однонаправленно; у некоторых больных на фоне сравнительно слабо выраженных диспепсических явлений могут наблюдаться резко выраженные симптомы общей интоксикации, особенно слабость.
Повышение температуры тела не всегда может отмечаться при ротавирусном гастроэнтерите, особенно у взрослых. У некоторых больных может быть озноб без повышения температуры. В то же время нередко в разгар заболевания выраженность лихорадочной реакции варьируется от субфебрильных цифр и выше и может достигать 38 — 39°С как у детей, так и у взрослых.
Важным в диагностическом плане для ротавирусного гастроэнтерита считается сочетание двух ведущих клинических синдромов с симптомами поражения верхних дыхательных путей. Катаральный синдром встречается приблизительно у 50% больных и проявляется в виде гиперемии и зернистости слизистых оболочек мягкого неба, небных дужек, язычка, задней стенки глотки, а также насморка, заложенности носа, кашля, болей в горле. В ряде случаев катаральные симптомы наблюдаются уже в продромальном периоде, до проявления симптомов гастроэнтерита.
В разгар болезни отмечается изменение функционального состояния сердечно-сосудистой системы, чаще у пациентов с более тяжелым течением и при наличии сопутствующих заболеваний органов кровообращения. У большинства пациентов отмечается тенденция к артериальной гипертензии, тахикардия, определяется глухость сердечных тонов при аускультации. У больных с тяжелым течением заболевания, как правило, возникают обмороки и коллапсы из-за выраженных расстройств гемоциркуляции, в генезе которых наряду с токсическими воздействиями существенное значение имеет гиповолемия. Потери жидкости и электролитов вследствие рвоты и диареи могут быть значительными и приводят к развитию дегидратации. Клинические проявления дегидратации зависят от ее степени. При легком и среднетяжелом течении ротавирусного гастроэнтерита отмечается жажда, сухость во рту, слабость, бледность (дегидратация I — II степени), при тяжелом течении наряду с этими симптомами наблюдаются также осиплость голоса, судороги мышц конечностей, акроцианоз, снижение тургора кожи, уменьшение диуреза (дегидратация III степени).
В связи с развитием при ротавирусном гастроэнтерите возможных осложнений, главным образом циркуляторных расстройств, острой сердечно-сосудистой недостаточности, нарушений гомеостаза, выделяют группы больных повышенного риска, в которые включают новорожденных, детей младшего возраста, лиц пожилого возраста, а также больных с тяжелыми сопутствующими заболеваниями. Описанные в литературе и наблюдавшиеся нами случаи ротавирусного заболевания с летальным исходом относятся именно к этим группам.
Выделяются две основные клинические формы ротавирусного заболевания — гастроэнтерическая и энтерическая. Симптомы только острого гастрита (гастритический вариант) встречаются в 3 — 10% случаев. Функциональные и морфологические нарушения со стороны желудочно-кишечного тракта, возникающие при ротавирусном гастроэнтерите в случае наличия у пациентов фоновой гастроэнтерологической патологии, нередко способствуют развитию таких осложнений основного заболевания, как обострение сопутствующих болезней: хронического гастрита, энтероколита, панкреатита, часто в сочетании с выраженными явлениями дисбактериоза кишечника, требующими коррекции при лечении.
При ротавирусном гастроэнтерите гемограмма изменяется следующим образом: в остром периоде заболевания с высокой частотой выявляются лейкоцитоз с нейтрофилезом и повышенная СОЭ. В периоде реконвалесценции картина крови обычно нормализуется полностью. Изменения урограммы у большинства больных имеют кратковременный характер и проявляются чаще всего небольшой протеин-, лейкоцит- и эритроцитурией; в редких случаях в моче появляются гиалиновые цилиндры в незначительном количестве. При тяжелом течении заболевания нарушения функции почек могут быть более выраженными, с повышением уровня мочевины крови, олигоурией или анурией, снижением клубочковой фильтрации. На фоне проводимой терапии указанные изменения быстро исчезают и при повторных обследованиях не отмечаются.
В качестве примера, иллюстрирующего особенности клинического течения ротавирусного гастроэнтерита, приводим выписку из истории болезни.
Лечение: обильное питье солевых растворов, парентеральная регидратационная и дезинтоксикационная терапия — трисоль 1000 мл внутривенное капельное введение, внутрь ферментные препараты: абомин, панкреатин, тансол, карболен. Течение заболевания без осложнений. На третий день болезни — субфебрильная температура, оставалась слабость; боли в животе прекратились. Стул кашицеобразный до пятого дня от начала заболевания. Полное выздоровление наступило на седьмой день болезни.
Дифференциальный диагноз у больных ротавирусным гастроэнтеритом проводят с другими острыми кишечными инфекциями как вирусной так и бактериальной этиологии, прежде всего в тех случаях, когда в клинической картине на первый план выступает синдром гастроэнтерита: с вирусными диареями различной этиологии (аденовирусы, коронавирусы, астровирусы, калицивирусы, вирус Норфолк, энтеровирусы Коксаки и ЕСНО); с гастроинтестинальной формой сальмонеллеза, с гастроэнтеритическим и гастроэнтероколитическим вариантами острой дизентерии, с пищевыми токсикоинфекциями, вызванными условно-патогенными бактериями; с холерой.
Обнаружение специфических антител и нарастание их титра в сыворотке крови больных и переболевших ротавирусным гастроэнтеритом при помощи серологических реакций с целью текущей диагностики на практике в настоящее время широкого распространения не получило и используется в основном для ретроспективного анализа различных эпидемиологических ситуаций.
Методы обнаружения вирусспецифической РНК, которые можно назвать высокочувствительными и специфичными, имеют, однако, ряд недостатков, ограничивающих их практическое применение (необходимость наличия специальной аппаратуры, реактивов, квалифицированного персонала и др.) Наиболее простой метод в этой группе — электрофорез ротавирусной РНК в полиакриламидном геле. Этот метод, позволяющий идентифицировать штаммы вирусов, вызвавшие заболевание, и дать характеристику штаммов, циркулирующих на данной территории, в основном применяется при эпидемиологических исследованиях.
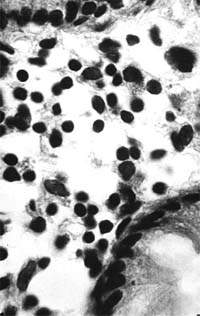 |
| Рисунок 2. Слизистая оболочка толстой кишки при ротавирусном гастроэнтерите. Минимальное содержание плазматических клеток в собственной пластинке, увеличение в ней числа макрофагов. х 400 |
В клинической практике врач нередко сталкивается с обстоятельствами (сомнительные результаты вирусологических и серологических исследований, случаи микст-инфекций), когда возникает необходимость в применении дополнительных методов для верификации диагноза. С этой целью может быть использован доступный для практического здравоохранения интрументальный метод исследования — ректороманоскопия с аспирационной биопсией слизистой оболочки толстой кишки. При гистологическом, морфометрическом и гистохимическом исследованиях биоптатов при ротавирусном гастроэнтерите выявляются характерные изменения в виде поверхностного минимально выраженного катарального колита с незначительной дистрофией эпителия (рис. 1), снижения числа серотонинсодержащих желудочно-кишечных эндокриноцитов (ЕС-клетки) в эпителиальном пласте кишечных желез, умеренной инфильтрацией собственной пластинки плазматическими клетками и увеличением в ней числа макрофагов (рис. 2). Эти особенности имеют дифференциально-диагностическое значение, поскольку отличаются указанным показателем от других острых кишечных инфекций, что может быть использовано в диагностически сложных случаях.
Здравоохранение в настоящее время не располагает препаратами, обладающими специфическим антиротавирусным действием, поэтому терапия ротавирусного гастроэнтерита является патогенетической. Основные ее цели — борьба с дегидратацией, токсикозом и связанными с ними наиболее часто встречающимися при ротавирусном гастроэнтерите нарушениями функции жизненно важных органов — сердечно-сосудистой системы и органов мочевыделения, степень выраженности которых во многом определяет тяжесть течения заболевания и его прогноз.
Для правильного выбора характера и объема проводимой регидратационной терапии в первую очередь необходимо установить степень дегидратации у того или иного пациента. При эксикозе I — II степени следует ограничиваться пероральной регидратационной терапией (препараты регидрон, глюксолан и др.). При дегидратации III степени целесообразно прибегать к комбинированной парентеральной и пероральной регидратации. Для парентеральной регидратации применяют растворы трисоль, квартасоль, ацесоль и др. С целью дезинтоксикации и улучшения гемодинамики при среднетяжелом и тяжелом течении заболевания показаны коллоидные растворы (гемодез, полиглюкин и др.).
| Для ротавирусной инфекции характерно сочетание гастроэнтерита, интоксикации и симптомов поражения верхних дыхательных путей |
Современными представлениями о патогенезе диарейного синдрома при ротавирусном гастроэнтерите обусловлено и назначение соответствующих средств, способствующих нормализации состояния пищеварительного тракта, а также диеты. Учитывая нарушения активности ряда пищеварительных ферментов, в частности лактазы, рекомендуется исключить в острый период заболевания из пищевого рациона больных молоко и молочные продукты. Кроме того, по этой же причине целесообразно ограничивать и пищу, богатую углеводами. В связи с вышеизложенным, в острый период необходимы энзимные препараты (панзинорм-форте, фестал и др). Кроме того, в остром периоде заболевания могут быть использованы адсорбирующие и вяжущие средства, способствующие ускоренному формированию стула (смекта, карболен и др.) также возможно применение хилака-форте. Высокой частотой дисбактериозов кишечника различной степени выраженности у больных ротавирусным гастроэнтеритом обусловлена необходимость применения в комплексной терапии бактерийных биологических препаратов. Лучшая терапевтическая эффективность при ротавирусном гастроэнтерите отмечена при применении лактосодержащих бактерийных биологических препаратов (ацилакт, лактобактерин и др.), что, по-видимому, связано с заместительным действием бактериальной лактазы, содержащейся в лактобактериях. В последние годы в комплексной терапии ротавирусного гастроэнтерита начал применяться комплексный иммуноглобулиновый препарат (КИП), который разработан и выпускается в МНИИЭМ им. Г. Н. Габричевского. Это первый отечественный иммуноглобулиновый препарат для энтерального применения. КИП характеризуется повышенной концентрацией антител к микроорганизмам, возбудителям острых кишечных инфекций, в том числе ротавирусам, сальмонеллам, шигеллам, эшерихиям и др. Применение КИП в комплексной терапии больных ротавирусным гастроэнтеритом оказывает отчетливый положительный терапевтический эффект, существенно сокращая продолжительность интоксикации и диареи, что открывает новые возможности в лечении этого заболевания.
Литература
1. Букринская А. Г., Грачева Н. М., Васильева В. И. Ротавирусная инфекция. М., 1989.
2. Дроздов С. Г., Покровский В. И., Шекоян Л. А., Машилов В. П. и др. Ротавирусный гастроэнтерит. М., 1982.
3. Новикова А. В. и др. Архив патологии, 1989, №6.
4. Щербаков И. Т. и др. Архив патологии, 2995, №3.
5. Юшук Н. Д., Царегородцев А. Д.. Лекции по инфекционным болезням. М., 1996.
Ротавирусная инфекция (РВИ) КРС (диарея неонатальных телят) - остропротекающая контагиозная болезнь новорожденных телят, характеризующаяся поражением ЖКТ. Болезнь широко распространена во всех географических регионах земного шара. Практически ее регистрировали везде, где проводили исследования. Доказана широкая диссиминация ротавирусов (РВ) телят среди животных разных видов и наличие АТ у грызунов (морских свинок, крыс, хомяков, мышей).
На основании эпизоотологических, клинических и патологоанатомических данных ставят предварительный диагноз, окончательный устанавливают лишь лабораторньм методами. Последние базируются на обнаружении вируса или вирусного АГ в фекали больных телят, содержимом кишечника, клетках слизистой оболочки тонкого кишечника павших и вынужденно убитых животных, а также на выявлении АТ к РВ в сыворотках крови больных и переболевших телят и в сыворотках крови и молозиве коров-матерей.
Экспресс-методы диагностики. Разработана тест-система ИФА на основе РВ свиней при выявлении специфического АГ РВ КРС, которая обладает высокой чувствительностью и специфичностью. Её целесообразно применять в лабораторных условиях для экспресс-диагностики. Поскольку полипептид VР5 содержит перекрестный групповой АГ, локализованный в консервативном домене, который является общим для всех РВ группы А. Показана возможность индикации рота- и коронавирусов методом флюоресцентных зондов и АТ к ним. Он основан на регистрации ранних этапов взаимодействия вирусов с рецепторами клеток.
Выделение вируса. В лабораторию для исследования направляют не менее 10 проб жидких фекалий, тонкий кишечник с содержимым (не позднее 2-3 ч с момента гибели или вынужденного убоя телят), 10-15 проб парных сывороток больных и переболевших животных, 6-10 проб сыворотки крови коров и 6-10 проб молозива. С наибольшим постоянством вирус удается обнаружить в пробах фекалий, взятых в первые дни болезни, поэтому для исследования пригодны фекалии, взятые от 2-14-дн телят с клиническими признаками диареи на 1-3-й день болезни. Сразу же после доставки в лабораторию пробы обрабатывают или хранят при 4°С не более суток, при -20-50°С до 1 мес. Сыворотки крови хранят при 4-10°С не более 1 нед, при -20°С до 1 мес; молозиво - при 4°С не более 2 сут, при -20°С - до 1 мес. Для вирусологических или электронно-микроскопических исследований готовят 10%-ную суспензию фекалий на р-ре Хенкса. Суспензию гомогенизируют и центрифугируют 1 ч при 3 тыс. об/мин, надосадочную жидкость переносят в стерильный флакон, добавляют пенициллин и стрептомицин (по 1000 ЕД/мл), выдерживают 10-12 ч (ночь) при 4°С и исследуют.
Выделение РВ в культуре клеток. Показана корреляция между заболеванием новорожденных телят диареей с присутствием РВ АГ в фекалиях. Следует иметь в виду, что обычными методами вирус не культивируется, а применение дополнительных воздействий - химических (трипсин) и физических (центрифугирование вируса на слое клеток) - дает положительные результаты при высоких концентрациях вируса в фекалиях, что проверяется электронной микроскопией. Для этого содержимое одной пробирки после замораживания и оттаивания и обработки полиэтиленгликолем ресуспендируют в 0,1 мл дистиллированной воды и исследуют в электронном микроскопе. В положительном случае обнаруживают типичные частицы РВ и их скопления. Специфический характер частиц подтверждают методом иммуноэлектронной микроскопии.
Индикация и идентификация вируса. ЭМ и ИЭМ. Метод электронной микроскопии (ЭМ) суспензии вируса из жидкой части фекалий наиболее широко применяется для диагностики инфекции при концентрации вируса в фекалиях не ниже 10 4 -10 5 частиц/мл жидкости. Препараты готовят из осветленной низким центрифугированием жидкой части фекалий, Однако лучшие препараты получают при разведении фекалий дистиллированной водой 1:1-1:10 и последующем осветлении суспензии центрифугированием при 4-10 тыс. об/мин в течение 15 мин. Простой метод приготовления препаратов из фекалий, не уступающий по чувствительности ультрацентрифутированию, состоит в следующем. К 4 мл осветленной низким центрифугированием жидкой части фекалий добавляют 60% насыщенного р-ра (NН4)2SО4 смешивают, оставляют на 1 ч при 4°С, а затем центрифугируют 10 мин при 10000 об/мин. Надосадочную жидкость сливают, а осадок ресуспендируют в 4-х каплях дистиллированной воды и готовят препараты. Существуют различные способы и модификации приготовления препаратов из. Наиболее широко используется капельный способ. Более целесообразно применять ИЭМ. Для этого можно использовать сыворотку лабораторных животных (кроликов, морских свинок), иммунизированных РВ обезьян или сыворотку реконвалесцентов. Содержание и специфичность АТ в сыворотках реконвалесцентов могут быть проверены в серологических реакциях с использованием вируса SА 11. При обработке фекальной суспензии иммунной сывороткой одновременно с обнаружением типичных частиц РВ устанавливается их специфичность, на что указывает выявление агрегатов, в которых РВ частицы связаны специфическими иммунными глобулинами. Чаще используют три модификации иммуноэлектронной микроскопии.
При положительном результате РВ частицы выявляются в препаратах в виде специфических скоплений (иммунных комплексов). Оценку специфичности реакции проводят путем подсчета числа и размеров подобных скоплений, а также по степени покрытия отдельных вирионов АТ сыворотки. Выраженность этого эффекта при определенном навыке можно оценивать по шкале условных единиц от 0 до 4-х плюсов.
ИФ. Для обнаружения вирусного АГ в замороженных срезах тонкого кишечника, мазках фекалий и культуре клеток успешно применяют прямой и непрямой методы. При исследовании криосрезов кишечника и мазков из фекалий телят лучшие результаты получают в течение 4-6 ч после обнаружения признаков диареи. Эпителиальные клетки быстро десква-мируются с поверхности ворсинок кишечника и удаляются с фекальными массами. Чаще всего суспензией фекалий заражают культуру клеток и идентифицируют вирусный АГ в реакции ИФ. Разработан прямой метод ИФ в клетках МДВК, инфицированных культуральным или фекальным вирусным материалом. В методических рекомендациях по индикации РВ КРС непрямым методом ИФ предусматривается использование диагностического набора, включающего антиген специфический - культуральную вируссодержащую суспензию клеток ПЭК или МА-104; АГ нормальный - неинфицированную суспензию клеток ПЭК или МА-104; специфическую сыворотку, полученную путем гипериммунизации телят, лабораторных животных; нормальную сыворотку от здорового КРС, не содержащую АТ к РВ; антивидовую сыворотку против глобулинов КРС, конъюгированную ФИТЦ (выпускает Институт эпидемиологии и микробиологии им. Н.Ф. Гамалеи). НИФ можно использовать для обнаружения и идентификации РВ АГ в инфицированных культурах клеток, фекалиях и кишечнике больных и павших телят для выявления и количественной оценки АТ к РВ.
РДП. Это - простой и доступный метод выявления РВ АГ в фекалиях больных телят, содержимом кишечника и суспензии слизистой оболочки кишечника павших или вынужденно убитых телят. Для этого 20%-ную суспензию фекалий в фосфатно-буферном солевом р-ре прогревают в водяной бане при 37°С 30 мин, периодически перемешивая. Затем центрифугируют 15 мин при 8000 g. Надосадочную жидкость фильтруют через фильтр "Миллипор" и фильтрат концентрируют в 25 раз при помощи диализного концентратора. В результате всех этапов обработки 0,2 мл концентрата соответствует 1 г исходного материала фекалий. Источником специфических АТ служат сыворотки реконвалесцентов после ротавирус-ного гастроэнтерита, предварительно проверенные в других серологических реакциях.
РДП проводят в геле агарозы на стеклянных пластинках 0,9% агарозы в буферном р-ре, содержащем 0,1 М NaС1, 0,01 М трис(гидроксиметил)-аминометана и 0,001 М этилендиа-минтетраацетата. Компоненты реакции помещают в вырезанные в слое агарозы лунки диаметром 3 мм, отстоящие друг от друга на 3 мм. Пластинки с гелем выдерживают в течение ночи при комнатной температуре, после чего учитывают результаты. Между лунками с АГ и АТ в положительных случаях формируется одна четкая линия преципитации. В РДП испытывается АГ - жидкая часть фекалий или надосадочная жидкость после центрифугирования суспензии фекалий или кишечника, испытуемая сыворотка от переболевших телят, молозиво и молоко в натуральном виде (в виде сыворотки) после обработки сычужным ферментом.
Реакция иммунопреципитации с окрашиванием преципитатов флюоресцирующими АТ может применяться дляобнаружения в фекалиях РВ человека и РВ диареи телят. Разработана ее ускоренная модификация. Диагностикум, включающий специфический и нормальный АГ, специфическую сыворотку, готовят по методике ВИЭВ, а в качестве нормальной сыворотки используют фетальную сыворотку или сыворотку безмолозивных телят. Реакцию оценивают по образованию характерных линий преципитата.
РСК. Для выявления АГ применяется реже других методов. Она менее чувствительна, чем электронная микроскопия и РИФ, чаще дает ложноположительные результаты из-за антикомплементарности многих проб фекалий. Однако при обработке фекалий комплементом, фетальной сывороткой, фреоном, очисткой ПЭГ 6000 или ультрацентрифугированием РСК не уступает по чувствительности электронной микроскопии. Реакцию ставят микрометодом со специфической сывороткой или сывороткой недавно переболевших телят, свободной от АТ к другим вирусам.
ВИЭФ. При этой реакции образуется линия преципитации между АГ, движущимся к аноду, и АТ, движущимся к катоду. Качество и чистота агарозы являются основным фактором получения воспроизводимых результатов. Большинство исследователей считают, что этот тест не уступает электронной микроскопии или даже превосходит ее.
ВИЭФ предложен для обнаружения РВ в фекалиях и патологическом материале и для выявления АТ в сыворотках крови. Для исследования берут жидкую часть фекалий. Если для исследования жидкой части недостаточно, то пробы фекалий центрифугируют 10-15 мин при 4 тыс. об/мин при 4-10°С. Исследуют надосадочную жидкость. Кишечник мелко измельчают, добавляют равный объем физиологического р-ра, затем гомогенизируют в ступке со стеклом, центрифугируют 10-15 мин при 2 тыс. об/мин при 4-10°С. Надосадочную жидкость используют в реакции.
ВИЭФ ставят в 0,85%-ом р-ре агарозы, приготовленной на 0,5 М веронал-мединаловом буфере (рН 8,6).
ЕLISА. По чувствительности выше, чем ЭИ, ИФ, РСК, ВИЭФ. Может быть использован в прямом и непрямом вариантах, а также в постановке на латексе. С помощью ЕLISА можно обнаружить РВ в фекалиях телят при разведении исследуемой пробы до 1:5000. Описан твердофазный ЕLISА для типирования и деления на подгруппы РВ человека и животных. Для этого используют IgG в концентрации 5 мкг/мл; разведение кроличьей антисыворотки к IgG КРС до 1:400. Продолжительность инкубации IgG -4 ч, реакции АГ РВ с IgG -3 ч, реакции антисыворотки к РВ с комплексом IgG - РВ АГ -16 ч, для соединения с конъюгатом - 4 ч, для изменения цвета субстрата (фосфата Р-нитрофенила) - 10 мин. Перед исследованием фекалии телят разводят в 4 раза фосфатно-буферным р-ром, осветляют центрифугированием и обрабатывают смесью Твина-20 с азидом натрия. Показания ЕLISА в 100% случаев совпадают с результатами электронной микроскопии.
Разработана тест-система ИФА на основе РВ свиней для выявления специфического АГ РВ КРС, которая обладает высокой чувствительностью и специфичностью. В Российской Федерации разработан иммуноферментный диагностикум, выпускаемый ВИЭВ. Набор включает: специфический лиофилизированный РВ АГ - вируссодержащая суспензия, полученная на культуре клеток МА-104, концентрированная ПЭГ 6000 и центрифугированная при 6000g, контрольный АГ, лиофилизированная специфическая антиротавирусная сыворотка, полученная путем гипериммунизации телят или кроликов вирусом, очищенным в градиенте плотности хлористого рубидия; сухие иммуноглобулины, выделенные из гипериммунной антиротавирусной сыворотки методом высаливания насыщенным р-ром (NН4)2SО4 с последующей ионообменной хроматографией на колонке с ДЭАЭ-целлюлозой.
Существует ряд других методов для выявления РВ АГ в фекалиях больных диареей телят: реакция обратной пассивной гемагглютинации, метод иммуноагрегатной ГА, реакция агглютинации латекса и др. Так, предложен простой стафилококковый метод для обнаружения РВ в фекалиях новорожденных телят с использованием кроличьей сыворотки к РВ телят. Метод основан на обнаружении РВ агглютинирующего стафилококка в 10%-ой суспензии образцов фекалий на предметных стеклах с золотистым стафилококком, нагруженным РВ АТ. Контролем служат стафилококки, обработанные неиммунной кроличьей сывороткой. Агглютинация видна под микроскопом через 2-3 мин после кругового покачивания стекла. Во избежание неспецифических реакций проводят предварительную обработку образцов фекалий нагреванием, фильтрацией и Ы-ацетилцистеином. Такая обработка не снижает специфичности метода. В сравнении с ЕLISА данный метод оказался чувствительнее; преимущества его - скорость, простота и низкая стоимость, что очень важно для скрининга большого числа образцов фекалий.
Метод агглютинации латекса с использованием коммерческого набора Rotalех для выявления РВ в фекалиях больных столь же специфичен, чувствителен, как и методы электронной микроскопии, ИФ и ЕLISА. Для дифференциации подгрупп и серотипов изолятов РВ описан метод гибридизации нуклеиновых кислот, электрофорез в ПААГ вирионной РНК вирусов. Метод точечной гибридизации высоко специфичен, позволяет выявлять 8 нг вирусной РНК и в 10-100 раз более чувствителен, чем ЕLISА.
Вариантная идентификация с помощью монАТ. Получены монАТ к шт. RIT4237 (серотип I) РВ КРС. Нейтрализация АГ выявила вариабельную специфичность к групповым и подгрупповым детерминантам. Использованием монАТ против субгрупповых АГ в ЕLISА было установлено доминирование серотипа II РВ человека в пробах кала больных детей. Наличие таких АТ увеличивает чувствительность и специфичность тест-систем.
Серодиагностика и ретроспективная диагностика. Серологическое исследование сывороток крови телят имеет весьма ограниченную ценность. В течение первых недель жизни не удается обнаружить прироста АТ, несмотря на прошедшую болезнь. Уровень гуморальных АТ у взрослых животных не позволяет прогнозировать возникновение эпизоотии в стаде.
РСК. Для диагностики РВИ показана возможность постановки РСК с парными сыворотками переболевших животных. В первые дни болезни КСА у большинства животных отсутствуют. К 7-10 дню уровень их возрастает, достигая максимума к 21 дню, затем происходит снижение, и к 30-35 дню титр КСА доходит до нуля. РСК ставят общепринятым методом в микро- и макрообъемах.
РТГА. Ставят по стандартной методике, используемой диагностическими вирусологи-) ческими лабораториями. Применяют стеклянные пробирки и обычные объемы реагентов или одноразовые пластиковые панели с лунками и микрообъемы реагентов. Для постановки реакции используют эритроциты человека группы О или эритроциты морской свинки. Исследуемые сыворотки обрабатывают каолином и эритроцитарной массой (последнее - при использовании эритроцитов человека). Все разведения готовят на физиологическом солевом р-ре с добавлением 0,04 % альбумина сыворотки КРС.
Непрямая ИФ, РН, радиоиммунологический метод ставятся по общепринятым методикам.
Дифференциальная диагностика. РВИ у новорожденных телят следует дифференцировать от коронавирусной инфекции, колибактериоза. Необходимо исключать диспепсию новорожденных телят алиментарного происхождения. Для титрования вирусов группы А разработаны методы дот- и блот-гибридизации РНК с зондами к ДНК геномного сегмента 4, полученными с помощью амплификации в ПЦР гипердивергентных областей гена белка VР4 (нуклеотиды 211-686) к ДНК шт. ИК, IND, NCDV и Сr с использованием олигонуклеотидных праймеров. Зонды 3 типоспецифичны (VР4) и не реагируют перекрестно с 2-нитевыми РНК гетерологичных Р-типов РВ.
Не нашли то, что искали? Воспользуйтесь поиском:
[youtube.player]Читайте также:


