Комбинированная антибактериальная терапия при инфекциях
Хоменко А.И., Шадурская С.К., Антибиотики: химиотерапия инфекционных заболеваний., 2002
В настоящее время комбинированное применение антибиотиков является преобладающим в терапии бактериальных инфекций.
Известно, что при комбинированном использовании антибиотиков могут возникнуть:
- индифферентные отношения;
- явления антагонизма;
- синергизма (в виде суммации и потенцирования).
Наиболее часто при комбинированном применении
антибиотиков встречаются явления индифферентности, ко/гДа эффект одного антибиотика не зависит от другого и не меняется в его присутствии. Синергизм в форме потенцирования преимущественно получается при сочетании бактерицидных антибиотиков. Например: бактерицидных антибиотиков, нарушающих синтез микробной стенки, с антибиотиками, ингибирующими проницаемость плазматической мембраны.
При комбинации двух бактериостатических антибиотиков могут быть явления суммации и антагонизма. При сочетании двух антибиотиков, один из которых нарушает синтез микробной стенки, а другой является чисто бактериостатическим, обычно отмечаются явления антагонизма.
Основными показаниями для комбинированной терапии антибиотиками являются:
- Необходимость длительной антибактериальной терапии (туберкулез, остеомиелит).
- Потенцирование антибактериального эффекта.
- Преодоление и предупреждение развития лекарственной резистентности.
- Расширение спектра антибактериальной активности при тяжелых и смешанных инфекциях до установления точного бактериологического диагноза.
- Начальное лечение тяжелых и среднетяжелых инфекций у больных с иммунодефицитом.
Однако при комбинированной терапии антибиотиками имеются и некоторые отрицательные стороны: во-первых, увеличивается риск развития аллергических реакций и токсического действия антибиотиков на организм; во-вторых, возрастает вероятность развития суперинфекции; в-третьих, возрастает стоимость лечения.
Основные принципы комбинирования антибиотиков:
- актерицидные антибиотики не следует комбинировать с бактериостатическими антибиотиками;
- нельзя назначать больше двух антибиотиков одновременно;
- нужно реже пользоваться стандартными комбинациями, стараясь подбирать пару синергистов для конкретного штамма возбудителя, выделенного у больного;
- необходимо использовать комбинации антибиотиков, обладающих различными побочными эффектами, во избежание суммации токсического эффекта.
В настоящее время эти принципы претерпели некоторые изменения, что связано с уточнением характера и механизма действия антибиотиков на микробную клетку. По этим признакам антибиотики можно разбить на 3 основные группы:
- Антибиотики с бактерицидным действием на покоящуюся микробную клетку — аминогликозиды, по- лимиксины.
- Антибиотики с бактерицидным действием на делящиеся клетки — бета-лактамные, рифамицины.
- Бактериостатические антибиотики.
Таким образом, 1-ю группу можно комбинировать со 2-й и 3-й.
Исключение: комбинация карбенициллина с аминог- ликозидами.
Комбинация 2-й и 3-й групп является нежелательной. Допустима комбинация 2-х антибиотиков из одной группы.
Нельзя комбинировать 2 аминогликозидных антибиотика, из-за увеличения риска побочных эффектов.
Антагонистами являются пенициллины и цефалос- порины с тетрациклинами и хлорамфениколом. Ашта- гонистами являются макролиды и хлорамфеникол.
Примеры рациональных комбинаций:
- Пенициллины с аминогликозидами.
Б. Пенициллины внутри группы.
- Пенициллины широкого спектра действия с ингибиторами бета-лактамаз.
Г. Тетрациклины и макролиды.
Д. Тетрациклины с нистатином и леворином.
Е. Тетрациклины и хлорамфеникол.
Ж Тетрациклин и стрептомицин (при лечении бруцеллеза).
- Карбенициллин и полимиксины.
И. Гентамицин и полимиксины.
В Приложении приводится таблица совместимости химиотерапевтических средств при одновременном использовании (табл. 2).
В заключение можно следующим образом представить основные правила выбора антибиотика.
- До начала антибиотикотерапии необходимо получить данные лабораторных исследований, которые подтверждают наличие инфекции, и собрать данные анамнеза больного, включая и его иммунный статус.
- Микробиологические исследования позволят определить наличие патогенной микрофлоры и помогут решить, был ли пациент действительно инфицирован или это только единственная выделенная колония возбудителей.
- Использование молекулярных тестирующих систем позволяет повысить возможности диагностики и определения антимикробной чувствительности для многочисленных и медленно развивающихся патогенных микроорганизмов, таких как микобактерии и вирусы.
- Высокостандартизированные антимикробные тесты чувствительности in vitro ограничивают и часто затрудняют возможность действительно установить локализацию инфекционного процесса, что приводит к определенным противоречиям между результатами, полученными на чувствительность in vitro и in vivo.
- Интеграция полученных in vitro тестов на чувствительность с фармакокинетическими и фармакоди- намическим свойствами антимикробных средств поможет врачу положительно решить проблему лечения инфекционного заболевания у пациента.
- Необходимо постоянно получать образцы культуры и определять чувствительность для выбора необходимого антибиотика.
- Эмпирическая антибиотикотерапия должна основываться на знаниях наиболее часто встречающихся возбудителей для определенных локализаций патологического процесса, информации из анамнеза пациента (дата последней госпитализации, воздействия, связанные с работой, путешествиями, половые контакты, последнюю дату определения чувствительности на антибиотики). Это дает в 80% случаев хороший результат.
- Больные с замедленной аллергической реакцией на пенициллины (кожные реакции) должны получать главным образом цефалоспорины. Пациенты с I типом
гиперчувствительности на пенициллин (анафилаксия) не должны получать цефалоспорины (альтернатива включает азтреонат, хинолоны, сульфаниламиды или ванкомицин).
- Для каждого пациента, получающего антибиотики, необходимо определить функциональную активность почек и печени для определения и установления интервалов времени между введениями препаратов. Функция печени должна контролироваться при использовании лекарств, которые выделяются через гепатобиллиарную систему, таких как эритромицин и клиндамицин.
- При проведении антибиотикотерапии необходимо собрать анамнез обо всех лекарствах, принимаемых пациентом, для лечения сопутствующих заболеваний.
- Комбинированная антибиотикотерапия показана при полимикробных инфекциях (абдоминальных, гинекологических), для получения синергического эффекта (бета-лактамные + аминогликозидные антибиотики против синегнойной палочки) и для предупреждения развития резистентности.
- Положительно полученные результаты воздействия на культуру микроорганизмов должны быть интерпретированы с осторожностью для отличия истинной инфекции от колоний микроорганизмов.
- При выявлении инфекций, вызванных специфическими микроорганизмами, лечение необходимо проводить антибиотиками с узким спектром действия. Расчет на использование антибиотиков широкого спектра действия не является основанием для проводимой терапии.
- Все пациенты, получающие антибиотики, должны подвергаться мониторингу на эффективность лечения (снижение температуры, уменьшение признаков и симптомов инфекций), мониторингу на признаки токсичности (гиперчувствительность: бета-лактамы, нефротоксичность: аминогликозиды, амфотерицин В;
диарея: все антибиотики), и при этом должен осуществляться контроль за развитием инфекции.
- Способ введения антибиотиков необходимо определять ежедневно. Они должны включать все способы - от внутривенных до оральных способов введения, основанных на симптомах улучшения состояния пациентов.
- В случае отсутствия положительных результатов при применении антибиотика в течение 2-3-х дней необходимо пересмотреть лечение, определить, правильно ли поставлен диагноз, достигнуты ли терапевтические концентрации химиотерапевтического средства, является ли больной иммунодепрессивным, нет ли у него локальной инфекции (абсцесс, инородное тело) или развития резистентности.
- Необходимо постоянно следить за научной периодической литературой об антибиотиках.
[youtube.player]
Для определения тактики леченияв каждой конкретной клинической ситуации следует исходить из предполагаемого или выделенного возбудителя и его чувствительности к антимикробным химиотерапевтическим средствам (АМХТС), из степени тяжести процесса или степени опасности возможного осложнения, умения интерпретировать деление АМХТС по химическому строению, спектру и механизму антимикробного действия. Бактериальную природу воспаления можно заподозрить при наличии в анамнезе травмы (например, стоматологических вмешательств) с нарушением целостности тканей, по характерному виду первичного очага (гиперемия, отек, болезненность) и характеру экссудата (гной, детрит), наличию реакции регионарных лимфоузлов и симптомов общей интоксикации, а также нейтрофильного лейкоцитоза, часто с палочкоядерным сдвигом в лейкоцитарной формуле и повышению СОЭ. Присутствие анаэробной флоры в очаге воспаления сопровождается неприятным, гнилостным запахом, наличием грязно-серого детрита (некротический стоматит Венсана, вызванный фузобактериями, периодонтальные осложнения пептострептококковой, энтерококковой или синегнойной этиологии, тяжелый энтероколит, вызванный клостридиями, при антибиотик-ассоциированной диарее). Для кандидоза слизистых оболочек типичным является появление белого творожистого, легко снимающегося налета на фоне ярко-красной, разрыхленной слизистой, жжение, болезненность во время еды.
Чувствительными к АМХТС считаются микроорганизмы, рост и размножение которых в крови и очагах воспаления прекращается при назначении средних терапевтических доз препарата. В начале лечения тяжелого острого инфекционного заболевания при неизвестном возбудителе после забора материала для микробиологического исследования целесообразно применять только максимальные дозы. По получении результата бакпосева и антибиотикограммы производят коррекцию терапии: если возбудитель чувствителен к антибиотику, можно перейти на среднюю терапевтическую дозу, если умеренно чувствительный, использовать только максимальную, и если нечувствительный, применение препарата нецелесообразно.
Стартовую терапию в тяжелых случаях проводят только бактерицидными АМХТС, вводя их в течение первых 2-4 суток внутривенно или внутримышечно с возможным переходом на пероральный прием этого же препарата при клинико-лабораторном улучшении (ступенчатая антибиотикотерапия). Последняя особенно широко применяется в стоматологии и оториноларигологии, так как позволяет, помимо улучшения качества жизни пациента, избежать постинъекционных осложнений (инфильтратов, гематом, абсцессов на местах инъекций, флебитов и сепсиса при длительной катетеризации вены) и получить фармакоэкономический эффект, связанный со стоимостью шприцев, инфузионных систем, труда медперсонала и пребывания больного в стационаре. Завершить лечение можно в амбулаторных условиях под контролем лечащего врача.
Комбинированная антибиотикотерапия показана: 1. С целью усиления противомикробного эффекта при очень тяжелом течении заболевания (одонтогенный остеомиелит, менингит, сепсис) до установления этиологического диагноза. 2. При полиэтиологичных инфекциях (несколько возбудителей с разной чувствительностью к АМХТС). 3. При инфекциях, вызванных полирезистентными штаммами микроорганизмов (нечувствительных или низкочувствительных к большинству АМХТС).
Составляя комбинацию, врач должен знать несколькоправил:
1. В большинстве случаев достаточно не более 2 антибиотиков. 2. При неизвестном возбудителе или полиэтиологической инфекции спектры антибиотиков должны дополнять друг друга, при известной чувствительности выделенного возбудителя он (возбудитель) должен входить в спектры обоих АМХТС комбинации. 3. Оба антибиотика комбинации должны иметь однотипный механизм действия (либо оба бактерицидные, либо оба бактериостатические), если бактерицидный антибиотик действует только на растущие или делящиеся бактерии). Комбинирование бета-лактамов, карбапенемов, гликопептидов с бактериостатиками, прекращающими деление микробов, приводит к снижению эффективности бактерицидных антибиотиков (антагонизм). 4. Нежелательно комбинирование АМХТС с однонаправленными побочными эффектами (возможно усиление токсичности). Категорически нельзя комбинировать между собой или назначать последовательными курсами 2 аминогликозида (интервал между их курсами должен быть не менее 2 недель) из-за опасности необратимого ототоксического действия.
Соблюдение определенных интервалов между введениями АМХТСдолжно быть аксиомой: их нельзя произвольно изменять, особенно для бактериостатиков, так как снижение концентрации в очаге инфекции сопровождается восстановлением жизнедеятельности бактерий. При назначении антибиотика не только указывают кратность введений, но, в соответствии с биоритмом бактерий и фармакокинетикой препарата, следует обозначать точное время (часы) введения.
Продолжительность курса терапии зависит от многих факторов. Бактерицидные антибиотики, действующие на фазу деления микробов, при условии чувствительности к ним возбудителя, применяются недолго: процесс деления микробов можно остановить в течение 4-5 дней. Бактериостатики - это препараты длительного использования для лечения хронических инфекций или для долечивания острых инфекций после отмены бактерицидного препарата. Рекомендуется продолжать антибиотикотерапию до полного клинического (общего и местного) и лабораторного улучшения - удовлетворительного самочувствия больного, 2-3 дней нормальной температуры тела, значительного уменьшения патологического отделяемого и удаления дренажей из раны. Забор материала для бактериологического контроля эффективности антибиотикотерапии с учетом постантибиотического действия проводится не ранее 48 часов после отменыантибиотика. Если в течение 2-3 суток клинического улучшения нет, антибиотик следует отменить, заменив другим, по возможности, из другой группы. Окончательное заключение об эффективности препарата можно сделать после значительного клинического улучшения и получения отрицательного результата контрольного бактериологического исследования.
Побочные эффекты антибиотикотерапии можно разделить на аллергические, токсические и биологические. Аллергические реакции могут быть местными (гиперемия и отечность, кожная сыпь и зуд) или общими (аллергический дерматит, отек Квинке, анафилактический шок). Для профилактики следует тщательно собирать аллергологический анамнез (не только в отношении медикаментозной, но и пищевой, бытовой, пыльцевой аллергии, а также аллергических заболеваний). При наличии аллергических симптомов в момент обследования или наличии поливалентной аллергии показано профилактическое назначение антигистаминных препаратов. Категорически нельзя назначать АМХТС, если в анамнезе была аллергическая реакция на любой компонент, входящий в его состав.
Возможные токсические осложнения указываются в аннотации к препарату или в фармакологических справочниках. Вероятность этих побочных эффектов возрастает при передозировке и длительных курсах, при заболевании органа-мишени токсического действия или при функциональной недостаточности органов, участвующих в элиминации антибиотика, так как создаются условия для его кумуляции. При печеночной недостаточности нельзя назначать в высоких дозах препараты, выводящиеся преимущественно с желчью. При почечной недостаточности выбор препарата, выводящегося с мочой, а также величина его дозы и режим применения определяются степенью снижения клубочковой фильтрации (чем ниже клиренс, тем меньше используемые суточные дозы и тем большие интервалы между введениями разовых доз, а некоторые АМХТС вообще противопоказаны). При необходимости во время курса приема антибиотика проводится лабораторный контроль состояния органов-мишеней токсического действия препарата.
АМХТС, противопоказанные детям: хлорамфеникол (левомицетин) до 1 года, а внутривенно - до 3 лет, рифампицин - до 5 лет, сульфаниламиды - до 1года, тетрациклины - до 8 лет, фуразолидон-до 1 мес., налидиксовая кислота - до 2 лет, фторхинолоны - до 16 лет, аминогликозиды кроме гентамицина, амикацина, нетилмицина - до 1 года.


Не нашли то, что искали? Воспользуйтесь поиском:
[youtube.player]Содержание
Комбинированная антимикробная терапия [ править | править код ]
Комбинированная антимикробная терапия применяется по строгим показаниям. При выборе комбинации препаратов необходимо учитывать возможные взаимодействия между ними, влияющие как на микро-, так и на макроорганизм. Препараты, действующие на разные мишени, могут усиливать или ослаблять антимикробную активность друг друга. Побочное действие комбинации антимикробных средств слагается из побочных эффектов отдельных препаратов, а иногда и превышает простую сумму их побочных эффектов. Например, ванкомицин сам по себе не оказывает выраженного нефротоксического действия, но, по некоторым данным, усугубляет нефротоксичность аминогликозидов (Farberand Moelle-ring, 1983).
Существует два способа оценки взаимодействия антимикробных средств. В первом случае микроорганизмы высевают на жидкие питательные среды, содержащие разные сочетания последовательных двукратных разведений двух исследуемых препаратов, и инкубируют в течение 18—24 ч. Затем определяют МПК каждого антибиотика в отдельности и в присутствии другого препарата. Если МПК комбинации антибиотиков составляет не более 25% МПК каждого препарата в отдельности, антибиотики действуют синергично. Синергизм может быть обусловлен повышением чувствительности микроорганизма к одному препарату под действием другого. Если МПК комбинации антибиотиков равна половине МПК каждого из них в отдельности, это означает, что препараты действуют независимо друг от друга, а их эффект суммируется (аддитивное действие). Если МПК комбинации антибиотиков меньше, чем МПК каждого из них в отдельности, препараты действуют антагонистически (то есть ослабляют действие друг друга). При сравнении всех (а не только одинаковых) комбинаций двукратных разведений антибиотиков можно построить так называемые изоболы (рис. 43.2). Если антибиотики действуют синергично, изобола представляет собой вогнутую кривую, если аддитивно — прямую линию, если антагонистически — выпуклую кривую. Для каждой точки изоболы можно рассчитать индекс МПК — сумму концентраций, выраженных в долях МПК. Для двух антимикробных средств А и Б его рассчитывают следующим образом:
Индекс МПК = МПК А в присутствии Б/МПКА+МПК Б в присутствии А/МПКБ
В случае аддитивного действия индекс МПК равен единице, при синергизме он меньше 1, при антагонизме — больше. К сожалению, с помощью этого метода нельзя выявить синергичный бактерицидный эффект, так как определяются не МБК, а МПК.
Другой способ оценки взаимодействия препаратов заключается в построении кривых, описывающих динамику гибели микроорганизмов. Культуру микроорганизмов инкубируют в присутствии обоих антимикробных средств и каждого из препаратов в отдельности. Для оценки числа выживших микроорганизмов ее периодически пересевают. О синергизме говорят в том случае, если число бактерий в среде, содержащей комбинацию препаратов, как минимум в 100 раз меньше, чем в среде, содержащей наиболее активный из препаратов. Если число бактерий различается менее чем в 100 раз, говорят об индифферентном действии. Если же число бактерий в присутствии комбинации антимикробных средств больше, чем в присутствии наиболее активного из них, препараты действуют антагонистично.
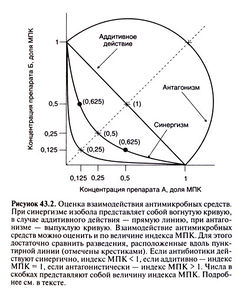
В 1952 г. Джавиц и Ганнисон предложили простой способ оценки взаимодействия антимикробных средств, основанный на их свойствах (Jawetz and Gunnison, 1952). Авторы заметили, что бактериостатические антибиотики (например, тетрациклины, эритромицин, хлорамфеникол) часто действуют антагонистично по отношению к бактерицидным препаратам (таким, как β-лактамные антибиотики, ванкомицин, аминогликозиды), поскольку первые подавляют деление бактериальных клеток и синтез белка, необходимые для реализации действия большинства бактерицидных антибиотиков. С другой стороны, два бактерицидных препарата обычно действуют синергично. Так, препараты, подавляющие синтез клеточной стенки, и аминогликозиды проявляют синергизм в отношении многих видов бактерий. Исключение составляет рифампицин. Будучи бактерицидным препаратом, он индифферентно или даже антагонистически взаимодействует с другими бактерицидными антибиотиками in vitro. Клиническое значение этого явления не установлено, поскольку in vivo комбинации с рифампицином эффективны.
Показания к комбинированной антимикробной терапии [ править | править код ]
Назначение нескольких антимикробных средств оправдано в следующих случаях: 1) при эмпирической терапии (возбудитель не известен), 2) при лечении смешанных инфекций, 3) при необходимости усилить антимикробное действие в отношении определенного возбудителя, 4) в целях предупреждения лекарственной устойчивости.
Это самый частый повод для назначения комбинации антимикробных средств. Чтобы правильно подобрать лечение, необходимо знать особенности инфекции, ее наиболее вероятных возбудителей, а также антимикробные спектры препаратов, которые могут применяться в данной ситуации. Если состояние больного тяжелое, антимикробная терапия должна быть направлена против всех возможных возбудителей. Для этого часто приходится назначать несколько препаратов. Например, при внебольничной пневмонии используют цефуроксим в сочетании с макролидами: первый активен в отношении грамотрицательных бактерий, а вторые — в отношении возбудителей атипичных пневмоний, например Mycoplasma pneumoniae. Но такое лечение не должно быть слишком длительным. В нем нет необходимости, если возбудитель уточнен или выяснилось, что инфекция вообще отсутствует. Комбинированная терапия недешева, увеличивает риск побочных эффектов, способствует развитию суперинфекции и отбору полирезистентных штаммов. Неоправданное применение комбинации антимикробных средств бывает обусловлено тем, что врачи начинают лечение до взятия материала на посев или же, получив данные о возбудителе и его чувствительности, не меняют схему лечения. Конечно, отказаться от терапии, доказавшей свою эффективность, может быть трудно. Тем не менее нужно всегда стремиться назначать препарат с наиболее узким спектром действия и минимальными побочными эффектами. Лечение смешанных инфекций. Комбинированная антимикробная терапия показана при смешанной инфекции, возбудители которой чувствительны к разным антимикробным средствам. Например, абсцессы брюшной полости, печени и головного мозга, а также инфекции половых органов часто бывают вызваны смешанной аэробной и анаэробной микрофлорой.
Совместное применение нескольких антимикробных средств может значительно усиливать их действие, хотя преимущества комбинированного лечения перед монотерапией доказаны лишь для небольшого числа инфекций.
Наиболее убедительные доказательства получены для энтерококкового эндокардита (Wilson et al., 1995). In vitro пенициллины оказывают на Enterococcus faecalis и Enterococcus faecium лишь бактериостатическое действие, а в комбинации со стрептомицином или с гентамицином — бактерицидное. Причем после монотерапии пенициллинами рецидивы возникают намного чаше, чем после комбинированной терапии.
In vitro пенициллины действуют синергично со стрептомицином или гентамицином и в отношении зеленящих стрептококков. В экспериментах на животных комбинация этих препаратов быстрее уничтожала возбудителей в вегетациях на клапанах по сравнению с монотерапией пенициллинами. Поданным клинических исследований, при стрептококковом эндокардите двухнедельная комбинированная терапия столь же эффективна, как и четырехнедельная монотерапия пенициллинами. Кроме того, пенициллины и аминогликозиды проявляют синергизм в отношении Staphylococcus aureus (как in vitro, так и в экспериментальных моделях in vivo). Например, у некоторых больных с инфекционным эндокардитом трехстворчатого клапана, вызванным Staphylococcus aureus, эффективна двухнедельная терапия тобрамицином или гентамицином (в низких дозах) в сочетании с нафциллином, хотя обычно таким больным назначают монотерапию нафциллином в течение 4—6 нед (Chambers etaL, 1988).
Комбинация β-лактамных антибиотиков и аминогликозидов рекомендуется при инфекциях, вызванных Pseudomonas aeruginosa. In vitro β-лактамные антибиотики, активные в отношении псевдомонад, и аминогликозиды действуют синергично в отношении большинства штаммов Pseudomonas aeruginosa. В экспериментах на животных комбинированная терапия тоже оказалась эффективнее, чем монотерапия указанными препаратами. В некоторых, хотя далеко не во всех, клинических испытаниях (Hilfetal., 1989; Vidal etal., 19%; Leibovici et al., 1997) сочетание β-лакгамных антибиотиков с аминогликозидами увеличивало выживаемость при тяжелых псевдомонадных инфекциях. Комбинированную терапию рекомендуется применять и при инфекциях, вызванных другими грамотрицательными палочками. Однако ее преимущества перед монотерапией во многих случаях остаются недоказанными (Ваглеге, 1992; Rybak and McGrath, 1996).
Синергизм сульфаниламидов и ингибиторов дигидрофолатредуктазы (например, триметоприма) обусловлен блокадой последовательных этапов синтеза фолиевой кислоты. Комбинированный препарат триметоприм/сульфаметоксазол активен в отношении микроорганизмов, устойчивых к сульфаниламидам. Его успешно применяют при инфекциях мочевых путей, пневмоцистной пневмонии, брюшном тифе, дизентерии и не которых инфекциях, вызванных устойчивыми к ампициллину штаммами Haemophilus influenzae.
По данным исследований in vitro и экспериментов на животных, фторцитозин и амфотерицин В действуют синергично в отношении Cryptococcus neoformans. При криптококковом менингите в отсутствие ВИЧ-инфекции фторцитозин позволяет снизить дозу амфотерицина В и сократить продолжительность лечения с 10 до 6 нед; риск побочных эффектов при этом снижается, а эффективность лечения остается прежней (Bennett et al., 1979). Кроме того, при криптококковом менингите на фоне СПИДа эта комбинация позволяет быстрее добиться стерильности СМЖ, чем монотерапия амфотерицином В (van der Horst etal., 1997).
Комбинированная терапия препятствует отбору штаммов, устойчивых к одному из препаратов. Если частота появления мутантов, устойчивых к одному антимикробному средству, составляет, например, 10
7, а к другому — 10
6, то вероятность одновременного возникновения обеих мутаций равна произведению этих частот, то есть 10
13. Чтобы это событие произошло, число микроорганизмов должно быть на несколько порядков больше, чем обычно бывает при инфекциях. Предупреждение лекарственной устойчивости лежит в основе комбинированной терапии туберкулеза. При монотерапии микобактерии туберкулеза часто приобретают устойчивость к препарату, а одновременное назначение двух и более противотуберкулезных средств существенно повышает шансы на успех лечения. Другим примером служит лечение стафилококковых инфекций (например, эндокардита протезированных клапанов и остеомиелита) рифампицином. Добавление второго препарата позволяет избежать появления устойчивых к рифампицину штаммов стафилококков (Zim-merli et al., 1998). С той же целью комбинированную терапию назначают и при инфекции, вызванной Helicobacter pylori (Taylor et al., 1997). В отношении прочих инфекций убедительных данных о том, что комбинированная терапия предотвращает возникновение лекарственной устойчивости, нет.
Недостатки комбинированной терапии [ править | править код ]
К ним относятся повышение риска побочных эффектов, появление полирезистентных штаммов и высокая стоимость. Кроме того, как уже было отмечено, бактериостатические и бактерицидные препараты могут действовать антагонистично. Клиническое значение антагонизма антимикробных средств остается неясным. Хотя in vitro он наблюдается довольно часто, in vivo случаи антагонизма редки. Наиболее яркий пример такого антагонизма—лечение пневмококкового менингита.
В 1951 г. Леппер и Даулинг заметили, что при лечении пневмококкового менингита пенициллином летальность составила 21%, а при одновременном назначении хпортетрациклина она увеличилась до 79% (Lepper and Dowling, 1951). Позднее эти данные были подтвержаены другими исследователями, обнаружившими увеличение летальности бактериального менингита у детей с 4,3 до 10,5% при комбинированной терапии ампициллином, хлорамфениколом и стрептомицином по сравнению с монотерапией ампициллином (Mathies at al., 1967).
Антагонизм возникает только в том случае, если оба препарата активны в отношении данного микроорганизма, и в большинстве случаев не играет сколько-нибудь заметной роли. Несмотря на то что комбинация бактериостатического и бактерицидного препарата обычно дает лишь бактериостатический эффект, лечение в большинстве случаев все равно будет успешным благодаря действию защитных механизмов. Если же эти механизмы не срабатывают и для излечения инфекции необходимо бактерицидное действие (например, при менингите, эндокардите, у больных с нейтропенией при инфекциях, вызванных грамотрицательными бактериями), эффективность антимикробной терапии снижается.
[youtube.player]*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Читайте в новом номере
Согласно современной концепции раннее назначение адекватной (перекрывающей спектр наиболее важных возбудителей) антибактериальной терапии (АБТ) при тяжелых инфекциях снижает летальность больных, находящихся в отделениях реанимации и интенсивной терапии (ОРИТ) [1–3] (рис. 1). При стартовом назначении антибиотика максимально широкого спектра (деэскалационный режим) можно ожидать снижения показателей смертности при таких угрожающих жизни инфекциях, как сепсис тяжелого течения; вентилятор–ассоциированная пневмония (ВАП); распространенный перитонит, инфицированный панкреонекроз.
Основные возбудители и выбор
антибиотикотерапии при тяжелых
бактериальных инфекциях
При тяжелом сепсисе АБТ должна быть начата в течение первого часа после постановки диагноза и взятия крови для посева. В этиологии сепсиса заметную роль играют стафилококки, включая коагулазонегативные виды (S. epidermidis и др.), наблюдается неуклонное увеличение метициллин (оксациллин) резистентных штаммов, растет частота сепсиса, вызываемого Pseudomonas aeruginosa, Acinetobacter spp. [4] (рис. 2). Для выбора оптимальной схемы эмпирической АБТ следует принимать во внимание локализацию первичного очага, место возникновения сепсиса (внебольничный, госпитальный), уровень устойчивости возбудителей нозокомиальных инфекций (рис. 3). При первоначальном старте с карбапенемов или с комбинации препаратов, перекрывающих спектр возможных патогенов, и стабилизации гемодинамики, регрессе синдрома системной воспалительной реакции (ССВР)1 и органной дисфункции в течение 3–4 дней переход на антибиотик более узкого спектра по результатам бактериологического исследования оправдан с позиции контроля резистентности проблемных возбудителей и экономии материальных средств.
Нозокомиальная пневмония является самой частой инфекцией (>45%) в ОРИТ и ведущей причиной летальных исходов, что обусловлено высокой частотой инвазивных вмешательств (интубация трахеи и др.) и более тяжелым течением основного и сопутствующих заболеваний у этих больных [5]. При ранней ВАП, возникшей в течение первых 5 сут. после искусственной вентиляции легких (ИВЛ), в качестве возбудителей доминирует микрофлора, обычно колонизирующая ротоглотку (Streptococcus pneumoniae, Haemophylus influenzae, анаэробы при наличии аспирации) с высокой чувствительностью к антибиотикам. При поздней ВАП (более 5 сут. ИВЛ) преобладают полирезистентные нозокомиальные микроорганизмы: Enterobacteriaceae, P.aeruginosa, Acinetobacter spp., MRSA2 [4] (рис. 2). Независимыми факторами риска возникновения ВАП, вызванной полирезистентными возбудителями (ПРВ), являются: длительность ИВЛ более 7 дней (ОШ3=6); предшествующая АБТ (ОШ=14); назначение цефалоспоринов III поколения, фторхинолонов, имипенема, способствующих селекции ПРВ (ОШ=4) [6].
У всех пациентов с подозрением на ВАП (о чем свидетельствует появление лихорадки, гнойной мокроты, снижение уровня оксигенации, наличие лейкоцитоза или лейкопении с увеличением количества юных форм) до начала АБТ необходимо сделать посев двух образцов крови из вены, произвести количественный посев и окраску мокроты или эндотрахеального аспирата по Граму. Обилие полиморфно–ядерных лейкоцитов (ПЯЛ) подтверждает наличие воспаления, а возможность дифференцировать грамотрицательные палочки и грамположительные кокки позволяет обосновать выбор эмпирического режима АБТ. При большом количестве ПЯЛ и отсутствии бактерий можно предположить присутствие атипичных микроорганизмов (вирусы, легионеллы, микобактерии) либо неинфекционную природу заболевания. Диагностическим титром является 105–106 бактерий в 1 мл аспирата, а при исследовании бронхоальвеолярного лаважа – 104 микробов/мл. Чувствительность количественного метода может быть снижена предшествующим назначением АБТ в течение 48–72 ч до забора образца. При ранней ВАП назначают препараты без антисинегнойной активности. При поздней ВАП в отсутствие микробиологических данных и факторов риска наличия ПРВ проводят стартовую АБТ с учетом локальных данных мониторинга антибиотикорезистентности. При подозрении на MRSA препаратами выбора являются ванкомицин и линезолид, а при наличии риска инфекции Acinetobacter или P. aeruginosa – меропенем. Не ранее 48–72 ч от начала АБТ возможна ее коррекция с учетом динамики заболевания и дополнительных данных микробиологического мониторинга. При высокой клинической эффективности стартовой АБТ и отсутствии осложнений продолжительность лечения в течение 7 сут. оказывается достаточной. У пациентов с инфекциями, вызванными Acinetobacter или P. aeruginosa, может потребоваться более продолжительная терапия. Алгоритм микробиологического мониторинга и АБТ ВАП представлен на рисунке 4.
Тяжелые интраабдоминальные инфекции (ИАИ) представлены распространенным перитонитом, панкреатогеным абсцессом и инфицированным панкреонекрозом. Они характеризуются быстрым развитием генерализованной реакции макроорганизма, обусловленной действием бактериальных эндо– и экзотоксинов и различных медиаторов воспаления. Отличительными особенностями ИАИ являются полиэтиологичность, охватывающая широкий круг потенциальных возбудителей инфекционного процесса, и полимикробная этиология, осложняющая клиническую оценку результатов микробиологического исследования при установлении ведущего возбудителя инфекции и часто представленная аэробно–анаэробными ассоциациями микроорганизмов [7].
Перитонит является воспалением брюшины, сопровождающимся местными и общими симптомами. Первичные перитониты встречаются редко (около 1% случаев). Основную проблему представляют вторичные перитониты, возникающие как осложнение острых хирургических заболеваний и травм органов брюшной полости. Летальность при тяжелых формах заболевания составляет 25–30%, а при развитии полиорганной недостаточности достигает 80–90% [8]. При вторичных перитонитах этиологическими агентами являются собственные микроорганизмы кишечника с естественным (невысоким) уровнем резистентности (среди аэробов чаще Escherichia coli, среди анаэробов чаще Вacteroides fragilis) [9]. Энтерококки часто выделяются из перитонеальной жидкости в ассоциации с другими бактериями, но эффективность лечения ВП не зависит от степени активности антибактериальных препаратов против Enterococcus spp. [10]. Проведение микробиологической диагностики при внебольничном перитоните нецелесообразно в отличие от послеоперационного перитонита, где возрастает значение госпитальных штаммов с более высоким уровнем резистентности (P. aeruginosa, Enterobacter spp., Serratia spp., Acinetobacter spp., MRSA и MRSE4) и повышается роль Enterococcus spp. в качестве этиологического агента [11] (рис. 2).
Третичный перитонит (без источника инфекции) встречается у больных в критических состояниях с нарушением механизмов противоинфекционной защиты и вызывается полирезистентными штаммами Enterobacteriaceae, Staphylococcus spp., Enterococcus spp., Pseudomonas spp., грибами рода Candida [12].
Хирургическое лечение составляет основу медицинской помощи при перитонитах: проведение операции в первые часы дает до 90% выздоровлений, в течение первого дня – 50%, позже третьего дня – всего 10% [13]. Однако, по возможности, операцию лучше отложить на 2–3 часа для целенаправленной подготовки к ней. Исход заболевания зависит от качества предоперационной подготовки и оперативной тактики, а также от грамотного комплексного лечения больного в послеоперационном периоде, где наряду с прочими лечебными мероприятиями важную роль играет эмпирическая антимикробная терапия (рис. 5). Ее продолжительность составляет 5–7 дней при отсутствии вторичных осложнений.
Панкреонекроз (ПН) является формой острого панкреатита (ОП) с некротической деструкцией поджелудочной железы (ПЖ). У 25–70% больных происходит инфицирование некротических очагов на 1–3–й неделях заболевания, а в сроки более 3 мес., как правило, развиваются панкреатогенные абсцессы [14]. Для диагностики и прогноза ОП, помимо оценки клинической картины заболевания и лабораторных показателей, важным является проведение инструментальных обследований, включающих ультразвуковое исследование (УЗИ) органов брюшной полости и забрюшинного пространства, лапароскопию, компьютерную томографию (КТ). Методом ранней и точной дифференциальной диагностики стерильного ПН и его септических осложнений является чрескожная пункция под контролем УЗИ или КТ с микробиологическим исследованием биосубстрата. Определение уровня прокальцитонина (ПКТ) с высокой долей вероятности позволяет диагностировать наличие инфекции. Стартовую оценку тяжести проводят по шкалам APACHE II и Ranson, для динамической оценки тяжести используют АРАСНЕ II и SOFA (шкала оценки полиорганной дисфункции). При значениях шкалы Ranson/Glasgow более 4 баллов, APACHE II более 9 баллов развитие деструктивного панкреатита носит преимущественно осложненный характер. Динамическая ежедневная оценка тяжести состояния больного по шкале APACHE II составляет основу объективизации показаний к операции и дифференцированного подхода в выборе тактики комплексного лечения при ПК. На современном уровне для точного прогнозирования течения ОП и его осложнений целесообразным является определение уровня содержания С–реактивного белка (СРБ) и прокальцитонина (ПКТ) в крови больного панкреатитом в динамике заболевания. В совокупности показатели позволяют оценить распространенность ПК (табл. 1).
Тактика и методы комплексного лечения деструктивного панкреатита определяются фазой патологического процесса и тяжестью состояния больного. Его следует проводить в условиях отделения интенсивной терапии (рис. 6). Основой выбора антибактериальных препаратов при ПК являются данные микробиологических исследований и способность антибиотиков селективно проникать в ткани ПЖ через гематопанкреатический барьер [15,16]. В зависимости от различной пенетрирующей способности в ткани ПЖ можно выделить три группы антибактериальных препаратов (табл. 2).
Монотерапия проводится меропенемом, имипенемом, эртапенемом (в отсутствие риска синегнойной инфекции) и цефоперазоном/сульбактамом. Комбинированная терапия включает метронидазол в комбинации с цефепимом или цефтриаксоном, или с фторхинолонами (пефлоксацином, ципрофлоксацином, левофлоксацином). При риске инфекции проблемными микроорганизмами используют следующие режимы АБТ: P. aeruginosa – меропенем (1–2 г 3 раза/сут.) или имипенем (0,5 г 4 раза/сут.); MRSA – ванкомицин (15 мг/кг/сут. в 2 введения) или линезолид (600 мг 2 раза/сут.); E. coli, Klebsiella spp. (БЛРС+)5 – меропенем (имипенем) ± амикацин (15 мг/кг/сут.) или нетилмицин (5–6 мг/кг/сут.); Candida spp. – флуконазол (6 мг/кг/сут.), при резистентности – амфотерицин/каспофунгин/вориконазол. Необходимо помнить, что инвазивный кандидоз при ПК возникает у 37% больных, а отсутствие антимикотической терапии резко увеличивает риск летального исхода [17].
Длительность АБТ при различных клинических формах ПК зависит от тяжести состояния больных, продолжительности многоэтапного хирургического лечения, регресса симптомов ССВР (тяжесть состояния по АРАСНЕ II
≤ 3 баллов).
Показанием к операции является инфицированный ПК и/или панкреатогенный абсцесс, септическая флегмона забрюшинной клетчатки, гнойный перитонит независимо от степени полиорганных нарушений.
Карбапенемы как препараты выбора при эмпирической терапии тяжелых инфекций
Карбапенемы (имипенем, меропенем и эртапенем)6 являются антибиотиками с наиболее широким спектром активности. Они проявляют быстрое бактерицидное действие в отношении грамположительных и грамотрицательных аэробных и анаэробных бактерий. Природной устойчивостью к карбапенемам обладают метициллинрезистентные стафилококки, Enterococcus faecium, Stenotrophomonas maltophilia. У имипенема в 2–4 раза выше активность in vitro против метициллинчувствительных стафилококков, S. pneumoniae и Enterococcus faecalis, а меропенем в 4–64 раза превосходит имипенем по действию на грамотрицательные бактерии, что имеет особое значение в отношении P. aeruginosa – самого частого возбудителя инфекций в ОРИТ [18,19]. Карбапенемы проявляют равную антианаэробную активность, более высокую по сравнению с метронидазолом, клиндамицином, цефокситином [20]. Эртапенем в отличие от имипенема и меропенема не действует на P. aeruginosa и Acinetobacter spp. [21] и характеризуется высоким связыванием с белками сыворотки крови, что увеличивает период его полувыведения до 4 ч по сравнению с 1 ч у антисинегнойных карбапенемов [22].
Механизмы резистентности микроорганизмов к карбаренемам сходные, исключением является P. aeruginosa. Карбапенемы проникают в клетку через особые белковые структуры внешней мембраны – пориновые каналы. Наиболее частым механизмом устойчивости синегнойной палочки к имипенему является утрата поринового белка OprD (или снижение его экспрессии) в результате мутаций, происходящих с частотой 10–7, что ведет к нарушению проникновения антибиотика в клетку [23]. При этом МПК увеличивается с 1–2 мкг/мл до 8–32 мкг/мл, что сопровождается клинической неэффективностью препарата. Этот механизм резистентности не затрагивает меропенем, так как его транспорт в клетку может осуществляться и через другие порины.
Резистентность меропенема связана с активацией систем активного выведения антибиотика за пределы микроорганизма (эффлюкс). Данный механизм устойчивости зависит от деятельности протеинов MexA–MexB–OprM, причем MexB представляет собой локализованный на цитоплазматической мембране эффлюксный насос, OprM образует поры, через которые удаляется антибиотик, а MexA связывает их воедино. При этом МПК увеличивается незначительно (с 0,12–0,5 мкг/мл до 2–4 мкг/мл7), а клиническая эффективность меропенема сохраняется при его назначении в суточной дозе 3 г. Лишь сочетание обоих механизмов – активного выведения и утраты порина OprD (что возможно при двух одновременных генных мутациях, вероятность которых крайне низкая – 10–14), приводит к развитию резистентности и неэффективности терапии [24].
По данным отдельных авторов, до 44% штаммов P. aeruginosa, резистентных к имипенему, сохраняли чувствительность к меропенему [25]. Потребление имипенема коррелирует с ростом резистентности к нему и антисинегнойным цефалоспоринам у P. aeruginosa [26]. Напротив, применение меропенема не ведет к селекции AmpC штаммов P. aeruginosa – гиперпродуцентов хромосомных бета–лактамаз8, так как препарат подавляет и дерепрессированные штаммы–мутанты [27].
Оптимизация режимов
дозирования карбапенемов
Важная роль в достижении максимальной клинической и микробиологической эффективности карбапенемов принадлежит рациональному их дозированию с учетом фармакокинетических и фармакодинамических (ФК/ФД) параметров. Карбапенемы относятся к время–зависимым антибиотикам. Стабильный бактерицидный и адекватный клинический эффект при их применении может быть достигнут, если концентрации препарата в крови в 2–4 раза превышают значения МПК бактерий в течение 40–50%–го интервала времени между дозами (%Т>МПК более 40% коррелирует с бактериальным киллингом) [28]. Для меропенема этот период длится 4 ч. Эффективность антибиотика можно повысить путем увеличения дозы, кратности применения (3–4 раза в сутки) и/или продолжительности инфузии.
Исходя из параметра 40%Т>МПК методом математического моделирования Monte Carlo было показано, что при инфузии 500 мг меропенема в течение 30 мин. каждые 8 ч достигается выраженный бактерицидный эффект в отношении E. coli и K. pneumoniae, но недостаточный для Acinetobacter baumanii и P. aeruginosa. Удлинение сроков инфузии антибиотика в той же дозе до 3 ч сопровождается заметным повышением его эффективности, сопоставимой с активностью меропенема при болюсном введении в дозе 2 г [29] (рис. 7). Также было показано, что при заданных значениях МПК 16 мкг/мл 3–часовая инфузия 2 г меропенема позволяет достичь показателя 48%Т>МПК, а это свидетельствует о возможности эффективного воздействия на штаммы, считающиеся резистентными к меропенему на основании данных МПК [30]. Полученные результаты были подтверждены в клиническом исследовании у больных с ВАП, где при 3–часовой инфузии 2 г меропенема каждые 8 ч создавались концентрации в плазме, превышающие МПК 16 мкг/мл в течение почти 60% 8–часового интервала [31] (рис. 8). В другом исследовании при лечении ВАП меропенемом в течение 14 дней (1 г каждые 6 ч) клиническая эффективность в режиме продленной инфузии (15 больных) была выше, в сравнении с болюсным введением (18 больных) препарата (93,3% против 63,3%; р=0,038), а атрибутивная летальность была ниже (соответственно, 6,7% и 23,3%; р=0,236) [32] (рис. 9). Режим дозирования меропенема в виде продленных инфузий наряду с фармакодинамическими преимуществами (достижение более высоких концентраций препарата в очаге воспаления, преодоление резистентности возбудителей) имеет фармакоэкономические преимущества, обеспечивающие снижение курсовой стоимости лечения [33,34].
Заключение
Массовое эмпирическое назначение карбапенемов связано со значительными финансовыми затратами и способствует селекции полирезистентных штаммов грамотрицательных бактерий, поэтому их следует применять строго по показаниям. Они являются препаратами первого ряда при инфекциях у больных в критическом состоянии (по шкале АРАСНЕ II более 13 баллов), при поздней (более 5 суток) ВАП, инфицированном панкреонекрозе, послеоперационном менингите (меропенем, но не имипенем!), при инфекциях у больных с нейтропенией, при гнойных процессах в легких на фоне иммунодефицита. У этих пациентов можно ожидать снижение смертности при проведении деэскалационной терапии.
При синегнойной инфекции меропенем превосходит имипенем по степени активности, а для преодоления приобретенной резистентности P. aeruginosa перспективным является применение антибиотика в режиме продленной инфузии.
1 ССВР характеризуется двумя или более признаками: темпе-
ратура тела >38°С или 90/мин.; частота дыхательных движений >20/мин.; лейкоци-
ты крови >12х109/л или 10
2 Метициллинрезистентные штаммы S. aureus.
3 ОШ – отношение шансов.
4 Метициллинрезистентные штаммы S. epidermidis (MRSE).
5 Штаммы, продуцирующие бета–лактамазы расширенного
спектра (БЛРС), гидролизующие природные и полусинтети-
ческие пенициллины, цефалоспорины I и отчасти II поколе-
ния, цефалоспорины III и IV поколений. Они сохраняют чув-
ствительность к действию ингибиторов, а продуцирующие их
бактерии (чаще K. pneumoniae и E. coli) отличаются ассоции-
рованной резистентностью к другим антибиотикам: гентами-
цину – до 80%, ципрофлоксацину – 40–60%.
6 В 2008 году в России зарегистрирован новый препарат дори-
пенем.
7 Согласно критериям NCCLS значения МПК для чувствитель-
ных, с умеренной чувствительностью и резистентных штам-
мов P. aeruginosa составляют, соответственно, ≤4 мкг/мл, 8
мкг/мл и ≥16 мкг/мл.
8 Бета–лактамазы AmpC способны гидролизовать пеницилли-
ны и цефалоспорины I–III поколения, устойчивы к действию
ингибиторов, чувствительны к цефалоспоринам IV поколения
и карбапенемам.
Читайте также:


