Клинические рекомендации дисбактериоз кишечника 2016
Что понимают под дисбактериозом? Какие методы диагностики являются современными и достоверными? Какие лекарственные препараты применяются при дисбактериозе? Вкишечнике человека находится свыше 500 различных видов микробов, общее количество которых
Вкишечнике человека находится свыше 500 различных видов микробов, общее количество которых достигает 10 14 , что на порядок выше общей численности клеточного состава человеческого организма. Количество микроорганизмов увеличивается в дистальном направлении, и в толстой кишке в 1 г кала содержится 10 11 бактерий, что составляет 30% сухого остатка кишечного содержимого.
В тощей кишке здоровых людей находится до 10 5 бактерий в 1 мл кишечного содержимого. Основную массу этих бактерий составляют стрептококки, стафилококки, молочнокислые палочки, другие грамположительные аэробные бактерии и грибы. В дистальном отделе подвздошной кишки количество микробов увеличивается до 10 7 –10 8 , в первую очередь за счет энтерококков, кишечной палочки, бактероидов и анаэробных бактерий. Недавно нами было установлено, что концентрация пристеночной микрофлоры тощей кишки на 6 порядков выше, чем в ее полости, и составляет 10 11 кл/мл. Около 50% биомассы пристеночной микрофлоры составляют актиномицеты, примерно 25% — аэробные кокки (стафилококки, стрептококки, энтерококки и коринеформные бактерии), от 20 до 30% приходится на бифидобактерии и лактобациллы.
Количество анаэробов (пептострептококки, бактероиды, клостридии, пропионобактерии) составляет около 10% в тонкой и до 20% в толстой кишке. На долю энтеробактерий приходится 1% от суммарной микрофлоры слизистой оболочки.
До 90-95% микробов в толстой кишке составляют анаэробы (бифидобактерии и бактероиды), и только 5-10% всех бактерий приходится на строгую аэробную и факультативную флору (молочнокислые и кишечные палочки, энтерококки, стафилококки, грибы, протей).
Кишечные палочки, энтерококки, бифидобактерии и ацидофильные палочки обладают выраженными антагонистическими свойствами. В условиях нормально функционирующего кишечника они способны подавлять рост несвойственных нормальной микрофлоре микроорганизмов.
Площадь внутренней поверхности кишечника составляет около 200 м 2 . Она надежно защищена от проникновения пищевых антигенов, микробов и вирусов. Важную роль в организации этой защиты играет иммунная система организма. Около 85% лимфатической ткани человека сосредоточено в стенке кишечника, где продуцируется секреторный IgA. Кишечная микрофлора стимулирует иммунную защиту. Кишечные антигены и токсины кишечных микробов значительно увеличивают секрецию IgA в просвет кишки.
Расщепление непереваренных пищевых веществ в толстой кишке осуществляется ферментами бактерий, при этом образуются разнообразные амины, фенолы, органические кислоты и другие соединения. Токсические продукты микробного метаболизма (кадаверин, гистамин и другие амины) выводятся с мочой и в норме не оказывают влияния на организм. При утилизации микробами неперевариваемых углеводов (клетчатки) образуются короткоцепочечные жирные кислоты. Они обеспечивают клетки кишки энергоносителями и, следовательно, улучшают трофику слизистой оболочки. При дефиците клетчатки может нарушаться проницаемость кишечного барьера вследствие дефицита короткоцепочечных жирных кислот. В результате кишечные микробы могут проникать в кровь.
Под влиянием микробных ферментов в дистальных отделах подвздошной кишки происходит деконъюгация желчных кислот и преобразование первичных желчных кислот во вторичные. В физиологических условиях от 80 до 95% желчных кислот реабсорбируется, остальные выделяются с фекалиями в виде бактериальных метаболитов. Последние способствуют нормальному формированию каловых масс: тормозят всасывание воды и тем самым препятствуют излишней дегидратации кала.
В понятие дисбактериоза кишечника входит избыточное микробное обсеменение тонкой кишки и изменение микробного состава толстой кишки. Нарушение микробиоценоза происходит в той или иной степени у большинства больных с патологией кишечника и других органов пищеварения. Следовательно, дисбактериоз является бактериологическим понятием. Он может рассматриваться как одно из проявлений или осложнение заболевания, но не самостоятельная нозологическая форма.
Крайней степенью дисбактериоза кишечника является появление бактерий желудочно-кишечного тракта в крови (бактериемия) или даже развитие сепсиса.
Состав микрофлоры кишечника нарушается при болезнях кишечника и других органов пищеварения, лечении антибиотиками и иммунодепрессантами, воздействиях вредных факторов внешней среды.
Клинические проявления дисбактериоза зависят от локализации дисбиотических изменений.
При дисбактериозе тонкой кишки численность одних микробов в слизистой оболочке тонкой кишки увеличена, а других уменьшена. Отмечается увеличение Eubacterium (в 30 раз), α-стрептококков (в 25 раз), энтерококков (в 10 раз), кандид (в 15 раз), появление бактерий рода Acinetobacter и вирусов герпеса. Уменьшается от 2 до 30 раз количество большинства анаэробов, актиномицетов, клебсиелл и других микроорганизмов, являющихся естественными обитателями кишечника.
Причиной дисбактериоза могут быть: а) избыточное поступление микроорганизмов в тонкую кишку при ахилии и нарушении функции илеоцекального клапана; б) благоприятные условия для развития патологических микроорганизмов в случаях нарушения кишечного пищеварения и всасывания, развития иммунодефицита и нарушений проходимости кишечника.
Повышенная пролиферация микробов в тонкой кишке приводит к преждевременной деконъюгации желчных кислот и потере их с калом. Избыток желчных кислот усиливает моторику толстой кишки и вызывает диарею и стеаторею, а дефицит желчных кислот приводит к нарушению всасывания жирорастворимых витаминов и развитию желчнокаменной болезни.
Бактериальные токсины и метаболиты, например фенолы и биогенные амины, могут связывать витамин В12.
Некоторые микроорганизмы обладают цитотоксическим действием и повреждают эпителий тонкой кишки. Это ведет к уменьшению высоты ворсинок и углублению крипт. При электронной микроскопии выявляется дегенерация микроворсинок, митохондрий и эндоплазматической сети.
Состав микрофлоры толстой кишки может меняться под влиянием различных факторов и неблагоприятных воздействий, ослабляющих защитные механизмы организма (экстремальные климатогеографические условия, загрязнение биосферы промышленными отходами и различными химическими веществами, инфекционные заболевания, болезни органов пищеварения, неполноценное питание, ионизирующая радиация).
В развитии дисбактериоза толстой кишки большую роль играют ятрогенные факторы: применение антибиотиков и сульфаниламидов, иммунодепрессантов, стероидных гормонов, рентгенотерапия, хирургические вмешательства. Антибактериальные препараты значительно подавляют не только патогенную микробную флору, но и рост нормальной микрофлоры в толстой кишке. В результате размножаются микробы, попавшие извне, или эндогенные виды, устойчивые к лекарственным препаратам (стафилококки, протей, дрожжевые грибы, энтерококки, синегнойная палочка).
Клинические проявления чрезмерного роста микроорганизмов в тонкой кишке могут полностью отсутствовать, выступать в качестве одного из патогенетических факторов хронической рецидивирующей диареи, а при некоторых болезнях, например, дивертикулезе тонкой кишки, частичной кишечной непроходимости или после хирургических операций на желудке и кишечнике, приводить к тяжелой диарее, стеаторее и В 12 -дефицитной анемии.
Особенностей клинического течения заболевания у больных с различными вариантами дисбактериоза толстой кишки, по данным бактериологических анализов кала, в большинстве случаев установить не удается. Можно отметить, что больные хроническими заболеваниями кишечника чаще инфицируются острыми кишечными инфекциями по сравнению со здоровыми. Вероятно, это связано со снижением у них антагонистических свойств нормальной микрофлоры кишечника и, прежде всего, частым отсутствием бифидобактерий.
Особенно большую опасность представляет псевдомембранозный колит, развивающийся у некоторых больных, длительно лечившихся антибиотиками широкого спектра действия. Этот тяжелый вариант дисбактериоза вызывается токсинами, выделяемыми синегнойной палочкой Clostridium difficile, которая размножается в кишечнике при угнетении нормальной микробной флоры.
Очень редко наблюдается молниеносное течение псевдомембранозного колита, напоминающее холеру. Обезвоживание развивается в течение нескольких часов и заканчивается летальным исходом.
Таким образом, оценка клинической значимости дисбиотических изменений должна основываться прежде всего на клинических проявлениях, а не только на результатах исследования микрофлоры кала.
Диагностика дисбактериоза представляет собой сложную и трудоемкую задачу. Для диагностики дисбактериоза тонкой кишки применяют посев сока тонкой кишки, полученного с помощью стерильного зонда. Дисбактериоз толстой кишки выявляют с помощью бактериологических исследований кала.
Микробная флора образует большое количество газов, в том числе водорода. Это явление используют для диагностики дисбактериоза. Концентрация водорода в выдыхаемом воздухе натощак находится в прямой зависимости от выраженности бактериального обсеменения тонкой кишки. У больных с заболеваниями кишечника, протекающими с хронической рецидивирующей диареей и бактериальным обсеменением тонкой кишки, концентрация водорода в выдыхаемом воздухе значительно превышает 15 ppm.
Для диагностики дисбактериоза применяют также нагрузку лактулозой. В норме лактулоза не расщепляется в тонкой кишке и метаболизируется микробной флорой толстой кишки. В результате количество водорода в выдыхаемом воздухе повышается (рис. 1).
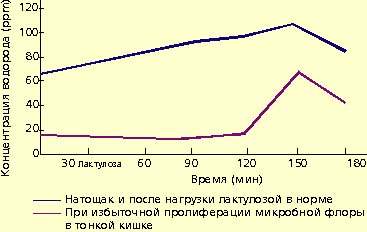 |
| Рисунок 1. Концентрация водорода в выдыхаемом воздухе |
Наиболее частыми бактериологическими признаками дисбактериоза толстой кишки являются отсутствие основных бактериальных симбионтов — бифидобактерий и уменьшение количества молочнокислых палочек. Увеличивается количество кишечных палочек, энтерококков, клостридий, стафилококков, дрожжеподобных грибов и протея. У отдельных бактериальных симбионтов появляются патологические формы. К ним относятся гемолизирующая флора, кишечные палочки со слабо выраженными ферментативными свойствами, энтеропатогенные кишечные палочки и т. д.
Углубленное изучение микробиоценоза показало, что традиционные методы не позволяют получить истинную информацию о состоянии микрофлоры кишечника. Из 500 известных видов микробов в целях диагностики обычно изучаются лишь 10-20 микроорганизмов. Важно, в каком отделе — в тощей, подвздошной или толстой кишках — исследуется микробный состав. Поэтому перспективы разработки клинических проблем дисбактериоза в настоящее время связывают с применением химических методов дифференциации микроорганизмов, позволяющих получить универсальную информацию о состоянии микробиоценоза. Наиболее широко для этих целей используются газовая хроматография (ГХ) и газовая хроматография в сочетании с масс-спектрометрией (ГХ-МС). Этот метод позволяет получить уникальную информацию о составе мономерных химических компонентов микробной клетки и метаболитов. Маркеры такого рода могут быть определены и использованы для детектирования микроорганизмов. Главным преимуществом и принципиальным отличием этого метода от бактериологических является возможность количественного определения более 170 таксонов клинически значимых микроорганизмов в различных средах организма. При этом результаты исследования могут быть получены в течение нескольких часов.
Проведенные нами исследования микробиоценоза в крови и биоптатов слизистой оболочки тонкой и толстой кишок у больных с синдромом раздраженного кишечника позволили обнаружить отклонения от нормы до 30-кратного увеличения или уменьшения многих компонентов. Существует возможность оценки изменений микрофлоры кишечника на основании данных анализа крови методом ГХ-МС-микробных маркеров.
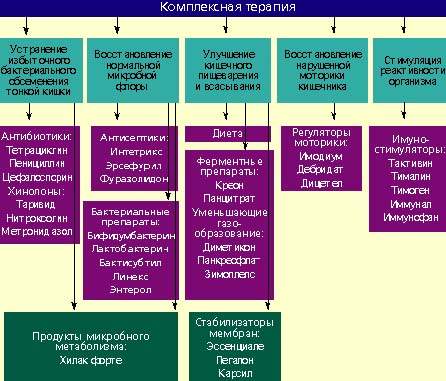 |
Лечение дисбактериоза должно быть комплексным (схема) и включать в себя следующие мероприятия:
- устранение избыточного бактериального обсеменения тонкой кишки;
- восстановление нормальной микробной флоры толстой кишки;
- улучшение кишечного пищеварения и всасывания;
- восстановление нарушенной моторики кишечника;
- стимулирование реактивности организма.
Антибактериальные препараты необходимы в первую очередь для подавления избыточного роста микробной флоры в тонкой кишке. Наиболее широко применяются антибиотики из группы тетрациклинов, пенициллинов, цефалоспорины, хинолоны (таривид, нитроксолин) и метронидазол.
Однако антибиотики широкого спектра действия в значительной степени нарушают эубиоз в толстой кишке. Поэтому они должны применяться только при заболеваниях, сопровождающихся нарушениями всасывания и моторики кишечника, при которых, как правило, отмечается выраженный рост микробной флоры в просвете тонкой кишки.
Антибиотики назначают внутрь в обычных дозах в течение 7–10 дней.
При заболеваниях, сопровождающихся дисбактериозом толстой кишки, лечение лучше проводить препаратами, которые оказывают минимальное влияние на симбионтную микробную флору и подавляют рост протея, стафилококков, дрожжевых грибов и других агрессивных штаммов микробов. К ним относятся антисептики: интетрикс, эрсефурил, нитроксолин, фуразолидон и др.
При тяжелых формах стафилококкового дисбактериоза применяют антибиотики: таривид, палин, метронидазол (трихопол), а также бисептол-480, невиграмон.
Антибактериальные препараты назначают в течение 10–14 дней. В случае появления в кале или кишечном соке грибов показано применение нистатина или леворина.
У всех больных с диареей, ассоциированной с антибиотиками, протекающей с интоксикацией и лейкоцитозом, возникновение острой диареи следует связывать с Cl. difficile.
В этом случае срочно делают посев кала на Cl. difficile и назначают ванкомицин по 125 мг внутрь 4 раза в сутки; при необходимости доза может быть увеличена до 500 мг 4 раза в день. Лечение продолжают в течение 7-10 суток. Эффективен также метронидазол в дозе 500 мг внутрь 2 раза в сутки, бацитрацин по 25 000 МЕ внутрь 4 раза в сутки. Бацитрацин почти не всасывается, в связи с чем в толстой кишке можно создать более высокую концентрацию препарата. При обезвоживании применяют адекватную инфузионную терапию для коррекции водно-электролитного баланса. Для связывания токсина Cl. difficile используют холестирамин (квестран).
Живые культуры нормальной микробной флоры выживают в кишечнике человека от 1 до 10% от общей дозы и способны в какой-то мере выполнять физиологическую функцию нормальной микробной флоры. Бактериальные препараты можно назначать без предварительной антибактериальной терапии или после нее. Применяют бифидумбактерин, бификол, лактобактерин, бактисубтил, линекс, энтерол и др. Курс лечения длится 1-2 месяца.
Возможен еще один способ устранения дисбактериоза — воздействие на патогенную микробную флору продуктами метаболизма нормальных микроорганизмов. К таким препаратам относится хилак форте. Он создан 50 лет назад и до настоящего времени применяется для лечения больных с патологией кишечника. Хилак форте представляет собой стерильный концентрат продуктов обмена веществ нормальной микрофлоры кишечника: молочной кислоты, лактозы, аминокислот и жирных кислот. Эти вещества способствуют восстановлению в кишечнике биологической среды, необходимой для существования нормальной микрофлоры, и подавляют рост патогенных бактерий. Возможно, продукты метаболизма улучшают трофику и функцию эпителиоцитов и колоноцитов. 1 мл препарата соответствует биосинтетическим активным веществам 100 млрд. нормальных микроорганизмов. Хилак форте назначают по 40–60 капель 3 раза в день на срок до 4 недель в сочетании с препаратами антибактериального действия или после их применения.
Совсем недавно появились сообщения о возможности лечения острой диареи, ассоциированной с антибактериальной терапией и Cl. difficile, большими дозами пре- и пробиотиков.
У больных с нарушением полостного пищеварения применяют креон, панцитрат и другие панкреатические ферменты. С целью улучшения функции всасывания назначают эссенциале, легалон или карсил, т. к. они стабилизируют мембраны кишечного эпителия. Пропульсивную функцию кишечника улучшают имодиум (лоперамид) и тримебутин (дебридат).
Для повышения реактивности организма ослабленным больным целесообразно применять тактивин, тималин, тимоген, иммунал, иммунофан и другие иммуностимулирующие средства. Курс лечения должен составлять в среднем 4 недели. Одновременно назначаются витамины.
Первичная профилактика дисбактериоза представляет очень сложную задачу. Ее решение связано с общими профилактическими проблемами: улучшением экологии, рациональным питанием, улучшением благосостояния и прочими многочисленными факторами внешней и внутренней среды.
Вторичная профилактика предполагает рациональное применение антибиотиков и других медикаментов, нарушающих эубиоз, своевременное и оптимальное лечение болезней органов пищеварения, сопровождающихся нарушением микробиоценоза.
Методические рекомендации предназначены для системы последипломного профессионального образования врачей. Посвящены общеклинической проблеме - дисбактериозу кишечника. Рассматриваются вопросы этиологии, патогенеза, клиники, диагностики и лечения дисбактериоза кишечника. Особое внимание уделено рациональному использованию пробиотиков и, в частности, Йогулакта в терапии данной патологии.
Количественные и качественные нарушения нормальной микрофлоры традиционно относят к понятию "дисбактериоз". В последнее время широко используется термин "дисбиоз кишечника", образованный из латинских слов "dis" - затруднение, нарушение, расстройство и "bios" - жизнь. Дисбиоз - это нарушение функционирования и механизмов взаимодействия организма человека, его микрофлоры и окружающей среды. Дисбактериоз кишечника всегда вторичен и представляет собой клинико-лабораторный синдром, который развивается при целом ряде заболеваний и клинических ситуаций и характеризуется изменением качественного и/или количественного состава микрофлоры определенного биотопа, транслокацией различных ее представителей в несвойственные биотопы, а также метаболическими и иммунными нарушениями, сопровождающимися у части пациентов клиническими симптомами.
Термин "дисбактериоз" был введен в клиническую практику в 1916 году немецким врачом А.Ниссле для обозначения явлений бродильной и гнилостной диспепсии. Существуют различные интерпретации этого термина.
В литературе рассматривается ряд определений дисбактериоза.
Дисбактериоз - это изменение количественного и (или) качественного состава бактериальной флоры, обусловленное динамическими нарушениями микроэкологии кишечника в результате расстройства адаптационных, защитных и компенсаторных механизмов. Микробиологически дисбиоз выражается в снижении количества облигатной флоры в кишечнике (бифидо - и лактобактерий, кишечной палочки)[Архипов Г.С., Венгеров Ю.Я., 2009].
За рубежом чаще используют термин "синдром избыточного бактериального роста" в тонкой кишке (СИБР). Его определение носит более конкретный характер, и постановка диагноза базируется на обнаружение более 10 5 микроорганизмов в одном мл аспирата из тощей кишки и/или появление флоры, характерной для толстой кишки
В последние годы проблема дисбактериоза вызывает немало дискуссий у специалистов различного профиля - клиницистов и бактериологов. Необходимо отдавать себе отчет в том, что, по мнению многих, такой нозологической единицы не существует, хотя в отечественных публикациях часто встречаются термины "дисбактериоз" или "дисбиоз кишечника". Дисбактериоз описывают даже в качестве самостоятельного заболевания, однако в существующих международных классификациях болезней он отсутствует. Некоторые авторы подчеркивают, что дисбактериоз или дисбиоз - не заболевание, а отклонение от нормы одного из параметров гомеостаза, который зачастую не требует обязательного лечения. Он всегда вторичен и причинно обусловлен. Данная точка зрения имеет важное практическое значение, так как исключает принадлежность дисбактериоза к самостоятельным болезням человека. В то же время сама возможность наличия такого патологического состояния, как дисбактериоз, никем не отрицается, так как в основе его развития лежат многообразные изменения в качественном и количественном составе микрофлоры пищеварительного тракта [Шендеров А.Б., 2000].
Эпидемиология дисбактериоза кишечника.
По данным РАМН более 90% населения России в той или иной мере страдает дисбактериозом. По данным зарубежных исследователей все жители планеты на протяжении жизни имеют те или иные отклонения от нормобиоценоза.
Роль нормальной микрофлоры кишечника в поддержании гомеостаза.
Нормальная микрофлора - эволюционно сложившаяся экологическая система симбиотических микроорганизмов, населяющих открытые полости человека и поддерживающие метаболическое, биохимическое и иммунологическое равновесие, необходимое для здоровья человека [Бондаренко В.М., 2007]. Микробиота кишечника взрослого содержит 10 - 100 триллионов микробов, общей массой от 1 до 2,5 кг. На жизнедеятельность кишечной микрофлоры расходуется до 10% поступившей энергии и 20% объема принятой человеком пищи. В толстой кишке содержится около 1,5 кг различных микроорганизмов. В 1 грамме содержимого слепой кишки обнаруживают около 2 миллиардов микробных клеток (представители 17 семейств, 45 родов, 500 видов). Плотность заселения микроорганизмами увеличивается к дистальному отделу тонкой кишки, резко возрастает в толстой кишке, достигая максимальных значений на уровне ободочной кишки. Толстая кишка человека в наибольшей степени колонизирована микроорганизмами. Количество бактерий в фекалиях может достигать 5х10 12 КОЕ/г содержимого (количество образующих колонии микроорганизмов - колониеобразующих единиц - на 1 грамм фекалий). В прямой кишке плотность обсеменения составляет до 400 миллиардов бактерий на 1 грамм содержимого.
Доминирующей группой, характерной для эубиоза здоровых взрослых людей, являются анаэробные бактерии, на долю которых приходится до 90-98% от общего количества микроорганизмов кишечника. Анаэробными являются микробы, способные существовать без свободного кислорода.
В отличие от них, жизнедеятельность аэробной флоры возможна только при наличии свободного кислорода. Аэробные и условно анаэробные бактерии, представленные кишечными палочками, стрептококками, энтерококками, составляют в сумме не более 5-10% от всей заселяющей кишечника человека аутофлоры.
Соотношение между кишечными анаэробами и аэробами в норме составляет 10:1.
В таблице 1 приведен состав представителей аэробной и анаэробной микрофлоры
Таблица 1. Состав аэробной и анаэробной микрофлоры
| Анаэробная микрофлора | Аэробная микрофлора |
|
|
|
Классификация нормальной микрофлоры толстой кишки здорового человека
Нормальная микрофлора кишечника по количественным соотношениям представлена тремя основными группами:
1. Основная или облигатная микрофлора. Обязательная для толстой кишки. Это, преимущественно, грамположительные бесспоровые анаэробы - бифидобактерии и грамотрицательные бактероиды. Составляет 90-95% микробиоценоза человека.
2. Сопутствующая микрофлора. Представлена, в основном, аэробами - лактобактерии, кокковые формы, кишечная палочка (E.coli). В сумме эти микроорганизмы не превышают 5% микробиоценоза. Лактобактерии и E.coli являются синергистами бифидобактерий.
3. Остаточная микрофлора (условно-патогенная или факультативная микрофлора). К этой группе относятся стафилококки, кандиды, протей, синегнойная палочка, энтеробактерии, кампилобактерии. Удельный вес этой группы в норме не превышает 1% от общего количества микроорганизмов.
В зависимости от времени присутствия бактерий в кишечнике: постоянного или периодического, микрофлору здоровых людей подразделяют на несколько видов:
По локализации в кишечнике микроорганизмы можно также разделить на следующие две группы, отличающиеся друг от друга по количественной и качественной характеристикам:
В зависимости от расщепляемых микрофлорой пищевых веществ бактерии разделяют на:
Пристеночная (мукозная) микрофлора включает с себя более 395 филогенетически обособленных групп микроорганизмов [Бондаренко В.М., 2007]. Мукозная микрофлора (пристеночно) формирует микроколонии, образующие биопленку. Биопленка - микробное сообщество, которое как бактериальный газон выстилает поверхность слизистых. Генная структура микрофлоры тождественна генной структуре макроорганизма [Конев Ю.В. и соавт. , 2001]. В микробно-тканевом комплексе (биопленке) происходит распознавание и обмен генетическим материалом поступающих в желудочно-кишечный тракт (ЖКТ) микроорганизмов (в том числе, в составе пробиотиков). Распознавание молекулярного образа патогенных и симбиотических микроорганизмов - ключевой момент межмикробного взаимодействия. Он определяет молекулярно-генетическую и метаболическую биосовместимость нормофлоры с пробиотиками.
При рассмотрении многогранной функции нормальной микрофлоры кишечника необходимо использовать термин "энтеральная среда". Она представляет собой сложную систему жидкостей, включающую пищу, ее компоненты, пищеварительные секреты, кишечную микрофлору макроорганизма и ее метаболиты [Щекина М.И., 2009]. Сбалансированное существование энтеральной среды жизненно важно как для самого макроорганизма, так и симбионтной микрофлоры, присутствующей в кишечнике.
С этих позиций представляется целесообразным выделить наиболее значимые функции нормальной микрофлоры желудочно-кишечного тракта (ЖКТ) [Архипов Г.С., Венгеров Ю.Я., 2009]:
- Участие в пищеварении:
- переваривание полисахаридов (пектин, микрополисахариды, гликопротеиды);
- расщепление непереваренных азотсодержащих соединений, мочевины;
- синтез некоторых незаменимых аминокислот;
- деконьюгация желчных кислот;
- детоксикация ксенобиотиков (лекарственных веществ, токсических веществ, консервантов).
- Синтез витаминов. Микрофлора - основной источник витамина К, витаминов группы В (цианкобаламин, фолиевая кислота, биотин, рибовлавин, пантотеновая кислота).
- Защитные функции :
- колонизационная резистентность: связывание с рецепторами и заселение слизистого слоя кишечника;
- синтез бактерицидных веществ: летучих жирных кислот, перекиси водорода, сероводорода;
- конкуренция с транзиторной микрофлорой за питательные вещества;
- снижение внутриполостной рН;
- стимуляция местного иммунитета: выработка иммуноглобулинов и неспецифических факторов защиты (лизоцим, интерферон);
- поддержание реакций клеточного иммунитета.
- Расширение наследственной программы: обмен регуляторными молекулами, фрагментами структурных генов с другими представителями микробиоценоза.
- Обеспечение трофического гомеостаза. Нормальная микрофлора кишечника является клеточным, метаболическим, иммунологическим и генетическим компонентом жизнедеятельности человека.
Рассмотрим функции микрофлоры подробнее.
Известно, что основной функцией нормальной микрофлоры человека является обеспечение колонизационной резистентности (КР) пищеварительного тракта. В обычных условиях поддержание КР микрофлорой осуществляется за счет продукции антибиотических веществ, конкуренции за места адгезии, подавления адгезии условно патогенных бактерий, ингибирования транслокации и ряда опосредованных механизмов.
Участие в пищеварении является важным звеном деятельности микрофлоры кишечника. Симбионты в качестве промежуточных продуктов бактериального гидролиза пищи образуют янтарную, уксусную, масляную, пропионовую, муравьиную и другие кислоты, а также ряд газов, включая водород, диоксид углерода, метан. В норме происходит практически полная активная утилизация этих токсических метаболитов самой микрофлорой. При этом бифидо -, лактобактерии и энтерококки расщепляют целлюлозу и гемицеллюлозу с образованием короткоцепочечных жирных кислот. Кишечная палочка, бактероиды, клостридии и протей метаболизируют протеины до аммония, фенолов и меркаптопурина. При сбалансированном микробиоценозе эти процессы равновесны. Анаэробная микрофлора трансформирует пищевые волокна с образованием крайне важных для организма сахаров, аминокислот и минеральных веществ (табл. 1)
Таблица 2. Влияние продуцируемой микрофлорой низкомолекулярных метаболитов на функции организма (Щекина М.И., 2009)
| Метаболиты микрофлоры | Физиологические эффекты |
| Оксид азота | Регуляция моторной активности кишечника Регуляция нейротрасмиссии Регуляция сосудистого тонуса Антиоксидантное действие Антиапоптическое действие |
| Глутамат | Влияние на процессы нейрорегуляции |
| Изовалериановая, изокапроновая кислоты | Индукция секреции инсулина |
| Ацетат | Субстрат гипогенеза |
| Бутират | Регуляция пролиферации и дифференцировки колоноцитов Влияние на моторику толстой кишки |
| Эстрогеноподобные вещества | Влияние на пролиферацию эпителия (изменение экспрессии генов) |
| Сигнальные молекулы | Позволяют иммунной системе человека распознавать эти микроорганизмы как "свои" |
Микрофлора кишечника участвует в деконьюгации желчных кислот. 80-95% желчных кислот реабсорбируются, остальные под действием бактериальных ферментов в комплексе с холестерином превращаются в нерастворимые соединения и выделяются с каловыми массами. Выраженными холестеринснижающей активностью обладают бифидо- и лактобактерии, уменьшающие растворимость холестерина.
Нормальная микрофлора участвует в синтезе основных витаминов группы В (В1,В2,В6,В8,В12), витаминах К, С, никотиновой, фолиевой, пантотеновой, липоевой кислот. Доминирующее позиции в этом плане занимает кишечная палочка, обеспечивающая синтез 9 витаминов.
Функционирование обширной и активированной иммунной системы кишечника зависит от наличия нормальной микрофлоры. При этом иммунная система кишечника у здоровых людей регулируется таким образом, чтобы избежать чрезмерного кишечного ответа на пищевые антигены и кишечные бактерии-комменсалы. Отличительной особенностью мукозной иммунной системы пищеварительного тракта является лимфоидная ткань, представленная пейеровыми бляшками. При активации Т- и В- клетки пейеровых бляшек, мигрируют в кровь и экспрессируют α4β7-интегрин. Способность лимфоцитов мигрировать из кровеносных сосудов в собственную пластинку достигается при экспрессии лиганда к α4β7-интегрину на эндотелиальных клетках сосудов кишечника [Campbell D.J. et al.,2003]. Посредством данного механизма хемокины, вырабатываемые эпителиальными клетками, регулируют миграцию лимфоцитов в ткани кишечника.
Кишечная микрофлора обеспечивает активацию специфического клеточного и гуморального иммунитета, а также стимулирует неспецифическую резистентность организма. Сложившийся микробиоценоз кишечника стимулирует продукцию IgА и секреторного IgА, участвующего в локальной защите слизистой оболочки кишечника от патогенных вирусов, бактерий, токсинов и аллергенов. Микрофлора кишечника активирует фагоцитарную активность макрофагов и нейтрофилов. Нормофлора стимулирует созревание лимфоидного аппарата, потенцируя продукцию интерферона и лизоцима. Лакто- и бифидобактерии повышают фагоцитарную активность гранулоцитов крови, стимулируют продукцию цитокинов мононуклеарами, нормализуют иммунорегуляторный индекс, синтезируют ряд биологически активных веществ, разрушающих антигены.
Для нормального развития мукозного иммунного ответа необходимо наличие в кишечнике бактерий-комменсалов, при этом мукозная иммунная система распознает их постоянно, обеспечивая толерантность и контролируя воспаление [Broad A. et. al., 2006]. Кишечный эпителий определяет присутствие бактерий-комменсалов через паттерн-распознающие рецепторы, к которым относятся Тoll-подобные (ТПР) и внутриклеточные NOD-подобные рецепторы. Паттерн-распознающие рецепторы идентифицируют структуру бактерий и вирусов и запускают провоспалительные механизмы путем активации транскрипционного ядерного транскрипционного фактора kВ (NF-kB) [Macdonald T.T., Monteleone G., 2005].. В норме активация ТПР сопровождается усиление естественной резистентности, обеспечивающей гомеостаз желудочно-кишечного тракта и дает возможность избежать проникновения патогенных бактерий и повреждения эпителия.
Нормальная микрофлора кишечника обеспечивает трофический гомеостаз, влияя на регенераторные процессы в слизистой оболочки кишечника. Так, бифидо- и лактобактерии повышают митотическую активность энтероцитов крипт. Представители нормальной кишечной флоры синтезируют короткоцепочечные жирные кислоты, которые являясь энергетическим субстратом окисления в цикле Кребса, оказываю благотворное влияние на трофику и клеточную регенерацию слизистой оболочки кишечника и других тканей организма.
Нормальная кишечная микрофлора участвует в нейтрализации экзогенных и эндогенных метаболитов (нитратов, ксенобиотиков, мутагенных стероидов, токсичных продуктов белкового обмена - индола, скатола, фенола)
Читайте также:


