Кишечная инфекция у недоношенных детей
Системные инфекции являются важной причиной заболеваемости и смертности недоношенных новорождённых. Данные инфекции подразделяются на 2 группы, различающиеся как по этиологии, так и по клиническим исходам:
- ранние заражение происходит в родах, инфекция проявляется в первые 48-72 ч жизни,
- поздние заражение происходит во время пребывания в лечебном учреждении, клинические проявления возникают через 72 ч и более с момента рождения (как правило, в течение первой недели жизни).
Ранние инфекции
Ранние инфекции у недоношенных детей представлены бактериемией, пневмонией, менингитом и инфекциями мочевыводящих путей. Данные инфекции развиваются редко, характеризуются тяжёлым течением и могут приводить к инвалидизации. Смертность от ранних инфекций достигает 40%, что в 3 раза превышает таковую у недоношенных новорождённых при отсутствии инфекции.
Основными их возбудителями инфекций у недоношенных детей являются стрептококки группы В и Escherichia coli. К факторам риска развития ранних инфекций, вызванных стрептококками группы В, относят:
- инфекцию, вызванную стрептококками группы В, у предыдущих детей данной матери,
- урогенитальную инфекцию, вызванную стрептококками группы В, у матери в течение беременности,
- лихорадку у матери в родах,
- ранее излитие околоплодных вод и длительный безводный промежуток (>18 ч).
В последние десятилетия во многих экономически развитых странах на фоне широкого проведения антибиотикопрофилактики в родах снизилась заболеваемость новорождённых стрептококковыми инфекциями и повысилась заболеваемость инфекциями, вызванными грам-отрицательной кишечной флорой.
У большинства детей ранняя системная инфекция проявляется в первые 12 ч жизни, однако симптомы могут возникать и позднее, особенно если мать получала антибиотикотерапию. Развитие инфекции сопровождается следующими клиническими проявлениями:
- дыхательная недостаточность,
- колебания температуры тела,
- раздражительность,
- снижение или отсутствие аппетита,
- ранняя желтуха,
- апноэ,
- нарушения кровообращения,
- тахикардия,
- судороги.
Всем новорождённым с симптомами сепсиса, а также имеющим в анамнезе факторы повышенного риска развития инфекции, назначают эмпирическую антибиотикотерапию. Препаратами выбора являются пенициллин в комбинации с аминогликозидами (гентамицин). При отсутствии клинических проявлений инфекции, а также отрицательном результате бактериологического исследования крови, мочи и ликвора терапию прекращают через 48 ч. При подтверждении бактериемии парентеральное введение антибиотиков продолжают до 14 дней, у пациентов с менингитом до 3 недель.
Поздние инфекции
Поздние инфекции развиваются у недоношенных новорожденных достаточно часто (до 20% младенцев с дефицитом массы тела).
Инфекции, как правило, вызываются нозокомиальной флорой, основными возбудителями являются:
- Грам-положительные микроорганизмы
- коагулазонегативные стафилококки (около 50% инфекций)
- Staphylococcus aureus
- энтерококки - Грам-отрицательные микроорганизмы
- E.coli
- Klebsiella spp.
- Pseudomonas spp. - Грибки
- преимущественно Candida spp.
Риск развития инфекции обратно пропорционален гестационному возрасту и массе тела при рождении и прямо пропорционален степени тяжести состояния новорождённого.
Поздние системные инфекции характеризуются следующими клиническими проявлениями:
- нарастающее апноэ,
- отказ от кормления или вздутие живота,
- нарушения дыхания,
- сонливость
- гипотония.
Результаты лабораторных исследований включают изменение количества лейкоцитов, необъяснимый метаболический ацидоз и гипергликемию.
При подозрении на возникновение инфекции проводят культуральное исследование биологических жидкостей. Антимикробные препараты начинают сразу после забора образцов для исследования. При получении отрицательного результата лечение отменяют. Препаратами выбора эмпирической терапии при подозрении на нозокомиальный сепсис у недоношенных новорождённых являются антистафилококковые антибиотики и аминогликозиды. При подтверждении этиологической роли коагулазонегативных стафилококков, а также при неэффективности антистафилококковых пенициллинов показано назначение ванкомицина или тейкопланина.
Поздние инфекции, как правило, характеризуются благоприятным клиническим исходом, за исключением вызванных грам-отрицательной кишечной и грибковой флорой, смертность при которых остается достаточно высокой.
Поздние грибковые инфекции
Факторами риска развития инвазивных грибковых инфекций у недоношенных детей являются:
- грибковая колонизация,
- тяжелое состояние при рождении,
- проведение множественных курсов антибактериальной терапии, особенно цефалоспоринами III поколения,
- парентеральное питание,
- наличие центрального венозного катетера,
- использования антагонистов Н2-рецепторов.
Клинические проявления инвазивных грибковых инфекций аналогичны таковым при бактериальных, что может затруднять диагностику.
Терапия осуществляется такими препаратами, как амфотерицин В (в том числе липосомальный), флуцитозин, триазолы (флуконазол, итраконазол) и имидазолы (миконазол, кетоконазол). Хотя системная противогрибковая терапия нередко назначается до подтверждения диагноза, летальность от данных инфекций среди недоношенных младенцев превышает 30%. Существует мнение, что проведение местной (нистатин) и/или системной (флуконазол) профилактики способствует снижению риска развития грибковых инфекций.
Неантибактериальная терапия
Назначение сопутствующей неантибактриальной терапии может, по мнению ряда авторов, способствовать снижению смертности от инфекций у недоношенных новорождённых. С данной целью предлагают использовать такие препараты, как:
- поликлональный иммуноглобулин,
- колониестимулирующие факторы (например, гранулоцит-макрофагально колониестимулирующий фактор),
- переливание гранулоцитов,
- антицитокины.
Профилактика
Меры по профилактике развития инфекций сводятся к тщательному соблюдению правил асептики и антисептики. Было показано, что обработка рук спиртом после каждого контакта с новорождёнными значительно снижает риск развития инфекций по сравнению с их мытьем с мылом. Такие меры как ношение перчаток, медицинских шапочек и масок персоналом и родителями значительно менее эффективны. Профилактическое использование антибиотиков не показано, поскольку способствует развитию резистентной флоры.
McGuire W., Clerihew L., Fowlie P.W.
Infection in the preterm infant.
BMJ 2004; 329 (7477): 1277-80
недоношенные новорождённые, системные инфекции, сепсис, бактериемия, пневмония, менингит
Заболевание вызывается, сальмонеллами, стафилококками, энтеровирусами, ассоциацией вирусов и бактерий и другими микробами. Заболевают чаще недоношенные и ослабленные дети, в особенности при нарушениях санитарно-гигиенического режима.
Клиническая картина. Кишечные инфекции могут протекать в форме гастрита, гастроэнтерита, энтероколита и колита.
Инкубационный период длится от некоторого количества часов до 5-8 суток. По тяжести течения различают 3 формы заболевания: легкую (стертая форма), характеризующуюся плоской кривой веса на протяжении 1-3 суток и кратковременным жидким стулом (до 5-7 раз в сутки); среднетяжелую и тяжелую формы с острым началом, нарастанием явлений токсикоза и эксикоза и неуклонным понижением веса. Ребенок резко истощен, кожа и слизистые оболочки сухие, возникает землистый оттенок кожных покровов, черты лица заостряются, огромной родничок западает. Температурная реакция бывает нечасто. Живот вздут, учащаются срыгивания, возникает рвота, нередко с примесью желчи. Стул 12-15 раз в сутки, жидкий, жидкий,с гнилостным запахом, порой с примесью зелени или имеет оранжевую окраску. В моче единичные красные кровяные клетки и цилиндры. В крови лейкоцитоз, время от времени нейтрофилез со сдвигом лейкоцитарной формулы влево. Для тяжелой формы характерны более выраженные нарушения водно-солевого обмена с последующим расстройством гемодинамики, развитием гипоксии, ацидоза и нарушением всех видов внутриклеточных обменных процессов.
В последние несколько лет участились вспышки внутрибольничной клебсиеллезной инфекции у новорожденных. Особенностью клебсиеллезного энтероколита является холероподобное течение, быстрое развитие эксикоза.
Прогноз. Серьезный, однако при своевременном лечении благоприятный.
Лечение. На весь период назначают водную паузу на протяжении 12-18 часов. В этот же период проводят дезинтоксикационную и регидратационную терапию по возможности с учетом степени и вида обезвоживания (вододефицитное, соледефицитное, изотоническое); коррекцию нарушения КОС. Для пероральной регидратации вероятно применение регидрона, отваров трав (ромашка, зверобой). При тяжелых инфекциях с неукротимой рвотой на 1-2 сут вероятно проведение полного парентерального питания, после частичного парентерального.
Для инфузионной терапии применяют раствор Рингера, 5-10 % раствор глюкозы, плазму (сухую и нативную), кровозамещающие жидкости. Расчет жидкости проводят с учетом возраста и веса ребенка (см. Диспепсические расстройства у новорожденных). С целью дезинтоксикации, десенсибилизации и удержания жидкости в сосудистом русле назначают гидрокортизон в дозе 2-3 мг/кг в сутки (половину суточной дозы возможноввести внутривенно капельно). Последующее проведение гормональной терапии продолжают коротким курсом (5-7 суток) по убывающей схеме.
После водной диеты назначают сцеженное грудное молоко по 5-10 миллилитра 10 раз в сутки, каждый день увеличивая дозу (недостающее число молока дополняют жидкостью).
Антимикробные препараты назначают с учетом чувствительности выделенной флоры. До получения посева вероятно внутримышечное (в тяжелых ситуациях внутривенное) введение антибиотиков широкого спектра действия: цепоринов, аминогликозидов — в возрастных дозах. Меньше лучше применение ампициллина и ампиокса. При клебсиеллезной, синегной или протейнойной инфекции неплохие результаты дает сочетанное использование одного из указанных антибиотиков (парентерально) и полимиксина-М (перорально), и поли- или моновалентных фагов: антиклебсиеллезного, антипротейного, колипротейного и т. д. (перорально и в клизмах).
Тяжелые формы стафилококковых энтероколитов требуют комбинированного лечения антибиотиками направленного действия: полусинтетические пенициллины (оксациллин, метициллин) в возрастной дозе. При стафилококковой этиологии заболевания показаны противостафилококковая плазма и гамма-глобулин.
Предупреждение. Строжайшее соблюдение санитарно-гигиенического режима в отделениях для новорожденных. В случае возникновения у ребенка признаков кишечной инфекции необходима его изоляция и индивидуальное, асептическое обслуживание. При огромной вспышке эпидемического диареи нужно закрыть отделение и произвести тщательную его дезинфекцию.
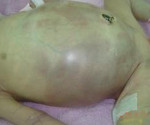
Некротический энтероколит новорожденных (НЭК) – это неспецифическое заболевание воспалительного характера, которое вызывается инфекционными агентами на фоне повреждения слизистой оболочки кишечника или ее функциональной незрелости. Симптомы включают соматические реакции и абдоминальные проявления. При длительном течении наблюдаются признаки перфорации кишечника и клиника перитонита. Диагностика НЭК сводится к физикальному обследованию, оценке симптомов по шкале Walsh и Kliegman и рентгенографии. Лечение зависит от стадии заболевания, может быть как консервативным, так и хирургическим.
Общие сведения

Причины НЭК новорожденных
Некротический энтероколит новорожденных – полиэтиологическое заболевание. Основными патогенетическими факторами являются гипоксия и ишемия в перинатальном периоде, нерациональное питание новорожденного и заселение кишечника аномальными микроорганизмами. К способствующим факторам относятся преждевременные роды, эклампсия, травмы ЦНС при родах, иммунодефицитные состояния у ребенка, аномалии развития кишечника, отягощенный семейный анамнез.
По скорости развития выделяют следующие формы некротического энтероколита новорожденных:
- Молниеносная. Перфорация стенки кишечника возникает на протяжении 36-48 часов после проявления первых симптомов – незначительного нарушения общего состояния ребенка. Характерна для доношенных детей с аномалиями развития ЖКТ (гастрошизис), гемолитической анемией, травмами ЦНС.
- Острая. Дебют характеризуется абдоминальными симптомами. Как правило, спустя 8-16 часов присоединяются соматические проявления, резко ухудшается общее состояние ребенка. Без соответствующего лечения НЭК быстро переходит в 3 стадию. Наблюдается у детей с массой тела при рождении свыше 1500 г.
- Подострая. Первичные абдоминальные проявления имеют перемежающийся характер, возникают поэтапно. Соматические расстройства развиваются медленно. Для этой формы характерно рецидивирующее течение. Обычно возникает у глубоко недоношенных детей с массой тела менее 1500 г.
В зависимости от массивности поражения различают следующие варианты НЭК:
- Локальный. Патологические изменения наблюдаются на ограниченном отрезке кишечника.
- Полисегментарный. Характерно поражение сразу нескольких участков.
- Паннекроз или тотальный. В патологический процесс втягивается весь кишечник.
Симптомы и осложнения НЭК новорожденных
Некротический энтероколит новорожденных может возникать в первые 24 часа после родов (ранняя форма) или после 1 месяца жизни (поздняя форма), средний возраст детей на момент появления симптомов – 1-2 недели. Все проявления данной патологии можно разделить на 3 группы: соматические, абдоминальные, генерализованные. Первыми, как правило, появляются абдоминальные симптомы, которые почти сразу дополняются соматическими. Генерализованные проявления НЭК отмечаются при прогрессировании заболевания и возникновении перфорации кишечника, что, в зависимости от формы, может происходить через 1-3 дня.
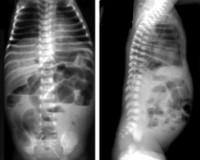
Диагностика НЭК новорожденных
Диагностика некротического энтероколита новорожденных включает в себя сбор анамнеза, клиническое, лабораторное и инструментальное обследование. Анамнестические данные могут помочь педиатру и детскому хирургу установить возможную этиологию, проследить за динамикой заболевания. При объективном осмотре выявляются присутствующие на данный момент клинические симптомы – абдоминальные, соматические и генерализованные проявления. Специфических лабораторных тестов для подтверждения НЭК не существует. Информативными являются следующие данные, полученные при проведении лабораторных исследований: лейкоцитоз со сдвигом формулы влево, лейкопения и тромбоцитопения в ОАК, ацидоз и гипоксемия при определении газового состава крови, гиперкалиемия и гипонатриемия в электролитном спектре, диспротеинемия и выявления С-реактивного протеина в белковом спектре, обнаружение крови в кале при пробе Грегерсена. С целью выявления инфекционного возбудителя проводится бактериальный посев, ИФА и ПЦР.
Дифференциальная диагностика некротического энтероколита новорожденных проводится с такими патологиями как неонатальный сепсис, пневмония, пневмоперитонеум, кишечная непроходимость различного генеза, аппендицит новорожденного, бактериальный перитонит и спонтанная перфорация кишечника.
Лечение НЭК новорожденных
Тактика лечения некротического энтероколита новорожденных зависит от тяжести состояния ребенка и стадии заболевания. Детям с 1а, 1б и 2а стадиями показана консервативная терапия. С момента постановки диагноза отменяется энтеральное питание и проводится постановка назо- или орогастрального зонда с целью декомпрессии. Ребенок переводится на полное парентеральное питание (TPN) в соответствии с клиническими протоколами. Параллельно назначаются антибактериальные препараты из групп пенициллинов (ампициллин) и аминогликозидов II поколения (гентамицин) в комбинации с медикаментами, действующими на анаэробную микрофлору (метронидазол). При неэффективности выбранной антибиотикотерапии применяют цефалоспорины III-IV поколения (цефтриаксон) в сочетании с аминогликозидами III поколения (амикацин). Таким детям рекомендованы пробиотики и эубиотики для нормализации кишечной микрофлоры. Также проводят СВЧ-терапию, вводят иммуномодуляторы и гамма-глобулины.
Исход НЭК зависит от тяжести общего состояния ребенка и стадии заболевания. Так как данные показатели почти всегда отличаются нестабильностью, прогноз считается сомнительным даже на фоне полноценного лечения. Профилактика некротического энтероколита новорожденных включает в себя антенатальную охрану здоровья плода, рациональное ведение беременности, грудное вскармливание в физиологических объемах. Согласно некоторым исследованиям, риск развития заболевания снижается при использовании эубиотиков, пробиотиков и IgA у детей из группы риска. При высоком риске преждевременных родов применяют глюкокортикостероиды с целью профилактики РДС.
Малыш лежит в реанимации, начался интероколит, что это такое. и как они это лечат?! насколько для малыша это опасно?!



Комментарии пользователей

![]()







спасибо! я очень надеюсь, что врачи знают, то деать, а Боженька не оставит нас!



энтероколит. он только срыгивает? стул сам отходит?


вот это не сказали(((((сказала, что сегодня начал подсрыгивать, поэтому через зонд кормить не будут, а через венку будут давать все необходимое!



если перестанет какать -некротический энтероколит- плохо! но и с этим врачи спаравляються, дай бог что обойдеться.
может рефлюкс быть-из-за боьшого количества смеси-желудок не воспринимает, не может удержать!
смотрите в динамике, главное избежать -апноэ, это тоже может быть.из-за неустройства пищеварения!
а в общем. вам терпения! все будет хорошо- вес при рождении уже по нашим временам -хороший!!
со мной выхаживались детки 480гр ,690гр,800гр все хорошо!!
если есть вопросы -пишите в личку всегда отвечу!
![]()
У меня малыш в реанимации, родился две недели назад, вес 750 гр. при рождении, сейчас говорят что у него энтероколит, это лечится ?


Желаю прежде всего малышу здоровья, а Вам терпения и спокойствия. Всё будет хорошо!


Спасибо! А у вашего малыша все хорошо?


![]()
в 35 с весом 2300,44см.лежали на ивл сутки.а потом с кислородной маской.


Мы слава богу дышим сразу сами, но вот сейчас эта беда((((


![]()


молюсь! еще я грудное молоко сцедил, может его от смесей так, а молочко возьмет?!


![]()
по идее вы имейте права каждые 3 часа относить ему свое молочко.у них смесь специальная есть для недонощенных пептинутрилон что ли((((





![]()
![]()
или хумана в стекляных баночках, не помню как точно называется, но нам она оооочень помогла


![]()





![]()
![]()


нам разрешают раз в день там бывать!(((((((((молочко пока ему не дают. раз пища не усваивается!


![]()
Евгения, я сама ничего не понимаю, но нашла статью в инете. почитайте
Эта болезнь чаще встречается у недоношенных и ослабленных новорожденных детей, получивших родовую травму и пострадавших от гипоксии. Раньше такие дети просто не доживали до яркой картины заболевания. Современная медицина позволяет своевременно определить болезнь и вылечить ребенка, даже с помощью хирургической операции.
О лечении на дому энтероколита у грудных детей не может быть и речи! Антибиотик – виновник болезни сразу отменяют, но ведь клостридий надо уничтожить, поэтому назначают ванкомицин, к которому они чувствительны. Кроме этого применяют комплексное лечение с учетом тяжести состояния, за которым идет круглосуточное наблюдение. При своевременном лечении острый энтероколит у детей заканчивается выздоровлением, важно не затягивать обращение к врачу.
Питание при энтероколите должно быть щадящим, дробным, содержащим больше белка и витаминов. После выписки из больницы рекомендуется диета на длительный срок. Предпочтение отдают ацидофильному молоку, слизистым отварам, протертым супам и кашам, отварным протертым овощам и фруктам. Нельзя давать ребенку мучное, черный хлеб, капусту и другие бродильные продукты. Все виды прикорма нужно согласовать с врачом.


![]()
короче, главное антибиотик отменить и правильное питание малышу. вовремя они, слава Богу, все заметили.
Здоровья вам и удачи!



дай бог здоровья вашему малышу и чтоб все обошлось! голодать он точно не будет — капельницы с глюкозой ставят в таких случаях.
Лечение некротического энтероколита
Лечение некротического энтероколита зависит от стадии заболевания и степени выраженности симптомов и складывается из консервативного и хирургического этапов. Консервативное лечение получают дети с НЭК, у которых нет показаний к хирургическому вмешательству. К ним относятся пациенты в 1А, Б и 2А стадии заболевания (по Bell и Walsh and Kliegman), а также дети групп риска, находящиея под особым контролем. При малейшем подозрении на развитие у них НЭК следует начинать профилактическое лечение, которое соответствует основным принципам консервативной терапии НЭК и чаще всего из разряда профилактического переходит в разряд диагностически обоснованного. При малейшем подозрении на НЭК ребенку необходимо отменить энтеральное питание, в желудок для декомпрессии поставить постоянный назогастральный или орогастральный зонд, который следует держать открытым для эвакуации содержимого из желудка и учета объема и качества выделяющейся жидкости. Консервативное лечение включает также назначение или усиление антибактериальной терапии. В качестве антибиотиков выбора для первого антибактериального курса служат полусинтетические пенициллины и аминогликозиды, например, ампициллин и гентомицин в возрастных дозировках, а кроме того, обязательными препаратами для лечения НЭК является препараты, воздействующие на анаэробную флору — метрогил, метронидазол, клиндамицин. При отсутствии клинического улучшения, ухудшении лабораторных показателей и рентгенологической картины производят смену антибиотиков, назначая антибиотики широкого спектра действия (цефалоспорин и аминогликозид последних поколений, например, фортум и нетромицин) в возрастных дозах. Если в результате бактериологического обследования удается выделить вероятный инфекционный агент — возбудитель, смена антибактериальной терапии производится с учетом спектра его чувствительности. Кроме того, проводят гемо- и плазмотрансфузии, СВЧ-терапию, вводят полигаммаглобулины и иммуномодуляторы. Как известно, одну из основных ролей в патогенезе НЭК играет инфекция, в том числе и условно патогенная флора, населяющая кишечник ребенка, а при неблагоприятных условиях вызывающая поражение слизистой кишки и определяющая транслокацию микробов в кровеностное русло, поэтому важным компонентом лечения являются биопрепараты — пробиотики и эубиотики. Следует использовать большие дозы лактобактерина (до 20 доз в сутки), бифидум-бактерин, бактисубтил. Курс лечения биопрепаратами длительный (более 2 месяцев) и значительно превышает сроки антибактериальной терапии. Эффективность эубиотикотерапии оценивают по данным микробного пейзажа кишки — посев кала на дисбактериоз целесообразно делать каждый месяц в течение первого полугода. В последние годы появилась возможность в наиболее тяжелых, резистентных к терапии случаях проводить курсы лечения бактериофагами, выращенными в лабораториях института им. Пастера, как антагонисты конкретных инфекционных агентов, выделенных от больного.
В комплекс консервативной терапии входят также все средства симптоматической терапии и терапии того патологического состояния, которое было первичным у ребенка и потенцировало развитие НЭК. С момента вынужденной отмены энтерального питания ребенок переводится на полное парэнтеральное питание (TPN).
Читайте также:


