Какой клапан чаще поражается при инфекционном эндокардите

Инфекционный эндокардит – болезнь, возникающая при поражении внутренней оболочки сердца (эндокарда) инфекционным процессом. При отсутствии своевременной диагностики и адекватного лечения данная патология достаточно быстро приведет к снижению качества жизни больного, а может стать причиной и его смерти.
Причины и механизмы развития

Инфекция, приводящая к развитию заболевания, может быть вызвана стафилококками, стрептококками, энтерококками, кишечной палочкой, протеем, клебсиеллой и другими микроорганизмами. Микробы попадают на поверхность эндокарда из хронических очагов инфекции (кариес зубов, хронический тонзиллит, пиелонефрит и так далее) или при несоблюдении техники внутривенных инъекций, в том числе при наркомании. Появление бактерий в крови (бактериемия) бывает кратковременным (после удаления зуба, при чистке зубов, катетеризации мочеиспускательного канала и многих других состояниях и медицинских манипуляциях). Инфекция может поражать здоровые сердечные клапаны или измененные в результате пороков сердца.
- микробы постоянно поступают в кровоток, приводя к развитию интоксикации, лихорадки, снижению массы тела, вызывая развитие анемии;
- возникают вегетации (разрастания) на самих клапанах, приводя к нарушению их функции; вегетации способствуют поражению окружающих тканей сердца;
- фрагменты микробных вегетаций распространяются по сосудам всего организма, вызывая закупорку сосудов внутренних органов и формирование в них гнойных очагов;
- образование в крови циркулирующих иммунных комплексов, состоящих из микробных антигенов и защитных антител; эти комплексы ответственны за появление гломерулонефрита, миокардита, артрита.
Клиническая картина
Начальные проявления болезни разнообразны и неспецифичны, они во многом зависят от варианта заболевания, вида возбудителя, возраста больного.
Высоковирулентная инфекция может вызвать заболевание при неповрежденных клапанах сердца с развитием первичного эндокардита. Начало болезни при этом внезапное, сопровождается высокой лихорадкой, интоксикацией. Общее состояние больного быстро ухудшается вплоть до тяжелого.
Вторичный инфекционный эндокардит (при поражении уже измененных клапанов) может развиваться постепенно. Ухудшается общее самочувствие, появляется утомляемость и слабость, снижается работоспособность. Температура тела повышается до 37 — 38˚С.
В некоторых случаях болезнь проявляется тромбоэмболией легочной артерии или сосудов головного мозга с развитием инсульта. Эти явления могут быть ошибочно расценены как осложнение фибрилляции предсердий у больных с ревматическим поражением клапанов сердца.
Иногда в дебюте заболевания развивается стойкая недостаточность кровообращения.
Температурная реакция может быть разной. У части больных температура тела не повышается, у других отмечается короткий эпизод лихорадки до 40˚С с последующим длительным субфебрилитетом. Более редко отмечается волнообразный вариант, при котором бывают рецидивы высокой лихорадки.
Примерно у трети больных повышение температуры тела сопровождается потрясающим ознобом, а понижение – обильным потоотделением.

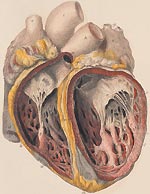
Поражение сердца является основным в клинике инфекционного эндокардита. Оно формируется в течение 2 – 3 месяцев от начала болезни. Поражаются все слои органа: эндокард, миокард, реже перикард.
Поражение эндокарда прежде всего вызывает патологию клапанов сердца. Отмечается изменение аускультативной картины: появляются шумы, патологические тоны. Постепенно возникают признаки клапанной недостаточности.При поражении аортального и митрального клапанов возникает недостаточность по малому кругу кровообращения. Она связана с застоем крови в легких и проявляется одышкой при минимальной нагрузке и в покое, в том числе в положении лежа, кровохарканьем и другими симптомами. Поражение клапанов правой половины сердца (трехстворчатого, клапана легочной артерии) приводит к развитию признаков застоя в большом круге кровообращения: увеличению печени, отекам, асциту и так далее.
Миокардит проявляется усиливающейся одышкой, нарушениями сердечного ритма, появлением тяжелой недостаточности кровообращения, плохо поддающейся медикаментозному лечению. Отмечаются такие тяжелые аритмии, как фибрилляция и трепетание предсердий, пароксизмальная желудочковая тахикардия, атриовентрикулярные блокады высокой степени и другие.
Более редко при инфекционном эндокардите возникает инфаркт миокарда. Он связан с закупоркой коронарного сосуда оторвавшимся фрагментом вегетации. Инфаркт миокарда часто имеет типичную клинику, но в некоторых случаях имеет затяжное или малосимптомное течение.
Перикардит при инфекционном эндокардите имеет чаще всего токсико-аллергическую природу, носит сухой характер, проявляется интенсивной болью в области сердца, сопровождается типичными изменениями аускультативной картины и электрокардиограммы.
Инфекционный эндокардит характеризуется полисиндромностью.
При поражении мелких сосудов возникают капилляриты, сопровождающиеся появлением петехиальной сыпи. Могут возникать артерииты и флебиты с соответствующей клиникой. Закупорка сосуда (тромбоз) приводит к инфарктам внутренних органов.
Инфаркт селезенки проявляется сильной болью в левом подреберье и поясничной области, с иррадиацией в левое плечо. Тромбоэмболия почечных сосудов сопровождается интенсивной болью в пояснице, иррадиирующей в паховую область. Возникают расстройства мочеиспускания, появляется примесь крови в моче (макрогематурия).
Тромбоэмболия легочной артерии сопровождается сильной болью в грудной клетке, одышкой, кровохарканьем. Тромбоэмболии мелких ветвей могут проявляться эпизодами усиливающейся одышки или непостоянными, но повторяющимися болями в груди. Иногда возникают абсцессы легких с соответствующей клиникой.
Тромбоэмболия мозговых сосудов сопровождается либо преходящими нарушениями мозгового кровообращения, либо тяжелыми инсультами с развитием парезов и параличей. Возможно формирование абсцесса мозга, приводящее к смертельному исходу.
В артериях формируются микотические аневризмы, связанные с воспалением стенок сосудов и их расширением. Микотическая аневризма аорты проявляется болью, нарушением кровотока в конечностях, абдоминальным синдромом. Аневризмы сосудов брыжейки сопровождаются болью в животе, кишечными кровотечениями, некрозом стенки кишечника. Аневризмы мозговых сосудов характеризуются развитием неврологической симптоматики.
Поражение почек проявляется их инфарктом или нефритом. Нефриты сопровождаются изменениями в анализе мочи. Может развиться нефротический синдром с отеками, протеинурией и артериальной гипертензией. Часто возникает почечная недостаточность, нередко определяющая прогноз заболевания.
Поражение селезенки может сопровождаться ее инфарктом с появлением острой боли в животе, а также гиперспленизмом с развитием анемии, кровоточивости, снижения иммунитета вследствие лейкопении.
Поражения печени чаще проявляются длительными гепатитами без существенного нарушения функции органа. Характерны тяжесть в правом подреберье и увеличение печени.
Поражения желудка, кишечника, поджелудочной железы бывают редко. Они проявляются в основном диспепсией (болью и нарушением пищеварения). При развитии инфаркта кишечника или острого панкреатита возникает абдоминальный синдром, требующий немедленной консультации хирурга.
Иногда возникают поражения нервной системы в виде энцефалита, менингита, абсцесса мозга. В более легких случаях больные жалуются на головные боли, нарушения сна, снижение настроения.
Диагностика
Назначается общий и биохимический анализ крови, неоднократное бактериологическое исследование с определением вида возбудителя и его чувствительности к антибиотикам.
Очень помогает в диагностике болезни ультразвуковое исследование сердца. Оно определяет пораженный клапан, уточняет степень тяжести и распространенность процесса, описывает функцию сократимости миокарда.
Лечение

Чем раньше начато лечение, тем больше шансов на его успех. Проводится оно в условиях стационара, продолжается длительное время.
Основа лечения инфекционного эндокардита – антибиотикотерапия. Применяются антибиотики бактерицидного действия, вводятся они парентерально, не менее 4 – 6 недель, до получения стойкого эффекта. Используются следующие основные группы: ингибитор-защищенные пенициллины, цефалоспорины, тиенамициды, аминогликозиды, фторхинолоны, хинолоны и некоторые другие. Часто используется комбинация антибиотиков разных групп. Назначаются эти препараты с учетом чувствительности выделенного возбудителя. При грибковом и вирусном эндокардите используются соответствующие противогрибковые и противовирусные средства.
При неэффективности антибиотикотерапии рассматриваются показания для хирургического лечения. К таким показаниям относятся:
- сохранение лихорадки и продолжающееся выделение возбудителя из крови (положительная гемокультура) в течение 2 недель адекватной антибиотикотерапии;
- прогрессирующая недостаточность кровообращения при рациональной антибиотикотерапии;
- нарушение функции протеза у больных с эндокардитом протезированного клапана;
- эмболии периферических сосудов.
При развитии иммунных нарушений (миокардита, нефрита, васкулита) необходимо назначение глюкокортикостероидов
.
Применяются антикоагулянты прямого действия во всех случаях, кроме грибкового эндокардита.
При развитии недостаточности кровообращения ее лечение проводится по принятым схемам, включающим периферические вазодилататоры, диуретики, ингибиторы ангиотензинпревращающего фермента. При нарушениях ритма назначают антиаритмические препараты.
Профилактика
Первичная профилактика подразумевает санацию очагов хронических инфекций, общеукрепляющие и оздоровительные мероприятия. Специальные профилактические мероприятия проводятся у больных с повышенным риском развития инфекционного эндокардита. К ним относятся пациенты:
- с протезированными клапанами сердца;
- с врожденными и приобретенными пороками сердца;
- перенесшие ранее инфекционный эндокардит;
- с идиопатическим гипертрофическим субаортальным стенозом;
- находящиеся на хроническом гемодиализе;
- с имплантированным кардиостимулятором;
- после аорто-коронарного шунтирования;
- наркоманы.
Лицам из группы риска необходима специальная медикаментозная подготовка при проведении следующих манипуляций:
- стоматологические;
- тонзиллэктомия;
- любые вмешательства на слизистой верхних дыхательных путей;
- бронхоскопия;
- вскрытие любых гнойных очагов;
- любые лечебно-диагностические вмешательства на органах желудочно-кишечного тракта и мочеполовой системы;
- неосложненные роды, прерывание беременности, кесарево сечение.
Для профилактики используют схемы с применением пенициллинов, цефалоспоринов, макролидов.
Инфекционный (бактериальный) эндокардит. Видеопрезентация.
[youtube.player]Инфекционный эндокардит (ИЭ) относится к числу тяжелых заболеваний с высоким уровнем летальности. В отсутствии лечения смертность при ИЭ составляет 100%. В последние годы отмечается значительный рост числа больных эндокардитом в нашей стране и за рубеж
Инфекционный эндокардит (ИЭ) относится к числу тяжелых заболеваний с высоким уровнем летальности. В отсутствии лечения смертность при ИЭ составляет 100%. В последние годы отмечается значительный рост числа больных эндокардитом в нашей стране и за рубежом. По данным различных авторов, сегодня выросла заболеваемость в пожилом и старческом возрасте, а также среди лиц в возрасте до 30 лет, использующих внутривенное введение наркотиков [1, 2].
Известно, что ИЭ представляет собой заболевание инфекционной природы с первичной локализацией возбудителя на клапанах сердца, пристеночном эндокарде, протекающее с проявлениями системной инфекции, сосудистыми осложнениями и иммунной реакцией [3, 4, 5].
В данной работе обобщен опыт диагностики и ведения больных ИЭ на базе общетерапевтического отделения Александровской больницы Санкт-Петербурга за период 1998–2003 гг. Диагностика заболевания осуществлялась в соответствии с критериями Duke [8]. Диагноз ИЭ оценивался как достоверный при наличии двух главных критериев, а именно:
- при выделении типичного для ИЭ возбудителя при посевах крови больного;
- при определении эхокардиографических признаков поражения эндокарда - подвижные вегетации на клапанах сердца, абсцессов в области протеза клапана; образования внутрисердечных фистул и др., в сочетании с тремя или/и пятью вспомогательными критериями, к которым относились сосудистые осложнения (эмболии крупных артерий, септические инфаркты легких, внутричерепные кровоизлияния и др.), иммунологические феномены (гломерулонефрит, узелки Ослера, геморрагический васкулит и др.), а также фебрильная лихорадка, гепато-спленомегалия и другие проявления системной инфекции.
Нами было проведено обследование 105 больных ИЭ, из них у 80 человек в возрасте от 18 до 30 лет (первая группа) основным фактором риска заболевания являлась инъекционная наркомания.
Во второй группе больных (25 чел.) основными предрасполагающими факторами развития ИЭ были врожденные и приобретенные пороки сердца, а также протезированные клапаны.
У лиц старшей возрастной группы дополнительным фактором риска являлись дегенеративно-дистрофические изменения клапанов сердца.
Взаимосвязь характера поражения клапанов сердца и факторов риска ИЭ представлена в таблице 1.
По данным эхокардиографического исследования, у 100% больных первой группы были выявлены подвижные вегетации на створках трикуспидального клапана (ТК), что сопровождалось формированием его недостаточности I—III степени.
Во второй группе больных ИЭ отмечалось поражение левых камер сердца с образованием вегетаций на створках аортального и митрального клапанов. Изолированное поражение митрального клапана наблюдалось у двух человек с ревматическим пороком сердца (митральный стеноз), у одной больной с врожденным дефектом межжелудочковой перегородки и в единственном случае обструктивной формы гипертрофической кардиомиопатии.
Среди лиц пожилого и старческого возраста у девяти человек (36%) определялось изолированное поражение аортального клапана в отсутствии признаков аортального стеноза. Наряду с этим, у пяти больных (20%) в возрасте от 72 до 87 лет ИЭ развился на фоне аортального порока атеросклеротического генеза, причем у всех пятерых было выявлено сочетанное поражение аортального и митрального клапанов. Дегенеративно-дистрофические изменения других клапанов сердца определялись у 100% больных старшей возрастной группы.
Образование вегетаций на створках аортального клапана наблюдалось у двух больных с третичной формой сифилиса на фоне имеющегося аортального порока, связанного со специфическим процессом в аорте.
В двух случаях мы наблюдали развитие эндокардита протезированных клапанов.
При сопоставлении результатов посевов крови в двух группах больных определялись существенные различия как в частоте выделения микробной флоры, так и в видовом составе возбудителей эндокардита. По нашим данным, возбудителем ИЭ у больных-наркоманов в 71,3% наблюдений (57 чел.) являлся золотистый стафилококк, тогда как во второй группе, наряду с кокковой флорой, чаще обнаруживались грамотрицательные микроорганизмы (28%). Отрицательные результаты посевов крови значительно реже наблюдались в первой, чем во второй, группе больных ИЭ: 18,7% и 56% — соответственно. Данные относительно этиологической структуры ИЭ в обследуемых группах больных представлены в таблице 2.
Клиническое течение и характер осложнений инфекционного эндокардита во многом зависят от локализации клапанных вегетаций — в правых или левых камерах сердца, а также степени вирулентности возбудителя заболевания.
Течение ИЭ у больных-наркоманов отличалось особой тяжестью и полисиндромностью. Причиной госпитализации у большинства больных были острые осложнения основного заболевания. Значительная часть больных поступала в реанимационное отделение стационара с клиническими симптомами одно- или двухсторонней многофокусной пневмонии, причиной которой являлась септическая тромбоэмболия ветвей легочной артерии (72% больных). Течение пневмонии сопровождалось тяжелой дыхательной недостаточностью, нередко с развитием респираторного дистресс-синдрома (РДСВ) и очагами деструкции в легких (12%). Проявления вторичной нефропатии, которые обнаруживались у 100% больных в первой группе, иногда ошибочно трактовались как обострение хронического гломеруло- или пиелонефрита, мочекаменной болезни, что служило поводом для госпитализации этих больных в урологическое и нефрологическое отделения.
Во второй группе больных основной причиной госпитализации была длительная фебрильная лихорадка в сочетании с анемией и гепатолиенальным синдромом. Наряду с этим, у пяти человек (20%) поводом для госпитализации послужила прогрессирующая сердечная недостаточность.
Основные клинические синдромы, наблюдаемые у больных ИЭ первой и второй групп, представлены в таблице 3.
По нашим наблюдениям, характерной особенностью клинического течения ИЭ у больных-наркоманов являлась высокая частота септической ТЭЛА с формированием множественных очагов инфильтрации в легких. У многих больных легочные тромбоэмболии носили рецидивирующий характер (31,3% больных) и нередко осложнялись развитием деструктивных очагов в легких.
Образование вегетаций у 100% больных первой группы сопровождалось недостаточностью трехстворчатого клапана I—III степени с формированием потоков регургитации. Вместе с тем, у большинства пациентов не определялось тяжелых нарушений центральной гемодинамики, связанных с дисфункцией ТК. В данной группе больных характерной клинической особенностью был обратимый характер нарушений гемодинамики на фоне проводимой терапии. Острая сердечная недостаточность с дилятацией полостей сердца и снижением фракции выброса до 40% и ниже наблюдалась у 28 больных (35,3%) в связи с присоединением острого миокардита или на фоне сочетанного поражения клапанов сердца.
Вторичная нефропатия являлась одним из самых распространенных синдромов в первой группе больных ИЭ. Острая почечная недостаточность наблюдалась у 16 больных, причем у 10 из них она носила обратимый характер и была связана с острым ДВС-синдромом, а также с острой сердечной недостаточностью с отеками. Инфекционно-токсическая нефропатия регистрировалась в 73,8% наблюдений и сопровождалась мочевым синдромом — гематурией, протеинурией, лейкоцитурией — при достаточном уровне клубочковой фильтрации.
Характерной особенностью ИЭ во второй группе было подострое течение заболевания с длительным периодом лихорадки на догоспитальном этапе, причем в пожилом и старческом возрасте лихорадка носила субфебрильный характер с редкими подъемами температуры до фебрильных цифр.
Большинство больных подострым инфекционным эндокардитом (ПИЭ) поступали в стационар в стадии развернутой клинической картины заболевания с клиническими признаками тромбоэмболии сосудов большого круга кровообращения. В данной группе больных наиболее распространенными следует признать такие осложнения, как церебральные эмболии с развитием ишемических и геморрагических инсультов, эмболии почечных сосудов с болевым синдромом и гематурией, а также формирование острых очаговых изменений в миокарде, связанных с эмболией коронарных сосудов или прикрытием устьев коронарных артерий вегетациями [9].
Септические тромбоэмболии церебральных сосудов нередко сопровождались развитием гнойного менингоэнцефалита с летальным исходом. Вместе с тем, при посевах крови у 56% больных второй группы не получено роста микробной флоры. Обращает на себя внимание тот факт, что септицемия у больных с положительными результатами посевов крови в 28% наблюдений была обусловлена грамотрицательной микрофлорой. В этой категории больных источником бактериемии являлись очаги хронической инфекции в мочеполовой системе, а у двух больных (по данным аутопсии) был выявлен двухсторонний апостематозный нефрит.
У значительного числа больных ПИЭ (62%) определялись признаки острой недостаточности кровообращения с застойными хрипами в легких, легочной гипертензией, увеличением полостей сердца и периферическими отеками.
В этой группе больных чаще, чем в первой, наблюдалась преренальная азотемия и ОПН, связанные с развитием острой недостаточности кровообращения.
Острый диффузный миокардит, типичными проявлениями которого были различные нарушения ритма, диагностирован у 27% больных второй группы.
Анемия со снижением уровня гемоглобина до 80 г/л и менее выявлена у 100% больных второй группы. Значительное увеличение СОЭ (более 45 мм/ч) наблюдалось у 85,8% больных подострым ИЭ.
Кожные изменения в виде геморрагических высыпаний, пурпуры Шенлейн-Геноха, а также другие проявления иммунного воспаления в обеих группах больных встречались нечасто — 6,3 и 4% в первой и второй группах, соответственно.
Консервативная терапия больных ИЭ проводилось с использованием антибиотиков широкого спектра действия в сочетании со средствами дезинтоксикационной, антикоагулянтной и метаболической терапии. В составе антибактериальной терапии больные получали цефалоспорины III-IV поколений в комбинации с аминогликозидами и метронидазолом. Из группы цефалоспоринов назначались: цефтриаксон (лонгацеф) 2 г в сутки внутривенно (в/в), или цефотаксим (тальцеф) 2 г в сутки в/в, или цефепим (максипим) 2 г в сутки в/в в сочетании с аминогликозидами (амикацин в суточной дозе 1,5 г в/в) и метронидазолом по 1,5-2 г в сутки в/в. В случае, если такая терапия оказывалась неэффективной или существовали противопоказания к вышеперечисленным препаратам, применялись антибиотики группы линкозаминов: клиндамицин 1,2 г в сутки в/в или линкомицин 3 г в сутки в/в в сочетании со фторхинолонами (ципрофлоксацин 400 мг в сутки в/в). В условиях отделения реанимации в течение пяти–семи дней проводилась терапия имипинемом (тиенамом) в дозе 2—4 г в сутки в/в или рифампицином в суточной дозе 0,45—0,6 г в/в. Средняя продолжительность курса антибиотикотерапии в обследуемой группе больных составила 28 + 3,5 дней.
Дезинтоксикационная терапия включала в себя внутривенные инфузии реополиглюкина, гемодеза, поляризующих смесей в сочетании с петлевыми диуретиками. Объем вводимой жидкости составлял в среднем 2-2,5 л в сутки. В течение всего периода инфузионной терапии осуществлялся контроль за функциональным состоянием почек, электролитным составом крови, суточным диурезом. В условиях отделения реанимации у всех больных осуществлялся мониторинг ЦВД. Инфузионная терапия проводилась в течение всего острого периода заболевания до купирования проявлений интоксикационного синдрома. Средняя продолжительность курса составила 22 + 4,5 дня.
Развитие легочной эмболии, особенно в сочетании с признаками острого ДВС-синдрома в стадии гиперкоагуляции, служило основанием для назначения антикоагулянтной терапии. Начальная доза гепарина составляла 10 тыс. ЕД внутривенно, струйно, за-тем — по 1000 ЕД в час внутривенно, капельно с переходом на подкожное введение до 30 тыс. ЕД в сутки. Введение гепарина осуществлялось под контролем показателей коагулограммы и времени свертывания крови. Одновременно проводились внутривенные трансфузии свежезамороженной плазмы по 300 мл в сутки с добавлением 2500–5000 ЕД гепарина. Анемия тяжелой степени (Нb менее 80 г/л, Ht ≤25) корригировалась переливаниями эритроцитарной массы (пять–семь доз). При наличии гипопротеинемии использовалось введение растворов аминокислот, альбумина или нативной плазмы. Выявление клинических и рентгенологических признаков отека легких на фоне рецидивирующего течения септической ТЭЛА служило показанием для назначения кортикостероидов (преднизолон от 120 до 200 мг в сутки внутривенно капельно). Терапия антикоагулянтами прямого действия в сочетании с трансфузиями криоплазмы проводилась до стойкого улучшения показателей гемостаза. Критериями нормокоагуляции являлись уровень фибриногена в плазме 3-4 г/л, отсутствие тромбоцитопении, нормализация ВСК, АЧТВ, тромбинового времени, а также отрицательные паракоагуляционные тесты. По нашим данным, купирование проявлений острого ДВС-синдрома на стадии гиперкоагуляции у 75% больных отмечалось на седьмой–десятый день от начала комплексной терапии.
У части больных формировалась резистентность к проводимой антибактериальной терапии, которая характеризовалась нарастанием интоксикации, фебрильной лихорадкой, прогрессирующей анемией, а также высевами из крови возбудителя ИЭ – золотистого стафилококка — в 65% наблюдений. При рентгенологическом обследовании данной категории больных с большой частотой определялись очаги деструкции легочной ткани, а у трех больных гнойный выпот в плевральной полости.
Длительное применение антибиотиков широкого спектра действия у 70,3% больных (38 чел.) сопровождалось развитием побочных эффектов антибактериальной терапии. Кандидоз полости рта глотки, пищевода, а также кишечный дисбактериоз III-IV стадии был выявлен у 36 больных (66,7%). Применение антибиотиков с гепатотоксическими свойствами (цефалоспорины, линкозамины, метронидазол) у двух больных (3,7%) с хроническим гепатитом С и В приводило к прогрессированию печеночной недостаточности, которая сопровождалась высокой ферментемией (АЛТ 1500 ЕД, АСТ 1000 ЕД) и желтухой.
Развитие застойной сердечной недостаточности с появлением акроцианоза, влажных хрипов в базальных отделах легких, периферических отеков в сочетании с кардиомегалией и падением фракции выброса до 50—45% наблюдалось у пяти больных (9,3%) на фоне массивной инфузионной терапии.
Длительная антикоагулянтная терапия в 20,4% (11 чел.) наблюдений сопровождалась повышением толерантности плазмы к гепарину, что клинически выражалось в развитии периферических флеботромбозов, в то время как гепарининдуцированной тромбоцитопении в обследуемой группе больных мы не наблюдали.
Положительные результаты консервативной терапии были получены у 70,2% больных (56 чел.) с поражением ТК и лишь у 32% пациентов (6 чел.) из второй группы. Исходом ИЭ в обеих группах больных являлось формирование недостаточности клапанов сердца.
Госпитальная летальность при ИЭ у наркозависимых лиц составила 29,4% (24 чел.), тогда как у больных с поражением левых камер сердца (вторая группа) уровень смертности составил 68% (19 чел.).
По данным аутопсии, основными причинами смерти больных ИЭ были:
- септикопиемия с формированием гнойных очагов в печени, почках селезенке, головном мозге с развитием полиорганной недостаточности (46,2%);
- сердечная недостаточность на фоне полипозно-язвенного эндокардита с разрушением клапанов сердца, а также острый миокардит с дилятацией полостей сердца (39,4%);
- вторичная нефропатия с развитием почечной недостаточности, отеком легких, отеком головного мозга (14,4%).
Таким образом, характерные особенности ИЭ у лиц с наркотической зависимостью — это острое течение заболевания с поражением правых камер сердца и рецидивами септической ТЭЛА. Возбудителем ИЭ у инъекционных наркоманов в 71,3% является высоковирулентный золотистый стафилококк. Формирование недостаточности трехстворчатого клапана I—III степени стало самым распределенным осложнением ИЭ у наркоманов. При этом у большинства больных не наблюдается тяжелых нарушений центральной гемодинамики, приводящих к развитию острой недостаточности кровообращения.
Подострый ИЭ у больных с предрасполагающими заболеваниями сердца, а также у лиц пожилого и старческого возраста протекает с преимущественным поражением левых камер сердца, причем в старшей возрастной группе преобладает моноклапанное поражение. Наличие сопутствующей патологии у лиц старше 60 лет маскирует течение основного заболевания, чем и обусловлены поздняя диагностика и высокая смертность больных. Для затяжного течения ИЭ характерна низкая высеваемость возбудителя, по сравнению с острыми формами заболевания. Развитие тромбоэмболий сосудов большого круга кровообращения является характерной клинической особенностью подострого ИЭ.
Положительный эффект от проводимой консервативной терапии наблюдается у большинства больных ИЭ с поражением ТК, тогда как при подостром эндокардите левых камер сердца консервативная терапия является малоэффективной у большинства больных.
Госпитальная летальность в обеих группах больных обусловлена диссеминацией возбудителя с формированием гнойных очагов и полиорганной недостаточностью, а также развитием острой недостаточности кровообращения и вторичной нефропатии.
- Буткевич О. М., Виноградова Т. Л. Инфекционный эндокардит. - М., 1997.
- Симоненко В. Б., Колесников С. А. Инфекционный эндокардит: современное течение, диагностика, принципы лечения и профилактики. - Клин. мед., 1999. - 3. - С. 44-49.
- Тазина С. Я., Гуревич М. А. Современный инфекционный эндокардит. - Клин. мед.,1999. - 12. - С. 19-23.
- Bansal R. C. Infective endocarditis. Med Clin North America 1995; 79 (5): 1205-1239.
- Bayer A. S., Bolger A. F., Taubert K. A. et al. Diagnosis and management of infective endocarditis and its complications. Circulation 1998; 98: 2936-2948.
- McKinsey D. S., Ratts T. E., Bisno A. I. Underlying cardiac lesions in adults with infective endocarditis. The changing spectrum. Amer J Med 1987; 82: 681-688.
- Lamas C. C. Eykyn S. J. Suggested modifications to the Duke criteria for the clinical diagnosis of native valve and prosthetic valve endocarditis: analysis of 118 pathologically proven cases. Clin Infect Dis 1997; 25: 713-719.
- Durack D. T., Lukes A. S., Bright D. K. et al. New criteria for diagnosis of Infective Endocarditis Utilization of Specific Echocardiographic Finding. Amer J Med 1994; 96: 200-209.
- Тюрин В. П., Дубинина С. В. Инфекционный эндокардит у лиц пожилого и старческого возраста. - Клин. мед., 2000. - 4. - С. 53-56.
В. И. Уланова
В. И. Мазуров, доктор медицинских наук, профессор
Медицинская академия последипломного образования, Санкт-Петербург
Читайте также:


