Как принимать преднизолон при красной волчанке
Н.С. Подчерняева
Программа лечения клинических вариантов системной красной волчанки у детей
Московская медицинская академия им. И.М. Сеченова
Системная красная волчанка (СКВ) — одно из наиболее тяжелых и часто встречающихся заболеваний из группы диффузных болезней соединительной ткани, при котором вследствие образования широкого спектра аутоантител к клеткам и их компонентам и развития иммунного воспаления поражаются многие системы и органы.
Цель лечения больных с СКВ заключается в подавлении активности воспалительного процесса, индукции и поддержании клинико-лабораторной ремиссии, предупреждении рецидивов. Конечным итогом терапии должно быть улучшение качества жизни больного и прогноза заболевания.
Основные принципы лечения детей с СКВ следующие:
1) индивидуальный подход при выборе наиболее рациональной схемы лечения с учетом клинических проявлений, степени активности и характера течения заболевания, а также конституциональных особенностей и ответа организма ребенка на лечение;
2) соблюдение последовательности применения всех компонентов выбранной для лечения терапевтической схемы (программы);
3) своевременный переход от интенсивной к поддерживающей иммуносупрессивной терапии;
4) постоянный контроль за эффективностью и безопасностью проводимой терапии;
5) длительность и непрерывность лечения;
Предлагаемая программа — результат обобщения многолетнего опыта лечения более 600 больных в возрасте от 4 до 15 лет с различными клиническими вариантами СКВ, наблюдавшихся в специализиро ванном отделении клиники детских болезней ММА им. И.М. Сеченова за период с 1961 по 1999 г.
Этиология СКВ окончательно не установлена, поэтому терапия должна быть в первую очередь патогенетической.
Основные группы препаратов и методы патогенетической терапии СКВ
Глюкокортикостероиды (ГКС; преднизолон, метипред) остаются препаратами первого ряда, используемыми при СКВ. Дозу препарата и способ его введения определяют в зависимости от тяжести состояния больного, ведущих клинических синдромов и активности заболевания. При низкой (I степень) активности процесса доза преднизолона для перорального применения составляет 0,3—0,5 мг/кг/сут; при умеренной (II степень) — 0,7—1 мг/кг/сут; при высокой (III степень) активности и во время кризов — 1—1,5 мг/кг/сут (но не более 65—70 мг/сут).
Лечение с применением максимальной подавляющей дозы преднизолона продолжают в течение 4— 8 нед, при снижении активности заболевания ее постепенно уменьшают вначале на 5 мг, затем на 2,5 мг в неделю, а в последующем на 2,5 мг в 2—4 нед, так чтобы через 6—9 мес от начала лечения снизить дозу до поддерживающей, которую определяют индивидуально. В первые 2—3 года после начала болезни поддерживающая доза преднизолона не должна составлять менее 12,5—15 мг/сут.
При необходимости более активного лечения, например при тяжелом полиорганном поражении или волчаночном кризе, применяют пульс-терапию (ПТ) — внутривенное введение больших доз метилпред низолона (МП) из расчета 10—15 мг/кг/сут (но не более 1000 мг/сут) обычно в течение 3 дней.
Побочные эффекты ГКС: ожирение, образование striae atrophicae, развитие артериальной гипертонии, остеопороза, гиперлипидемии, пептических язв, задержка роста, катаракта, нарушение толерантности к глюкозе.
Цитотоксические иммунодепрессанты (ЦИ). В целях более быстрого достижения лечебного эффекта и с учетом тяжести побочных проявлений применения ГКС в лечении СКВ у детей широко используют ЦИ. Показания к их назначению следующие: 1) высокая или кризовая активность СКВ; 2) наличие выраженного нефрита; 3) тяжелое поражение ЦНС; 4) отсутствие явного эффекта от предшествующей терапии; 5) необходимость уменьшить дозу ГКС или невозможность ее повысить из-за побочного действия препаратов данного класса; 6) нестойкость ремиссии и частые рецидивы заболевания.
Препаратом выбора для лечения волчаночного нефрита и тяжелых полиорганных форм СКВ является циклофосфамид (ЦФ), а методом его введения — пульс-терапия, позволяющая уменьшить частоту осложнений по сравнению с ежедневным пероральным приемом препаратов.
При интермиттирующей пульс-терапии (ИПТ) ЦФ сверхвысокие дозы препарата вводят внутривен но периодически. ЦФ в дозе 15—20 мг/кг (но не более 1000 мг) вводят вначале 1 раз в месяц в течение 6—12 мес до достижения ремиссии, а затем 1 раз в 3 мес еще в течение 6—12 мес. В течение первого месяца лечения предпочтительно вводить ЦФ дробно (1 раз в 2 нед или 1 раз в неделю), разделяя указанные дозы на 2—4 приема. При нарушении функции почек дозу препарата необходимо уменьшить. Общая продолжительность ИПТ ЦФ должна составлять не менее 18 мес.
Побочные эффекты ЦФ: лейкопения, тромбоцитопения, алопеция, диспептические проявления (тошнота, рвота, диарея, боли в животе), развитие инфекционных осложнений, редко — геморрагический цистит.
Ввиду того, что влияние ЦФ и ГКС на механизмы иммунного воспаления различно, на начальном этапе лечения (в течение 1—1,5 мес) патогенетически оправдана комбинация пульс-тера пии ЦФ с пульс-терапией МП, а в последующем — длительное использование монотерапии ЦФ в сочетании с ежедневной базисной терапией ГКС. Пульс-терапия ЦФ и МП позволяет добиться значительного улучшения или ремиссии в более короткие сроки при одновременном использовании относительно меньших доз преднизолона, принимаемого перорально.
При наиболее тяжелых вариантах СКВ, осложняющихся развитием волчаночного криза (почечного или полиорганного), или резистентности к традиционной терапии, в схемы лечения включают плазмаферез (ПФ), синхронизируя его проведение с пульс-терапией ЦФ. Применение ПФ направлено на удаление из крови циркулирующих иммунных комплексов (ЦИК), криопреципитинов, различных антител, медиаторов воспаления, продуктов метаболизма и др. При плазмаферезе активируется эндогенный фагоцитоз ЦИК, в результате чего уменьшается выраженность поражений различных органов, повышается чувствительность рецепторов клеток к воздействию иммунодепрессантов.
Схема синхронной терапии — одновременного применения ПФ и пульс-терапии ЦФ (или ЦФ и МП) љ— состоит из трех сеансов ПФ (забор крови из общего расчета 10—15 мл/кг), осуществляемых в 1-й, 2-й и 3-й дни лечения; через 6 ч после третьего сеанса ПФ проводят пульс-терапию ЦФ (или ЦФ и МП), которую повторяют в 4-й и 5-й дни лечения. Доза ЦФ должна составлять 10—12 мг/кг массы тела больного (при уровне креатинина более 0,400 ммоль/л дозу ЦФ следует уменьшать вдвое).
Азатиоприн менее эффективен при лечении волчаночного нефрита, его используют при выраженном и распространенном поражении кожи, а также для снижения дозы ГКС. Азатиоприн назначают перорально в дозе 2,0 мг/кг/сут в течение 1,5—2 мес, а затем дозу уменьшают до поддерживающей 0,5—1 мг/кг/сут), которую при хорошей переносимости препарата рекомендуется принимать в течение многих месяцев.
Побочные эффекты азатиоприна: лейкопения, диспептические проявления, развитие инфекционных осложнений.
Препараты группы аминохинолинов (плаквенил, делагил) применяют при хронической СКВ с низкой активностью или при снижении доз ГКС для поддержания ремиссии. Плаквенил назначают в дозе 0,1—0,4 г/сут, а делагил — в дозе 0,125—0,25 г/сут в течение длительного времени.
Побочные эффекты: диспептические проявления, высыпания на коже, офтальмологические осложнения, нарушение пигментации кожи, волос и ногтей, редко лейкопения.
Антикоагулянты и антиагреганты широко используют при лечении волчаночного нефрита и СКВ с проявлениями тромботической ангиопатии. При нефрите лечение проводят вначале гепарином (в дозе 200—300 ЕД/кг в сутки и более под контролем показателей коагулограммы и времени свертывания крови) в течение 4—6 нед, а затем антикоагулянтами непрямого действия (синкумар, фенилин).
Для профилактики тромбозов назначают антикоагулянты непрямого действия или антиагреганты (курантил в дозе 75—200 мг/сут, аспирин в дозе 50—100 мг/сут).
Иммуноглобулины для внутривенного применения (ИГВВ; ИмБИО, пентаглобин, интраглобин, биавен) показаны при высокой активности и во время кризов (в частности при гематологических кризах) и/или возникновении инфекционных осложнений. ИГВВ назначают в курсовой дозе 0,5—2,0 г/кг массы тела. Эту дозу вводят в 2—3 приема в течение 2—3 последовательных дней или через день, в дальнейшем — по показаниям ежемесячно в меньшей дозе.
Схемы лечения при различных клинических вариантах СКВ
СКВ отличается чрезвычайным многообразием клинических проявлений и вариабельностью характера течения и может быть представлена как одним доминирующим синдромом, так и поражениями многих органов (так называемые полиорганные варианты).
Преимущественно кожный вариант хронического течения и низкой активности СКВ: преднизолон в небольших дозах в сочетании с препаратами группы аминохинолинов.
Преимущественно суставной и кожно-суставной варианты: преднизолон в средних дозах в сочетании с препаратами группы аминохинолинов; при недостаточном эффекте необходимо добавлять азатиоприн.
Хроническая СКВ с ведущим синдромом Рейно: низкие дозы ГКС в комбинации с препаратами группы аминохинолинов, антиагрегантами и вазодилататорами.
Моносиндромный вариант, представленный тромбоцитопенической пурпурой: ГКС в средних и больших дозах, ИГВВ; при тромбоцитопеническом кризе — пульс-терапия МП; при резистентности к стероидам — ИПТ ЦФ.
Полиорганные варианты без поражения почек или ЦНС: ГКС в больших дозах.
Полиорганные варианты с поражением ЦНС: ГКС в больших дозах в комбинации с ИПТ ЦФ:
Волчаночный нефрит выраженной формы: применяют 4-компонентную схему (пероральный прием ГКС; интермиттирующая пульс-терапия ЦФ; гепарин; антиагреганты).
Волчаночный криз (моно- или полиорганный): большие дозы ГКС, одновременное применение ПФ с пульс-терапией ЦФ и МП (в дальнейшем — пульс-терапия ЦФ в интермиттирующем режиме), ИГВВ, антикоагулянты и антиагреганты (исключение составляет гематологический криз, при котором проведение ПФ сопряжено с возможным развитием осложнений).
Вариант СКВ с тромботической ангиопатией: средние дозы ГКС в сочетании с длительной антикоагулянтной и антиагрегантной терапией, при высокой активности заболевания — с цитостатическими иммунодепрессантами.
Наряду с базисной терапией при лечении СКВ по показаниям используют антибиотики, гипотензивные средства, диуретики, а также препараты, назначаемые для профилактики и лечения остеопороза.
Лечение больных СКВ представляет собой сложную задачу и предполагает наличие у врача определенных знаний и опыта, позволяющих добиться эффекта и избежать развития тяжелых осложнений. Современные методы терапии способствуют достижению ремиссии СКВ у большинства больных и обеспечению достаточно высокого качества жизни.
- 18160
- 14,3
- 4
- 4
Системная красная волчанка — это мультифакторное заболевание, развивающееся на основе генетического несовершенства иммунной системы и характеризующееся выработкой широкого спектра аутоантител к компонентам клеточного ядра. Молекулярно-генетические основы болезни изучены довольно плохо, в связи с чем специфического лечения до сих пор не создано, а в основе проводимой в клинике патогенетической терапии лежат иммунодепрессанты — глюкокортикостероиды и цитостатики. И вот, после более чем 50 лет попыток разработать специфическое лечение волчанки, произошел сдвиг: Управление по контролю за качеством пищевых продуктов и лекарств США официально утвердило в качестве лекарства от волчанки препарат Бенлиста (Benlysta) на основе моноклональных антител, специфически блокирующих B-лимфоцит-стимулирующий белок (BLyS).
Системная красная волчанка (СКВ) — одно из самых распространённых аутоиммуных заболеваний, в основе которого лежит генетически обусловленное комплексное нарушение иммунорегуляторных механизмов. При заболевании происходит образование широкого спектра аутоантител к различным компонентам ядра клеток и формирование иммунных комплексов. Развивающееся в различных органах и тканях иммунное воспаление приводит к обширным поражениям микроциркуляторного кровяного русла и системной дезорганизации соединительной ткани [1], [2].
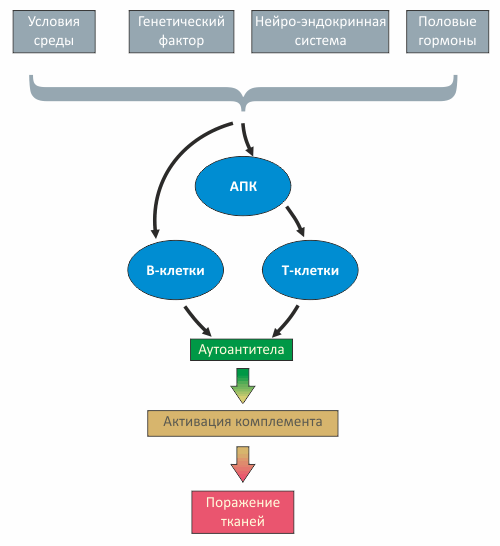
Рисунок 1. Патогенез СКВ
Волчанка во многом связана с нарушениями на уровне пролиферации различных клонов В-клеток, активируемых многочисленными антигенами, в роли которых могут выступать медицинские препараты, бактериальная или вирусная ДНК и даже фосфолипиды мембраны митохондрий. Взаимодействие антигенов с лейкоцитами связано либо с поглощением антигенов антиген-презентирующими клетками (АПК), либо с взаимодействием антигена с антителом на поверхности В-клетки.
В результате поочередной активации то T-, то B-клеток увеличивается продукция антител (в том числе, аутоантител), наступает гипергаммаглобулинемия, образуются иммунные комплексы, чрезмерно и неконтролируемо дифференцируются Т-хелперы. Разнообразные дефекты иммунорегуляции, свойственные СКВ, связаны также с гиперпродукцией цитокинов Th2-типа (IL-2, IL-6, IL-4, IL-10 IL-12).
Одним из ключевых моментов в нарушении иммунной регуляции при СКВ является затрудненное расщепление (клиренс) иммунных комплексов, — возможно, вследствие их недостаточного фагоцитоза, связанного, в частности, с уменьшением экспрессии CR1-рецепторов комплемента на фагоцитах и с функциональными рецепторными дефектами.
Распространённость СКВ колеблется в пределах 4–250 случаев на 100 000 населения; пик заболеваемости приходится на возраст 15–25 лет при соотношении заболевших женщин к мужчинам 18:1. Наиболее часто заболевание развивается у женщин репродуктивного возраста с увеличением риска обострения во время беременности, в послеродовом периоде, а также после инсоляции и вакцинации.
СКВ часто становится причиной инвалидности. В развитых странах в среднем через 3,5 года после постановки диагноза 40% больных СКВ полностью прекращают работать, — в основном, в связи с нейрокогнитивными дисфункциями и повышенной утомляемостью. К потере трудоспособности чаще всего приводят дискоидная волчанка и волчаночный нефрит.
Клинические проявления СКВ чрезвычайно разнообразны: поражение кожи, суставов, мышц, слизистых оболочек, лёгких, сердца, нервной системы и т.д. У одного пациента можно наблюдать различные, сменяющие друг друга варианты течения и активности заболевания; у большинства больных периоды обострения заболевания чередуются с ремиссией. Более чем у половины больных есть признаки поражения почек, сопровождающиеся ухудшением реологических свойств крови [4].
Поскольку молекулярные и генетические механизмы, лежащие в основе заболевания, до сих пор как следует не изучены, специфического лечения волчанки до недавнего времени не существовало. Базисная терапия основана на приёме противовоспалительных препаратов, действие которых направлено на подавление иммунокомплексного воспаления, как в период обострения, так и во время ремиссии. Основными препаратами для лечения СКВ являются:
Для лечения СКВ применяют также препарат моноклональных антител, селективно действующий на CD20 + В-лимфоциты, — ритуксимаб, зарегистрированный FDA для лечения неходжкинской лимфомы. Впрочем, высокая цена этого препарата не позволила ему получить широкого применения при лечении СКВ в нашей стране.
Исследователи, желая специфически блокировать BLyS, сделали ставку на человеческое моноклональное антитело, разработанное совместно с английской биотехнологической фирмой Cambridge Antibody Technology, и названное белимумаб (belimumab). В начале марта 2011 года американское Управление по контролю за качеством пищевых продуктов и лекарственных препаратов (FDA) впервые за 56 лет одобрило препарат, предназначенный для специфического лечения системной красной волчанки. Эти препаратом стал Бенлиста — коммерческое название антитела белимумаба, производством которого уже занимается компания GlaxoSmithKline. До того FDA одобряла для терапии СКВ гидроксихлорохин — лекарство от малярии; было это в 1956 году.
Рисунок 2. Человек, больной системной красной волчанкой (акварель 1902 года кисти Мэйбл Грин). Свое название заболевание получило ещё в средневековье, когда людям казалось, что характерная волчаночная сыпь на переносице напоминает волчьи укусы.
Целенаправленная терапия
Следующие на очереди
Аннотация научной статьи по клинической медицине, автор научной работы — Середавкина Н. В., Смирнов А. В., Дыдыкина И. С., Решетняк Т. М.
Глюкокортикоиды (ГК) являются препаратами первой линии в лечении системной красной волчанки (СКВ) как при высокой, так и при умеренной активности. Это единственные лекарственные средства, способные давать столь быстрый противовоспалительный и иммуносупрессивный эффект при ревматических заболеваниях. Наряду с антималярийными препаратами и иммунодепрессантами ГК используются в стандартной классической схеме лечения СКВ, однако, несмотря на высокую эффективность этих препаратов, связанные с ними непосредственные или отсроченные нежелательные реакции являются одной из главных проблем ведения больного СКВ. Иногда они могут быть более тяжелыми, чем само показание для их назначения, и даже фатальными. В статье приводится описание нежелательных реакций, отмечавшихся у больной СКВ на фоне длительного приема высокой поддерживающей дозы ГК.
Похожие темы научных работ по клинической медицине , автор научной работы — Середавкина Н. В., Смирнов А. В., Дыдыкина И. С., Решетняк Т. М.
Glucocorticoids in the treatment of systemic lupus erythematosus: positive and negative aspects
Glucocorticoids (GCs) are first-line drugs to treat systemic lupus erythematosus (SLE) of both high and moderate activities. These are the only agents that are able to provide so prompt anti-inflammatory and immunosuppressant effects in rheumatic diseases. Along with antimalarials and immunosuppressants, GCs are used in the standard classical treatment regimen for SLE; however, despite the high efficacy of these drugs, their related immediate or delayed adverse reactions are one of the major problems in the management of a patient with SLE. Occasionally, they may be severer than the indication itself for their use and may be even fatal. The paper describes the adverse reactions observed in a female patient with SLE during long-term use of a high maintenance GC dose.
ГЛЮКОКОРТИКОИДЫ В ЛЕЧЕНИИ СИСТЕМНОЙ КРАСНОЙ ВОЛЧАНКИ: ПОЛОЖИТЕЛЬНЫЕ И ОТРИЦАТЕЛЬНЫЕ СТОРОНЫ
Н.В. Середавкина, А.В. Смирнов, И.С. Дыдыкина, Т.М. Решетняк
Контакты: Наталия Валерьевна Середавкина n_seredavkina@mail.ru
Глюкокортикоиды (ГК) являются препаратами первой линии в лечении системной красной волчанки (СКВ) как при высокой, так и при умеренной активности. Это единственные лекарственные средства, способные давать столь быстрый противовоспалительный и иммуносупрессивный эффект при ревматических заболеваниях. Наряду с антималярийными препаратами и иммуно-депрессантами ГК используются в стандартной классической схеме лечения СКВ, однако, несмотря на высокую эффективность этих препаратов, связанные с ними непосредственные или отсроченные нежелательные реакции являются одной из главных проблем ведения больного СКВ. Иногда они могут быть более тяжелыми, чем само показание для их назначения, и даже фатальными. В статье приводится описание нежелательных реакций, отмечавшихся у больной СКВ на фоне длительного приема высокой поддерживающей дозы ГК.
Ключевые слова: глюкокортикоиды, побочные эффекты, системная красная волчанка
GLUCOCORTICOIDS IN THE TREATMENT OF SYSTEMIC LUPUS ERYTHEMATOSUS: POSITIVE AND NEGATIVE ASPECTS
N. V. Seredavkina, A. V. Smirnov, I.S. Dydykina, T.M. Reshetnyak
V.A. Nasonova Research Institute of Rheumatology, Russian Academy of Medical Sciences, Moscow
Glucocorticoids (GCs) are first-line drugs to treat systemic lupus erythematosus (SLE) of both high and moderate activities. These are the only agents that are able to provide so prompt anti-inflammatory and immunosuppressant effects in rheumatic diseases. Along with antimalarials and immunosuppressants, GCs are used in the standard classical treatment regimen for SLE; however, despite the high efficacy of these drugs, their related immediate or delayed adverse reactions are one of the major problems in the management of a patient with SLE. Occasionally, they may be severer than the indication itself for their use and may be even fatal. The paper describes the adverse reactions observed in a female patient with SLE during long-term use of a high maintenance GC dose.
Key words: glucocorticoids, side effects, systemic lupus erythematosus
Системная красная волчанка (СКВ) — хроническое аутоиммунное заболевание, характеризующееся развитием обострений и ремиссий, а также разнообразными клиническими проявлениями, которые могут варьировать от синдрома малых признаков, например усталости, потери веса, артралгий, до угрожающего жизни поражения почек или центральной нервной системы [1].
Продолжительность жизни у современных больных СКВ значительно превышает соответствующие параметры 1950-х годов. В то время 4-летняя выживаемость пациентов составляла только 51 % [2], тогда как в 1990-х годах 15-летняя выживаемость пациентов с СКВ достигла 80-85 %, 20-летняя - 70 % [3, 4]. Переломным моментом в терапии болезни, обеспечившим резкое увеличение продолжительности жизни пациентов, стало внедрение в практику глюкокортико-идов (ГК).
В настоящее время ГК являются препаратами первой линии в лечении СКВ как при высокой, так и при умеренной активности. Это единственные лекарственные средства, способные давать столь быстрый противовоспалительный и иммуносупрессив-ный эффект при ревматических заболеваниях [5, 6]. Однако в процессе клинического применения ГК очень скоро стало очевидным, что их назначение ассоциируется с широким спектром тяжелых нежелательных реакций (НР), и недостаточная осведомленность врачей общей практики относительно выбора адекватной дозы существенно ограничивает их использование в клинической практике [7].
На сегодня назначение ГК наряду с антималярийными препаратами и иммунодепрессантами включено в стандартную схему лечения СКВ. Однако связанные с ГК непосредственные или отсроченные НР являются одной из главных проблем ведения больного СКВ, иногда они могут быть более тяжелыми, чем са-
^ мо показание для их назначения, и даже фатальными ^ [8]. Кроме того, трудности ведения ревматических па" циентов зачастую и в немалой степени обусловлены к недостаточной подготовкой врачей общей практики = по клинической ревматологии.
Приводим описание клинического наблюдения. и Пациентка Ж., 56 лет, впервые поступила в ФГБУ
Ухудшение состояния в конце октября 2006 г. — после инсоляции появился сухой кашель, лихорадка до 40 °С, одышка, боли в грудной клетке. Пациентка была госпитализирована по месту жительства, где выявлен лейкоцитоз с палочкоядерным сдвигом, повышение скорости оседания эритроцитов (СОЭ) (до 60 мм/ч). На компьютерной томографии органов грудной клетки без контрастирования отмечалось уплотнение легочной ткани с полостями распада в правом легком на уровне сегмента 86. Фтизиатрами был исключен туберкулез легких. Тогда же при ультразвуковом дуплексном сканировании (УЗДС) вен нижних конечностей был выявлен тромбоз задних большеберцовых, медиальных суральных, подколенных, поверхностных бедренных, общих бедренных вен с 2 сторон в стадии реканализации. Проводилась терапия антибиотиками широкого спектра действия. Пред-низолон был заменен на метипред, доза ГКбыла увеличена с 2 таблеток (8мг) до 7 (28мг) в сутки, назначен варфарин 5мг/сут. Состояние пациентки улучшилось,
на контрольных томограммах выявлялись фиброзные изменения в сегменте Б6размером 4,5 х 3 см, остаточный участок инфильтрации линейной формы до 1,5см, накапливающий контраст.
Клинические анализы крови и мочи были в пределах нормы.
Иммунологическое исследование крови: антитела к ДНК (аДНК) — 56 (норма (Ы) Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
При поступлении предъявляла жалобы на генерализованную мышечную слабость (садилась в кровати с посторонней помощью, не ходила, не обслуживала себя, не могла поднять руки над головой), боли в спине в покое и при движении, ежедневные эпизоды головокружения при смене положения тела, при наклонах головы назад, множественные синяки на коже ног и туловища и спонтанное их образование.
При осмотре (рисунок) состояние средней тяжести, обусловленное выраженным миопатическим синдромом, гипостеническое телосложение, температура тела 36,7 °С. Артропатия Жаку. Медикаментозный синдром Иценко—Кушинга. Гирсутизм. Множественные гематомы и экхимозы кожи голеней и бедер, липодерматосклероз кожи голеней. Ограничение движений и их болезненность в коленных, голеностопных, плечевых суставах, артрит
Пациентка Ж. Множественные подкожные гематомы, экхимозы и липодерматосклероз кожи голеней (а); вторичная подагра; артрит I плюснефалангового сустава левой стопы; ониходистрофия (б); артропатия Жаку (в); МРТ правого коленного сустава: множественные инфаркты костного мозга (белые стрелки), асептический некроз латеральных мыщелков бедренной и большеберцовой костей (красная стрелка) (г)
Отмечались: анемия (Hb 97—102 г/л), лейкоцитоз (10,5—13,9 х 109/л) с нормальной лейкоцитарной формулой, тромбоцитоз (496—557 х 109/л), повышение СОЭ до 40—44мм/ч, дислипидемия (повышение уровня общего холестерина и триглицеридов), повышение уровня растворимых фибринмономерных комплексов в 2раза. Повышение уровня С-реактивного белка (СРБ) — 30,9 мг/л (N Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
Необратимое повреждение органов — один из важных факторов, определяющих тяжесть течения и летальность при СКВ [9]. Наряду с повреждающим действием самой болезни причиной хронической дисфункции могут также стать препараты, применяемые для ее лечения. Данные об инициирующей дозе ГК в зависимости от активности СКВ носят скорее эмпирический характер, отсутствуют рандомизированные контролируемые исследования по этому поводу, также остается открытым вопрос о сроках приема максимальных доз ГК и темпах их снижения. ГК могут индуцировать остеопороз, остеонекроз, катаракту, диабет и сердечно-сосудистые заболевания, т. е. те проявления, которые имелись в приведенном случае. В некоторых исследованиях изучалось соотношение нарушений, связанных с заболеванием, и НР на ГК [8]. Так, Б. 01аёшап е! а1. приводят результаты проспективного наблюдения 73 больных СКВ. Из них 87,7 % получали ГК, средняя максимальная доза в пересчете на преднизолон составила 37,7 мг/сут. За первый год наблюдения 42 % имевшихся у больных повреждений считались ГК-независимыми (главным образом, повреждения желудочно-кишечного тракта и кожи), 42 % — вероятно связанными с ГК (главным образом,
психоневрологические и сердечно-сосудистые повреждения) и оставшиеся 16 % были определенно связаны с ГК (офтальмологические и костно-мышечные повреждения). К окончанию 15-го года наблюдения только 20 % вновь приобретенных повреждений были не связаны с ГК, в то время как 31 % были возможно и 49 % определенно ассоциированы с ГК [10].
Еще одно исследование с помощью модели пропорциональных рисков Кокса демонстрирует увеличение первичного повреждения на фоне ГК у 539 больных СКВ Хопкинской когорты [11]. За время наблюдения повреждения различных органов были зарегистрированы у 60 % больных. Общая кумулятивная доза ГК ассоциировалась с повышенным риском развития остеопоротических переломов, асептических некрозов костей, катаракты, сахарного диабета, ише-мической болезни сердца (ИБС), легочного фиброза, когнитивных нарушений и психоза (отношение рисков от 1,5 до 2). При этом кумулятивная доза пред-низолона, назначавшегося перорально, ассоциировалась с нарастанием риска остеопороза/переломов, катаракты и ИБС. Тогда как пульс-терапия метилпред-низолоном в основном была связана с появлением когнитивных нарушений и психоза.
В исследование, проведенное M. Thamer et al., были включены 525 пациентов, у которых СКВ диагностирована за 6 мес до регистрации в Хопкинской когорте. Необратимые повреждения органов были впервые диагностированы у 141 из них. Риск повреждения возрастал с увеличением суммарной дозы пред-низолона. Однако он существенно не менялся при кумулятивной дозе преднизолона Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
Нежелательные эффекты ГК
Угнетение синтеза белка, его ускоренный катаболизм: задержка регенеративных процессов, подавление клеточной пролиферации и фибробластической функции Стероидная капилляроангиопатия, миопатия, ониходистрофия
Медикаментозный синдром Иценко—Кушинга +
Угнетение гипоталамо-гипофизарно-надпочечниковой системы/недостаточность коры надпочечников (синдром отмены) +
Нарушения высшей нервной деятельности (эйфория, психомоторное возбуждение, психоз, депрессивные состояния) -
Гипергликемия/диабет Стероидный диабет
Влияние на водно-солевой баланс, гиперкалиемия (остановка сердца), задержка жидкости, отеки, артериальная гипертензия Отеки, транзиторная артериальная гипертензия
Опосредованное нарушение метаболизма мочевой кислоты (вторичная подагра) Вторичная подагра
Атрофия мышц, миопатия Стероидная миопатия, генерализованная амиотрофия
Резорбтивное действие при нанесении на кожу, атрофия кожи +
Изъязвления слизистой оболочки желудочно-кишечного тракта -
Остеопороз Стероидная спондилопатия, остеопороз, компрессионный перелом ТИ8, ТЫ2
Нарушения менструальной функции Менопауза с 38 лет
Гиперкоагуляция Множественные инфаркты костного мозга, посттромбофлебитиче-ская болезнь: тромбозы задних большеберцовых, малоберцовых, подколенных, суральных, поверхностной бедренной вен с 2 сторон
Стероидная катаракта, провоцирование латентной глаукомы +
Появление стероидных угрей, пурпуры, телеангиэктазий +
Асептические некрозы костей Асептический некроз латеральных мыщелков бедренной и больше-берцовой костей
Атравматический разрыв сухожилий -
Нарушение кроветворения (снижение числа эозинофилов, лимфоцитов, повышение числа нейтрофилов, эритроцитов, тромбоцитов, ретикулоцитов) Лейкоцитоз, тромбоцитоз
Ранний атеросклероз, дислипидемия +
демию, вторичную подагру, нарушение толерантности к глюкозе.
Несмотря на то что гормональная терапия является рутинным методом лечения СКВ, ее использование требует определенного опыта и практических навыков.
При назначении ГК необходимо оценить тяжесть течения СКВ, ее активность и предварительный прогноз. Выполнение этих задач возможно при взаимном сотрудничестве врача общего профиля, врача-ревматолога, а также самого больного.
1. Насонова В.А. Системная красная волчанка. М.: Медицина, 1972.
2. Bresnihan B. Outcome and survival in systemic lupus erythematosus. Ann Rheum Dis 1989;48(6):443-5.
3. Gladman D.D. Prognosis and treatment of systemic lupus erythematosus. Curr Opin Rheum 1995;7(5):402-7.
4. Monneaux F., Muller S. Molecular therapies for systemic lupus erythematosus: clinical trials and future prospects. Arthritis Res Ther 2009;11(3):234-44.
5. Насонов Е.Л., Чичасова Н.В., Ковалев В.Ю. Глюкокортикоиды в ревматологии (системная и локальная терапия). М., 1998.
6. Соловьев С.К., Асеева ЕА., Чикликчи А.С., Насонова В.А. Синхронная программная интенсивная терапия у больных с тяжелым течением ревматоидного артрита. Тер архив 2002;74(5):112-8.
7. Харкевич Д.А. Фармакология: Учебник. 8-е изд., перераб., доп. и испр. М.: ГЭОТАР-Медиа, 2005.
8. Ad Hoc Working Group on Steroid-Sparing Criteria in Lupus. Criteria for steroid-sparing ability of interventions in systemic lupus erythematosus meeting. Arthritis Rheum 2004;50(11):3427-31.
9. Chambers S.A., Allen E., Rahman A., Isenberg D. Damage and mortality
in a group of British patients with systemic lupus erythematosus followed up for over 10 years. Rheumatology (Oxford) 2009;48(6):673-5.
10. Gladman D.D., Urowitz M.B., Rahman P. et al. Accrual of organ damage over time in patients with systemic lupus erythematosus.
J Rheumatol 2003;30(9):1955-9.
11. Zonana-Nacach A., Barr S.G., Magder L.S., Petri M. Damage in systemic lupus erythematosus and its association with corticosteroids. Arthritis Rheum 2000;43(8):1801-8.
12. Thamer M., Hernan M.A., Zhang Y. et al. Prednisone, lupus activity and permanent organ damage. J Rheumatol 2009;36(3):560—4.
13. Trikudantan S., McMahon G.T. Optimum management of glucocorticoid-treated patients. Nat Clin Pract Endocrinol Metab 2008;4(5):262-71.
14. Yee C.S., Crabtree N., Skan J. et al. Prevalence and predictors of fragility fractures in systemic lupus erythematosus. Ann Rheum Dis 2005;64(1):111-3.
15. Ruiz-Irastorza G., Danza A., Khamashta M. Glucocorticoid use and abuse in SLE. Rheumatology (Oxford) 2012;51(7):1145-53.
16. Korczowska I., Olewicz-Gawlik A., Hrycaj P., Lacki J. The effect of long-term glucocorticoids on bonemetabolism
in systemic lupus erythematosus patients: the prevalence of its anti-inflammatory action upon bone resorption. Yale J Biol Med 2003;76(2):45-54.
17. Engvall I.L., Svensson B., Tengstrand B.
et al. Impact of low-dose prednisolone on bone synthesis and resorption in early rheumatoid arthritis: experiences from a two-year
randomized study. Arthritis Res Ther 2008;10(6):R128.
18. Oniuma K., Harada Y., Nawata Y. et al. Osteonecrosis in patients with systemic lupus erythematosus develops very early after starting high dose corticosteroids treatment. Ann Rheum Dis 2001;60(12):1145-8.
19. Gladman D.D., Chaudhry-Ahluwalia V., Ibañez D. et al. Outcomes of symptomatic osteonecrosis in 95 patients with systemic lupus erythematosus. J Rheum 2001;28(10):2226-9.
20. Prasad R., Ibanez D., Gladman D., Urowitz M. The role of non-corticosteroid related factors in osteonecrosis (ON)
in systemic lupus erythematosus: a nested case-control study of inception patients. Lupus 2007;16(3):157-62.
Читайте также:


