Инфекционный эндокардит группы инвалидности
Здравствуйте.
1.Возраст 23 года
2. мужской
3. профессии не имею (11 классов)
4.
5. Стационарные лечения:
04.04.14 по 14.04.14 Диагноз: Врожденный порок сердца: дефект межжелудочковой перегородки ( 2000 г). Перенесенный инфекционный эндокардит с локализацией на аортальном клапане (2011г). Гипертоническая болезнь 2 стадии, риск 2 степени. Осложнение: ХСН 3 ФК НК 2А. Застойная печень. Сопутствующий: Хронический панкреатит умеренное обострение. Хронический гастрит. Функциональное расстройство кишечника.
28.05.14 по 10.06.14 Диагноз: Хронический рецидивирующий панкреатит,обострение.Хронический рефлюкс-гастрит,обострение. Хронический энтероколит,обострение. Сопутствующий: ВПС Перенесенный инфекционный эндокардит. Хр. геморрой 2-3 степени, ремиссия.
12.09.14 по 22.09.14 Диагноз: Врожденный порок сердца: дефект межжелудочковой перегородки. Коррекция пороков ( 2000 г). Перенесенный инфекционный эндокардит с преимущественной локализацией на аортальном клапане. Сочетанный аортальный порок. Незначительный стеноз и недостаточность аортального клапана 2 степени. Недостаточность трикуспидального клапана 2 степени. Легочная гипертензия 1 степени. Гипертоническая болезнь 2 стадия риск 3. Осложнение: ХСН 3 ФК НК 2А. Застойная печень. Сопутствующий: Хронический панкреатит вне обострения. Хронический гастрит вне обострения.
По результатам ЭхоКГ у меня после эндокардита плохо работают 3 клапана сердца (аортальный 2ст и нез.стеноз, митральный 2 ст., трикуспидальный 2ст.) + врожденный порок,операция по поводу врожденного порока 2000г. Если нужно выложу ЭхоКГ.
У меня не так много остается свободного времени вечерами после работы (когда я отвечаю на вопросы пользователей сайта) и четкое выполнение вышеуказанных требований мне его ОЧЕНЬ экономит.
По существу заданного Вами вопроса - по приведенным Вами данным - оснований для установления инвалидности 2-й группы - не имеется.
Приведенные Вами диагнозы ЧЕТКО (без вариантов) соответствуют инвалидности 3-й группы (которая Вам и установлена).
Мой вопрос к Вам по поводу сопутствующий заболеваний. С начала этого года я лежал в больнице с впервые выявленным диабетом, а затем обострением панкреатита. Так же выявлен артроз суставов и плохо поддается лечению хат, гипотериоз.
По сопутствующим заболеваниям: с 12.02.15 по 24.02.15 г. лежал в больнице, диагноз основной: Сахарный диабет 2 тип впервые выявленный. Сопутствующий : хронический панкреатит в стадии умеренного обострения.Врожденный порок сердца: дефект межжелудочковой перегородки (коррекция 2000 г.). Киста правой доли щитовидной железы. Хронический аутоиммуный тиреоидит.Субклинический гипотериоз.Гипертоническая болезнь 2,риск 4.
С 02.03.15 по 13.03.15 г. лежал в больнице, диагноз основной : хронический билиарнозависимый панкреатит,обострение.Сопутствующий:Сахарный диабет 2 тип в стадии субкомпенсации. Хронический рефлюкс-гастрит,ремиссия. Антибиотикодиссоциированная диарея. Перенесенный инфекционный эндокардит. Хр. геморрой.
Уважаемый Astra71, я может быть, что то пишу не по порядку, или не так но, вот эти две выписки если быть точным отражают один диагноз : Хронический рецидивирующий панкреатит с экзокринной и эндокринной недостаточностью. Панкреатогенный сахарный диабет. ( мой диабет из-за панкреатита). У меня лежат направления на здачу анализов: эластаза 1 и с-пептид, после сдачи анализов, когда будет известна точная степень недостаточности поджелудочной железы - эти результаты будут иметь значение для МСЭ? Так же по заболеванию ХАТ.Гипотериоз. Кисты правой доли, мне увеличивают дозировку L-тироксина,но попрежнему уровень ТТГ выше нормы. Выявлен артроз колленных суставов: двусторонний гонартроз 1 ст.фн 1. По поводу основного заболевание, диагноз тот же, но появились обмороки из-за аритмии. До МСЭ еще полгода, мой вопрос насчет утяжеливщихся сопутствующих заболеваний: хронический панкреатит с недостаточностью и осложнившийся панкреатогенным диабетом будет иметь значение для комиссии ? Усиление для группы. Так же другие сопутствующие. В заранее спасибо.
По вышеприведенной патологии - оснований для установления инвалидности не имеется вообще и данная патология никак не повлияет на перспективы возможного усиления Вам группы инвалидности при очередном освидетельствовании в бюро МСЭ.
По этой патологии:
Чем полнее будет больной обследован для МСЭ - тем более точным будет принятое по его поводу экспертное решение.
Перспективы установления инвалидности при патологии ЖКТ (желудочно-кишечного тракта) в том числе и при панкреатите, зависят в основном от выраженности БЭН (белково-энергетической недостаточности).
Ведущими критериями определения тяжести БЭН являются:
- росто-весовые показатели (упадок питания);
- признаки белково-витаминной недостаточности по анализам крови (общему и биохимии).
Если у больного с патологией ЖКТ не имеется выраженного упадка питания и признаков стойкой белково-витаминной недостаточности по анализам крови, то инвалидность по данной патологии, как правило, не устанавливается.
Что касается сахарного диабета, то он выявлен у Вас совсем недавно и при отсутствии крайне тяжелых осложнений (диабетическая гангрена стопы с ампутацией и т.д.) - инвалидность по этой патологии не устанавливается.
Исходя из вышеизложенного - с высокой степенью вероятности можно говорить об отсутствии у Вас оснований для усиления группы инвалидности по вышеприведенной патологии.
Что касается перспектив установления конкретной группы инвалидности по патологии ССС (сердечно-сосудистой системы), то здесь решающее значение имеет степень СТОЙКОЙ НК (ХСН), которую Вы не указали.

За последние десять лет в России увеличилось в три раза количество случаев заболевания инфекционным эндокардитом. Это воспаление внутренней оболочки сердца, которое может вызвать серьезные осложнения вплоть до летального исхода.
Сниженный иммунитет и аномалии
Ренат Муратов: Причин несколько. Растет число имплантируемых материалов, электрокардиостимуляторов, становится больше открытых операций на сердце, все больше используются искусственные сосуды и клапаны. Увеличение числа людей, живущих с этими устройствами, приводит к обязательному росту инфекционных проблем у пациентов. Смертность от таких осложнений крайне высока. Но инфекционный эндокардит может развиться и у человека, у которого нет никаких имплантируемых устройств, и даже при хирургическом вмешательстве летальность составляет 20%. При развитии инфекции на имплантируемых устройствах смертность еще выше. Важна профилактика осложнений и своевременное распознавание болезни.
- На фоне чего еще может развиться заболевание? И можно ли его как-то распознать?
- Получается, что, если вовремя поставить диагноз, то пациента можно до конца вылечить?
- Совершенно верно. Чем раньше вмешается специалист, тем больший эффект будет достигнут. Важно, чтобы врачи как можно быстрей отправляли пациента за хирургической помощью. На ранних стадиях операция проходит довольно гладко, и смертность крайне низкая. А при нерациональном и запоздалом лечении шансов на удачный исход с каждой неделей становится все меньше.
- Какие категории населения находятся в группе риска развития инфекционного эндокардита?
- Влияют социальные факторы риска. Заболевание может развиться у людей, живущих за чертой бедности, а также у тех, кто страдает алкогольной зависимостью. В первую очередь, причина заболевания кроется в сниженном иммунитете. Более подвержен заболеванию ослабленный человек. Кроме того, в группе риска – люди с небольшими аномалиями строения сердца. Казалось бы, порока нет, качество жизни не страдает, но есть пролапс (выпячивание органа или его части через естественные отверстия – ред.). И эта категория людей уязвима для развития инфекции на фоне провоцирующих факторов – например, тяжелого гриппа, гнойных ран или даже при проведении такой урологической процедуры, как уретроскопия.

- К каким болезням может привести несвоевременное лечение инфекционного эндокардита?
Сергей Ковалев: Когда инфекционный очаг находится на сердечном клапане, то может вызвать образование тромбов. Осложнения могут привести к инсульту. Эти процессы сегодня довольно распространены и существуют определенные проблемы в их лечении.
- Какие именно?
- Люди, которые думают, что знают все о медицине, бездумно пьют антибиотики. Поднялась температура, они попили один день антибиотик и бросили лечение. А возбудитель на этот антибиотик уже реагировать не будет. Да и вообще все современные подходы основаны на том, чтобы как можно меньше пичкать больных антибиотиками. Надо искать первопричину – вот что важно.
- Какие еще ошибки совершают пациенты?
- Нежелание заниматься профилактикой заболеваний. Температура может подняться не только при ОРВИ. А вдруг это, например, почечная инфекция? Или появился рубец на коже – в организме может зреть инфекция. Иммунитет упал, и на этом фоне инфекция может получить более сильное развитие и дать осложнение на другие органы. Если пациенты с имплантируемыми устройствами заболели гриппом, то они должны в течение 48 часов провести очень серьезную антибактериальную терапию. Это тоже необходимо для того, чтобы избежать осложнений.
- В целом, число пациентов с заболеваниями сердца растет. С чем это связано?
Инфекционный эндокардит (ИЭ) относится к числу тяжелых заболеваний с высоким уровнем летальности. В отсутствии лечения смертность при ИЭ составляет 100%. В последние годы отмечается значительный рост числа больных эндокардитом в нашей стране и за рубеж
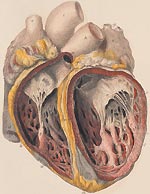
Инфекционный эндокардит (ИЭ) относится к числу тяжелых заболеваний с высоким уровнем летальности. В отсутствии лечения смертность при ИЭ составляет 100%. В последние годы отмечается значительный рост числа больных эндокардитом в нашей стране и за рубежом. По данным различных авторов, сегодня выросла заболеваемость в пожилом и старческом возрасте, а также среди лиц в возрасте до 30 лет, использующих внутривенное введение наркотиков [1, 2].
Известно, что ИЭ представляет собой заболевание инфекционной природы с первичной локализацией возбудителя на клапанах сердца, пристеночном эндокарде, протекающее с проявлениями системной инфекции, сосудистыми осложнениями и иммунной реакцией [3, 4, 5].
В данной работе обобщен опыт диагностики и ведения больных ИЭ на базе общетерапевтического отделения Александровской больницы Санкт-Петербурга за период 1998–2003 гг. Диагностика заболевания осуществлялась в соответствии с критериями Duke [8]. Диагноз ИЭ оценивался как достоверный при наличии двух главных критериев, а именно:
- при выделении типичного для ИЭ возбудителя при посевах крови больного;
- при определении эхокардиографических признаков поражения эндокарда - подвижные вегетации на клапанах сердца, абсцессов в области протеза клапана; образования внутрисердечных фистул и др., в сочетании с тремя или/и пятью вспомогательными критериями, к которым относились сосудистые осложнения (эмболии крупных артерий, септические инфаркты легких, внутричерепные кровоизлияния и др.), иммунологические феномены (гломерулонефрит, узелки Ослера, геморрагический васкулит и др.), а также фебрильная лихорадка, гепато-спленомегалия и другие проявления системной инфекции.
Нами было проведено обследование 105 больных ИЭ, из них у 80 человек в возрасте от 18 до 30 лет (первая группа) основным фактором риска заболевания являлась инъекционная наркомания.
Во второй группе больных (25 чел.) основными предрасполагающими факторами развития ИЭ были врожденные и приобретенные пороки сердца, а также протезированные клапаны.
У лиц старшей возрастной группы дополнительным фактором риска являлись дегенеративно-дистрофические изменения клапанов сердца.
Взаимосвязь характера поражения клапанов сердца и факторов риска ИЭ представлена в таблице 1.
По данным эхокардиографического исследования, у 100% больных первой группы были выявлены подвижные вегетации на створках трикуспидального клапана (ТК), что сопровождалось формированием его недостаточности I—III степени.
Во второй группе больных ИЭ отмечалось поражение левых камер сердца с образованием вегетаций на створках аортального и митрального клапанов. Изолированное поражение митрального клапана наблюдалось у двух человек с ревматическим пороком сердца (митральный стеноз), у одной больной с врожденным дефектом межжелудочковой перегородки и в единственном случае обструктивной формы гипертрофической кардиомиопатии.
Среди лиц пожилого и старческого возраста у девяти человек (36%) определялось изолированное поражение аортального клапана в отсутствии признаков аортального стеноза. Наряду с этим, у пяти больных (20%) в возрасте от 72 до 87 лет ИЭ развился на фоне аортального порока атеросклеротического генеза, причем у всех пятерых было выявлено сочетанное поражение аортального и митрального клапанов. Дегенеративно-дистрофические изменения других клапанов сердца определялись у 100% больных старшей возрастной группы.
Образование вегетаций на створках аортального клапана наблюдалось у двух больных с третичной формой сифилиса на фоне имеющегося аортального порока, связанного со специфическим процессом в аорте.
В двух случаях мы наблюдали развитие эндокардита протезированных клапанов.
При сопоставлении результатов посевов крови в двух группах больных определялись существенные различия как в частоте выделения микробной флоры, так и в видовом составе возбудителей эндокардита. По нашим данным, возбудителем ИЭ у больных-наркоманов в 71,3% наблюдений (57 чел.) являлся золотистый стафилококк, тогда как во второй группе, наряду с кокковой флорой, чаще обнаруживались грамотрицательные микроорганизмы (28%). Отрицательные результаты посевов крови значительно реже наблюдались в первой, чем во второй, группе больных ИЭ: 18,7% и 56% — соответственно. Данные относительно этиологической структуры ИЭ в обследуемых группах больных представлены в таблице 2.
Клиническое течение и характер осложнений инфекционного эндокардита во многом зависят от локализации клапанных вегетаций — в правых или левых камерах сердца, а также степени вирулентности возбудителя заболевания.
Течение ИЭ у больных-наркоманов отличалось особой тяжестью и полисиндромностью. Причиной госпитализации у большинства больных были острые осложнения основного заболевания. Значительная часть больных поступала в реанимационное отделение стационара с клиническими симптомами одно- или двухсторонней многофокусной пневмонии, причиной которой являлась септическая тромбоэмболия ветвей легочной артерии (72% больных). Течение пневмонии сопровождалось тяжелой дыхательной недостаточностью, нередко с развитием респираторного дистресс-синдрома (РДСВ) и очагами деструкции в легких (12%). Проявления вторичной нефропатии, которые обнаруживались у 100% больных в первой группе, иногда ошибочно трактовались как обострение хронического гломеруло- или пиелонефрита, мочекаменной болезни, что служило поводом для госпитализации этих больных в урологическое и нефрологическое отделения.
Во второй группе больных основной причиной госпитализации была длительная фебрильная лихорадка в сочетании с анемией и гепатолиенальным синдромом. Наряду с этим, у пяти человек (20%) поводом для госпитализации послужила прогрессирующая сердечная недостаточность.
Основные клинические синдромы, наблюдаемые у больных ИЭ первой и второй групп, представлены в таблице 3.
По нашим наблюдениям, характерной особенностью клинического течения ИЭ у больных-наркоманов являлась высокая частота септической ТЭЛА с формированием множественных очагов инфильтрации в легких. У многих больных легочные тромбоэмболии носили рецидивирующий характер (31,3% больных) и нередко осложнялись развитием деструктивных очагов в легких.
Образование вегетаций у 100% больных первой группы сопровождалось недостаточностью трехстворчатого клапана I—III степени с формированием потоков регургитации. Вместе с тем, у большинства пациентов не определялось тяжелых нарушений центральной гемодинамики, связанных с дисфункцией ТК. В данной группе больных характерной клинической особенностью был обратимый характер нарушений гемодинамики на фоне проводимой терапии. Острая сердечная недостаточность с дилятацией полостей сердца и снижением фракции выброса до 40% и ниже наблюдалась у 28 больных (35,3%) в связи с присоединением острого миокардита или на фоне сочетанного поражения клапанов сердца.
Вторичная нефропатия являлась одним из самых распространенных синдромов в первой группе больных ИЭ. Острая почечная недостаточность наблюдалась у 16 больных, причем у 10 из них она носила обратимый характер и была связана с острым ДВС-синдромом, а также с острой сердечной недостаточностью с отеками. Инфекционно-токсическая нефропатия регистрировалась в 73,8% наблюдений и сопровождалась мочевым синдромом — гематурией, протеинурией, лейкоцитурией — при достаточном уровне клубочковой фильтрации.
Характерной особенностью ИЭ во второй группе было подострое течение заболевания с длительным периодом лихорадки на догоспитальном этапе, причем в пожилом и старческом возрасте лихорадка носила субфебрильный характер с редкими подъемами температуры до фебрильных цифр.
Большинство больных подострым инфекционным эндокардитом (ПИЭ) поступали в стационар в стадии развернутой клинической картины заболевания с клиническими признаками тромбоэмболии сосудов большого круга кровообращения. В данной группе больных наиболее распространенными следует признать такие осложнения, как церебральные эмболии с развитием ишемических и геморрагических инсультов, эмболии почечных сосудов с болевым синдромом и гематурией, а также формирование острых очаговых изменений в миокарде, связанных с эмболией коронарных сосудов или прикрытием устьев коронарных артерий вегетациями [9].
Септические тромбоэмболии церебральных сосудов нередко сопровождались развитием гнойного менингоэнцефалита с летальным исходом. Вместе с тем, при посевах крови у 56% больных второй группы не получено роста микробной флоры. Обращает на себя внимание тот факт, что септицемия у больных с положительными результатами посевов крови в 28% наблюдений была обусловлена грамотрицательной микрофлорой. В этой категории больных источником бактериемии являлись очаги хронической инфекции в мочеполовой системе, а у двух больных (по данным аутопсии) был выявлен двухсторонний апостематозный нефрит.
У значительного числа больных ПИЭ (62%) определялись признаки острой недостаточности кровообращения с застойными хрипами в легких, легочной гипертензией, увеличением полостей сердца и периферическими отеками.
В этой группе больных чаще, чем в первой, наблюдалась преренальная азотемия и ОПН, связанные с развитием острой недостаточности кровообращения.
Острый диффузный миокардит, типичными проявлениями которого были различные нарушения ритма, диагностирован у 27% больных второй группы.
Анемия со снижением уровня гемоглобина до 80 г/л и менее выявлена у 100% больных второй группы. Значительное увеличение СОЭ (более 45 мм/ч) наблюдалось у 85,8% больных подострым ИЭ.
Кожные изменения в виде геморрагических высыпаний, пурпуры Шенлейн-Геноха, а также другие проявления иммунного воспаления в обеих группах больных встречались нечасто — 6,3 и 4% в первой и второй группах, соответственно.
Консервативная терапия больных ИЭ проводилось с использованием антибиотиков широкого спектра действия в сочетании со средствами дезинтоксикационной, антикоагулянтной и метаболической терапии. В составе антибактериальной терапии больные получали цефалоспорины III-IV поколений в комбинации с аминогликозидами и метронидазолом. Из группы цефалоспоринов назначались: цефтриаксон (лонгацеф) 2 г в сутки внутривенно (в/в), или цефотаксим (тальцеф) 2 г в сутки в/в, или цефепим (максипим) 2 г в сутки в/в в сочетании с аминогликозидами (амикацин в суточной дозе 1,5 г в/в) и метронидазолом по 1,5-2 г в сутки в/в. В случае, если такая терапия оказывалась неэффективной или существовали противопоказания к вышеперечисленным препаратам, применялись антибиотики группы линкозаминов: клиндамицин 1,2 г в сутки в/в или линкомицин 3 г в сутки в/в в сочетании со фторхинолонами (ципрофлоксацин 400 мг в сутки в/в). В условиях отделения реанимации в течение пяти–семи дней проводилась терапия имипинемом (тиенамом) в дозе 2—4 г в сутки в/в или рифампицином в суточной дозе 0,45—0,6 г в/в. Средняя продолжительность курса антибиотикотерапии в обследуемой группе больных составила 28 + 3,5 дней.
Дезинтоксикационная терапия включала в себя внутривенные инфузии реополиглюкина, гемодеза, поляризующих смесей в сочетании с петлевыми диуретиками. Объем вводимой жидкости составлял в среднем 2-2,5 л в сутки. В течение всего периода инфузионной терапии осуществлялся контроль за функциональным состоянием почек, электролитным составом крови, суточным диурезом. В условиях отделения реанимации у всех больных осуществлялся мониторинг ЦВД. Инфузионная терапия проводилась в течение всего острого периода заболевания до купирования проявлений интоксикационного синдрома. Средняя продолжительность курса составила 22 + 4,5 дня.
Развитие легочной эмболии, особенно в сочетании с признаками острого ДВС-синдрома в стадии гиперкоагуляции, служило основанием для назначения антикоагулянтной терапии. Начальная доза гепарина составляла 10 тыс. ЕД внутривенно, струйно, за-тем — по 1000 ЕД в час внутривенно, капельно с переходом на подкожное введение до 30 тыс. ЕД в сутки. Введение гепарина осуществлялось под контролем показателей коагулограммы и времени свертывания крови. Одновременно проводились внутривенные трансфузии свежезамороженной плазмы по 300 мл в сутки с добавлением 2500–5000 ЕД гепарина. Анемия тяжелой степени (Нb менее 80 г/л, Ht ≤25) корригировалась переливаниями эритроцитарной массы (пять–семь доз). При наличии гипопротеинемии использовалось введение растворов аминокислот, альбумина или нативной плазмы. Выявление клинических и рентгенологических признаков отека легких на фоне рецидивирующего течения септической ТЭЛА служило показанием для назначения кортикостероидов (преднизолон от 120 до 200 мг в сутки внутривенно капельно). Терапия антикоагулянтами прямого действия в сочетании с трансфузиями криоплазмы проводилась до стойкого улучшения показателей гемостаза. Критериями нормокоагуляции являлись уровень фибриногена в плазме 3-4 г/л, отсутствие тромбоцитопении, нормализация ВСК, АЧТВ, тромбинового времени, а также отрицательные паракоагуляционные тесты. По нашим данным, купирование проявлений острого ДВС-синдрома на стадии гиперкоагуляции у 75% больных отмечалось на седьмой–десятый день от начала комплексной терапии.
У части больных формировалась резистентность к проводимой антибактериальной терапии, которая характеризовалась нарастанием интоксикации, фебрильной лихорадкой, прогрессирующей анемией, а также высевами из крови возбудителя ИЭ – золотистого стафилококка — в 65% наблюдений. При рентгенологическом обследовании данной категории больных с большой частотой определялись очаги деструкции легочной ткани, а у трех больных гнойный выпот в плевральной полости.
Длительное применение антибиотиков широкого спектра действия у 70,3% больных (38 чел.) сопровождалось развитием побочных эффектов антибактериальной терапии. Кандидоз полости рта глотки, пищевода, а также кишечный дисбактериоз III-IV стадии был выявлен у 36 больных (66,7%). Применение антибиотиков с гепатотоксическими свойствами (цефалоспорины, линкозамины, метронидазол) у двух больных (3,7%) с хроническим гепатитом С и В приводило к прогрессированию печеночной недостаточности, которая сопровождалась высокой ферментемией (АЛТ 1500 ЕД, АСТ 1000 ЕД) и желтухой.
Развитие застойной сердечной недостаточности с появлением акроцианоза, влажных хрипов в базальных отделах легких, периферических отеков в сочетании с кардиомегалией и падением фракции выброса до 50—45% наблюдалось у пяти больных (9,3%) на фоне массивной инфузионной терапии.
Длительная антикоагулянтная терапия в 20,4% (11 чел.) наблюдений сопровождалась повышением толерантности плазмы к гепарину, что клинически выражалось в развитии периферических флеботромбозов, в то время как гепарининдуцированной тромбоцитопении в обследуемой группе больных мы не наблюдали.
Положительные результаты консервативной терапии были получены у 70,2% больных (56 чел.) с поражением ТК и лишь у 32% пациентов (6 чел.) из второй группы. Исходом ИЭ в обеих группах больных являлось формирование недостаточности клапанов сердца.
Госпитальная летальность при ИЭ у наркозависимых лиц составила 29,4% (24 чел.), тогда как у больных с поражением левых камер сердца (вторая группа) уровень смертности составил 68% (19 чел.).
По данным аутопсии, основными причинами смерти больных ИЭ были:
- септикопиемия с формированием гнойных очагов в печени, почках селезенке, головном мозге с развитием полиорганной недостаточности (46,2%);
- сердечная недостаточность на фоне полипозно-язвенного эндокардита с разрушением клапанов сердца, а также острый миокардит с дилятацией полостей сердца (39,4%);
- вторичная нефропатия с развитием почечной недостаточности, отеком легких, отеком головного мозга (14,4%).
Таким образом, характерные особенности ИЭ у лиц с наркотической зависимостью — это острое течение заболевания с поражением правых камер сердца и рецидивами септической ТЭЛА. Возбудителем ИЭ у инъекционных наркоманов в 71,3% является высоковирулентный золотистый стафилококк. Формирование недостаточности трехстворчатого клапана I—III степени стало самым распределенным осложнением ИЭ у наркоманов. При этом у большинства больных не наблюдается тяжелых нарушений центральной гемодинамики, приводящих к развитию острой недостаточности кровообращения.
Подострый ИЭ у больных с предрасполагающими заболеваниями сердца, а также у лиц пожилого и старческого возраста протекает с преимущественным поражением левых камер сердца, причем в старшей возрастной группе преобладает моноклапанное поражение. Наличие сопутствующей патологии у лиц старше 60 лет маскирует течение основного заболевания, чем и обусловлены поздняя диагностика и высокая смертность больных. Для затяжного течения ИЭ характерна низкая высеваемость возбудителя, по сравнению с острыми формами заболевания. Развитие тромбоэмболий сосудов большого круга кровообращения является характерной клинической особенностью подострого ИЭ.
Положительный эффект от проводимой консервативной терапии наблюдается у большинства больных ИЭ с поражением ТК, тогда как при подостром эндокардите левых камер сердца консервативная терапия является малоэффективной у большинства больных.
Госпитальная летальность в обеих группах больных обусловлена диссеминацией возбудителя с формированием гнойных очагов и полиорганной недостаточностью, а также развитием острой недостаточности кровообращения и вторичной нефропатии.
- Буткевич О. М., Виноградова Т. Л. Инфекционный эндокардит. - М., 1997.
- Симоненко В. Б., Колесников С. А. Инфекционный эндокардит: современное течение, диагностика, принципы лечения и профилактики. - Клин. мед., 1999. - 3. - С. 44-49.
- Тазина С. Я., Гуревич М. А. Современный инфекционный эндокардит. - Клин. мед.,1999. - 12. - С. 19-23.
- Bansal R. C. Infective endocarditis. Med Clin North America 1995; 79 (5): 1205-1239.
- Bayer A. S., Bolger A. F., Taubert K. A. et al. Diagnosis and management of infective endocarditis and its complications. Circulation 1998; 98: 2936-2948.
- McKinsey D. S., Ratts T. E., Bisno A. I. Underlying cardiac lesions in adults with infective endocarditis. The changing spectrum. Amer J Med 1987; 82: 681-688.
- Lamas C. C. Eykyn S. J. Suggested modifications to the Duke criteria for the clinical diagnosis of native valve and prosthetic valve endocarditis: analysis of 118 pathologically proven cases. Clin Infect Dis 1997; 25: 713-719.
- Durack D. T., Lukes A. S., Bright D. K. et al. New criteria for diagnosis of Infective Endocarditis Utilization of Specific Echocardiographic Finding. Amer J Med 1994; 96: 200-209.
- Тюрин В. П., Дубинина С. В. Инфекционный эндокардит у лиц пожилого и старческого возраста. - Клин. мед., 2000. - 4. - С. 53-56.
В. И. Уланова
В. И. Мазуров, доктор медицинских наук, профессор
Медицинская академия последипломного образования, Санкт-Петербург
ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ ЧИТИНСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ
КАФЕДРА ПОЛИКЛИНИЧЕСКОЙ ТЕРАПИИ С КУРСОМ ОБЩЕЙ ВРАЧЕБНОЙ ПРАКТИКИ
НЕКОРОНАРОГЕННЫЕ ЗАБОЛЕВАНИЯ СЕРДЦА
УЧЕБНОЕ ПОСОБИЕ
ЧИТА, 2008
УДК 616.126-002-022.7:616.127-002:616-002.77:616.11-002
ББК 54.101
Алексенко, Е.Ю. Некоронарогенные заболевания сердца: Учебное пособие. / Е.Ю. Алексенко, Л.П. Шелудько, Е.А. Томина, С.М. Цвингер. – Чита: ИЦЦ ЧГМА, 2008. – 84 с.
Учебное пособие предназначено для врачей общей практики. Содержит необходимые сведения об этиологии, патогенезе, классификации, клинических проявлениях, диагностике, современных принципах лечения, профилактике, экспертизе временной нетрудоспособности и медико-социальной экспертизе некоронарогенных заболеваний сердца: эндокардитов, миокардитов, перикардитов и синдромносходных заболеваний.
Рецензенты:
Алексенко Ю.И.– доцент кафедры внутренних болезней стоматологического и педиатрического факультетов, к.м.н.
Лузина Е.В. – доцент кафедры терапии ФПК и ППС, к.м.н.
СОДЕРЖАНИЕ
1. Инфекционный эндокардит……………. ………………………. ………….…7
1.1 Классификация и терминология инфекционного эндокардита………..….….7
1.2 Этиология и патогенез……………………………………………………. 9
1.3 Диагностика инфекционного эндокардита………………………………. 10
1.4 Дифференциальный диагноз…………………………………………………..15
1.5 Лечение инфекционного эндокардита……………………………………. 19
1.6 Профилактика инфекционного эндокардита…………………………………24
1.7 Экспертиза трудоспособности……………………………………………. 27
2.2 Патоморфология миокарда…………………………………………………….31
2.3 Классификация миокардита….……………………..…………………………32
2.5 Дифференциальный диагноз……………………………………………….….39
2.7 Экспертиза трудоспособности………………………………………….……..44
3. Ревматическая лихорадка………………………………………………………46
3.1 Терминология и диагностика…………………………………………………..46
3.2 Первичная профилактика ОРЛ…………………………………………………52
3.4 Вторичная профилактика ОРЛ………………………………………………. 54
3.6 Экспертиза трудоспособности…………………………………………………55
4.1 Классификация перикардита…………………………………………………..58
4.4 Хронический перикардит………………………………………………………64
4.5 Специфические формы перикардита………………………………………….68
4.6 Редкие формы болезней перикарда……………………………………………77
4.7 Профилактика и реабилитация………………………………………………. 80
4.8 Экспертиза трудоспособности…………………………………………………80
СПИСОК СОКРАЩЕНИЙ
АВ-блокада – атриовентрикулярная блокада
АД – артериальное давление
АДНК В – антидезоксирибонуклеаза В
АСЛ-О – антистрептолизин О
БГСА – бета-гемолитический стрептококк группы А
ВИЧ – вирус иммунодефицита человека
ДНК – дезоксирибонуклеиновая кислота
иАПФ – ингибитор ангиотензин-превращающего фермента
ИЭ – инфекционный эндокардит
ЛЖ – левый желудочек
ЛНЭ – лихорадка неясной этиологии
ЛС – лекарственное средство
МВ - КФК – миокардиальная фракция креатинфосфокиназы
МК – митральный клапан
МНО – международное нормализованное время
МСЭ – медико-социальная экспертиза
НК – недостаточность кровообращения
НПВС – нестероидные противовоспалительные средства
НЦД – нейроциркуляторная дистония
ОРЛ – острая ревматическая лихорадка
РА – ревматоидный артрит
РЛ – ревматическая лихорадка
РНГА – реакция нейтрализации гемагглютинации
РНК – рибонуклеиновая кислота
РПС – ревматический порок сердца
РСК – реакция связывания комплемента
САД – систолическое артериальное давление
СКВ – системная красная волчанка
СН – сердечная недостаточность
СОЭ – скорость оседания эритроцитов
СРБ – С-реактивный белок
ССД – системная склеродермия
ФК – функциональный класс
ХРБС – хроническая ревматическая болезнь сердца
ЦИК – циркулирующие иммунные комплексы
ЧСС – число сердечных сокращений
ИНФЕКЦИОННЫЙ ЭНДОКАРДИТ
В настоящее время инфекционный эндокардит (ИЭ) является значимой проблемой кардиологии. Распространённость данного недуга в экономически развитых странах составляет от 25 до 93 человек на 1000000 населения.
ИЭ чаще развивается у трудоспособного населения вследствие эпидемии инъекционной наркомании, широкого распространения кардиохирургических операций, инвазивных медицинских манипуляций и исследований, др. причин. Появились особые формы заболевания:
В России с 1990 по 2001 гг. количество наркоманов увеличилось в 16,5 раз и составило 45,2-48,7 на 100 тысяч населения (примерно 3,5-4 млн). Ежегодная заболеваемость инфекционным эндокардитом среди наркоманов превышает 5-6%. Осложнениями хирургического лечения пороков сердца, нарушений ритма и проводимости являются ИЭ протеза клапана (12-18%) и ИЭ у пациентов с имплантированным электрокардиостимулятором (1-8%). После проведения программного гемодиализа ИЭ развивается у 1,7-5,1% больных, трансплантации органов - у 7,7-18% реципиентов. Сохраняется повышенная смертность (60-100%), во многом обусловленная видовым составом возбудителей.
У больных инфекционным эндокардитом в патологический процесс вовлекаются сердечно-сосудистая система, печень, селезёнка, лёгкие, почки, нервная система и др., что в значительной степени определяет полиморфизм клинической картины. Поэтому продолжительность верификации диагноза составляет 3,8-10 месяцев. У 40% пациентов заболевание длительное время остаётся нераспознанным или не диагностируется вовсе.
Несмотря на широкий спектр современной антибактериальной терапии, сохраняется высокая летальность от инфекционного эндокардита, которая, по данным различных исследований, колеблется от 18 до 36%. Ранняя диагностика заболевания проблематична, а патоморфоз болезни претерпевает существенные изменения.
Читайте также:
- Вакцинация против ротавирусной инфекции у взрослых
- Сколько получает медсестра в инфекционной больнице
- Может ли быть инфекционный мононуклеоз без температуры
- Анализа спинномозговой жидкости при энцефалите
- Какие половые инфекции могут быть причиной цистита
 Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.
Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.


