Инфекции вызванные acinetobacter baumannii
Acinetobacter baumannii Это грамотрицательная бактерия, принадлежащая к отряду псевдомонад. На протяжении всей своей таксономической истории он находился в Micrococcus, Moraxella, Alcaligenes, Mirococcuscalco-aceticus, Herellea и Achromobacter, пока он не был расположен в своем нынешнем жанре в 1968 году.
. baumannii Это патогенная бактерия, которая считается видом, наиболее часто встречающимся в инфекциях своего рода. Она была замешана в различных типах инфекций, таких как сепсис, пневмония и менингит..
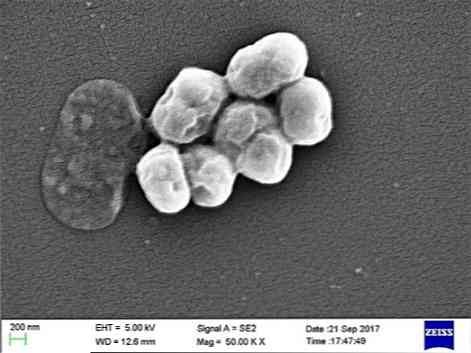
Это оппортунистический паразит, который часто встречается в больничных или внутрибольничных заболеваниях. Передача через искусственную вентиляцию легких была указана как важная причина инфекции, особенно в отделениях интенсивной терапии.
Несмотря на то, что он считается низкосортным патогеном, он обладает способностью увеличивать свою вирулентность у штаммов, вовлеченных в частые инфекции. Обладает большой способностью развивать резистентность и мультирезистентность к антибиотикам..
В больницах он передается в основном через контакт с персоналом, через загрязненные больничные материалы, а также через воздух на короткие расстояния..
Всемирная организация здравоохранения включает А. Бауманны в списке устойчивых патогенов, для которых срочно требуются новые антибиотики, с присвоением категории 1 с критическим приоритетом.
- 1 Биологические характеристики
- 2 Морфология
- 3 Метаболизм
- 4 Устойчивость к антибиотикам
- 5 патологий
- 6 Симптомы
- 7 Лечение
- 8 ссылок
Биологические характеристики
Все виды рода Acinetobacter они имеют широкое распространение в разных природных нишах. А. Бауманны он может естественным образом обитать на коже здоровых людей, будучи способен колонизировать слизистые поверхности, что является важным эпидемиологическим резервуаром. Тем не менее, среда обитания А. Бауманны это почти исключительно для больниц.
Эти бактерии не имеют жгутики или структуры, используемые для передвижения. Однако движение достигается за счет структур, которые позволяют им расширить и втягиваться, а также химических механизмов, таких, как выведение пленки с высокой молекулярной массой, экзополисахарида позади бактерий.
А. Бауманны может колонизировать большое количество живых или инертных сред и обладает большой способностью выживать на искусственных поверхностях в течение длительного периода времени.
Эта способность, возможно, из-за его способность противостоять обезвоживанию, используя различные источники углерода через различные метаболические пути и способность образовывать биопленки. По этой причине он является общим, чтобы найти его в больничных принадлежностей, таких как катетеры и механической вентиляции устройства.
морфология
A. baumannii - коккобацилл, промежуточный по форме между кокосами и тростниками. Они измеряют от 1,5 до 2,5 на 1-1,5 мкм, когда популяции находятся в логарифмической фазе роста. Они более сферические, когда достигают стационарной фазы.
метаболизм
Бактерия А. Бауманны это не ферментер глюкозы; он строго аэробный, то есть для метаболизма необходим кислород.
Вид рода Acinetobacter они являются единственными из семейства Moraxellaceae, в которых отсутствуют оксидазы цитохрома с, для которых они дают отрицательные результаты в тестах оксидаз.
А. Бауманны растет при температуре от 20 до 44ºC, оптимальная температура от 30 до 35ºC.
Устойчивость к антибиотикам
Постоянная генерация устойчивости к антибиотикам не только препятствует лечению инфекций, вызываемых А. Бауманны, это также способствует отбору эндемических и эпидемических мультирезистентных штаммов.
Некоторые внутренние механизмы А. Бауманны, которые способствуют устойчивости к антибиотикам:
- Наличие β-лактамазы придают устойчивость к b-лактамам.
- Продукция специфических ферментов, таких как аммониглюкозид-3'-фосфотрансфераза VI, инактивирует амикацин.
- Присутствие оксациллиназы ОХА-51 гидролизует пенициллины и карбапенемы.
- Присутствие и избыточная экспрессия эффлюксных наркотиков насосов, которые являются насосами, которые высылать вне клетки к малым молекулам, которые способны ввести в цитоплазму, снижающие чувствительность к антибиотикам.
Биопленки, созданные А. Бауманны они изменяют метаболизм микроорганизмов, снижая их чувствительность к антибиотикам, а также создают физический барьер против больших молекул и предотвращают обезвоживание бактерий..
патологиями
А. Бауманны колонизирует нового хозяина путем контакта с инфицированными людьми или с загрязненным медицинским оборудованием. Во-первых, эта бактерия прилипает к поверхности кожи и слизистой оболочки. Для размножения необходимо выжить антибиотики и ингибиторы и условия этих поверхностей.
Увеличение числа бактерий на поверхности слизистых оболочек, в частности в стационарных катетеров контакта внутрисосудистых или эндотрахеальных трубок, может повысить риск инфекции дыхательных путей и кровоток.
Пневмония в больницах является наиболее распространенной из инфекций, вызываемых А. Баумании. Обычно заключаются в отделениях интенсивной терапии пациентами, получающими искусственное дыхание.
А. Баумании Это также вызвало серьезные проблемы из-за заражения военнослужащих послевоенными травмами, особенно в Ираке и Афганистане. В частности, из-за остеомиелита и инфекций мягких тканей, которые могут вызвать некроз и целлюлит.
Есть также риск менингита от А. Баумании у пациентов, восстанавливающихся после нейрохирургии.
Лица, подверженные заражению А. Баумании включают в себя те, которые были ранее подвергнуты антибиотикам, серьезной операции, ожоги, травмы, иммуносупрессии или использования инвазивных медицинских устройств, в первую очередь для искусственной вентиляции легких в отделениях интенсивной терапии.
симптомы
Не существует специфической симптоматики инфекций из-за А. Баумании. Каждая из различных инфекций, вызываемых этой бактерией, имеет свои характерные симптомы.
В целом симптомы инфекций, которые могут включать А. Баумании или другие оппортунистические бактерии, такие как Klebsiella pneumoniae и Streptococcus pneumoniae, Они могут включать лихорадку, озноб, сыпь, болезненное мочеиспускание, насущную необходимость часто мочиться, путаницы или измененных психических состояний, тошнота, боли в мышцах, груди и кашель.
лечение
Антибиотики для лечения инфекций А. Бауманны они чрезвычайно ограничены из-за их большой способности приобретать сопротивления и мультирезистентность. Поэтому важно определить восприимчивость каждого штамма к различным антибиотикам, чтобы обеспечить эффективность каждого лечения..
В связи с устойчивостью к карбапенемам использовалось использование полимиксинов, в частности колистина, несмотря на относительно низкий индекс резистентности и его побочные эффекты на почки..
Однако штаммы, устойчивые к колистину, уже были обнаружены. В качестве альтернативы устойчивости к этим антибиотикам использовалась комбинированная терапия..

Acinetobacter – повсеместно распространенный, свободно живущий, сапрофитный микроорганизм, обитающий у здоровых людей на коже, в кишечнике и урогенитальном тракте. Эти микробы обычно колонизируют участки кожного покрова на ногах и в паху. Чаще всего бактерии вызывают внутрибольничные инфекции, имеющие вялотекущий характер, а также пищевые токсикоинфекции и диарею путешественников. Большинство микробов рода Acinetobacter чрезвычайно устойчивы к проводимой терапии.
Acinetobacter spp. до недавнего времени считали малопатогенными микроорганизмами. Современные ученые доказали, что при определенных условиях вирулентность микробов повышается. Это приводит к развитию тяжелых инфекционных процессов – менингита и септицемии. С 2017 года ацинетобактеры стали официально относиться к классу опасных бактерий, что обусловлено их резистентностью к современным противомикробным средствам.
Acinetobacter spp. встречается в различных природных объектах: воде, почве, стоках. A. baumannii — клинически значимый представитель данного рода. Он является типичным возбудителем внутрибольничной инфекции. У тяжелых больных A. baumannii вызывает пневмонию, трахеобронхит, сепсис, уретрит, раневую инфекцию.
Рост полирезистентных штаммов ацинетобактерий — серьезная проблема современной медицины. В настоящее время появились бактерии, устойчивые ко всем основным группам антибиотиков. Они с трудом поддаются элиминации из организма. Ученые-медики активно ведут поиск профилактических мер и разрабатывают новые медикаменты, активные в отношении таких возбудителей.
Этиология
Ацинетобактер — род неферментирующих микроорганизмов из семейства Moraxellaceae.

Эпидемиология
Ацинетобактерии охотно заселяют любые биотопы с минимально подходящими для них условиями и контаминируют самые разнообразные объекты. Штаммы бактерий обнаруживают во всех образцах почвы и воды, на коже и слизистых оболочках верхних дыхательных путей здоровых людей.
Бактерии рода Acinetobacter выделяют также из пастеризованного молока, замороженных продуктов, воздуха стационаров и смывов с различного медицинского оборудования. Они обладают низкой вирулентностью и являются нормальными обитателями организма человека. Появление микробов в большом количестве на коже, в мокроте или моче указывает не на развитие инфекционного процесса, а на колонизацию или контаминацию.

Источником и резервуаром инфекции являются инфицированные и больные люди, а также контаминированные предметы. Распространение бактерий осуществляется воздушно-капельным, контактно-бытовым, гематогенным путями.
Факторы, предрасполагающие к развитию инфекции:
- Экстренная госпитализация,
- Тяжелые сопутствующие заболевания — гематологические, онкологические, эндокринные,
- Длительная ИВЛ,
- Ингаляционное введение препаратов,
- Инвазивные медицинские манипуляции — введение катетеров и зондов, трахеостомия,
- Недоношенные и новорожденные дети в первую неделю жизни,
- Лечение цитостатиками или гормонами,
- Перенесенные операции и трансплантации,
- Долгое стационарное лечение,
- Мужской пол и пожилой возраст.
Для ацинетобактерной инфекции характерна сезонность вспышек в летний сезон, что связано с увеличением колонизации кожи микробами за счет потливости.
A. baumannii – микроб, обитающий преимущественно в водных объектах: искусственных и естественных водоемах. На сухой поверхности бациллы сохраняют свою жизнеспособность в течение месяца. В лечебно-профилактических учреждениях ацинетобактер колонизирует растворы многоразового использования.
Acinetobacter spp. вызывают назокомиальные инфекции у истощенных, физически ослабленных или умственно отсталых больных. Микробы обладают тропностью к эпителию респираторного и урогенитального трактов, ликвору, крови, перитонеальной жидкости. У иммуноскомпрометированных больных обычно развиваются пневмонии, бактериемия, септицемия, менингит, эндокардит, абсцессы мозга и легких, эмпиема плевры, медиастенит, перитонит.
В стационарных условиях A. baumannii колонизирует:
- Постельные принадлежности, белье, предметы мебели, водопроводные краны,
- Медицинскую аппаратуру — ИВЛ, инфузоматы, тонометры, термометры, системы переливания крови, катетеры,
- Перчатки, маски, халаты и прочие принадлежности медперсонала,
- Разнообразные растворы,
- Материалы для медицинских манипуляций — гидротерапии, операций, катетеризации, трахеостомии, люмбальной пункции.
Симптоматика
Ацинетобактерии – условно-патогенный микроорганизм, вызывающий инфекционный процесс только при снижении иммунной защиты.
- Воспаление органов дыхания — придаточных пазух носа, трахеи и бронхов, легких,
- Инфицирование крови — бактериемию, септицемию,
- Патологию урогенитального тракта — цистит, уретрит,
- Поражение кожи и мягких тканей,
- Болезни ЦНС — воспаление мозговых оболочек и абсцессы мозга,
- Патологию внутрибрюшного пространства – абсцессы, перитонит,
- Заболевания костей и суставов – остеомиелит, артрит,
- Поражение глаз – неблагоприятно протекающие эндофтальмиты и кератиты.
A. calcoaceticus — возбудитель воспалительных процессов в легочной ткани, урогенитальном тракте, крови. A. junii вызывает у больных бактериемию и сепсис, гнойное воспаление подкожно-жировой клетчатки. A. lwoffii и A. pittii — возбудители гастрита и колита, а A. haemolyticus — кровавой диареи.

Инфекции кровотока, вызванные A. baumannii протекают в форме бактериемии или сепсиса. Входными воротами являются внутрисосудистые катетеры. Микробы могут проникать в кровь из имеющихся очагов – мочевыводящих путей, инфицированных мягких тканей, ожоговых поверхностей, органов брюшной полости и ЦНС. Молниеносная бактериемия проявляется выраженной лихорадкой, сосудистым коллапсом, петехиями, массивными подкожными кровоизлияниями. При отсутствии эффективной терапии у 30% пациентов развивается инфекционно-токсический шок.
При инфицировании дыхательных путей развиваются нозокомиальные пневмонии, которые характеризуются одновременным поражением нескольких сегментов, формированием полостей, плевральным выпотом, образованием бронхоплевральной фистулы. У больных на фоне тяжелой интоксикации появляется удушающий кашель с гнойной мокротой, одышка, дыхание становится шумным с влажными хрипами. Ацинетобактерная пневмония имеет тяжелое течение и с трудом поддается лечению. Нередко она заканчивается смертью больных.
A. baumannii – значимый патоген, инфицирующий ожоговые поверхности и послеоперационные раны. Инфекции кожи и мягких тканей часто осложняются бактериемией. Этот микроб является возбудителем назокомиального менингита и абсцедирования мозгового вещества. У больных возникают характерные признаки: интоксикация, очаговая симптоматика, менингеальные знаки. На коже появляется петехиальная сыпь, в ликворе — плейоцитоз, увеличение уровня белка и молочной кислоты, снижение глюкозы.
Ацинетобактерии в более редких случаях вызывают:
- Перитонит у лиц на диализе;
- Инфицирование мочевыводящих путей при катетеризации мочевого пузыря и нефролитиазе;
- Воспаление желчевыводящих путей после их дренирования;
- Остеомиелиты и артриты, обусловленный травматическим повреждением или установкой имплантатов;
- Поражения глаз, обусловленные инфицирование контактных линз.
Диагностика
Основным диагностическим методом ацинетобактерной инфекции является бактериологический. Он заключается в правильном заборе материала, быстрой его доставке в лабораторию, идентификации выделенного возбудителя, определении его этиологической значимости и чувствительности к антибактериальным средствам.
Материал отбирают до начала противомикробной терапии непосредственно из очага инфекции с соблюдением правил асептики, предупреждающих его контаминацию посторонней микрофлорой. Отбор осуществляют стерильным ватным тампоном, который помещают в специальные транспортные среды. Жидкий биоматериал помещают в стерильные и плотно закрывающиеся контейнеры. Пробы доставляют в лабораторию не позднее 1,5–2 ч от момента отбора.

Материал засевают на жидкие и плотные питательные среды, инкубируют в термостате и учитывают результаты. На плотных средах образуются гладкие, непрозрачные, блестящие, мелкие колонии. На КА через 48 ч формируются выпуклые серовато-белые колонии, иногда окруженные зоной гемолиза. Микроскопическое исследование заключается в изучении окрашенного препарата под световым микроскопом. В мазках из нативного материала доминируют кокки и коккобациллы, а в мазках из культур — палочковидные формы. Ацинетобактерии относятся к грамотрицательным микробам. После выделения чистой культуры проводят идентификацию возбудителя по биохимическим свойствам. Ацинетобактер не ферментирует лактозу и окисляет глюкозу до кислоты.
Обнаружение ацинетобактерий в мокроте в количестве 106 КОЕ/мл – диагностически значимый критерий. В бронхиальном смыве это количество составляет 104 КОЕ/мл, а в моче 105 КОЕ/мл.
Лечение
Лечение ацинетобактерной инфекций — серьезная проблема, актуальность которой растет с каждым днем. Это связано с увеличением частоты встречаемости микробов, повышением их резистентности к лекарствам и снижением эффективности проводимой терапии.

Этиотропное противомикробное лечение заключается в применении следующих препаратов:
При необходимости используют комбинации:
Выбор антибиотика основывается на результатах антибиотикограммы.
При локализованных абсцессах, вызванных этими микроорганизмами, необходимо применять хирургическое дренирование.
Acinetobacter spp. – достаточно проблематичный возбудитель тяжелых состояний и заболеваний, встречающихся в пульмонологической и терапевтической практике. Бактерии вызывают нозокомиальную пневмонию и муковисцидоз, а также целые ряд внебольничных патологий. Эти микроорганизмы обладают природной устойчивостью и приобретенной резистентностью. Большинство штаммов имеют мультирезистентность — устойчивость к основным группам антибиотиков. Члены научного медицинского общества ведут активное наблюдение за состоянием чувствительности таких микробов, создают формуляры и стандарты применения противомикробных средств.
Профилактические мероприятия
Специфическая профилактика ацинетобактерной инфекции в настоящее время не разработана. Неспецифические профилактические мероприятия имеют большое значение, поскольку микроорганизмы имеют высокую резистентность к антибиотикам. Они быстро вырабатывают новые механизмы устойчивости.
В основе профилактических мероприятий госпитальной инфекции лежат принципы и нормы инфекционного контроля.
Мероприятия, предупреждающие инфицирование ацинетобактером :
- Проведение дезинфекционных и антисептических процедур в медучреждениях,
- Исключение контактов с больными людьми,
- Использование средств индивидуальной защиты в местах массового скопления людей в эпидемически опасный период,
- Соблюдение индивидуальных гигиенических норм медперсоналом,
- Рациональное назначение антибиотиков с учетом данных антибиотикограммы,
- Своевременная санация очагов хронической инфекции – лечение кариеса, тонзиллита, синуситов,
- Укрепление иммунитета – закаливание, питание растительной и молочнокислой пищей, занятия спортом, оптимальный режим труда и отдыха, полноценный сон, прогулки на свежем воздухе,
- Поддержание чистоты тела и жилища, регулярное проветривание комнат, влажная уборка в общественных помещениях с хлорсодержащими дезинфектантами,
- Плановое прохождение врачебных осмотров,
- Прием витаминно-минеральных комплексов в весенний и осенний периоды.
Acinetobacter — род микроорганизмов, вызывающих преимущественно внутрибольничную инфекцию и поражающих тяжелобольных пациентов. Эти условно-патогенные микробы являются нормальными обитателями различных локусов человеческого организма. При определенных условиях они активно размножаются и вызывают заболевания внутренних органов и систем, которые требуют проведения специфического противомикробного лечения. Прогноз и исход ацинетобактериальной инфекции зависят от патогенности штамма, активности иммунной системы макроорганизма, своевременности и грамотности назначенного лечения.
Видео: ацинетобактер в программе “Жить здорово!”
Acinetobacter spp. относится к микроорганизмам, свободно живущим в окружающей среде (сапрофиты), па различных объектах в лечебных учреждениях, в воде, пищевых продуктах. Помимо этого Acinetobacter spp. выделяется из различных биотопов (например, с кожи, слизистой оболочки) человека.
Присутствие Acinetobacter spp. в биоматериалах от пациента, находящегося в стационаре, может быть как следствием колонизации слизистых оболочек и кожи, так и причиной инфекционных осложнений различной локализации. У 25% взрослых людей имеет место колонизация кожи, а у 7% детей колонизированы верхние дыхательные пути. Acinetobacter spp., так же как и P. aeruginosa, способна месяцами находиться на различных объектах окружающей среды в жизнеспособном состоянии.
Кроме того, Acinetobacter spp. устойчива ко многим бактерицидным растворам, например к хлоргексидину.
По данным CDC (NNIS), за последние 20 лет значение неферментирующих грамотрицательных палочек рода Acinetobacter как возбудителей НКИ значительно позросло во всем мире. При хирургических вмешательствах Acinetobacter spp. выделяют из гнойных ран в 2,1 % случаев. Вид A. baumannii составляет 80% всех видов этого рода, ответственных за ЕКИ, и поэтому выделение любого другого вида этого рода дает основание предполагать, что имеет место коптам и нация исследуемого биоматериала.
Повторное выделение Acinetobacter spp. из любых биоматериалов важно для исключения контаминации или колонизации и, в конечном счете, для правильной трактовки полученных результатов микробиологических исследований. Следует заметить, что наиболее часто Acinetobacter spp. выделяют при пневмонии (Acinetobacter spp. составляет 6,9% всех возбудителей при этой локализации), особенно если ей предшествовала колонизация слизистых верхних дыхательных путей. Летальность при пневмонии, обусловленной Acinetobacler spp., составляет 40-64%.
Наряду с другими микробами-оппортунистами (такими, как S. maltophilia) Acinetobacter spp. отличается высокой резистентностью к большинству антимикробных препаратов, хотя имеются существенные различия по антибиотикорезистентности штаммов в разных странах и регионах. В настоящее время, по сообщениям различных авторов, большинство штаммов А. baumannii резистентно ко многим классам антимикробных препаратов. Фторхинолоны, тигециклин, цефтазидим, триметоприм/сульфаметоксазол, доксициклин, имипенем, меропенем, дорипенем, полимиксин В и колистин до недавнего времени считались активными против госпитальных штаммов A. baumannii.
Быстрое развитие резистентности A. baumannii к большинству антибиотиков (МDR-Acinetobacter) регистрируется во всем мире. Сульбактам имеет более высокую природную бактерицидную активность против MDR-Acinetobacter в сравнении с тазобактамом и клавулановой кислотой, в то же время отмечается увеличение резистентности и к сульбактаму. Комбинация имипенема с амикацином в исследованиях in vitro показала синергизм в отношении MDR-штаммов, тогда как in vivo эффект менее выражен. Комбинация фторхинолонов с амикацином приемлема, когда имеет место низкая МПК фторхинолонов для госпитальных штаммов A baumannii.
При выделении штаммов МDR-A. baumannii применяют комбинацию полимиксипа В с рифампицином (или с имипенемом, или с азитромицином). Имеется небольшое количество исследований по применению тигециклина для лечения инфекций, обусловленных A. baumannii, но уже сейчас использование этого антибиотика связывают с постепенным увеличением резистентности. По данным из Германии, резистентность к тигециклину среди A. baumannii составляет 6%, тогда как к кол истину — 2,8%.
По данным SENTRY 2001-2004 гг. (30 стран Европы), доля штаммов Acinetobacter spp., резистентных к имипенему, меропенему, ампициллину/сульбактаму и полимиксину В составляет 26,3, 29,6, 51,6 и 2,7% соответственно. Важно отметить, что даже в странах с низким уровнем резистентности феномен распространения MDR-, XDR- или PDR-штаммов A. baumannii пока неясен. Одним из факторов риска MDR-A. baumannii считается назначении карбапенемов и цефалоспоринов III поколения.
Кроме того, риск связан с искусственной вентиляцией легких (ИВЛ), длительным пребыванием в реанимации, оперативным вмешательством, контаминацией окружающих объектов.
Опубликован список из 12 бактерий, устойчивых к действию большинства антибиотиков
Критически высокий уровень приоритетности
- Acinetobacter baumannii
- Pseudomonas aeruginosa
- Enterobacteriaceae
Рейтинг бактерий, устойчивых к антибиотикам, заслуженно возглавляют грамотрицательные микроорганизмы — возбудители большинства нозокомиальных (внутрибольничных) инфекций в отделениях реанимации и интенсивной терапии, гнойной хирургии и онкологии. Вызывают инфекции кожи и мягких тканей, ЖКТ, мочевыводящих путей, раневые, эндокардит, менингит, остеомиелит. У ослабленных пациентов особое значение имеют инфекции кровотока и ИВЛ-ассоциированная пневмония. Для бактерий этой группы практически не осталось антибиотиков резерва.
В терапии карбапенем-резистентной A. baumannii относительно эффективны комбинации антибиотиков: полимиксин Е + рифампицин/карбапенемы/хинолоны/цефепим/ампициллин-сульбактам/пиперациллин-тазобактам.
Синегнойная палочка распространена повсеместно, встречается в почве и воде, на/в растениях, животных, людях. Вызывает до 20 % нозокомиальных инфекций. Чувствительность к антибактериальной терапии очень сильно варьирует. В тяжелых случаях отмечается развитие резистентности к ранее высокоэффективным цефалоспоринам, фторхинолонам, карбапенемам, аминогликозидам, азтреонаму, пиперациллину-тазобактаму. Сохраняется чувствительность к полимиксину Е, а также комбинациям антибиотиков.
Смертность при развитии инфекций, вызванных мультирезистентной P. aeruginosa, варьирует от 5 до 50 %, в зависимости от состояния пациента и локализации процесса.
Из большого семейства энтеробактерий основные проблемы в стационарах доставляют Klebsiella, Escherichia coli, Citrobacter, Salmonella, Enterobacter, Serratia, Proteus. Вызывает опасения растущее повсеместное снижение чувствительности семейства к карбапенемам. Описаны единичные случаи резистентности E. coli ко всем существующим антибиотикам, включая полимиксин Е.
Высокий уровень приоритетности
- Enterococcus faecium
- Staphylococcus aureus
- Helicobacter pylori
- Campylobacter spp.
- Salmonellae
- Neisseria gonorrhoeae
Бактерии второй группы объединены по признаку повсеместного распространения, высокой социально-экономической значимости вызываемых ими заболеваний и быстрого развития резистентности к основным антибиотикам, используемым для их эрадикации, однако в резерве еще остается один или несколько эффективных препаратов.
E. faecium входит в состав нормальной микрофлоры кишечника, но в то же время является условно-патогенным микроорганизмом. У ослабленных больных может вызывать инфекции мочевыводящих путей, раневую инфекцию, сепсис и эндокардит. Резистентен к аминогликозидам, пенициллинам и цефалоспоринам. Беспокойство вызывает снижение чувствительности к ванкомицину — до 72 % в отдельных популяциях. Большинство штаммов E. faecium чувствительны к линезолиду, тигециклину, даптомицину.
Золотистый стафилококк, колонизирующий кожу и слизистые оболочки, способен вызывать тяжелые инфекции кожи и мягких тканей, респираторные, раневые инфекции, остеомиелит, сепсис, артрит, эндокардит. Недавнее появление и распространение ванкомицин- и гликопептид-резистентных штаммов в дополнение метициллин-резистентному S. aureus значительно сужает выбор антибактериальных препаратов, однако у возбудителя сохраняется чувствительность к аминогликозидам, эритромицину, тетрациклину, ко-тримоксазолу, линезолиду.
Тревогу ВОЗ вызывает увеличение случаев резистентности всем известной H. pylori к кларитромицину, что сказывается на эффективности традиционных схем эрадикационной терапии, в том числе и в России. Перед эрадикацией ВОЗ рекомендует проверить чувствительность бактерии к этому антибиотику, при выявлении устойчивости — использовать схемы без него — с метронидазолом, тетрациклином или рифаксимином, а также добавлять висмута трикалия дицитрат.
Бактерии рода Campylobacter удерживают первое место в мире по гастроэнтеритам, которые у большинства населения планеты протекают в легкой форме, но представляют опасность для маленьких детей, беременных, стариков и иммунокомпрометированных больных. В большинстве случаев достаточно регидратации и восстановления электролитного баланса, антибактериальную терапию назначают при тяжелом течении. Проблемой является резистентность Campylobacter к фторхинолонам, основному средству борьбы с кишечной микрофлорой, и макролидам. Устойчивость к этим препаратам, впрочем, сильно варьирует от страны к стране — от менее 5 % в Финляндии до более 90 % в Индии. В Европе и России эритромицин всё еще остается препаратом выбора. По данным микробилогических исследований, в России также еще вполне актуальны фторхинолоны. В запасе для особо тяжелых случаев с осложнениями — гентамицин и карбапенемы.
Представители рода сальмонелл также вызывают набор кишечных инфекций, от легкого энтерита до брюшного тифа. Большинство этих бактерий уже резистентны к бета-лактамам, аминогликозидам, тетрациклинам, хлорамфениколу и ко-тримоксазолу. Устойчивость к фторхинолонам растет во всем мире, но пока не привела к полной бесполезности этих препаратов, они остаются антибиотиками выбора, наравне с макролидами и цефалоспоринами третьего поколения. Антибактериальной терапии требуют только тяжелые случаи кишечных инфекций и, конечно, брюшной тиф и паратифы.
Гонорея из неприятной, но относительно легко излечимой болезни эволюционировала в глобальную медицинскую проблему. Гонококк потерял чувствительность к пенициллинам, тетрациклинам, сульфаниламидам и фторхинолонам.
Особое опасение вызывает появление и постепенное распространение штаммов, резистентных к цефалоспоринам (цефтриаксону), долгое время служивших безотказным средством борьбы с этой инфекцией. При резистентной к стандартным схемам лечения гонорее рекомендовано использовать комбинацию азитромицина с высокими дозами цефтриаксона. В России гонококк также практически резистентен к фторхинолонам, но пока сохраняет 100 %-ную чувствительность к цефтриаксону.
Средний уровень приоритетности
- Streptococcus pneumoniae
- Haemophilus influenzae
- Shigella spp.
Пневмококки — одни из основных возбудителей инфекций ЛОР-органов, внебольничной пневмонии, менингита. Резистентны к тетрациклину и ко-тримоксазолу. В мире постепенно снижается чувствительность S. pneumoniae к бета-лактамам и макролидам, однако, как и в других случаях, доля резистентных штаммов сильно варьирует от страны к стране. В России большинство штаммов пневмококков, к счастью, всё еще чувствительны к пенициллинам и макролидам, также эффективны хлорамфеникол, рифампицин, левофлоксацин, ванкомицин.
Гемофильная инфекция у детей младшего возраста протекает в виде бактериемии, гнойного менингита, пневмонии, целлюлита и эпиглоттита, у взрослых — в основном в виде пневмонии. Тревогу ВОЗ вызывает развитие полной резистентности гемофильной палочки к ранее эффективному ампициллину, в результате чего от него пришлось повсеместно отказаться. В России эффективны амоксициллин, цефалоспорины и макролиды, однако рекомендуется проводить бактериологический анализ с оценкой резистентности.
Возбудители дизентерии практически не чувствительны к ампициллину. Как и прочие энтеробактерии, они также постепенно вырабатывают устойчивость к фторхинолонам, которые тем не менее всё еще остаются препаратами выбора. В качестве альтернативы — цефалоспорины III поколения, ко-тримоксазол.
Итого
Появление устойчивых к антибиотикам бактерий и публикация этого списка в очередной раз привлекают внимание человечества к необходимости создания — в идеале — принципиально новых средств борьбы с микроорганизмами, иначе, по пессимистичным прогнозам, из-за появления бактерий, устойчивых к антибиотикам, через несколько десятилетий одна только послеоперационная летальность может скатиться до уровня начала прошлого века. Разработка таких препаратов — занятие неблагодарное, поэтому фармацевтические компании не стремятся развивать данное направление, и ВОЗ выносит проблему на межгосударственный уровень.
Сводная таблица: чувствительность возбудителей к антибактериальной терапии
Читайте также:


