Инфекции не содержащие рнк днк
Среди опухолеродных вирусов есть ДНК- и РНК-содержащие. ДНК-содержащие вирусы разделяются на следующие 5 классов.
1. Полиомавирусы – обезьяний вирус SV40, вирус полиомы мышей и вирусы человека ВК и JC.
2. Папилломавирусы – 16 вирусов папилломы человека и множество папилломовирусов животных.
3. Аденовирусы – 37 вирусов человека, множество аденовирусов животных (например, 24 вируса обезьян и 9 вирусов крупного рогатого скота).
4. Герповирусы – вирусы простого герпеса человека, цитомегаловирус человека, вирус Эпштейна–Барр и онкогенные вирусы приматов, лошадей, кур, кроликов, лягушек.
5. Вирусы, подобные вирусу гепатита В, – вирус гепатита В человека, гепатита североамериканского сурка, гепатита земляных белок и гепатита уток.
РНК-содержащие опухолеродные вирусы разделяются на 4 класса.
1. Вирусы типа С – возбудители лейкозов и сарком.
2. Вирусы типа В – вирус рака молочных желез мышей.
3. Вирусы типа А.
4. Вирусы типа D – вирус, выделенный при раке молочных желез обезьян резус, и вирус, выделенный из перевиваемых клеток человека.
Объяснение возникновения рака интеграцией вирусного и клеточного геномов, данное Л.А. Зильбером, было понятно для ДНК-содержащих вирусов. Однако его теория сталкивалась с большими трудностями в случае онкогенных вирусов, содержащих РНК, поскольку вирусная РНК не может встраиваться непосредственно в геном клетки.
Между ДНК- и РНК-содержащими опухолеродными вирусами существуют кардинальные различия. При заражении клеток ДНК-содержащими вирусами происходит либо репликация, приводящая к инфекции, либо интеграция геномов, приводящая к трансформации клетки. РНК-содержащие вирусы индуцируют только трансформацию нормальной клетки в злокачественную, т.е. при заражении клетки таким вирусом должна происходить интеграция их геномов.
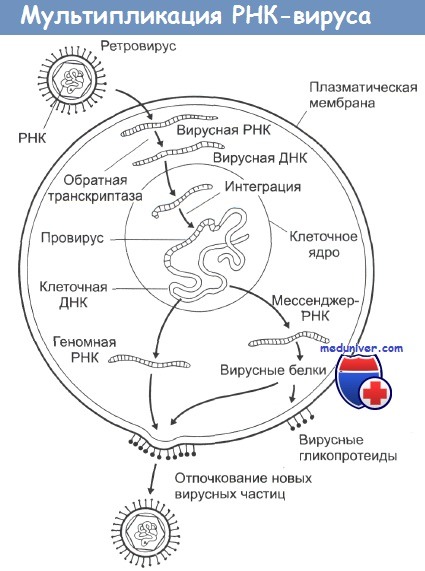
Только в 1970 г. американские ученые Г.Темин и Мицутани и независимо от них Д.Балтимор разрешили эту загадку. Они доказали возможность передачи генетической информации от РНК к ДНК. Это открытие перевернуло центральную догму молекулярной биологии о том, что генетическая информация может переноситься только в направлении ДНК–РНК–белок.
Пять лет понадобилось Г.Темину для обнаружения фермента, осуществляющего перенос информации от РНК к ДНК, – РНК-зависимой ДНК-полимеразы. Этот фермент получил название обратной транскриптазы. Г.Темину удалось не только получить фрагменты ДНК, комплементарные заданной цепи РНК, но и доказать что ДНК-копии могут встраиваться в ДНК клеток и передаваться потомству.
Группа РНК-содержащих вирусов, в цикле развития которых по геномной РНК с помощью обратной транскриптазы осуществляется синтез ДНК, встраивающейся затем в геном клетки хозяина, получила название ретровирусов (Retroviridae – от REversed TRanscription). В семейство ретровирусов входят вирусы саркомы Рауса, миелоцитоматоза, саркомы мышей Харви и Молони, лейкоза птиц, ретикулоэндотелиоза птиц, лейкоза мышей, Т-клеточного лейкоза человека, иммунодефицита человека.
Вирусная ДНК, встроившаяся в геном эукариотической клетки-хозяина, может в течение многих поколений никак себя не проявлять. Однако при определенных условиях вирусные гены могут активироваться и вызывать либо репликацию вируса, либо превращение клетки в раковую.
Многочисленные работы, проведенные в 1970–1980-х гг. показали, что у многих видов животных есть гены, похожие, но не совпадающие с генами ретровирусов. Эти гены животных и человека иногда называют эндогенными ретровирусами (HERV), или провирусами.
Обычно HERV не активны и менее онкогенны для вида-хозяина, чем экзогенные. Возможно, вызывающие рак гены ряда ретровирусов когда-то, на ранних этапах биологической эволюции, закрепились в ДНК предков вида-хозяина. При репликации всей ДНК клетки онкогены передавались из поколения в поколение. По оценкам ученых HERV появились в геноме предков человека приблизительно 50 млн лет назад.
Интеграция экзогенного ретровируса в геном хозяина не сайт-специфична (случайна), поэтому закрепление его в геноме подчиняется достаточно жестким правилам. Поскольку провирус не исчезает из генома, присутствует во всех клетках своего носителя и распространяется по популяции, то его присутствие должно быть безвредным для организма и, возможно, дает какие-то преимущества своему хозяину.
Имеются данные об участии HERV в регуляции экспрессии генов, в эмбриональном развитии, в предотвращении заражения родственными экзогенными ретровирусами, в иммуносупрессии и развитии некоторых аутоиммунных заболеваний.
Необходимо упомянуть также, что существует теория происхождения ретровирусов из клеточных генов. Главную роль в этом процессе отводится обратной транскриптазе, включению созданных ею ДНК в ДНК клетки и процесс рекомбинации (Г.Темин).
Опухолеродные вирусы, как правило, видоспецифичны, т.е. поражают животных только определенного вида. Но из каждого правила есть исключения. Например, вирусом куриной саркомы можно заразить крыс, кроликов, хомячков, обезьян, ящериц и даже змей.
Группа ученых под руководством Б.А. Лапина установила, что вирус лейкоза человека может вызывать сходное заболевание у двух видов обезьян. Это привело к созданию экспериментальной модели для изучения всех стадий развития заболевания, начиная с самых первых этапов.
Исследователи показали, что при заражении клетки ретровирусом синтез его ДНК происходит в два этапа: вначале по нити вирусной РНК синтезируется комплементарная ей нить ДНК, затем на последней достраивается комплементарная ей вторая нить ДНК и одновременно происходит, деградация нити РНК вируса.
Онковирусы могут принимать участие в развитии иммунологических заболеваний. Так, при изучении красной волчанки методом молекулярной гибридизации было показано, что в ДНК клеток пораженных болезнью тканей имеются последовательности, комплементарные РНК вируса кори и обратная транскриптаза. Это указывало на экспрессию онковируса в клетках больных волчанкой.
На основании полученных данных было высказано предположение, что на начальных стадиях заболевания происходит взаимодействие коревого вируса с латентным онковирусом. В результате обратная транскриптаза онковируса транскрибирует коревую РНК в ДНК, которая затем встраивается в геном клетки. Экспрессия этих дополнительных генов проявляется в синтезе специфических вирусных белков, часть из которых встраивается в мембраны клеток и изменяет их свойства. Эти клетки становятся чужеродными для организма и подвергаются атаке собственной иммунной системы.
Онковирусы могут активироваться при трансплантации (пересадке) тканей. Рассмотрим следующий пример. При скрещивании двух чистых линий мышей рождается потомство, толерантное к пересадке тканей любого из родителей: все виды тканей, включая и лимфоидную, содержащую иммуноактивные клетки, приживаются. Однако если перед пересадкой лимфоидной ткани у реципиента подавить иммунную систему, то после трансплантации у мышей резко усиливается экспрессия онковирусов. С течением времени у животных развиваются злокачественные лимфомы.
Возможно, онковирусы – нормальные компоненты организма, принимающие участие в процессах клеточного цикла, дифференциации и пролиферации. Тогда старение, действие физических и химических канцерогенов может вызвать развитие рака. Однако присутствие канцерогенов нехарактерно для естественной среды обитания, а заболевание особей, вышедших из репродуктивного периода, не может отразиться на судьбе популяции. В то же время, интегрированный в геном клетки онковирус
Во время нашего путешествия в микромир вы о вирусах доброго слова не услышали. Действительно, они – враги всего живого. Но нельзя ли врагов превратить в друзей?
Открытие вирусов, вызывающих злокачественные опухоли у животных, произошло еще на рубеже XIX и XX веков. В 1910 г. Пейтон Рауш обнаружил, что бесклеточный фильтрат из тканей птичьей саркомы может вызывать развитие аналогичной саркомы у цыплят. Примерно в это же время была доказана вирусная природа птичьего миелобластоза. Позднее было обнаружено, что часто проходит весьма значительный латентный период между инфицированием вирусом и развитием рака.
Тем не менее вплоть до 1960-х годов не существовало четких доказательств того, что инкорпорация вирусной ДНК в геном клетки является необходимым условием развития злокачественной трансформации, как не было и случаев выделения вирусной ДНК из раковых клеток.
РНК-содержащие вирусы вызывают развитие целого ряда различных опухолей у животных, при этом наиболее распространена индукция этими вирусами лимфом, лейкемий и сарком. Типичная структура таких вирусов - это две идентичные цепочки молекул РНК в сочетании с ферментом обратная транскриптаза, одетых в гликопротеиновую оболочку. При инфицировании вирусом его обратная транскриптаза заставляет клетки синтезировать ДНК, комплементарную вирусной РНК.
Эта ДНК затем встраивается в клеточные хромосомы, и на ее основе клетка уже сама начинает синтез новых вирусных белков, вирусных обратных транскриптаз и элементов гликопротеиновой оболочки. Из-за механизма их действия этот тип вирусов получил название ретровирусы. Все они имеют весьма схожий внешний вид на электронных микрофотографиях и являются самыми маленькими из известных вирусов.
Некоторые из ретровирусов (например, вирусы птичьего лейкоза, кошачьей и мышиной лейкемии) содержат в себе только три гена и обладают очень длительным инкубационным периодом с момента заражения до возникновения опухоли. Другие вирусы (например, вирус саркомы Рауса (ВСР)) вызывают очень быструю злокачественную трансформацию и могут быть выделены из культуры опухолевых клеток.
Показано, что вирус ВСР содержит особый ген (v-src), способный вызывать трансформацию фибробластов in vitro. Этот ген кодирует наработку протеинкиназы, которая фосфорилирует тирозин. К сожалению, действие этой протеинкиназы запускает целый каскад различных метаболических процессов, и очень сложно оценить, какой именно из них ведет к злокачественной трансформации.
В настоящее время известно, что и нормальные, и злокачественные клетки содержат в своем генотипе участки ДНК, сходные или идентичные ряду последовательностей онкогенных РНК-содержащих вирусов. Такие участки получили название клеточных прото-онкогенов (чтобы отличать их от вирусных онкогенов). Постулируется, что активация этих участков, возникающая в результате канцерогенного воздействия, запускает целую цепочку событий, ведущую в итоге к злокачественной трансформации клетки. Считается также, что ретровирусы инкорпорировали эти клеточные участки в свой геном в процессе эволюции.
В настоящее время мы лучше понимаем механизмы действия продуктов вирусной активации. Примером такого продукта является протеинкиназа, активируемая геном sre, а также целый ряд других вирус-индуцированных канцерогенов. Это и рецепторы к эпидермальному фактору роста, продуцируемые геном v-erb, и тромбоцитарный фактор роста (ТФР), кодируемый фрагментами гена v-sis, и целый ряд связывающихся с ядром клетки белков, продукцию которых вызывает вирус птичьей лейкемии.
Как нормальные, так и раковые клетки содержат в себе участки последовательностей ДНК, гомологичные РНК онкогенных вирусов. Если происходит экспрессия или активация под действием канцерогенов этих клеточных онкогенов, это ведет к злокачественной трансформации клеток.
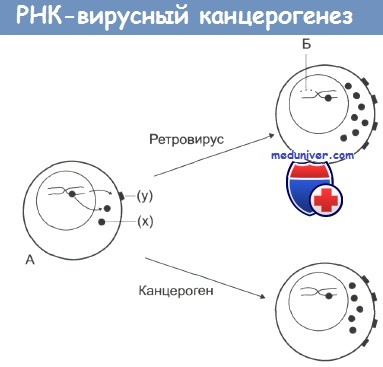
Онкогенная и злокачественная трансформация.
На стадии А нормальная клетка, которая характеризуется низкой протоонкогенной активностью, продуцирует фактор роста (х) или белки дифференцировки или рецепторы (у).
Канцерогены повышают активность протоонкогенов, что дает начало неопластической трансформации.
По другому механизму: при заражении ретровирусом происходит внедрение в ДНК клетки вирусных промоторов или онкогенов (Б), что также ведет к увеличению онкогенной активности и последующей злокачественной трансформации.
Первым ретровирусом, для которого была однозначно доказана связь со злокачественными новообразованиями, был вирус Т-клеточной лейкемии человека (ВТКЛ-1), выделенный из клеток хронической кожной Т-лимфомы. Этот вирус довольно широко распространен, может передаваться половым путем, через кровь, особенно в среде наркоманов, и от беременной женщины к плоду. Первоначально эндемический ареал циркуляции данного вируса был в основном представлен тропическими странами, однако в настоящее время в США серопозитивная реакция на вирус обнаруживается у каждого из 4000 человек населения. Кроме Т-клеточной лейкемии вирус вызывает тропический спастический паралич.
После 20 лет наблюдения за серопозитивными пациентами оценено, что риск развития последнего заболевания составляет около 5%. Один из вирусных генов, а именно tax-ген, вызывает увеличение продукции клеточного интерлейкина-2 (ИЛ-2) и его рецепторов, что является основным фактором, стимулирующим деление Т-клеток.
Ретровирусы могут вызывать опухолевые заболевания не напрямую, а опосредованно, как это было показано для вируса иммунодефицита человека (ВИЧ-1), вызывающего развитие СПИДа. Случаи развития рака у ВИЧ-инфицированных рассмотрены в одном из обзоров. Отмечается, что у ВИЧ-инфицированных наиболее часто развиваются три типа опухолей: мгновенная или высокозлокачественная В-клеточная лимфома; саркома Капоши (СК, которую вызывает другой вирус — герпесвирус ГСК, или герпесвирус 8); карцинома шейки матки.
До разработки эффективных методов терапии ВИЧ-инфицированных более 40% из них заболевали тем или иным видом рака. Тем не менее связь этого вируса с развитием онкологических заболеваний скорее всего косвенная и опосредована развитием общей хронической иммунодепрессии организма, которая и позволяет другим канцерогенным вирусам вызывать рак. В-клеточные лимфомы также характеризуются довольно сложным патогенезом. Хотя В-клетки не поражаются вирусом ВИЧ-1, они могут быть мишенью для других типов вирусов, например для вируса Эпштейна-Барра (ВЭБ). Рак шейки матки у женщин также развивается на основе вторичной вирусной инфекции — вируса папилломы человека (ВПЧ), на фоне общей иммунодепрессии, вызванной ВИЧ-1. По причине общего снижения иммунных реакций организма все эти опухоли развиваются особенно быстро и агрессивно.
Показано, что РНК-содержащий вирус гепатита С значительно увеличивает риск заболевания гепатоклеточной карциномой. У больных, инфицированных этим вирусом, риск развития раковой опухоли возрастает в 100 раз, но механизмы его канцерогенного действия в настоящее время почти не изучены. Если больной заражен еще и вирусом гепатита В, риск развития рака печени возрастает многократно. На земном шаре одним или обоими из этих вирусов заражено около миллиарда человек.
ВИРУСНЫЕ ИНФЕКЦИИ
Эпидемиология.Вирусы являются возбудителями многих болезней, например респираторные инфекции вызываются более чем 200 вирусами, включая их серотипы, вирусами гриппа типов А, В, С, вирусами паротита человека 4 типов, реовирусами (115 серотипов), кишечными вирусами, коронавирусами, аденовирусами (42 серотипа) и др. Вирусные гастроэнтериты вызываются 7 группами вирусов. Распространенными вирусными инфекциями являются корь и герпетическая инфекция. В определенных регионах распространены арбовирусные инфекции, передаваемые насекомыми (в основном клещами и комарами).
Некоторые вирусы (краснухи, цитомегалии, паротита) могут передаваться трансплацентарно и вызывать выкидыши, гибель плода, врожденные пороки развития. Вирусы являются возбудителями медленных инфекций, характеризующихся поражением центральной нервной системы.
Вирусы имеют отношение к канцерогенезу, способствуя превращению нормального клеточного гена в онкоген.
Вирусы представляют собой важный фактор эволюции органического мира. Преодолевая видовые барьеры, вирусы могут переносить отдельные гены или группы генов из клетки в клетку.
Патогенез.Все вирусы являются облигатными внутриклеточными паразитами. На поверхности вирусов имеются белки, способные связываться со специфическими рецепторными белками на поверхности клеток хозяина, причем функции многих из этих рецепторов хорошо известны (например, вирус бешенства связывает рецептор ацетилхолина на нейронах, а вирус Эпштейна—Барра — рецептор комплемента на макрофагах). Кроме того, внутри определенных типов клеток происходит репликация вирусов.
Проникновение вириона или его части, содержащей геном, и специфических полимераз происходит путем транслокации целого вируса сквозь плазматическую мембрану посредством слияния вирусной оболочки с клеточной мембраной или с помощью обусловленного рецептором эндоцитоза вируса и слияния с мембраной эндосом.
В процессе репликации вирус использует определенные ферменты клетки, характерные для каждого семейства вирусов. Вирусная инфекция может быть абортивной (при неполном цикле репликации вируса), латентной (например, вирус герпеса персистирует в нервных ганглиях) и персистирующей (вирионы синтезируются постоянно).
Классификация.Все вирусные инфекции можно условно разделить на две большие группы: вирусные инфекции, вызываемые РНК- и ДНК-содержащими вирусами.
1. Аденовирусы.Имеют наиболее важное клиническое значение, так как способны вызывать острые заболевания органов дыхания и конъюнктивы. Аденовирусывступают во взаимодействие с клетками организма хозяина, вызывая три вида повреждений1) могут проходить в клетках полный цикл репликации, вызывая их гибель (например, в эпителиальных клетках 2) в лимфоидных клетках могут существовать в виде латентной или хронической инфекции. При этом за пределы клеток выделяется незначительное количество вирусов 3) могут участвовать в онкогенной трансформации клеток.
Аденовирусные инфекции человека убиквитарны. Первичное инфицирование человека происходит обычно в первые годы жизни. Серотип аденовируса и характер заболевания тесно связаны с возрастом больного.
В неэпидемический период примерно в половине случаев инфицирование аденовирусом не приводит к заболеванию. В то же время возникновение 10 % респираторных заболеваний у детей связано с аденовирусом. Эти заболевания протекают в форме фарингита или трахеита.
В летний период аденовирусная инфекция у детей может протекать в форме фарингоконъюнктивальной лихорадки, которая характеризуется острым началом, развитием конъюнктивита, фарингита, ринита и тонзиллита. Продолжительность заболевания 3—5 дней.
Кератоконъюнктивит встречается у взрослых и протекает как эпидемическая вспышка. Инкубационный период может достигать А—24 дней, а продолжительность заболевания — 1—4 нед.
Аденовирусы могут также вызывать развитие геморрагического цистита, диарею у детей, энцефалит и минингоэнцефалит, однако эти формы инфекции встречаются значительно реже.
2. Вирусы герпеса.Представляют собой одно из самых больших семейств вирусов и включают около 80 разновидностей. Вирусы герпеса делятся на три подсемейства: а-вирусы герпеса быстро растут и быстро разрушают ткани хозяина; (3-вирусы герпеса растут медленно и лишь в определенном типе клеток; -у-вирусы герпеса растут медленно и почти исключительно в лимфоидных клетках их естественного хозяина.
Вирусы герпеса способны заражать клетки различных типов. Например, вирус herpes simplex растет в эпителиальных клетках и фибробластах человека, обезьяны, кролика, мыши и многих других животных. Вирус varicella/zoster лучше всего растет в эпителиальных клетках и фибробластах человека. Цитомегаловирус хорошо растет только в культуре фибробластов человека. Вирус Эпштейна—Барра можно культивировать только в В-лимфоцитах.
Все вирусы герпеса вызывают продолжительную латентную инфекцию. Вирусы герпеса неустойчивы и не могут длительное время выживать в окружающей среде, поэтому заражение обычно происходит при попадании на чувствительные к вирусу ткани хозяина свежей, содержащей вирусы жидкости из тела больного. Чувствительностью к вирусу герпеса обладают слизистая оболочка ротовой полости, глаза, половых органов, заднего прохода, дыхательных путей, а также эндотелий сосудов.
Вирус герпеса вызывает развитие заболевания путем разрушения тканей, провоцируя иммунопатологический ответ, а также вызывая неопластическую трансформацию клеток. Цитопатогенный механизм действия вируса представлен энцефалитом, пневмонитом и гепатитом. Мультиформная эритема, гемолитическая анемия и тромбоцитопения являются иммунологически обусловленными. Известна связь вируса Эпштейна—Барр с некоторыми В-клеточными лимфомами и назофарингеальной карциномой.
Вирус герпеса вызывает развитие множества заболеваний, которые могут быть условно сгруппированы в болезни кожи и слизистых оболочек, органов, центральной нервной системы и реактивные синдромы.
Herpes simplex virus (HSV).Инфекции, вызываемые вирусом простого герпеса (herpes simplex), являются одними из самых распространенных у человека. Заражение HSV-1 происходит через секрет слизистой оболочки полости рта, a HSV-2 — через секрет слизистой оболочки половых органов.
В случае, если входными воротами инфекции является кожа, репликация вируса происходит в парабазальных и промежуточных эпителиальных клетках, которые затем подвергаются лизису, а в месте повреждения развивается воспалительный процесс, образуются тонкостенные пузырьки, появляются многоядерные клетки, отек. Лимфатические узлы набухают. Дальнейшая репликация вируса может привести к виремии и висцеральной диссеминации в зависимости от иммунного статуса больного. Впоследствии включаются защитные механизмы, такие как продукция интерферонов, естественные киллеры, защитные антитела.
После первичного инфицирования вирус простого герпеса может локализоваться в нейронах нервных узлов (ганглиев). Реактивированный вирус движется к кожным покровам и слизистым оболочкам по периферическим нервам.
Первичная инфекция HS V-1 часто бессимптомна, но может протекать в виде гингивостоматшпа и фарингита. Инкубационный период 2—12 дней. Заболевание начинается с лихорадки, болей в горле с отеком глотки и эритемы. Вскоре после начала заболевания на слизистой оболочке глотки и полости рта появляются мелкие пузырьки, которые быстро изъязвляются. Процесс часто затрагивает также мягкое небо и язык. Продолжительность заболевания 10—14 дней. Необходимо провести дифференциальную диагностику со стрептококковым и дифтеритическим фарингитом, афтозным стоматитом и инфекционным мононуклеозом.
Поражение глаз HSV-1 сопровождается фотофобией, хемозом, отеком век. При первичном инфицировании развивается односторонний фолликулярный конъюнктивит и/или блефарит с пузырьками по краям век.
Первичную гениталъную инфекцию вызывает HSV-2 (в 70—95 %). Инкубационный период 2—7 дней. У мужчин везикулярные повреждения возникают на головке полового члена и крайней плоти, а у женщин — на вульве, ягодицах, шейке матки и во влагалище. Пузырьки быстро изъязвляются, особенно у женщин. Проводится дифференциальный диагноз с сифилисом, генитальными проявлениями мультиформной эритемы и локальным кандидозом.
Для герпетической инфекции характерно рецидивирующее течение. Осложнения относительно редки. К ним относят герпетический энцефалит, герпетическое поражение новорожденного.
Герпетическая инфекция нередко возникает после пересадки органов и тканей, у больных СПИДом. Кроме того, генитальный герпес рассматривают в качестве фактора риска заражения вирусом иммунодефицита человека.
Для диагностики герпетической инфекции используют цитопатическое действие HSV на культуру клеток эмбриональной почки, почки кролика и амниона человека. Для типирования и идентификации индивидуального антигена HSV используют мо-ноклональные антитела. Для экспресс-диагностики мазки, полученные с поврежденных участков кожи или слизистых оболочек, окрашивают по Романовскому—Гимзе. Обнаружение в мазках многоядерных гигантских клеток свидетельствует о наличии инфекции HSV или вируса varicella/zoster.
Varicella/zoster virus (VZV).Вирус varicella/zoster вызывает два различных заболевания: ветряную оспу и опоясывающий лишай (herpes zoster).
Ветряная оспа (varicella) является убиквитарным и чрезвычайно контагиозным заболеванием, которое характеризуется сезонным возникновением и течет в виде эпидемий. Единственным резервуаром вируса ветряной оспы являются люди. Ежегодно в мире ветряной оспой заболевают 3—4 млн человек. До 90 % заболевших составляют дети в возрасте до 13 лет (школьный возраст). Среди лиц старше 15 лет к вирусу чувствительны не более 10 %.
Ветряная оспа протекает в виде кожной сыпи с невысокой лихорадкой. Обычно заболевание продолжается 3—5 дней и сопровождается недомоганием, кожным зудом и отсутствием аппетита. Кожные проявления представлены макулопапулезной сыпью, пузырьками и корками, отражающими стадии эволюции сыпи.
Самым серьезным осложнением ветряной оспы считается энцефалит, который возникает у 0,1—0,2 % больных и особенно тяжело протекает у взрослых. Летальность при этом осложнении ветряной оспы достигает 5—20 %, а у 15 % выживших наблюдаются остаточные явления. Кроме того, ветряная оспа может осложниться пневмонитом.
Возбудителя опоясывающего лишая (herpes zoster) после первичной инфекции находят в ганглиях дорсальных корешков спинного мозга, в которых обнаруживают сателлитоз, лимфоцитарную инфильтрацию и деструкцию ганглиозных клеток. В клетках ганглиев находят также внутриядерные включения. Herpes zoster встречается у людей всех возрастов, однако до 20 % заболевших люди старческого возраста.
Herpes zoster, или опоясывающий герпес (лишай), характеризуется односторонними пузырьковыми высыпаниями на коже грудной или поясничной области и сопровождается сильными болями. К необычной локализации herpes zoster относят веки, кончик носа, проекции верхнечелюстной и нижнечелюстной ветвей тройничного нерва (язык, мягкое и твердое небо). После исчезновения кожных проявлений до 50 % больных страдают постгерпетическими невралгиями.
Наиболее серьезными осложнениями опоясывающего герпеса являются менингоэнцефалит и энцефалит.
Односторонние везикулярные поражения кожных покровов могут вызывать также HSV и вирус Коксаки. В подобных случаях наилучшим способом идентификации вируса остается метод культуры ткани. Кроме того, используются моноклональные антитела и PCR-анализ.
Цитомегаловирусвызывает врожденный синдром у новорожденных, который нередко является причиной их смерти. У детей и взрослых цитомегаловирус вызывает цитомегаловирусный мононуклеоз. Диагноз цитомегаловирусной инфекции можно поставить только лабораторным путем.
Заболевания, вызываемые цитомегаловирусом, чаще всего встречаются в Африке и Юго-Восточной Азии. Заражение обычно происходит при переливаниях крови и половых контактах (особенно гомосексуальных). Заражение чаще всего происходит через шейку матки и сперму. Через шейку матки возможно также заражение новорожденного при прохождении его через родовой канал. Существует также связь между цитомегаловирусной инфекцией и СПИДом. Так, 30—40 % гомосексуалистов, в семени которых обнаружен цитомегаловирус, являются ВИЧ-положительными.
Симптомы заболевания обнаруживаются лишь у V4 новорожденных, зараженных цитомегаловирусом. Классическое врожденное цитомегаловирусное заболевание характеризуется желтухой, гепатоспленомегалией, петехиальными высыпаниями и множественными поражениями внутренних органов. Кроме того, изредка наблюдаются микроцефалия, нарушения движений, хориоретинит и отложения солей кальция в мозге. Сразу после рождения развиваются летаргия, нарушения дыхания, эпилептические припадки. Смерть больного наступает через несколько дней или недель.
У выживших больных некоторое время наблюдаются геморрагическая пневмония, желтуха, гепатоспленомегалия. Однако остаточные явления в виде микроцефалии, отставания в умственном развитии, двигательных нарушений могут проявиться в более поздний период.
При постнатальном заражении цитомегаловирусом диффузное висцеральное поражение и повреждение центральной нервной системы встречаются редко. Чаще заболевание протекает в виде цитомегаловирусного мононуклеоза и сопровождается респираторными заболеваниями (фарингит, бронхит, пневмония, круп).
У взрослых пациентов трудно отличить мононуклеоз, вызванный цитомегаловирусом, от мононуклеоза, вызванного вирусом Эпштейна—Барра. Характерен лимфоцитоз с большим количеством атипичных лимфоцитов. Увеличение лимфатических узлов и селезенки не всегда выражено.
Среди осложнений мононуклеоза выделяют интерстициальный пневмонит, гепатит, синдром Гийена—Барре (острый первичный идиопатический полирадикулоневрит), менингоэнцефалит, миокардит.
Вирус Эпштейна—Барр.Убиквитарный вирус герпеса человека, который является возбудителем инфекционного мононуклеоза. Кроме того, установлена связь между заражением человека вирусом Эпштейна—Барр и развитием у него лимфомы Беркитта и назофарингеальной карциномы. Антитела к вирусу Эпштейна—Барр обнаружены у 90—95 % взрослого населения.
Считают, что вирус Эпштейна—Барр проникает в организм через лимфоэпителиальное кольцо глотки, а репликация вируса происходит в лимфоретикулярной системе.
В острый период инфекционного мононуклеоза наблюдается умеренное увеличение всех лимфатических узлов. В лимфатических узлах находят умеренно активные лимфоидные фолликулы с увеличенными герменативными центрами, содержащими бластные клетки, гистиоциты и лимфоциты. Селезенка в 2—3 раза увеличена в размерах. Капсула селезенки и трабекулы отечны, истончены и пронизаны лимфоидными клетками. Увеличение селезенки происходит за счет гиперплазии красной пульпы, в которой появляются полиморфные властные клетки. Белая пульпа остается относительно нормальной. В биоптатах миндалин находят интенсивную пролиферацию клеток, многочисленные митозы.
Основные клинические проявления инфекционного мононуклеоза сводятся к триаде симптомов: болям в глотке, лихорадке и лимфаденопатии.
Среди осложнений инфекционного мононуклеоза выделяют гематологические (аутоиммунная гемолитическая анемия), разрыв селезенки, неврологические (энцефалит, менингит), печеночные (гепатит, цирроз), сердечные (перикардит, миокардит), легочные (пневмонии).
Осложнения являются основными причинами смерти больных инфекционным мононуклеозом.
3. Паповавирусы.Разновидность паповавирусов — папилломавирусы человека — широко распространены среди населения и вызывают развитие эпителиальных опухолей кожи и слизистых оболочек, а также злокачественных опухолей половых органов.
Папилломавирусы поражают все виды многослойного плоского эпителия, а их репликация скорее всего происходит в ба-зальном слое эпидермиса. В процессе трансформации клеток эпидермиса вирусные частицы, связанные с ядром, перемещаются в поверхностные слои эпидермиса. Одновременно в эпидермисе развиваются акантоз, паракератоз и гиперкератоз, нарушается механизм иммунологической активации кератиноцитов и естественных киллеров, меняется количество внутриэпидермальных макрофагов (клетки Лангерганса) и Т-хелперов.
Наиболее частым проявлением инфекции папилломавирусами служат кожные бородавки. Общие бородавки представляют собой хорошо отграниченные папулоподобные образования с шероховатой поверхностью (гиперкератоз). Они могут возникать на руках, между пальцами, вокруг ногтей и реже на слизистых оболочках.
Глубокие подошвенные бородавки встречаются у молодых людей и лиц старческого возраста и состоят из пучков кератиновых волокон и кровоточащих кровеносных сосудов.
Аногенитальные бородавки представляют собой серого цвета папулы на широкой ножке с признаками выраженного гиперкератоза.
4. Гепаднавирусы.Резервуаром вируса гепатита В (HBV) является человек. Острый и хронический гепатит В представлен комплексом клинических признаков: некроза гепатоцитов, воспаления и регенерации ткани печени, возникающих в ответ на инфицирование гепатоцитов вирусом гепатита В.
О гепатите В см. лекцию 12 "Болезни печени".
Не нашли то, что искали? Воспользуйтесь поиском:
Читайте также:


