Иммунитет при протозойных инфекциях
Как и при всех других инфекциях, при болезнях, вызываемых простейшими (Protozoa), инфекционный процесс и развивающийся по ходу его приобретенный иммунитет формируются на основе взаимоотношений хозяина и паразита.
Судьба возбудителя инфекции, проникающего в организм животного или человека, в первую очередь зависит от иммунологического состояния хозяина, которое Ш. Д. Мошковский характеризует как совокупность свойств макроорганизма, определяющих его взаимоотношения с данным возбудителем. Состояние организма хозяина до встречи с антигенами возбудителя (а также с антигенами неживой природы) обозначается Ш. Д. Мошковским как первичное, после встречи — как вторичное иммунологическое. Принципиальное различие между обоими формами иммунологического состояния заключается в том, что при вторичном иммунологическом состоянии к комплексу неспецифических факторов защиты присоединяются факторы специфической защиты — антитела.
Естественный иммунитет. При протозойных инфекциях естественный иммунитет, так же как при инфекциях другой этиологии, может быть абсолютным и относительным.
Абсолютный иммунитет обусловлен полным несоответствием условий в организме хозяина для развития и размножения возбудителей инфекции.
Относительный иммунитет выражается в большей или меньшей способности организма преодолевать инфекцию. Эта способность, как и при инфекциях, вызываемых возбудителями другой природы, может зависеть от ряда условий.
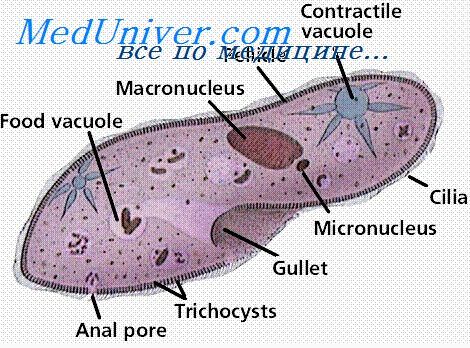
Одним из важнейших факторов, определяющих напряженность относительного иммунитета, является возраст. При ряде протозойных инфекций резистентность организма хозяина с возрастом значительно меняется. Некоторые инфекции у детей и молодых животных протекают тяжело, часто со смертельным исходом, в то время как у взрослых наблюдается более легкое, иногда бессимптомное течение. Примером может служить американский трипаносомоз (болезнь Шагаса). Инфекция Plasmodium berghei, смертельная для молодых крысят, у большинства взрослых крыс протекает доброкачественно.
При некоторых инфекциях наблюдаются обратные отношения. Так, например, при бабезиозе (Meitz, 1956) жеребята, ягнята, козлята, поросята до 3-месячного возраста проявляют высокую степень резистентности к соответствующим видам бабезий. Щенята, наоборот, очень чувствительны к этой инфекции. Предполагается, что эти различия обусловлены разной быстротой обратного развития тимуса, которому в последнее время приписывается значительная роль в формировании иммунитета. У щенят атрофия зобной железы наступает через несколько дней после рождения, у других животных — через несколько месяцев.
Большая роль в иммунитете к протозойным инфекциям принадлежит селезенке. Skrabolo и Deanovic (1957) описали у человека с удаленной селезенкой тяжелый пироплазмоз со смертельным исходом, вызванный Babesia bovis. Лица, не лишенные этого органа, к пироплазмозу невосприимчивы. Garnham и Вгау (1959) и Вгау и Garnham (1961) наблюдали тяжелую инфекцию Babesia divergans у шимпанзе только после спленэктомни. Хорошо изучена роль селезенки при малярии — экстирпация этого органа у людей, а также у обезьян в латентной (после серии первичных приступов) фазе инфекции приводит к развитию тяжелого, часто смертельного рецидива.
Известна различная степень восприимчивости у разных пород животных одного вида к одному и тому же возбудителю: у крупного рогатого скота породы зебу высокая чувствительность к Trypanosoma vivax и значительно меньшая у карликовой породы рогатого скота — ндама. Беспородные белые мыши, а также мыши разных линий высоко чувствительны к Plasmodium berghei, вызывающему у них острую смертельную инфекцию. Но у одной породы мышей — NMRI, наблюдается выраженная резистентность к данному паразиту — инфекция протекает легко и заканчивается выздоровлением (Kretschmar, 1962).
Простейшие, как и возбудители других инфекций и инвазий, для своего нормального развития и размножения в организме зараженного хозяина нуждаются в витаминах и других веществах, исключение которых из раниона больного или животного способствует более легкому течению и даже выздоровлению. Taк Maegraith и др., Hawking (1953, 1954) в опытах с Р. bеrghei показали, что у зараженных крыс, содержавшихся исключительно на маточной диете, инфекция не развивается. При добавлении парааминобензойной кислоты инфекция у крыс развивалась нормально. То же установлено и при некоторых формах малярии обезьян — P. knowlesi (Singh и др., 1953), P. cynomolgi (Вгау и Garnham, 1953; Hawking, 1954).
Некоторые виды малярийных паразитов нуждаются в пантотеноновой, фолиевой кислоте, метнонине и др. Для трипаносом необходима пантотеновая кислота.
Питание влияет на взаимоотношения хозяина и паразита и через организм хозяина, усиливая или ослабляя его сопротивляемость.
Невосприимчивость животных к возбудителям протозойных болезней является следствием естественного (врожденного) или приобретенного иммунитета.
Естественный иммунитет обусловлен врожденными биологическими особенностями организма животных, он является, как правило, видовым признаком хозяина. Способность организма животного противостоять патогенному воздействию возбудителя проявляется в зависимости от его возраста, породы, состояния естественной резистентности и условий, в которых находится животное (кормление, содержание и температура окружающей среды).
Естественный иммунитет к возбудителям может быть абсолютным или относительным. Абсолютный иммунитет наблюдают в тем случае, если при всех условиях снижения резистентности организм зевается невосприимчивым к возбудителям. Например, лошади не заражаются возбудителем тейлериоза крупного рогатого скота. Следовательно, у лошадей имеется абсолютный иммунитет к возбудителю тейлериоза крупного рогатого скота. Относительный иммунитет у животного проявляется в том случае, если возможно преодолеть его естественную резистентность и вызвать заражение. Так, взрослые мыши невосприимчивы к пироплазмам лошадей и собак, а новорожденные мыши заражаются указанными возбудителями. Таким образом, мыши имеют относительный естественный иммунитет к пироплазмидам животных.
Возможно, что абсолютная невосприимчивость к возбудителям протозойных болезней у многих видов животных может быть преодолена применением соответствующих методов и средств, снижающих естественную резистентность.
Приобретенный иммунитет к возбудителям протозойных болезней в зависимости от их вида может быть стерильным и нестерильным. Нестерильный иммунитет называют премуницией. С исчезновением возбудителя из организма кончается и премуниция.
Приобретенный иммунитет к протозойным болезням у животных обусловлен клеточным и гуморальным факторами, тесно связанными между собой. Фагоцитирующие клетки имеют значение в механизме усвоения антигенов и образования антител. В то же время образующиеся специфические антитела повышают фагоцитоз.
Организм, находящийся в утробе матери, защищен от большинства патогенных простейших, поскольку паразиты не могут пройти через неповрежденный плацентарный барьер, если даже животное больное или является паразитоносителем. Не проникают через плаценту и антитела, (последние попадают в плод у собак и овец). У новорожденных неспецифические защитные гуморальные факторы, как правило, отсутствуют, так как глобулины в постэмбриональный период еще не вырабатываются или же поступают в кровь в очень незначительном количестве. В организме иммуноглобулины начинают вырабатываться с 4-недельного возраста. Но в то же время в постэмбриональный период у животных резко выражена фагоцитарная способность. В этот период в защите молодого организма от возбудителей протозойных болезней принимают участие фагоциты и антитела, поступающие вместе с молозивом и молоком матери. Степень этой защиты у различных видов животных выражена по-разному. Например, у щенят очень высокая чувствительность к заражению их пироплазмами, а у телят повышенная устойчивость к бабезиидам по сравнению со взрослыми. У птиц в раннем возрасте гуморальные факторы защиты от возбудителей инвазии выражены незначительно, а фагоцитоз проявляется активно.
В защите животных от возбудителей протозойных заболеваний большое значение имеет клеточная система организма. Это подтверждается следующим опытом: если у животного-паразитоносителя удалить селезенку (основное депо фагоцитов), то у пего возникает рецидив данной болезни, которая излечивается уже с большим трудом. В процессе стимуляции защитных механизмов инвазированного организма принимают участие и гормоны, которые стимулируют или угнетают образование лимфоцитов. Все процессы выработки антител регулируются гипоталамо-гипофизо-адренокортиковой системой организма.
В возникновении гуморальных реакций иммунитета на антиген у животных при протозойных болезнях имеется полная аналогия в образовании антител при инфицировании их бактериями и вирусами. При протозойных болезнях установлены специфические комплементсвязывающие антитела, агглютинины, преципитины и другие антитела. Наибольшее практическое значение и использование получила реакция связывания комплемента (РСК).
Участие указанных антител не равноценно в подавлении жизнедеятельности возбудителя. У животных с резко положительной РСК процесс может окончиться летально. Возможно, что комплементсвязывающие вещества не связаны с иммунологической резистентностью. Выработка антител производится плазматическими клетками. Большинство исследователей считают, что иммунные антитела — глобулины отличаются от нормальных только своей способностью специфически реагировать с антигеном. У животных, инвазированных трипаносомами, появляются специфические антитела — абластины, которые вызывают задержку развития молодых трипаносом.
До настоящего времени у животных, инвазированных патогенными простейшими, не выявлено такого количества антител, чтобы их можно было применять в качестве серотерапии и серопрофилактики. Кроме того, существование скрытого носительства возбудителей вирусных и других заболеваний ограничивает возможность использования сыворотки крови и крови переболевших животных для терапии и профилактики протозойных болезнен без соответствующего обезвреживания.
При протозойиых болезнях в результате мобилизации клеточных, гуморальных и гормональных систем инвазированный организм становится здоровым и приобретает стерильный или нестерильный иммунитет.
Стерильный иммунитет у млекопитающих животных выявлен против трипаносом и у птиц против боррелий.
Против большинства возбудителей протозойных заболеваний у животных возникает нестерильный иммунитет, который является лабильным. При понижении резистентности организма происходит активирование жизнедеятельности паразита и может возникнуть рецидив. Нестерильный иммунитет, предохраняя животных от последующего заражения, в ряде случаев служит источником рассеивания возбудителя в окружающую среду через испражнения при кишечных простейших или через переносчиков при трансмиссивных болезнях.
При различных протозойных болезнях длительность премуниции неодинакова. Ослабление напряженности ее зависит от снижения вирулентности паразита. Если возбудитель из организма исчезает, наступает автостерилизация, и некоторое время отмечают стерильный иммунитет. Последний вскоре теряется, а организм вновь становится неиммунным и восприимчивым к тому же возбудителю.
Иммунитет у животных при протозойных болезнях строго специфичен, иммунные тела вырабатываются только против того вида или штамма возбудителя, который вызвал заболевание. Более того, иммунтела могут быть различными в зависимости от стадии развития у одного и того же вида простейшего. Например, у тейлерий организм, инвазированный шизонтами, вырабатывает антитела, которые не проявляют своего действия против внутриэритроцитарных форм. Эта специфическая выраженность антител против различных фаз развития паразитов, возможно, зависит от степени выраженности заболевания (малой антигенной раздражимости организма).
Нестерильный иммунитет при большинстве протозойных болезней адекватен степени перенесенного заболевания. Иммунитет будет наиболее стойким и продолжительным, если животные переболевают тяжело.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Рефераты и конспекты лекций по географии, физике, химии, истории, биологии. Универсальная подготовка к ЕГЭ, ГИА, ЗНО и ДПА!
Иммунитет к простейшим
К возбудителей протозойных заболеваний человека и животных относятся мельчайшие живые существа царства эукариот, которые значительно различаются между собой по размерам, антигенной структуре, способами проникновения в макроорганизм, местами и формами паразитирования.
Простейшие гораздо сложнее бактерий по своему строению (большинство имеет плотную эластичную мембрану - петикулы, а иногда и минеральный скелет) и антигенным составом. Значительная часть простейших в организме проходит несколько стадий развития, которые отличаются своей антигенной строением, могут развиваться в организме в разных местах - на слизистых оболочках и коже (амебы, балантидии, лямблии, трихомонады, лейшмании), внутриклеточно (лейшмании, трипаносомы, плазмодии, токсоплазмы , Кокциды), в межклеточном пространстве (балантидии, токсоплазмы, амебы), в крови (плазмодии, трипаносомы, амебы) и в кишечнике, желчном пузыре, печени, спинном и головном мозге, мышцах, миокарде. Для некоторых возбудителей характерна постоянная изменчивость поверхностных антигенов. Кроме того, продукты жизнедеятельности простейших имеют иммуносупрессивные свойства. При некоторых инфекциях в организме появляется большое количество новых антигенов простых и измененных структур собственных клеток вследствие агрессии возбудителей. Так, при малярии в организме появляется более тысячи различных новых антигенов. Все это обусловливает формирование малоэффективной иммунного ответа.
Простейшие проникают в организм чаще всего через укусы насекомых, клопов и алиментарным путем. Для внутриклеточного проникновения они используют различные рецепторы. Так, лейшмании проникают в макрофаги с помощью рецептора к dq-компонента комплемента, а также с помощью манозно-фукозного рецептора, возбудитель малярии проникает в эритроциты благодаря специальной органеллы - ронтрии и из-за специфического на эритроцитах рецептор - антиген Дафи. Чувствительность отдельных особей к протозойных заболеваний контролируется определенными генами иммунного ответа.
Существуют наблюдения о наличии в некоторых простейших врожденной устойчивости организма. Так, большинство взрослых людей устойчивы к балантидиозу. Выявлено индивидуальную непереносимость отдельных лиц патогенных амеб, которая в некоторых случаях вызывается строением и функционированием стенки кишок. Естественная резистентность местных жителей Африки к возбудителям малярии обусловлено двумя факторами - отсутствием в эритроцитах изоантигены Дафи или наличием серповидной формы эритроцитов.
Неспецифические факторы защиты первыми сталкиваются с простейшими и преимущественно обезвреживают патогены. Однако при наличии определенных недостатков системы защиты организма, значительной патогенности возбудителя или способности его обходить соответствующие звенья защитной системы простейшие способны закрепляться на слизистых оболочках или проникать во внутреннюю среду организма и колонизировать некоторые ткани, органы, клетки.
Характер и особенности индуцирования и формирования адаптивной иммунного ответа для большинства протозойных заболеваний еще мало изучены. Существует много наблюдений об отсутствии формирования адаптивной иммунного ответа или очень низкий ее уровень при некоторых протозойных заболеваниях (лямблиоз, амебиоз, трихомоноз), о чем свидетельствует частое возникновение повторных заболеваний. Известно, что некоторые простейшие обусловливают становление гуморального и клеточного иммунитета, но его роль в защитных реакциях организма неодинакова и обычно малоэффективна. Это вызывается рядом факторов - особенностью антигенного состава, физиологическими особенностями паразитов, стадиями развития и существования, местами паразитирования т.д.. Вид специфического иммунного ответа зависит от антигенной строения простого, стадий существования и местонахождения его. Гуморальная иммунный ответ формируется почти всех форм паразитирования протозойных возбудителей, но эффективно она оказывается в случае пребывания паразитов в крови (малярия, трипаносомоз), В межклеточном пространстве определенных тканей и органов (лейшманиоз). Внутриклеточная форма существования паразитов способствует формированию клеточного иммунного ответа (токсоплазмоз, лейшманиоз). При существовании на поверхности слизистых оболочек (лямблиоз, трихомоноз, амебиоз, балантидиоз) специфический иммунный ответ формируется очень слабо или совсем не обнаруживается.
Специфическая гуморальная иммунная ответ для каждого возбудителя формируется со своими особенностями в зависимости от антигенной строения возбудителя, формы существования на определенной стадии, способности к антигенной мимикрии т.д.. Так, при токсоплазмозе интенсивно вырабатываются антитела классов G и М, которые имеют определенные защитные функции. При лейшманиозе также продуцируются специфические IgM и IgG, но они не препятствуют размножению лейшманий и не влияют на развитие болезни. Это обусловлено преимущественно внутриклеточным (внутришньофагоцитарним и внутришньоендотелиальним) развитием лейшманий. Следует отметить, что лейшмании имеют общие антигены с микобактериями и трипаносомами, что затрудняет серологическое их дифференцировки. Важным является процесс формирования специфической устойчивости к плазмодиев. При малярии образуются специфические антитела, но в связи с изменением стадий развития паразита в каждом случае образованные ранее антитела к предыдущих стадий развития плазмодиев малоэффективны к следующим стадиям и только после образования антител ко всем стадиям развития плазмодиев формируется протективный защиту. Поэтому эффективный протективный иммунитет при малярии формируется только у людей, длительно проживающих в этой местности, после нескольких реинфекций. При малярии IgG лишают способности активных форм плазмодиев проникать в эритроциты и способствуют распознаванию и фагоцитоза спорозоитов, свободных мерозоитов инвазированных эритроцитов. Массовое разрушение эритроцитов и появление большого количества измененных собственных эритроцитарных антигенных структур при малярии способствует образованию большого количества аутоантител.
Для большинства протозойных заболеваний решающую роль в защитных реакциях организма играют клеточные факторы иммунного ответа. Специфический иммунный ответ при протозойных заболеваниях характеризуется сенсибилизацией организма, что приводит формирования аллергических реакций, и появлением активированных клеток иммунной системы, производством ними БАР с разной активностью. Основными эффекторными клетками иммунного ответа является цитотоксические Т-лимфоциты _ CD8 и CD4 - и клетки с АЗКЦ как результат специфического иммунного гуморального ответа. В осуществлении эффекторных реакций важную роль играют цитокины, выделяемые Т-хелперами, цитотоксическими Т-лимфоцитами, макрофагами и другими клетками при их активации и способны сами осуществлять киллерные эффекты (ФНО-а и Р) или активно участвовать в регуляции (ИФНы, интерлейкины 1, 2, 12, КСФ и др..).
О важной роли клеточного звена в защите против большинства протозойных заболеваний свидетельствуют данные о способности Т-клеток от иммунных животных защищать здоровые животные от возбудителей ряда протозойных заболеваний (трипаносомы, плазмодии), а также данные о неспособности мышей с дефектами Т-клеточного звена противостоять некоторым непатогенные видам трипаносом и плазмодиев, которые у нормальных мышей не вызывают инфекций с летальным исходом.
Роль отдельных субпопуляций Т-лимфоцитов в защитных реакциях различна и зависит от многих факторов - вида паразита, местонахождение, стадии его развития. Так, малярийный плазмодий паразитирует в эритроцитах и в клетках печени. Эритроциты и гепатоциты различаются по экспрессии антигенов МЧС - эритроциты экспрессируют антигены МНС класса II, а гепатоциты - класса I. В свою очередь, CD4 выполняется только антигены МНС класса II, а CD8 - класса I. Таким образом, при взаимодействии с инфицированными эритроцитами только CD4, а при взаимодействии с инфицированными гепатоцитами только CD8 будут активироваться и продуцировать ИФН-у. Последний ингибирует размножение паразитов и разрушает инфицированные гепатоцита
Хронические протозойные заболевания часто сопровождаются иммуносупрессией со значительным снижением выработки ИФН-у.
Участие в защитных реакциях Тх1 или Тх2 обусловлено антигенной структуре возбудителей и их местонахождению. Так, после поражения гепатоцитов плазмодиями активируется Тх1, вследствие чего уменьшается количество паразитов благодаря выделению ИФН-у. Введение антител к ИФН-у устойчивым против малярии мышам вызывает возникновение заболевания после их инфицирования плазмодиями. Вместе Тх2 индуцируют образование антител, активно участвуют в разрушении инфицированных плазмодиями эритроцитов в селезенке по механизму АЗКЦ.
Роль отдельных цитокинов в противопротозойное защите может быть положительной и отрицательной. Так, ИФН-у и ФНО-а активируют внутриклеточную микробоциднисть фагоцитов, поэтому происходит быстрое их уничтожения (лейшмании, трипаносомы, токсоплазмы, некоторые стадии плазмодиев). ИЛ-12 стимулирует пролиферацию Тх1 _ основного продуцента ИФН-у и, как следствие, патоген обезвреживается. ИФН-у и ИЛ-1, которые секретируются макрофагами, повышают устойчивость гепатоцитов к малярийного паразита. Следует отметить, что ИЛ-4, ИЛ-10, ТФР-Р тормозят активацию макрофагов, нейтрализуют активувальну действие ИФН-у, снижают пролиферацию Тх1, способствуют выживанию патогена и усложнению течения инфекционного процесса. После введения ИЛ-3 инфицированным лейшманиями мышам наблюдается обострение и расширение процесса.
У переболевших на некоторые протозойные заболевания (трипаносомоз, кокцидиоз) преимущественно формируется нестерильный малонапружений иммунитет. Стойкий иммунитет (в основном не стерильный) возникает только после лейшманиоза и малярии у местных жителей. При лейшманиозе протективный иммунитет обусловливается в основном клеточными факторами, поскольку введение специфических антител от инфицированных лейшманиями животным не защищает их, а перенос Т-лимфоцитов от иммунных животных, наоборот, их защищает. При малярии протективный иммунитет вызывается гуморальными и клеточными факторами и является строго типовидовим и штамоспецифичним.
У животных иммунитет определяется генетически обусловленными факторами. Иммунная реакция бывает как к инфекционным, так и неинфекционным факторам. В создании иммунитета принимает участие весь организм, все защитные механизмы которого тесно между собой взаимосвязаны. При иммунитете наряду с факторами специфической защиты (антитела, аллергия) принимают участие многочисленные неспецифические факторы (слизистые, кожа, лимфатическая система, ферменты крови, секреты, выделяемые пищеварительной системой и другие средства защиты). Все защитные реакции в организме осуществляются под воздействием нейро-гормональной регуляции.
Виды иммунитета.
Принято различать два вида иммунитета: видовой (наследственный) и приобретенный. При видовом иммунитете происходит передача иммунитета по наследству, от одного поколения другому, является весьма стойким в естественных условиях. При данном виде иммунитета животные одного вида не болеют инфекционными заболеваниями другого вида (крупный рогатый скот не болеет африканской чумой свиней, а свиньи не болеют чумой крупного рогатого скота). Приобретенный иммунитет возникает у животных в результате естественного переболевания – естественно приобретенный иммунитет или в результате искусственной иммунизации – искусственно приобретенный. Приобретенный иммунитет в свою очередь может быть активным или пассивным. Активным он будет в случае естественного переболевания той или иной инфекционной болезнью, по наследству не передается и длится месяцы и более.
В некоторых случаях он может быть пожизненным (оспа у человека, чума у собак). Искусственно приобретенный иммунитет мы получаем при вакцинации животных, когда подкожно или внутримышечно вводим ослабленных или инактивированных возбудителей инфекционных болезней или продуктов их жизнедеятельности; наступает через две недели после вакцинации и продолжается, если вакцина была живая, от нескольких месяцев до года.
Искусственно приобретенный иммунитет может быть пассивным — это когда животному вводят в кровь или подкожно иммунную или гипериммунную сыворотку, которая содержит готовые антитела против определенных возбудителей инфекционной болезни. Такой иммунитет длиться у животного 2-3 недели, причем применением гамма-глобулина длительность пассивного иммунитета можно увеличить. Этим видом иммунитета обладают и новорожденные животные, получающие готовые антитела с молозивом и молоком матери (колостральный иммунитет), он длиться несколько месяцев.
Стерильный и нестерильный иммунитет.
При некоторых инфекционных заболеваниях, когда состояние невосприимчивости связано с присутствием в организме возбудителя (туберкулез, бруцеллез и т.д.), устойчивость к новому заражению продолжается до тех пор, пока в организме животного сохраняется возбудитель данной инфекции. Такой иммунитет называется инфекционным, нестерильным или премуницией.
Данное положение используется в практике при вакцинации организма маловирулентными живыми возбудителями против туберкулеза (вакцина БЦЖ), бруцеллеза (штамм 19) и др. Состояние нестерильного иммунитета длиться иногда годами.
Иммунитет, образующийся после переболевания или вакцинации и сохраняющийся при отсутствии в организме возбудителя болезни называют стерильным.
У специалистов принято различать иммунитет в зависимости от того, на что направлено действие защитных механизмов организма – непосредственно на микробы или на их продукты. При антимикробном иммунитете происходит обезвреживание (разрушение или ингибиция) возбудителя. При антитоксическом иммунитете бактерии не разрушаются, а идет активная нейтрализация вырабатываемых ими токсинов (столбняк, ботулизм). Бывает иммунитет противогельминтный и неинфекционный.
Антимикробный иммунитет включает в себя невосприимчивость к бактериям, вирусам, риккетсиям, микоплазмам, грибам и простейшим. При антибактериальном иммунитете введенные в неиммунизированый организм авирулентные или слабовирулентные бактерии захватываются клетками ретикулоэндотелиальной системы, а также лейкоцитами крови, в результате чего организм быстро очищается от них, при введении же вирулентных бактерий в иммунный организм происходит заметная задержка в проникновении их в кровь и лимфатическую систему с места внедрения.
Противовирусный иммунитет основан, как и противобактериальный и антитоксический, на тех же механизмах защиты, но имеет ряд особенностей. При таких вирусных болезнях, как оспа, чума собак, приобретается длительный и напряженный иммунитет, однако, например, при гриппе человека или гриппе лошадей и др. вирусных болезнях иммунитет бывает непродолжительным и недостаточно напряженным.
Неспецифические факторы иммунитета.
Они многочисленны и взаимосвязанно действуют в целостной системе организма. В естественных условиях заражению организма препятствуют следующие группы защитных приспособлений:
1. Кожные и слизистые барьеры. Неповрежденные кожа и слизистые оболочки непроходимы для большинства микроорганизмов. Кожа и слизистые оболочки являются не только механическим барьером, но и стерилизующим в отношении многих микробов. Бактерицидные свойства кожи обусловлены молочной и жирной кислотами, содержащимися в секрете потовых и сальных желез. Антимикробным действием обладает секрет желез слизистых оболочек, содержащийся в слюне, слезах, носовом секрете, молоке ( лизим-белковое вещество типа энзима, растворяет бактерии, преимущественно из группы кокков). Секреты желез пищеварительного тракта оказывают бактерицидное действие на бактерии. Высокую бактерицидность имеет слюна и желудочный сок, а также желчь, обладающая способностью обезвреживать ряд вирусов.
2. Лимфатические барьеры. Те микробы, которые сумели пройти кожу и слизистые оболочки, встречаются с новым барьером — лимфатическими узлами (при попадании микробов через глотку барьером становится окологлоточное лимфатическое кольцо). Попав в лимфатические узлы, микробы захватываются клетками ретикулоэндотелиальной системы и подвергаются фагоцитозу. Барьерная функция лимфоузлов возрастает после проведенной вакцинации.
3. Фагоцитоз и воспаление. Борьба с проникшими в организм микробами, в месте внедрения которых организм отвечает воспалением, проводиться лейкоцитами (макрофагами), которые поглощают микробные клетки и своими ферментами разрушают их.
4. Гуморальные факторы. Попав в кровь, микробы встречаются с рядом защитных механизмов. Кровь и ее сыворотка обладает бактерицидной и бактериостатической активностью в отношении многих микробов (сибирской язвы, рожи свиней, стафилококков), имеющимся в ней бактериолизином. К гуморальным факторам относиться также комплемент, пропердин, термостабильный β-лизин, лизоцим и лейкины.
Все явления иммунитета регулируются нейро-гуморальным путем. При этом особое значение имеют гормоны, снижающие реактивность соединительной ткани — противовоспалительные и повышающие ее реактивность воспалительные. К противовоспалительным относятся адренокортикотропный гормон и кортизон, к воспалительным -соматотропный и гормон типа дезоксикортикостерона. Противовоспалительные гормоны угнетают выработку антител, воспалительные гормоны усиливают.
Тканевой иммунитет.
В процессе взаимодействия вируса с клеткой, наряду с гибелью одних клеток, в других происходит образование противовирусных антител -интерферона, происходит перестройка метаболизма клеток организма, не позволяющая вирусным частицам и дальше проникать в клетки и размножаться в них. Нейтрализующие вирус антитела в клетках появляются на второй день, как попал вирус в организм. В результате появления внутриклеточных антител, происходит нейтрализация вируса, без развития патологических изменений в органах.
Функциональный иммунитет.
Защитные реакции организма на действие возбудителя инфекционной болезни возникает не изолированно, а во взаимосвязи всех систем и органов. Взаимосвязь в организме осуществляет нервная система, и от типа нервной системы и ее тонуса целиком зависит уровень и качество защитных механизмов. Центральная нервная система во время болезни обеспечивает восстановление функций, нарушенных попавшим в организм возбудителем инфекции. Лихорадка, являющаяся характерным клиническим симптомом инфекционной болезни, является результатом реакции организма в целом. Она носит неспецифический, но в то же время защитный характер. Повышением температуры тела организм усиливает окислительные процессы, губительно действует на микроорганизмы, разрушая их. Проявлением данного вида иммунитета является усиление выделительной функции кишечника, почек, дыхательных путей на токсические продукты микробов и вирусов попавших в организм.
Аллергия.
При инфекционной болезни происходит повышение чувствительности организма к попавшему возбудителю и продуктам его жизнедеятельности. Такое состояние организма называется инфекционной аллергией. Она легко выявляется при хронических инфекционных болезнях, сопровождающихся премуницией (сап, туберкулез, бруцеллез и др.).
Данный факт широко используется в практической деятельности при проведении диагностических исследований на сап, туберкулез, бруцеллез.
Большое значение в регулирование иммунитета имеет нервная система. Тяжесть течения инфекционной болезни определяется функциональным состоянием высших отделов нервной системы. Перенапряжение нервной системы ослабляет противомикробную защиту организма животного. Длительный медикаментозный сон в определенных условиях резко снижает реактивность организма на некоторые токсины и виды микроорганизмов, в то же время при сибирской язве, столбняке, когда охранительное торможение отсутствует, течение болезни ухудшается.
Новорожденные животные в молозивный период обладают чувствительностью к ряду инфекционных болезней, несвойственных в дальнейшем для данного вида. Так, молодняк сельскохозяйственных животных часто переболевает колибактериозом, ягнята особенно чувствительны к столбняку и оспе. В то же время в раннем возрасте телята не болеют эмфизематозным карбункулом, поросята до 2-3 месяцев редко болеют рожей, щенята в молозивный период — чумой. Ряд инфекционных болезней поражают животных в определенном возрастном диапазоне(эмфизематозный карбункул у КРС бывает в возрасте от 3мес. до 4лет, рожа у свиней от 3 до 12месяцев и т.д.).
У взрослых животных возможен иммунитет в результате скрытой иммунизации. Если в организм систематически попадают дозы возбудителя инфекции меньше той, которая может вызвать заболевание, то происходит малозаметная иммунизация (так называемая иммунизирующая субинфекция, например отсутствие заболеваемости эмкаром у животных старше 4лет). Иммунологическая реактивность организма (антителообразование и аллергия) с возрастом нарастает.
Неинфекционный иммунитет.
Первооткрываетелем неинфекционного иммунитета является великий русский ученый И.И.Мечников, установивший общебиологический характер реакций иммунитета против клеток любой категории. Группа крови животных является постоянной генетической характеристикой организма, используется в племенной работе при селекции, генетическом контроле, в ветеринарии при переливании крови, пересадке тканей и органов, применении тканевых препаратов, биопрепаратов и др. В медицине особо актуальное значение имеют вопросы трансплантационного иммунитета и т.д.
Иммунитет при паразитарных болезнях.
К настоящему времени данный вид иммунитета находиться в стадии активного изучения. Иммунопрофилактика при паразитарных болезнях находиться в стадии разработки. Так, идет активный поиск иммунопрофилактики заболеваний, вызываемых клещами – бабезиоз, пироплазмоз. Разработан и применяется для профилактики пироплазмоза у собак ряд вакцин – Нобивак Piro, Pirodog.
Условия кормления и содержания.
Особенно данные факторы важны для малышей. Полноценное кормление и создание оптимальных условий содержания ведет к повышению общей и специфической резистентности организма. В результате неполноценного кормления (недостаток белков, авитаминоз и др.) снижается устойчивость животных к заболеваниям, уменьшается синтез в организме белков, иммунных глобулинов, ослабляется лейкоцитарная реакция. При неполноценном кормлении и нарушении зоогигиенических условий содержания, при проведении вакцинации у животных наблюдаются поствакцинальные осложнения, иммунитет у таких животных не будет достаточно напряженным.
Читайте также:


