Гепатит с кафедра инфекционных болезней
Научная деятельность кафедры инфекционных болезней
Научно-исследовательская работа на кафедре проводится с первых дней её создания. В первые годы работы кафедры были определены следующие основные направления научных исследований: бактериальные менингиты, дифтерия, острые кишечные инфекции.
В последние годы происходит смещение научных интересов на изучение проблем вирусных гепатитов, ВИЧ-инфекции: методы прогнозирования неблагоприятных исходов вирусных гепатитов, персонификация лечения гепатитов В, С, ко-инфекции ВИЧ/вирусные гепатиты, гепатита С с атипичным серологическим профилем и гепатита неуточненной этиологии. Изучаются особенности пространственно-временных проявлений эпидемического процесса ВИЧ-инфекции. Проводятся исследования патогенеза поражений головного мозга и по разработке методов диагностики и лечения бактериальных менингитов, генерализованной бактериальной инфекции.
Ежегодно сотрудники кафедры выступают на международных конференциях, съездах, симпозиумах. Динамика сделанных сотрудниками кафедры докладов на различных уровнях представлена на рис. 1.
Рис. 1. Количество докладов, выполненных сотрудниками кафедры за последние 5 лет.
Следует обратить внимание, что в структуре докладов (рис.2) имеется тенденция к увеличению выступлений на международном и республиканском уровнях (2016-2017 гг. – до 66,6%).
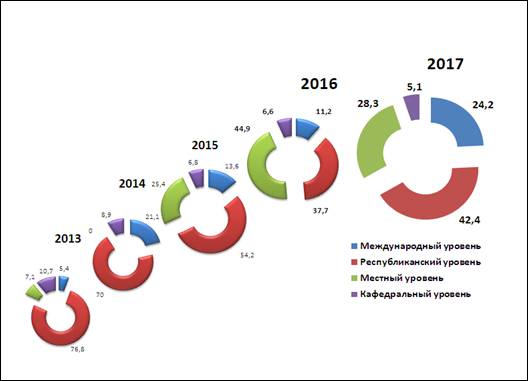
Рис. 2. Структура докладов, сделанных сотрудниками кафедры за последние 5 лет.
Количество публикаций за год в среднем составляет около 80 с ростом числа статей, опубликованных в центральных журналах, включенных в Перечень российских рецензируемых, которые рекомендованы ВАК для публикации результатов диссертаций на соискание ученой степени кандидата и доктора медицинских наук. На рис. 3 приведена динамика публикаций за последние 5 лет.
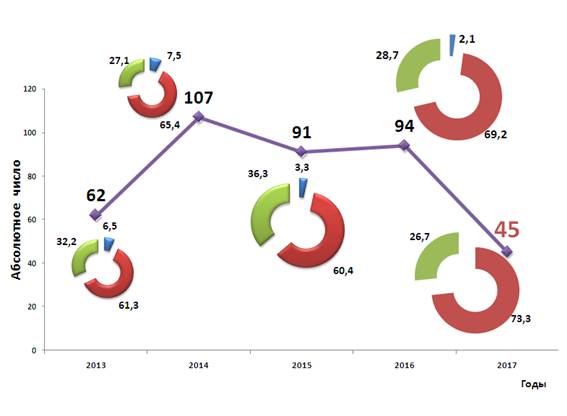
Рис 3. Количество публикаций, сделанных сотрудниками кафедры за последние 5 лет. Обозначения те же (см. рис 2).
В рамках кафедральных НИР все исследования проводятся комплексно с межинститутским взаимодействием. Сотрудники кафедры выполняют исследования по хоздоговорной тематике и в рамках государственных грантов, Федеральных целевых программ, научных школ.
Изучение исходов хронического гепатита В, основанное на анализе генетических факторов человека, в сочетании с методами определения вирусной нагрузки и геновариантов HBV, позволит оптимизировать тактику ведения больных с различными вариантами хронической HBV-инфекции.
Другим подходом прогнозирования неблагоприятных исходов ХГ является оценка показателей клеточного состава крови больных ХГ. В результате исследований получены новые данные о патогенезе хронического вирусного гепатита С в соответствии со стадиями фиброзных изменений в печени. Преимуществом разработанной методики является возможность ее применения в клинической практике на базе стационаров и центров, оснащенных иммунологическими лабораториями. Предложено проводить ежегодный мониторинг клеточного состава крови у больных с верифицированным диагнозом хронического гепатита С по определенному алгоритму.
В 2015 г. проведено генотипирование 239 образцов РНК больных ХГС (как получавших, так и не получавших противовирусную терапию (ПВТ) и 200 образцов РНК людей контрольной группы для определения SNP - rs738409 гена PNPLA3, rs2248814 гена NOS2A, rs2072324 гена NOS2A, rs11234870 гена FZD4, rs12980275 и rs12980275 гена IL-28B в ПЦР с использованием олигонуклеотидов собственной разработки. Проведен анализ данных пациентов с ХГС без цирроза печени, закончивших комбинированную терапию (пегилированным интерфероном и рибавирином) с длительностью 24 недели в соответствии с выявленным генотипом HCV.
В группе пациентов, закончивших комбинированную ПВТ, дополнительно проведен анализ полиморфизмов rs12979860 и rs8099917 гена человека ИЛ-28В, являющимся предиктором эффективности ПВТ. Благоприятный по отношению к эффективности ПВТ генотип СС выявлен у 36% больных. Генотип GG, ассоциирующийся с низким уровнем ответа на терапию, выявлен в 6% случаев. Выявлено преобладание генотипа СТ rs12979860 (48%), и только в 16% случаев - генотип ТТ. Частота встречаемости генотипов ТТ и ТG rs8099917 гена ИЛ-28В составила 58% и 36%, соответственно. Носительство благоприятного генотипа СС полиморфизма rs12979860 гена ИЛ-28В у пациентов с отсутствием УВО зарегистрировано лишь у 2 пациентов (11, 8%), генотип СТ был выявлен у большинства пациентов (64,7%), в 23,% случаев выявлен генотип ТТ. Частота достижения УВО была статистически значимо выше у больных с достижением быстрого вирусологического ответа (БВО) по сравнению с его отсутствием (р=0,0263), 94%больных с отсутствием ответа на ПВТ не достигли БВО. В группе с отсутствием УВО статистически достоверно чаще встречаются больные, инфицированные генотипом 1 HCV (78%,14/18), и пациенты с исходно высоким уровнем виремии (>8х10 5 МЕ/мл).
С целью выявления возможных генетически детерминированных факторов эффективности ПВТ было проведено сопоставление предварительных результатов исхода ПВТ с особенностями генома HCV. Всего секвенировано и проанализировано 66 фрагментов из NS5B области (размером в среднем около 300 пар оснований), 31 фрагмент из 5’UTR/core области (размером в среднем около 450-600 пар оснований), 41 полноразмерный ген core (573 пар оснований). В результате филогенетического анализа фрагмента NS5B области генома 66 изолятов идентифицированы восемь субтипов HCV: 1a, 1b, 2a, 2b, 2c, 2k, 3a и 3b. У тридцати двух изолятов наблюдалось полное совпадение результатов генотипирования. В то же время, 32 изолята (7 от пациентов с ХГС и 25 от пациентов с коинфекцией ВИЧ/HCV), отнесенные к генотипу 2 на основе коммерческих-тест систем, по NS5B области принадлежали к субтипу 1b. Филогенетический анализ показал, что все 32 изолята входили в монофилетическую группу, сформированную изолятами рекомбинантной формы RF2k/1b (RF2k/1b). Для верификации их принадлежности к RF2k/1b, у 21 из 32 был секвенирован фрагмент 5’UTR/core области генома. Анализ нуклеотидных последовательностей подтвердил, что все они по этой области принадлежали к субтипу 2k. Наличие значительного пула изолятов RF2k/1b позволяет по результатам филогенетического анализа NS5B области генома идентифицировать рекомбинантную форму RF2k/1b.
Типирование вариантов HCV с использованием коммерческих тест-систем российского производства и результатов генотипирования на основе анализа фрагментов NS5B и core областей генома подтвердило невозможность идентификации в клинической лабораторной практике RF2k/1b, которая при использовании тест-систем типируется как генотип 2. Особенностями строения рекомбинантной формы RF2k/1b является принадлежность всех структурных генов к субтипу 2k, а неструктурных генов, к субтипу 1b. Впервые выявлен тренд существенного увеличения доли RF2k/1b в структуре циркулирующего генотипа 2 HCV на территориях г. Москва и г. Санкт-Петербург, которая стала достигать 37-45% и 67% в основной популяции населения и среди людей ко-инфицированных ВИЧ соответственно.
Установлено, что ни у одного пациента (n=5), инфицированного RF2k/1b, с опытом ПВТ в прошлом, не был достигнут УВО. В группе больных, инфицированных генотипом 2 HCV, закончивших лечение в рамках настоящего исследования (n=7), у двух пациентов выявлен рекомбинантный вариант RF2k/1b, и только у этих пациентов ПВТ была не эффективна. В отсутствии рекомбинантного варианта при генотипе 2 HCV в 100% достигнут успех лечения, а при его наличии в 100% терапия была неуспешной.
Полученные результаты позволяют констатировать, что необходимо включить в клиническую лабораторную практику обязательное субтипирование всех изолятов генотипа 2 на основе анализа фрагмента NS5B области генома, что позволит оптимизировать схему ПВТ и повысит её эффективность.

В исследования, посвященные проблеме ВИЧ/СПИДа, сотрудники кафедры включились с конца 90-х годов XX столетия. Изучение клинических и эпидемиологических аспектов позволило вскрыть особенности проявлений эпидемического процесса ВИЧ-инфекции, что учтено при совершенствовании системы эпидемиологического надзора, а исследования особенностей течения инфекционного процесса при ВИЧ/СПИДе позволили повысить качество жизни ВИЧ-инфицированных людей.
Работа по совершенствованию диагностики и лечения сопутствующей патологии (инфекционной и хирургической) у ВИЧ-инфицированных была проведена в рамках ГрантаРФФИ; 09-02-00836-а.
Роль и значение этих факторов риска неоднозначны. Ведущее значение принадлежит социальным факторам.
Сопоставление стандартизованных коэффициентов возрастной структуры смертности населения г. Москвы и возрастной структуры смертности среди ВИЧ-инфицированных показало, что основной возрастной группой, в которой отмечена наибольшая смертность от ВИЧ-инфекции была группа трудоспособного возраста, т.е. смертность при ВИЧ-инфекции вносит существенный вклад в общую смертность трудоспособного населения (избыточная смертность), уменьшая трудовой ресурс и вызывая депопуляцию населения в социально-значимой возрастной группе населения.
Причинами летального исхода при ВИЧ/СПИДе могут быть как квазиэндогенные, так и экзогенные несвязанные с основным заболеванием.
Детальный анализ эндогенных и квазиэндогенных причин смерти ВИЧ-инфицированных позволяет констатировать, что принятая форма врачебного свидетельства о смерти не отражает в полной мере комплекс причин, приведших к летальному исходу при болезни, вызванной ВИЧ. При наличии у больного ко-инфекции, например, туберкулез, вирусные гепатиты В, С, в первую часть свидетельства может быть внесена только одна из перечисленных выше нозологических форм.
Учитывая вышеприведенные обстоятельства, становится очевидным необходимость комплексного анализа смертности среди ВИЧ-инфицированных с обязательным учетом возраста, пола умерших, пути заражения с выделением причин наступления смерти.
Изучение динамики проявлений эпидемического процесса на различных этапах развития эпидемии ВИЧ-инфекции позволило определить тенденции распространения ВИЧ в индикаторных социальных и возрастных группах населения. Было условно выделено IV периода, которые различались интенсивностью динамики заболеваемости, трендом хода эпидемического процесса и ведущим путем передачи ВИЧ. Начиная с 2005 по 2017 г. в Российской Федерации стал отмечаться новый постепенный рост показателя заболеваемости ВИЧ-инфекцией (четвертый период).
Группой риска инфицирования ВИЧ остаются люди в возрасте 30 - 40 лет. Отмечена тенденция смещения заболеваемости ВИЧ-инфекцией на более старшие возрастные группы. Удельный вес вновь выявленных случаев ВИЧ-инфекции в группе 40-50-летних мужчин вырос с 13,6% в 2012 г. до 21,1% в 2016 г., а среди женщин – с 11% в 2012 г. до 17% в 2016 г.
Установлено, что имеется доминирование рискованной модели сексуального поведения среди учащейся молодежи. Среднее количество половых партнеров с начала половой жизни составило 4,8±0,3 у мужчин (ДИ 95%от 1 до 9,9) и 3,5±0,5 у женщин (ДИ 95%от 1 до 18). Принимая во внимание кумулятивный эффект, на связь не менее чем с тремя половыми партнерами приходилось 60,3%, то есть это каждый 2, и каждый 5 имел половые контакты не менее чем с 6 половыми партнерами. Выявлено, что имеется негативная тенденция роста опасности заражения ИППП, так как более половины респондентов имели в анамнезе переболевание ИППП, причем во время болезни 32,8% вступали в половые контакты и в 20% случаев не использовали профилактические средства защиты. Обращено внимание на то, что в 32,4% случаев имели место случайные половые связи с 3-5 половыми партнерами за последний год, а в 60,3% случаев число половых партнеров с начала половой жизни было более трех.
У большинства пациентов с синдромом генерализованной лимфаденопатии инфекционной природы она была обусловлена микобактериями (66,7%). На втором месте по частоте развития синдрома лимфаденопатии была цитомегаловирусная инфекция (25.5%) и реже она регистрировалась при токсоплазмозе (в 5,8% случаев). Генерализованная туберкулёзная лимфаденопатия с наибольшей частотой выявлялась у ВИЧ-инфицированных пациентов на стадии 4В этой болезни (73,5%) и в три раза реже на стадии 4Б (23,5%). Фактором риска развития генерализованной лимфаденопатии было падение числа CD4+ лимфоцитов ниже 100 клеток/мкл. Результаты работы позволяют обосновать целесообразность использования отобранных критериальных значений для прогнозирования рисков развития лимфаденопатии у ВИЧ-инфицированных, что повысит эффективность диагностическх мероприятий и применения схем АРВТ.
Доказано, что при БГМ происходит увеличение в СМЖ содержания белка, преимущественно за счет al- и а2-глобулиновых фракций, которые являются белками ранней фазы гнойного воспаления и элиминируются из СМЖ при эффективном лечении к 7-10 дням. Уровень этих фракций существенно выше при осложненном течении болезни, что позволяет использовать эти показатели для ранней диагностики БГМ, оценки тяжести течения и эффективности терапии. Установлено повышение уровня D-димера фибрина в СМЖ при БГМ, обусловленное лизисом фибринозно-гнойного экссудата. Уровень D-димера при динамическом исследовании зависел от этиологии менингита и эффективности терапии, что позволило рекомендовать данный показатель для ранней диагностики менингита и оценки эффективности лечения.
В процессе работы установлена важная роль в саногенезе при БГМ автономной иммунной системы ЦНС, которая проявляется в отличие от серозных и невоспалительных поражений ЦНС повышением количества Т-лимфоцитов (CD3+), в основном за счет увеличения числа цитотоксических Т-лимфоцитов (CD3+/CD8+), снижением естественных киллеров (CD16+/CD56+), снижением ИРИ, резким повышением ИЛ-1/3 и появлением IgG в СМЖ.
Динамическое наблюдение за пациентами с БГМ различной этиологии позволило установить, что наиболее распространенными являются менингиты менингококковой, пневмококковой, гемофильной этиологии и с 2008 г. - увеличение числа больных менингитами стафилококковой, клебсиеллезной и листериозной этиологии, что позволило ввести в обязательное исследование СМЖ методом ПЦР использование тест-систем для обнаружения фрагментов генома стафилококка (качественно и количественно), листерий и клебсиеллы в режиме реального времени в комплексе с бактериологическим методом.
На основе результатов проведенных исследований разработаны клинико-лабораторные алгоритмы для ранней дифференциальной диагностики БГМ с серозными вирусными менингитами и не воспалительными заболеваниями ЦНС.
Все новости
– Алексей Александрович, какие инфекции являются самыми распространенными в Самаре?
– Самые распространенные – ОРВИ, грипп, герпесвирусные инфекции, хронические вирусные гепатиты В и С, а также ВИЧ-инфекция. Если говорить про гепатиты, то сейчас значительно реже регистрируются острые, в основном хронические, но и те, и другие успешно вылечиваются, так как постоянно создаются новые, более совершенные противовирусные препараты. И вирус исчезает даже при циррозах печени. Хронический гепатит В и гепатит С могут протекать без выраженных симптомов. Очень долго человек может жаловаться на общую слабость и неприятные ощущения в правом боку, при этом он не знает о своей болезни и даже не замечает ее, но может передать вирус гепатита окружающим. Назову несколько цифр. Примерно три процента населения Земли инфицировано вирусом гепатита С, что составляет от 120 до 180 миллионов человек. В России число инфицированных вирусом гепатита С приближается к пяти миллионам. За 20 лет от вирусных гепатитов умерло столько людей, сколько погибло во Вторую мировую войну. Поэтому советую после 25-30 лет всем проверяться на гепатит, то есть сдать анализ крови на антитела к вирусам гепатитов В и С и ВИЧ.
С 1945 года три инфекции – малярия, туберкулез и СПИД – унесли 150 миллионов человеческих жизней.
– Гепатит С сейчас лечится хорошо, постоянно создаются новые препараты. В настоящее время стандартом лечения вирусного гепатита С является комбинированная противовирусная терапия препаратами интерферона и рибавирина. Длительность терапии – от 6 месяцев до одного года.
– А как обстоит дело в Самарской области с лечением других инфекций?
– Инфекционные возбудители – причина многих болезней, раньше считавшихся неинфекционными, а терапевтическими, неврологическими, гастроэнтерологическими, даже психическими. К примеру, 80% язвенной болезни желудка и гастритов вызываются бактериями хеликобактер. Или онкология. Казалось бы, она далека от инфекций, но многие онкологические заболевания, среди которых первичный рак печени, в абсолютном большинстве случаев связаны с вирусами гепатитов. Когда мы прививаемся от острого гепатита В, это значит, что защищаем себя не только от острого хронического гепатита, но и от цирроза и рака печени. Кроме того, рак шейки матки вызывается вирусом герпеса. Папилломавирус человека также вызывает онкологические заболевания.
– Надеюсь, вы перечислили все болезни?
– Специалист в области эпидемиологии Галаско отметил, что все болезни делятся на две группы, первая вызывается инфекционными причинами, а вторая – абсолютно инфекционными причинами. Даже атеросклероз может быть обусловлен энтеровирусами. Многие заболевания сердца, например миокардит, нарушения ритма, связаны с различными инфекционными возбудителями. Клещевой системный боррелиоз или болезнь Лайма развивается после присасывания клеща и нередко протекает в скрытой форме. Если есть клиническая картина, то диагностировать клещевой боррелиоз не составит труда, но если протекает без симптомов, то проявляется через 3-4 месяца болями в сердце. И так еще очень много болезней – печени, легких, почек, суставов. Далеко не все возбудители инфекционных болезней открыты. За последние 30 лет стало известно о более чем 30 новых возбудителях инфекционных болезней. Среди них ротавирусы, легионеллы, прионы, ВИЧ.
– Как же защититься от инфекций?
– Ежегодно в РФ регистрируется от 30 до 40 миллионов инфекционных болезней. В мире инфекции составляют 20-40% от общего количества заболеваний. Отмечен рост заболеваемости острыми кишечными инфекциями, энтеровирусными инфекциями, острым гепатитом А, коклюшем, корью, краснухой, инфекционным мононуклеозом, хроническим гепатитами, ВИЧ-инфекцией.
– Какое количество пациентов с ВИЧ в Самарской области?
– Сейчас зарегистрировано более 50 тысяч ВИЧ-инфицированных. От единичных случаев в конце 80 годов до такого количества сейчас.
– Алексей Александрович, да, это понятно, каких инфекций еще стоит опасаться?
– Каковы симптомы заражения малярией?
– Прежде всего озноб, высокая температура, которая может держаться несколько дней подряд, проливной пот. Самый простой способ диагностики малярии – микроскопия мазка крови. Но определить эту инфекцию может грамотный специалист – врач-лаборант. Хочу отметить, что инфекции имеют мало специфических черт, и врачу поставить диагноз бывает очень сложно.
– Алексей Александрович, вы говорите, что случай инфицирования малярией был давно. А какие инфекционные заболевания были отмечены недавно?
– После мартовских праздников у нас в инфекционном отделении лечился пациент с ботулизмом. Говорит, собирали грибы в прошлом году, а баночку консервированных открыли на праздники. Ежегодно в области регистрируется 10-15 случаев бутолизма. А ведь при ботулизме поражается продолговатый мозг (отдел головного мозга). Важно отметить, что все случаи ботулизма связаны с употреблением в пищу продуктов домашнего консервирования, а также вяленой рыбы.
– Алексей Александрович, посоветуйте, пожалуйста, нашим читателям, как им уберечься от инфекций?

Одесский национальный медицинский университет
Кафедра инфекционных болезней
на методическом совещании кафедры
“___” ______________ в 200__ г.
Зав. кафедрой ___________________ К.Л. Сервецкий
Лекция №8. ВИРУСНЫЕ ГЕПАТИТЫ
V курса медицинского факультета
Это группа антропонозных заболеваний, вызываемых гепатотропными вирусами. Механизм передачи может быть различным.
Проблема вирусных гепатитов остаётся наиболее актуальной, так как по распространенности эти заболевания уступают только острым респираторным и острым кишечным инфекциям. Вирусные гепатиты являются одной из наиболее частых причин хронического гепатита и цирроза печени, а у некоторых лиц могут заканчиваться летальным исходом.
Проблема вирусных гепатитов находится под пристальным вниманием многих ученых всего мира. На нынешнее время имеются определенные успехи в изучении этиологии, эпидемиологии, клиники, диагностики этого полиэтиологического вирусного заболевания.
Этиология.В настоящее время известны следующие вирусы, вызывающие гепатиты: вирус гепатита А (HAV); вирус гепатита В (HBV); вирус гепатита Е (HEV); вирус гепатита D (HDV), ассоциированный с HBV, вирус гепатита С (HCV), вирус гепатита F (HFV). Недавно открыт вирус гепатита G (HGV), а также вирусы TTV, SEN роль которых в поражении печени еще мало изучена. Поиски новых вирусов, вызывающих гепатиты продолжаются. В литературе можно встретить различные названия болезни, вызываемые этими вирусами: инфекционный гепатит, эпидемический гепатит, сывороточный гепатит, шприцевой гепатит. Указанные заболевания имеют много общего, однако выявлены и весьма существенные клинические, эпидемиологические, патогенетические и иммунологические особенности, требующие проведения дифференциального диагноза. Группа экспертов ВОЗ рекомендует различать следующие варианты вирусных гепатитов: гепатит А (ГА); гепатит В (ГВ); гепатит Е (ГЕ); вирусный гепатит С (ГС); гепатит Д (ГД).
Вирус гепатита А(HAV).Возбудитель впервые обнаружен в 1973 году. Feinstone. Это РНК – содержащий вирус. При электронной микроскопии обнаруживаются как полные, так и пустые его частицы размером 27-30 нм. На их поверхности обнаруживаются капсомеры. Нуклеопептид HAV не имеет поверхностных выступов и оболочки. В вирионе не выявлено сердцевидной структуры. Вирус содержит 4 пептида (VP 1-4). Участвующих в реакциях иммунной преципитации. Предполагается, что VР1 и VP3 находятся частично на поверхности, а VР2 и VP4 располагаются внутри вириона. Однако, до настоящего времени нет достоверных сведений об их значении в отношении антигенности и иммуногенности. У HAV установлен общий антиген, к которому в организме человека образуются антитела в классе Ig G и Ig M.
HAV устойчив при рН 3,0-9,0, чувствителен к формалину, может сохраняться в течение нескольких месяцев или даже лет при температуре +4°С, неделями – при комнатной температуре. Полная инактивация вируса происходит при 85°С в течение 5 минут. HAV устойчив к хлору, по сравнению с другими вирусами этой группы и может проникать через барьеры водоочистных сооружений. Полная инактивация вируса наступает при концентрации хлора 2,0-2,5 мг/л с экспозицией в течение 15 минут, хлорной извести – 10 мг/л через 15 минут.
Вирус гепатита А может репродуцироваться в человеческих или обезьяньих клеточных культурах, откуда и получают вирусный антиген. Необходимо отметить, что успешная адаптация HAV к культуре клеток крайне необходима для изучения биологических свойств, получения источника реагентов для диагностикумов (антигена, антисыворотки), а также для конструирования вакцин (живых, убитых).
Вирус гепатита В(HBV).
HBV в природных условиях выявлен у больных людей и носителей, у лесных сурков, земляных белок, пекинских уток. Это ДНК – содержащий вирус, патогенен для человека и некоторых видов приматов – шимпанзе, гориллы, орангутанга. HBV вызывает острую и персистентную инфекцию, поражает преимущественно печень.
Вирус состоит из ядра и оболочки. Различают следующую антигенную структуру HBV: HBsAg – поверхностный, HBcAg – внутренний, HBeAg – отражает инфекционность вируса.
К этим антигенам в организме больного вырабатываются антитела: анти-HBs; анти-HBc; анти-HВe в классе Ig G и Ig M.
Обнаруженный в организме человека HBsAg свидетельствует о наличии острой и латентно протекающей инфекции. Предполагается, что длительное сохранение в сыворотке крови больных HBsAg может свидетельствовать о переходе процесса в хроническую форму. HBcAg в крови практически не определяется и фиксируется косвенно по ДНК-полимеразной реакции, выпадающей положительной как в остром периоде болезни, так и спустя много месяцев и лет у больных хронической формой инфекции и вирусоносителей. Вскоре после обнаружения HBsAg в крови больных появляются анти-НВс. Чаще всего их обнаруживают при хроническом гепатите В и у носителей инфекции.
В ранние сроки болезни выявляется HBеAg, сменяясь затем анти-НВе. Весьма важную диагностическую информацию можно получить, используя методы определения специфической ДНК HBV. Для этой цели используют молекулярную гибридизацию нуклеиновых кислот и полимеразную цепную реакцию (ПЦР). Геноспецифическая вирусная ДНК обнаруживается в сыворотке крови, биоптатах печени, лимфоцитах периферической крови. Приведенный метод позволят обнаруживать очень малые количества вирусной ДНК в исследуемых образцах, что значительно повышает надежность диагностики.
Вирус гепатита С (HCV).Вирион вируса гепатита С состоит из ядра и липидной наружной мембраны. Геном представлен одноцепочечной РНК. HCV довольно устойчив по внешней среде, особенно в биологических жидкостях, таких как препараты крови, сперма и др. Чувствителен к хлороформу, другим дезрастворам и высоким температурам (100°С и более).
Антигенная структура HCV мало изучена. Установлено, что к вирусу в организме больного вырабатываются антитела в классе Ig G и Ig M. Их обнаружение в сыворотке крови больного свидетельствует о наличии острого либо хронического заболевания. В сыворотке крови больных обнаруживаются также антитела к неструктурным белкам (aNS3, aNS4, aNS5), что свидетельствует о репликационной активности вируса в организме больного. Антитела могут сохраняться на определенном уровне в течение 6-9 месяцев, а затем их титры в сыворотке крови снижаются вплоть до полного исчезновения.
Вирус гепатита Д (HDV). HDV представляет собой дефектную вирусную частицу размером 30-35 нм, содержит внутренний антиген (HDАg), состоит из небольшой циркулярной РНК и поверхностной оболочки, которая является HBsAg HBV. Считают, что репродукция вируса возможна только при наличии HBsAg в организме больного, поэтому гепатит Д протекает всегда как коинфекция либо суперинфекция, присоединяющаяся к HBV.
На внутренний антиген VHD организм человека отвечает выработкой антител в классе Ig G и Ig M, что используется в диагностике заболевания.
Вирус гепатита Е (HEV).Вирус гепатита Е выделен из фекалий больных желтухой. Обнаружить сферические вирусоподобные частицы удалось, используя метод иммунной электронной микроскопии. Материал для исследования забирался от добровольцев, зараженных материалом от больных желтухой с предполагаемым диагнозом гепатита Е. Предполагается, что HEV может вызываться несколькими антигеноразличающимися штаммами вируса.
В настоящее время разработаны тест-системы, позволяющие иммунно-ферментным методом обнаруживать антигены вируса в фекалиях, используя для этого сыворотки реконвалесцентов. Имеются такеже тест-системы для обнаружения антител к антигену HEV.
Остальные вирусы в настоящее время изучены мало.
Эпидемиология. Гепатит А – антропоноз. Источником болезни является больной человек в преджелтушном периоде и 15-20 дней периода разгара болезни, вирусоноситель. Первичная локализация вируса – желудочно-кишечный тракт. Вирус из организма больного человека выделяется с фекалиями. Механизм передачи – фекально-оральный. Конечными факторами передачи вируса гепатита А являются пища и вода. Промежуточным фактором передачи являются мухи, переносящие вирус вместе с фекалиями на продукты питания, посуду. В пищевые продукты и на посуду вирус может вноситься и с помощью больных людей, руки которых загрязнены вирусом.
Восприимчивость к заболеванию высокая. Заболевают преимущественно дети и лица до 30 лет. Соотношения перенесших клинические формы болезни и лиц, имеющих аHAV составляет 1:22 – 1:125 в различных городах.
Повышение показателей заболеваемости ВГА наблюдается в осенне-зимнем периоде года.
Источником вируса гепатита В природе является больной острой или хронической формой человек, здоровый носитель. Естественный путь передачи – половой. Инфекция может передаваться и при поцелуях через травмированную слизистую, через молоко матери, через плаценту от больной матери плоду (вертикальный путь передачи). Существенное значение имеет также парентеральный путь передачи: переливание крови и ее препаратов, инъекции, манипуляции, оперативные вмешательства.
Восприимчивость к заболеванию высокая. Наиболее часто гепатитом В болеют наркоманы, гомосексуалисты, проститутки, медицинские работники (хирурги, стоматологи, акушеры-гинекологи, работники отделений гемодиализа, манипуляционные медицинские сестры, врачи-инфекционисты).
Профилактика ВГВ заключается, прежде всего, в использовании в медучреждениях одноразового инструментария, одноразовых систем для переливания крови, ее препаратов, инфузионных растворов, в строгом контроле при отборе доноров. Инструменты многоразового использования должны подвергаться термической обработке не ниже 100°С в течение 45 минут.
Эпидемиология гепатита Д изучена недостаточно. Полагают, что источником инфекции является больной человек, основной путь передачи – парентеральный. Восприимчивы к гепатиту Д лица, страдающие ГВ или HBsAg – носители.
Эпидемиология вирусного гепатита Е идентична эпидемиологическим закономерностям ВГА, а гепатита С – вирусному гепатиту В.
Патологическая морфология. Морфологические изменения в печени происходят во всех тканевых компонентах – паренхиме, соединительной ткани, ретикулоэндотелии, в меньшей степени в желчных путях, то есть имеется диффузное поражение органа. Степень поражения варьирует от несущественных дистрофических и единичных некротических изменений эпителиальной ткани дольки печени при легких формах до обширных субмассивных и массивных некрозов печеночной паренхимы. Различают 3 варианта острой формы болезни: острую циклическую, холестатическую и массивный некроз печени.
При острой циклической форме обнаруживают диффузное поражение эпителиальных и мезенхимальных элементов. Отмечается декомпенсация балочного строения с беспорядочным расположением гепатоцитов и их значительным полиморфизмом. Наряду с дистрофическими изменениями определяются выраженные процессы регенерации с фигурами митозов и обилием двухядерных клеток. Характерно наличие рассеянных по дольке некротизированных гепатоцитов. Изменения мезенхимальных элементов внутри дольки выражаются в пролиферации куппферовских клеток с превращением их в макрофаги. Цитоплазма этих клеток базофильна, содержит желчный пигмент и липофусцин. Капилляры в центре долек расширены. В портальном тракте отмечается пролиферация лимфогистоцитарных элементов с примесью плазматических клеток, эозинофилов и нейтрофилов. Наряду с этим, наблюдается ретикулярная гиперплазия селезенки и портальных лимфатических узлов.
Клинические проявления болезни соответствуют тяжести деструктивных изменений в паренхиме печени.
При холестатическом варианте вирусных гепатитов наибольшие морфологические изменения обнаруживаются со стороны внутрипеченочных желчных ходов с картиной холангита и перихолангита.
Патогенез. Патогенез вирусных гепатитов до конца еще не исследован вследствие больших трудностей, обусловленных отсутствием доступной экспериментальной модели болезни. В основе существующих представлений о патогенезе ОВГ лежат клинические наблюдения, прижизненные исследования ткани печени и сравнительное изучение вирусного гепатита у животных.
Общая схема без детализации определенных звеньев разработана Г.П.Рудневым (1966). Однако, в настоящее время в литературе накопилось много новых данных, значительно углубляющих современные знания патогенеза острых вирусных гепатитов. Поступление возбудителя болезни в организм больного происходит перорально (HAV, HEV), половым путем, (HBV, HCV), парентерально (HBV, HCV, HDV и не исключен для HAV и HEV), вертикальный путь передачи.
Фаза вирусемии при вирусных гепатитах подтверждается обнаружением в крови больных DNA или RNA вирусов. Наряду с вирусемией происходит и паренхиматозная диффузия. Вирусы гепатита проникают в клетки печени, прежде всего, в гепатоциты. Вирус также обнаруживается в эритроцитах, тромбоцитах, клетках поджелудочной и щитовидной желез, ретикулоэндотелиальной системы, что также должно учитываться в оценке патологических процессов при этом заболевании, оказывающих существенное влияние на степень тяжести, течение и исходы болезни.
Однако данная теория не объясняет многие стороны патогенеза вирусного гепатита. Остается неясным, почему при аутоагрессии (наличие антител, Т-лимфоцитов, вируса) реализация их наступает только в единичных случаях. Неясно также, почему у погибших в печени не обнаруживается лимфоцитарная инфильтрация. Ответ на поставленные вопросы сформулировал А.Ф. Блюгер, высказав мысль, что для реализации аутоагресии необходимы дефекты по генетическому типу в системе иммунологического гомеостаза. Этот аргумент, на наш взгляд, весьма неубедителен. Анализируя полученные нами данные, мы пришли к выводу, что механизмы цитолиза гепатоцитов и других клеток при вирусных гепатитах совершаются следующим образом. Вирус внедряется в гепатоцит, где осуществляется его репродукция с использованием субстантов клеточных компонентов, особенно таких, как субстрат ядерной субстанции, митохондрий, микросом. В результате такого, несвойственного для клетки процесса, в клетке в несколько раз повышается активность свободнорадикального окисления (СРО). Это стимулирует чрезмерное накопление активных форм кислорода. Активные формы кислорода приводят к окислению различных биологически активных веществ и структурных образований биологических мембран – фосфолипидов. В липидах перекисному окислению подвергаются преимущественно ненасыщенные жирные кислоты, что приводит к изменению их пространственного расположения, конфигурации, включению в интенсивные метаболические процессы. В меру адаптационной емкости интенсификация перекисного окисления липидов (ПОЛ) нивелируется, прежде всего, ферментативной и неферментативной антиоксидантными системами (АОС). В случае невысокой активности ПОЛ и достаточной емкости АОС течение и исход болезни благоприятные. В случае крайне высокой активности ПОЛ происходит истощение АОС, а в целом это приводит к нарушениям активности клеточных ферментов, особенно гликолиза, гликогенолиза, разобщению фосфорилирования, в результате чего клетка теряет энергический потенциал, что само по себе приводит к гибели клетки, в частности, гепатоцита. Наряду с этим нарушается проницаемость как мембраны гепатоцита, так и его внутренних структурных компонентов. Происходит коррозия гепатоцита, теряется его синтетическая, дезинтоксикационная и другие функции. Нарушение проницаемости лизосомальных мембран способствует выходу в цитоплазму протеолитических ферментов, которые и завершают гибель гепатоцита. Обломки разрушившейся клетки становятся чужеродными для макроорганизма и обезвреживаются компонентами неспецифической иммунной системы.
Многие из положений данной теории доказаны нашими работами, а также работами Н.И. Нисевич и В.Ф. Учайкина. Верность такого взгляда на патогенез цитолиза гепатоцитов при вирусных гепатитах подтверждена положительными результатами терапии с использованием антиоксидантов.
При тяжелом течении вирусных гепатитов возможна и следующая фаза патогенеза – вторичная вирусемия, что может привести к хронизации болезни. Последней в патогенетической цепи вирусных гепатитов является резидуальная фаза. Что клинически соответствует периоду ранней реконвалесценции.
Читайте также:


