Генетические методы диагностики инфекционных заболеваний пцр
МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИМИ МЕТОДАМИ в исследуемом материале обнаруживают нуклеотидные последовательности ДНК возбудителя. К ним относятся метод ДНК-гибридизации и полимеразная цепная реакция.
Метод ДНК- г и б р и д и з а ц и и основан на способности денатурированной одноцепочечной ДНК возбудителя достраивать гомологичную цепь в бесклеточной системе. В качестве материала для этой второй нити используют ДНК-зонды. Это лабораторно приготовленные фрагменты молекулы ДНК, гомологичные фрагментам ДНК искомого возбудителя. Зонд метят либо радиоактивным изотопом, либо ферментом. В последнем случае для регистрации включения ДНК-зонда в ДНК бактерий, содержащуюся в исследуемом материале, к пробе добавляют субстрат, соответствующий использованному ферменту. Положительная реакция субстрат-фермент проявляется в изменении окраски субстрата и свидетельствует о соответствии ДНК-зонда ДНК возбудителя, находящейся в исследуемом материале.
Чувствительность метода уступает ПЦР (103 микроорганизмов в пробе), что ограничивает его применение как диагностического теста, тем более что аналогичную чувствительность имеют иммунологические методы, выявляющие микробные антигены.
По л и ме р а з н а я ц е п н а я р е а к ц и я (ПЦР) представляет собой метод направленной амплификации (воспроизведения) ДНК, позволяющий найти в исследуемом клиническом материале небольшие участки генетической информации любого организма и многократно размножить их. Для реализации ПЦР создают набор праймеров - фрагментов ДНК, являющихся маркером данного возбудителя. При добавлении такого праймера к пробе исследуемого материала, содержащей денатурированную одноцепочечную ДНК, происходит их соединение с комплементарным участком ДНК.
Образовавшийся двунитевой стартовый участок воспроизводится с помощью фермента Taq-полимеразы, входящей в набор для ПЦР. Вновь синтезированные фрагменты ДНК служат матрицей для синтеза новых нитей в следующем цикле амплификации и т. д. Это и есть цепная реакция. В течение нескольких часов происходит 30-40 циклов амплификации. В результате амплификации количество копий специфической нуклеотидной последовательности в реакционной пробе возрастает в 106-108 раз, что обеспечивает высокую чувствительность метода.
Преимущества молекулярно-генетических методов диагностики состоят в их высокой специфичности и чувствительности. Они позволяют обнаруживать в исследуемом материале единичные клетки возбудителя.
ПЦР имеет три технологические стадии:
❖ выделение и экстракция ДНК (пробоподготовка);
❖ регистрация результатов амплификации.
Вторая стадия ПЦР — циклическая амплификация — протекает поэтапно при определённой температуре реакционной смеси.
Образовавшиеся в каждом цикле амплификации новые цепи ДНК служат матрицами для последующих циклов, при этом число копий ДНК нарастает в геометрической прогрессии (2n, где n — число прошедших циклов амплификации).
Описанные процессы протекают в термоциклере — программируемом термостате, по заданной программе осуществляющем смену температур согласно числу циклов шплификации.
Схема цикла полимеразной цепной реакции:
1 — нативная двухцепочечная ДНК;
2 — денатурация ДНК при температуре 94 °С;
3 — гибридизация (присоединение праймеров при температуре 55⁰ С);
4 — синтез комплементарной цепи ДНК при температуре 72 ⁰С, образование двухцепочечной ДНК.
Визуализацию результатов ПЦР осуществляют электрофоретическим разделением продуктов реакции в агарозном геле или методом гибридизации ампликонов с комплементарным к определяемой последовательности олигонуклеотидным зондом, меченным флюоресцентной, ферментной или другой меткой. Принципиально новое направление развития регистрационных систем — использование оптических биосенсоров, позволяющих определять в ходе гибридизации в реальном режиме времени пикограммовые количества фрагментов нуклеиновых кислот, иммобилизованных на поверхности оптической кюветы.
- высокая чувствительность метода, позволяющая определять 10-1000 клеток впробе;
- высокая специфичность — в исследуемом материале выявляют уникальный для данного возбудителя фрагмент ДНК;
- универсальность процедуры выявления различных возбудителей, что даёт возможность диагностировать несколько возбудителей в одной биопробе;
- высокая скорость анализа — унифицированная обработка биоматериала и детекция продуктов реакции, а также автоматизация процесса амплификации дают возможность провести полный анализ за 4-4,5 ч;
- возможность проводить количественный анализ и определять число копий специфических последовательностей нуклеотидов в пробе, контролируя таким образом вирусемию или бактериемию (например, вирусную нагрузку при вирусных гепатитах или ВИЧ-инфекции);
- возможность диагностики не только острых, но и латентных инфекций. ПЦР можно эффективно использовать для диагностики труднокультивируемых, некультивируемых и персистирующих форм микроорганизмов, её использование целесообразно для выявления возбудителей с высокой антигенной изменчивостью и внутриклеточных паразитов.
Метод ПЦР имеет свои ограничения, в частности, для диагностики инфекций, вызванных условно-патогенной микрофлорой. Высокая чувствительность ПЦР создаёт опасность получения ложноположительных результатов за счёт минимальных загрязнений ДНК окружающей среды лабораторий, регулярно выполняющих однотипные исследования. Это формирует строгие требования к режиму проведения анализа.
[youtube.player]Полимеразная цепная реакцияпозволяет обнаружить микроб в исследуемом материале (воде, продуктах, материале от больного) по наличию в нем ДНК микроба без выделения последнего в чистую культуру.
Для проведения этой реакции из исследуемого материала выделяют ДНК, в которой определяют наличие специфичного для данного микроба гена. Обнаружение гена осуществляют его накоплением. Для этого необходимо иметь праймеры комплементарного З'-концам ДНК. исходного гена. Накопление (амплификация) гена выполняется следующим образом. Выделенную из исследуемого материала ДНК нагревают. При этом ДНК распадается на 2 нити. Добавляют праймеры. Смесь ДНК и праймеров охлаждают. При этом праймеры, при наличии в смеси ДНК искомого гена, связываются с его комплементарными участками. Затем к смеси ДНК и праймера добавляют ДНК-полимеразу и нуклеотиды. Устанавливают температуру, оптимальную для функционирования ДНК-полимеразы. В этих условиях, в случае комплементарное™ ДНК гена и праймера, происходит присоединение нуклеотидов к З'-концам праймеров, в результате чего синтезируются две копии гена. После этого цикл повторяется снова, при этом количество ДНК гена будет увеличиваться каждый раз вдвое. Проводят реакцию в специальных приборах — амплификаторах. ПЦР применяется для диагностики вирусных и бактериальных инфекций.
Рестрикционный анализ.Данный метод основан на применении ферментов, носящих название рестриктаз. Рестриктазы представляют собой эндонук-леазы, которые расщепляют молекулы ДНК, разрывая фосфатные связи не в произвольных местах, а в определенных последовательностях нуклеотидов. Особое значение для методов молекулярной генетики имеют рестриктазы, которые узнают последовательности, обладающие центральной симметрией и считывающиеся одинаково в обе стороны от оси симметрии. Точка разрыва ДНК может или совпадать с осью симметрии, или быть сдвинута относительно нее.
В настоящее время из различных бактерий выделено и очищено более 175 различных рестриктаз, для которых известны сайты (участки) узнавания (рестрикции). Выявлено более 80 различных типов сайтов, в которых может происходить разрыв двойной спирали ДНК.
В геноме конкретной таксономической единицы находится строго определенное (генетически задетерминированное) число участков узнавания для определенной рестриктазы.
Если выделенную из конкретного микроба ДНК обработать определенной рестриктазой, то это приведет к образованию строго определенного количества фрагментов ДНК фиксированного размера.
Размер каждого типа фрагментов можно узнать с помощью электрофореза в агарозном геле: мелкие фрагменты перемещаются в геле быстрее, чем более крупные фрагменты, и длина их пробега больше. Гель окрашивают бромистым этидием и фотографируют в УФ-излучении. Таким образом, можно получить рестрикционную карту определенного вида микробов.
Сопоставляя карты рестрикции ДНК, выделенных из различных штаммов, можно определить их генетическое родство, выявить принадлежность к определенному виду или роду, а также обнаружить участки, подвергнутые мутациям.
Этот метод используется также как начальный этап метода определения последовательности нуклеотидных пар (секвенирования) и метода молекулярной гибридизации.
Метод молекулярной гибридизациипозволяет выявить степень сходства различных ДНК. Применяется при идентификации микробов для определения их точного таксономического положения.
Метод основан на способности двухцепочечной ДНК при повышенной температуре (90 °С) в щелочной среде денатурировать, т. е. расплетаться на две нити, а при понижении температуры на 10 °С вновь восстанавливать исходную двухцепочечную структуру. Метод требует наличия молекулярного зонда.
Зондомназывается одноцепочечная молекула нуклеиновой кислоты, меченная радиоактивными нуклидами, с которой сравнивают исследуемую ДНК.
Для проведения молекулярной гибридизации исследуемую ДНК расплетают указанным выше способом, одну нить фиксируют на специальном фильтре, который затем помещают в раствор, содержащий радиоактивный зонд. Создаются условия, благоприятные для образования двойных спиралей. В случае наличия комплементарности между зондом и исследуемой ДНК, они образуют между собой двойную спираль.
Риботипирование и опосредованная транскрипцией амплификация рибосомальной РНК.Последовательность нуклеотидных оснований в оперонах, кодирующих рРНК, отличается консервативностью, присущей каждомувиду бактерий. Эти опероны представлены на бактериальной хромосоме в нескольких копиях. Фрагменты ДНК, полученные после обработки ее рестриктазами, содержат последовательности генов рРНК, которые могут быть обнаружены методом молекулярной гибридизации с меченой рРНК соответствующего виды бактерий. Количество и локализация копий оперонов рРНК и рестрикционный состав сайтов как внутри рРНК-оперона, так и по его флангам варьируют у различных вида бактерий. На основе этого свойства построен метод риботипирования, который позволяет производить мониторинг выделенных штаммов и определение их вида. В настоящее время риботипирование проводится в автоматическом режиме в специальных приборах.
Опосредованная транскрипцией амплификация рРНКиспользуется для диагностики смешанных инфекций. Этот метод основан на обнаружении с помощью молекулярной гибридизации амплифицированных рРНК, специфичных для определенного вида бактерий. Исследование проводится в три этапа:
1. Амплификация пула рРНК на матрице выделенной из исследуемого материала ДНК при помощи ДНК-зависимой РНК-полимеразы.
2. Гибридизация накопленного пула рРНК с комплементарными видоспецифическим рРНК олигонуклеотидами, меченными флюорохромом или ферментами.
3. Определение продуктов гибридизации методами денситометрии, иммунофермент-ного анализа (ИФА).
Реакция проводится в автоматическом режиме в установках, в которых одномоментное определение рРНК, принадлежащих различным видам бактерий, достигается разделением амплифицированного пула рРНК на несколько проб, в которые вносятся комплементарные видоспецифическим рРНК меченые олигонуклеотиды для гибридизации.
Не нашли то, что искали? Воспользуйтесь поиском:
[youtube.player]Для диагностики инфекционных заболеваний генетическими методами маркером возбудителя является его геном. Методы индикации нуклеиновых кислот применяют для диагностики вирусных инфекций, для идентификации бактерий (особенно таких, которые трудно выделить) и для определения точного таксономического положения микроорганизмов. Методы позволяют обнаружить микроорганизм в исследуемом материале (воде, продуктах, материале от больного) по наличию ДНК без его выделения в чистую культуру.
Метод молекулярной гибридизацииоснован на способности ДНК и РНК специфически соединяться (гибридизироваться) с комплементарными олигонуклеотидными фрагментами, искусственно синтезированными и меченными ферментом, флюорохромом или изотопом. Эти фрагменты называются зондами .
Для проведения молекулярной гибридизации молекулу исследуемой ДНК расплетают, одну нить закрепляют на специальном фильтре, который помещают в раствор, содержащий меченый зонд. Создаются условия, благоприятные образованию двойных спиралей. При наличии комплементарности между зондом и исследуемой ДНК они образуют между собой двойную спираль. После окончания гибридизации и отмывания несвязавшихся продуктов проводится детекция образовавшегося комплекса при помощи соответствующей метки.
Рис. Схема реакции молекулярной гибридизации для обнаружения в образцах ДНК или РНК возбудителя специфическим меченным зондом. (Иммунология инфекционного процесса. Под ред. В.И. Покровского, С.П. Гордиенко и В.И. Литвинова.-М., 1994.)
Полимеразная цепная реакция (ПЦР)основана на многократном увеличении числа копий (амплификации) определенного участка ДНК, катализируемое ферментом ДНК-полимеразой. ПЦР - это очень чувствительный метод, теоретически для получения результата достаточно наличие в материале одной молекулы ДНК.
ПЦР состоит из трех основных этапов: подготовки исследуемой пробы (изоляция ДНК или РНК), собственно ПЦР и детекции продукта ПЦР (амплифицированной ДНК). При использовании РНК в качестве матриц для ПЦР предварительно на этой РНК-матрице посредством фермента РНК-зависимой ДНК-полимеразы (обратной транскриптазы или ревертазы) синтезируют комплементарную ДНК, которая затем используется в качестве матрицы в ПЦР. После того, как из бактерий Thermous thermophilis удалось получить ДНК-полимеразу, которая наряду с полимеразной обладает еще и обратно-транскриптазной активностью, удалось совместить эти две реакции. Этот вариант ПЦР широко применяется для детекции РНК-содержащих вирусов, определения экспрессии вирусных, бактериальных и клеточных генов по их РНК.
Для проведения ПЦР необходимы пять основных компонентов:
- фермент ДНК-полимераза;
- пара олигонуклеотидных праймеров;
- набор нуклеотидов;
- копируемая ДНК;
- ионы Mg +2 , необходимые для функционирования ДНК-полимеразы.
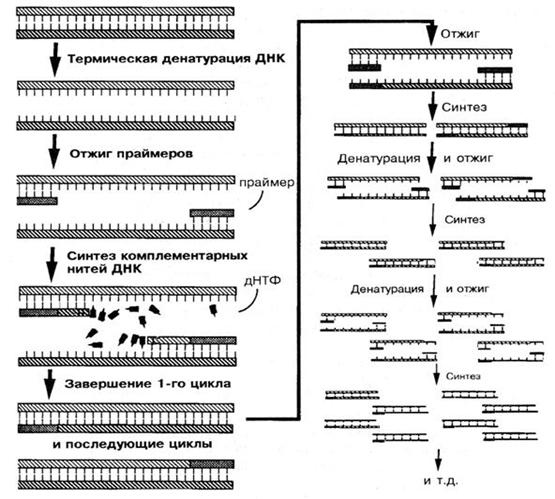
Рис. Схема полимеразной цепной реакции. дНТФ - дезоксинуклеотидтрифосфат (Из: Schaechter M ., Medoff G ., Eisenstein B . Mechanisms of microbial diseases , 2 nd ed ., Williams & Wilkins , 1993).
Для амплификации (т.е. синтеза ДНК-матрицы) отбирают наиболее консервативную часть, уникальный ген. Для запуска синтеза на ДНК-матрице используют 2 праймера (короткие, длиной 20-30 оснований одноцепочечные фрагменты ДНК), комплементарные 3 ¢ -концам ДНК искомого гена. Выделенную из исследуемого материала ДНК нагревают. При этом ДНК распадается на две нити. Добавляют праймеры, затем смесь ДНК и праймеров охлаждают. При этом праймеры при наличии в смеси ДНК искомого гена связываются с его комплементарными участками ( отжиг ). Добавляют ДНК-полимеразу и нуклеотиды. При температуре, оптимальной для функционирования ДНК-полимеразы, нуклеотиды присоединяются к 3' -концам праймеров, формируется специфический фрагмент (ампликон). После этого цикл повторяют снова, при этом количество ДНК гена будет увеличиваться каждый раз в 2 раза. Рассчитано, что за 30-40 циклов из одной матрицы можно получить 10 8 ампликонов. Реакцию проводят в специальных приборах - амплификаторах. После 30-80 циклов накопления копий ДНК проводят их идентификацию методом гель-электрофореза и визуализацию в УФ свете после окрашивания этидием бромида. Для подтверждения принадлежности ДНК возбудителю можно провести ДНК-гибридизацию.
РАЗДЕЛ V . ИНФЕКЦИЯ

Папиллярные узоры пальцев рук - маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни.
[youtube.player]Идентификация нуклеиновых кислот
Метод молекулярной гибридизации нуклеиновых кислот (НК) основывается на способности НК специфически соединяться (гибридизироваться) с комплементарными фрагментами гомологичных ДНК или РНК искусственно созданных нитей, меченных изотопами или ферментами (пероксидаза, щелочная фосфатаза).
Полимеразная цепная реакция (ПЦР). В случаях когда в исследуемом материале ДНК или РНК мало или недостаточно для того, чтобы установить её точную генетическую принадлежность, прибегают к полимеразной цепной реакции, основу которой составляет катализируемое ДНК-полимеразой многократное образование копий определённого участка ДНК.ПЦР была разработана в 1983 году американским учёным Керри Мюллисом. В 1993 году К. Мюллис за свои исследования был удостоен Нобелевской премии.
ДНК состоит из двух цепей, построенных из четырёх нуклеотидов: аденина, тимина, гуанина, цитозина (А, Т, Г, Ц). Последовательность нуклеотидов одной цепи комплементарна последовательности другой. У каждой цепи есть 3’- и 5’-концы. 3’-конец одной цепи связан с 5’-концом другой. ДНК-полимераза узнает азотистые основания в цепочке-матрице и наращивает вторую цепочку от 3’- к 5’-концу ДНК, делая подобие негатива. В среде, где производится синтез, должен присутствовать строительный материал – свободные нуклеотиды. ДНК-полимераза начинает работать только тогда, когда к цепи ДНК присоединяется праймер. Праймер представляет собой небольшую цепочку нуклеотидов, служащую затравкой для синтеза новой цепи. С матрицей она соединяется комплементарно. В праймере должно быть не менее 20-30 нуклеотидов: чем их больше, тем точнее выбирается антипоследовательность. Многократно повторяя эту операцию, полимераза способна удлинять 3’-конец праймера до тех пор, пока не достигнет 5’-конца матрицы. Однако если добавить в среду дидезоксинуклеотидтрифосфат (ddNTP), например, дидезоксиаденин (ddA), дальнейший рост цепи невозможен, поскольку к 3’-концу нуклеотиды присоединяться уже не могут.
Зная последовательность оснований, на его границе синтезируют праймер-антипоследовательность из 20-30 нуклеотидов. Их добавляют к препарату расплетённой ДНК, они связываются с родственным участком. С этого места начинает работать фермент-копировщик ДНК-полимераза. Чтобы ограничить нужный участок с другой стороны, с 3’-конца, нужны ddNTP четырёх типов. Копия антипараллельна, и по ней ДНК-полимераза движется в обратную сторону. Работу она начинает с праймера ко второму граничному участку (он должен быть антипоследовательностью, то есть таким же, как в матрице). Дойдя до конца, который был началом в предыдущем проходе, фермент уже во втором цикле выдаёт точную копию избранного участка. Полимераза копирует её в следующем цикле, потом обе копии, потом – 4 и т.д. Заставив полимеразу работать дальше побочных продуктов реакции - копий с длинными хвостами с обеих сторон, будет всё меньше. После 20 проходов будет около 1 миллиона копий нужного участка, а других фрагментов – лишь несколько десятков.
Техника ПЦР
Исследуемым материалом для ПЦР может быть культура бактерий, нуклеиновые кислоты, выделенные из клеток, биологические жидкости (кровь, моча), материал из внешней среды – вода, почва, пищевые продукты и т.д., содержащие ДНК или РНК.
На I этапе молекула ДНК разделяется нагреванием до 95 0 С на 2 комплементарные нити.
На II этапев реакционную смесь добавляют искусственно синтезированные ДНК-олигонуклеотидные праймеры двух типов. Одни из них комплементарны началу одной цепи ДНК, другие – концу второй. Одновременно вводится смесь 4 типов ddNTP. Праймеры соединяются с цепями ДНК.
На III этапе смесь нагревают до 70 0 С и добавляют фермент ДНК-полимеразу (термостабильную), выделенную в 1980 году Калединым из бактерий Thermus aquaticus, живущих в горячих источниках. Этот фермент достраивает вслед за каждым праймером вторую цепь. Процесс удвоения повторяется 20-30 раз до получения миллиона копий исходной молекулы ДНК. Для проведения ПЦР применяются специальные термостаты – термальные циклеры, позволяющие многократно и быстро проводить нагревание и охлаждение исследуемых проб.
На IV этапе проводится оценка результатов ПЦР с помощью электрофореза в 1% геле с окраской фракций ДНК бромидом этидия, ярко светящимся в ультрафиолетовых лучах. Полученные электрофореграммы затем анализируются.
ПЦР наиболее эффективна для обнаружения микроорганизмов, трудно культивируемых в лабораторных условиях. Как правило, эти возбудители – внутриклеточные паразиты, длительно персистирующие в организме хозяина.
Контрольные вопросы
ЗАДАЧА. У больного К. с диагнозом бактериальная дизентерия в первый день заболевания выделен возбудитель дизентерии с типичными для этого вида биохимическими и другими свойствами (не ферментировал лактозу). Через два дня у этого же больного был выделен микроб, у которого все свойства были типичными для возбудителя дизентерии: у него появилась способность ферментировать лактозу. Какой генетический механизм возникновения у возбудителя дизентерии нового свойства можно предположить? Как доказать наличие предполагаемого вами механизма изменчивости?
[youtube.player]За звучной аббревиатурой ПЦР скрывается сложная и не слишком понятная для рядового пациента расшифровка — полимеразная цепная реакция. Что же такое ПЦР-диагностика, на чем она основана и почему в последнее время ее стали считать самой перспективной технологией в постановке диагнозов, касающихся инфекционных и вирусных заболеваний? Мы расскажем о преимуществах ПЦР-метода, его особенностях и этапах проведения.
ПЦР-диагностика: что это такое?
Диагностика методом ПЦР существует чуть более 30 лет. Значительно эволюционировав за это время, она зарекомендовала себя как один из наиболее точных способов выявления инфекций. В основе метода лежит принцип многократного увеличения микроскопических концентраций фрагментов ДНК возбудителя в биологической пробе пациента в искусственных условиях. В результате сложного процесса, называемого амплификацией, под воздействием ферментов и изменения температуры (от 50 до 95°С) из одной молекулы ДНК образуется две. При этом происходит копирование участка ДНК, который присутствует только у того вида патогенного микроорганизма, который интересует врача.
Цикл образования новой молекулы ДНК занимает всего около 3 минут, а тридцати-сорока циклов вполне достаточно, чтобы получить количество молекул, необходимое для достоверного визуального определения методом электрофореза.
Кроме амплификации, то есть простого увеличения числа копий молекулы ДНК, с помощью ПЦР можно производить и другие манипуляции с генетическим материалом, например, сращивать фрагменты ДНК, вводить мутации и т.д. Это позволяет использовать ПЦР не только для диагностики инфекционных и генетических заболеваний, но и для установления отцовства, клонирования и выделения новых генов.
ПЦР-диагностика проводится в специальных лабораториях с помощью амплификационного оборудования. На сегодня существует множество различных модификаций ПЦР, включая технологии с использованием не только ДНК, но и фрагментов рибонуклеиновой кислоты (РНК). В некоторых из них амплификация осуществляется при постоянной температуре, и для их проведения специальное оборудование не требуется.
Еще одна популярная модификация ПЦР — мультиплексная амплификация (МПА), которая позволяет проводить исследование сразу нескольких изучаемых фрагментов в одной пробирке. Это не только ускоряет и удешевляет проведение анализа, но и позволяет рассматривать одни фрагменты, получившиеся в результате реакции, в качестве положительных маркеров для других, что еще больше увеличивает точность исследования методом ПЦР.
В клинической медицине ПЦР-диагностика является одним из наиболее востребованных методов анализа в самых разных сферах:
- Прямое определение возбудителя инфекции. Некоторые традиционные методы, такие как иммуноферментный анализ (ИФА), выделяют только белки-маркеры, которые являются продуктом жизнедеятельности возбудителей инфекции, а потому только косвенно указывают на присутствие микроорганизмов. Наличие специфического участка в ДНК, выявленное с помощью ПЦР, безошибочно или почти безошибочно указывает на присутствие конкретной инфекции.
- Высокая специфичность метода . Она обусловлена тем, что в исследуемом материале выявляется фрагмент ДНК, характерный только для конкретного возбудителя инфекции. Специфичность исключает возможность ложных результатов анализа, тогда как в иммунологических методах исследований ошибки вполне вероятны из-за перекрестной реакции антигенов.
- Высокая чувствительность . При помощи ПЦР-диагностики можно выявить присутствие в организме даже единичных клеток вирусов или бактерий в тех случаях, когда обычными методами сделать это практически невозможно. ПРЦ определяет наличие всего 10–100 клеток в пробе, тогда как иммунологическими и микроскопическими тестами можно определить наличие инфекции при количестве клеток не менее 103–105.
- Универсальность . Сходство состава всех ДНК или РНК дает возможность применять универсальные методы лабораторных исследований, диагностируя сразу несколько возбудителей из одной биологической пробы.
- Скорость получения результатов . Поскольку для проведения ПЦР-диагностики не нужен посев и выделение культуры возбудителя, то и большого количества времени на нее не требуется. Весь цикл — от забора биоматериала до получения результатов — занимает 4–5 часов.
- Диагностика латентных инфекций . ПЦР-методом диагностируются трудно культивируемые и некультивируемые формы микроорганизмов, встречающиеся в тех случаях, когда заболевание протекает в скрытой форме.
Методом ПЦР можно выявлять возбудителей инфекции не только в организме человека, но и в почве, воде, продуктах питания.
Тем не менее не стоит думать, что ПЦР-диагностика не имеет недостатков. У нее есть свои ограничения, но их количество настолько незначительно, что не может отрицательно повлиять на популярность и эффективность метода:
- Вероятность амплификации ДНК не только живого, но и погибшего микроорганизма . При проведении ПЦР-диагностики для контроля эффективности лечения необходимо соблюдать определенные требования. В частности, проводить ПЦР нужно после определенного промежутка времени (1–2 месяца), за который происходит полное исчезновение возбудителя инфекции в организме.
- Возможность возникновения перекрестной реакции . Подбор фрагментов ДНК (праймеров) осуществляется на основе знаний о генетическом строении конкретного микроорганизма. Но теоретически такой же фрагмент может присутствовать и у других микроорганизмов, геном которых на сегодняшний день еще не расшифрован. Их присутствие в пробе может привести к ложноположительному результату анализа.
- Изменчивость микроорганизмов . Эта способность возбудителей к мутации иногда приводит к тому, что некоторые их штаммы становятся неуловимыми в процессе ПЦР-анализа.
Чтобы уменьшить риски, разработаны стандарты объемов испытаний тест-систем ПЦР-диагностики, включающие проверку на перекрестные реакции и тестирование всех известных штаммов конкретного возбудителя.
ПЦР-диагностика проводится в специальной лаборатории в несколько этапов.
- Забор биоматериала . Процедура, предшествующая непосредственному анализу, которая осуществляется в процедурном кабинете соответствующего профиля. Забор делается с помощью стерильного оборудования только в стерильные пробирки. Материалом для исследования могут быть:
- Эпителиальные соскобы со слизистых оболочек: из уретры, из цервикального канала, со слизистой дыхательных путей и зева, из конъюнктивы. Забор проводится с помощью специального ершика, при этом недопустимо попадание в материал следов крови.
- Моча . Собираются первые 50 г утренней мочи в стерильную емкость. Материал используется для диагностики мочеполовых инфекций.
- Мокрота . Используется для ПЦР-диагностики туберкулеза и респираторных форм микоплазмоза и хламидиоза. Мокроту собирают в стерильный флакон в количестве 15–20 мг.
- Кровь, сыворотка, плазма . С их помощью диагностируются гепатиты, герпес, ВИЧ-инфекция. Для анализа используется венозная кровь (1–1,5 мл), собранная у пациента натощак в стерильную пробирку. Хранить биоматериал можно не более суток при температуре 4°С. Замораживать кровь категорически запрещается.
- Биологические жидкости . К ним относятся слюна, сок простаты, околоплодная, плевральная, спинномозговая, суставная жидкости. Собираются при помощи пункции с использованием стерильного инструментария в количестве 0,1–1,5 мл в стерильные пробирки.
- Биоптаты , т.е. материалы, полученные путем биопсии. Обычно на анализ отправляют биоптаты двенадцатиперстной кишки или желудка, чтобы выявить хеликобактерную инфекцию. Объем материала 2–3 мм 3 .
- Хранение и транспортировка биоматериала . Хранить образцы можно при комнатной температуре не более 2 часов. Если необходимо длительное хранение, то пробы помещают в холодильник с температурой 2–8°С на срок не более одних суток. Допустимо хранение некоторых биоматериалов в течение двух недель в замороженном виде при температуре -20°С. Оттаивание и повторное замораживание проб запрещено. Транспортировка, если она необходима, должна проводиться в специальных термоконтейнерах или термосах с соблюдением всех правил хранения и перевозки биоматериалов.
- Выделение ДНК из образца . Способ выделения зависит от вида определяемого микроорганизма и от вида биологического образца. Если, например, анализируется соскоб эпителиальных клеток, используется так называемый метод твердофазной сорбции, заключающийся в добавлении в образец специального вещества, концентрации ДНК на сорбенте и его многократной отмывке буферным раствором.
- Проведение ПЦР . Некоторое количество образца из биологической пробы переносится в специальную микроцентрифужную пробирку. Туда же добавляется амплификационная смесь, имеющая сложный состав, в объеме 25 мл. Пробирки устанавливают в программируемый термостат, и автоматическом режиме проводится амплификация. Время ее проведения зависит от заданной программы и составляет 2–3 часа. Одновременно с опытными пробами проводятся контрольные — положительные , включающие в себя контрольный препарат ДНК исследуемого возбудителя, и отрицательные , не содержащие исследуемую ДНК. Количество циклов амплификации варьирует от 30 до 40, более 40 циклов проводить не рекомендуется, так как это способствует увеличению количества неспецифических продуктов в пробе.
- Регистрация результатов . Фрагмент ДНК, характерный для возбудителя инфекции, выделяют методом электрофореза в присутствии специального вещества — бромистого этидия. Его соединение с фрагментами ДНК дает светящиеся полосы при облучении ультрафиолетовым излучением. Образец помещают в камеру для электрофореза и в течение 35–40 минут проводят разделение продуктов амплификации. После этого образец просматривают в ультрафиолетовом свете — наличие оранжевой светящейся полосы свидетельствует о положительном результате.
- Интерпретация результатов исследования . Результат ПЦР-диагностики может быть либо положительным, либо отрицательным. Положительный результат говорит о том, что в организме человека обнаружены следы инфекции, причем именно в данный момент времени. Количественный результат ПЦР-анализа оценить может только врач, они индивидуальны для разных типов инфекций. На основании количественного результата можно сделать вывод о степени активности заболевания и определить характер лечения.
Цена ПЦР-диагностики зависит от того, на какую конкретно инфекцию пациент планирует проверяться, от вида анализируемого материала, методики тестирования — качественной или количественной. Цена за определение одной инфекции составляет от 200 до 800 рублей в разных клиниках. Кроме того, к стоимости анализа добавится и плата за забор биоматериала — около 400 рублей. Средняя стоимость ПЦР-диагностики разных видов приведена в таблице 1.
Таблица 1 . Примерные цены на анализы ПЦР в Москве
| Название анализа | Цена, руб. |
| Определение ДНК хламидия | 750 |
| Определение ДНК микоплазмы хоминис | 540 |
| Определение микоплазмы гениталиум | 350 |
| Определение ДНК уреаплазмы | 350 |
| Гонококк, определение ДНК | 350 |
| Определение ДНК герпеса (разные типы) | 350–600 |
| Определение ДНК кандиды | 570 |
| Вирус краснухи, определение РНК | 800 |
| Дифференцированное определение ДНК ВПЧ (разные типы) | 350–1900 [1] |
Читайте также:


