Фотодинамическая терапия при гиперкератозе
Дистрофические заболевания вульвы включают две нозологические формы: склеротический лишай (крауроз) и плоскоклеточная гиперплазия (лейкоплакия), которые относятся к доброкачественным поражениям. Для крауроза вульвы характерны атрофия многослойного плоского эпителия (от греческого craurosis - сухой, сморщенный). При данном заболевании прогрессируют атрофия и склероз кожи и слизистых оболочек вульвы. При лейкоплакии вульвы преобладает гиперплазия плоского эпителия с нарушением его дифференцировки и созревания. Плоскоклеточная гиперплазия визуализируется как белый утолщённый эпителий с неровной поверхностью без процессов сморщивания и склероза. Часто встречается вариант смешанной дистрофии вульвы - сочетание крауроза с лейкоплакией.
Существуют разные теории происхождения лейкоплакии и крауроза вульвы: эндокринная, инфекционная, вирусная, генетическая, нейрогенная, аутоиммунная. Однако не одна из них не может объяснить в полной мере изменений, которые происходят при развитии данных заболеваний. Многие специалисты отмечают у этих больных гипоэстрогению и/или обменно-эндокринные нарушения (сахарный диабет).
Чаще всего самый ранний симптом заболевания — мучительный зуд, сочетающийся иногда с чувством жжения, усиливающийся по ночам или при физической нагрузке. Расчесы, трещины, в которые внедряются микроорганизмы, способствуют возникновению очагов хронического воспаления. В результате развивающейся атрофии тканей при склерозирующем лишае слизистый покров вульвы истончается, становится блестящим, сухим, легко ранимым, напоминает пергаментную бумагу. При плоскоклеточной гиперплазии слизистая приобретает белую окраску, эпителиальные бляшки утолщаются, а иногда и покрываются трещинами.
Дистрофические заболевания вульвы диагностируют во всех возрастных группах. Среди женщин репродуктивного возраста пик заболеваемости приходится на возраст старше 30 лет. Однако, эти заболевания встречаются преимущественно у лиц пожилого возраста. Нередко при дистрофических заболеваниях вульвы отмечается наличие интраэпителиальной дисплазии и имеется риск возникновения рака вульвы. Частота его развития на фоне хронических дистрофических заболеваний по данным разных авторов варьирует от 3 до 30 %.
Диагностика и обследование больных с краурозом и лейкоплакией вульвы включает в себя визуальный осмотр, вульвоскопию с проведением пробы Шиллера, цитологическое исследование. Для исключения рака вульвы необходима биопсия с последующим гистологическим исследованием.
Лейкоплакия и крауроз вульвы относятся к трудноизлечимым заболеваниям.
Консервативная терапия - основной подход к лечению склеротического лишая. Она должна быть направлена на ликвидацию воспалительных изменений, улучшение трофики тканей, снятие психоэмоционального напряжения и чувства зуда. В практике лечения дистрофических заболеваний вульвы в основном используются препараты для местного применения, среди которых ведущее место отводят гормональным средствам (эстрогены, прогестерон, андрогены, глюкокортикоиды), которые приводят к временной ремиссии заболевания. Также применяется немедикаментозная терапия, включающая криодеструкцию, лазерную терапию и иглорефлексотерапию. При отсутствии эффекта от консервативной терапии прибегают к хирургическому лечению, которое также дает большой процент рецидивов.
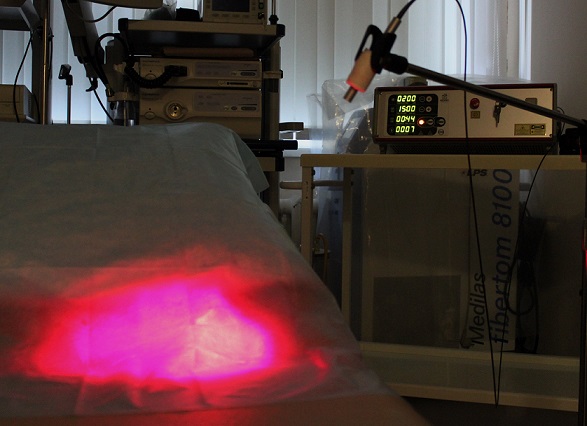
В нашей клинике на основе данных зарубежной и отечественной литературы разработана и эффективно внедрена в практику оригинальная методика лечения крауроза и лейкоплакии вульвы. На основе использования местной аппликации 5-аминолевулиновой кислоты создаются условия для избирательного накопления эндогенного фотосенсибилизатора протопорфирина IX в клетках измененного эпителия вульвы, а последующее лазерное облучение вызывает селективное повреждение в зоне поражения слизистой с минимальными рубцовыми изменениями в окружающих тканях. Данная методика относится к косметическим процедурам и не имеет осложнений. Уже через 1-2 сеанса фотодинамической терапии самочувствие пациентов улучшается, ослабевает зуд. Как показывает собственный клинический опыт наблюдения за больными, при незначительных изменениях в области вульвы после одного курса лечения (5 сеансов ФДТ) в последующем состояние кожи и слизистых оболочек улучшается. Положительный эффект от лечения сохраняется в течении от нескольких месяцев до нескольких лет. У 70% пациентов наступает длительная ремиссия.

Фотодинамическая терапия (ФДТ) представляет собой один из современных методов лечения серьезного офтальмологического заболевания — влажной формы ВМД (возрастной макулодистрофии). Для лечения другой формы данного заболевания (сухой ВМД) этот метод не применяется.
Суть метода ФДТ
- Скопления под сетчаткой жидкости, приводящей к ее отеку и нарушению положения и формы макулы.
- Разрастания, разрушающей клетки макулы соединительной ткани и патологической мембраны.
- Потери центрального зрения.
Процедура занимает примерно 20-25 минут и должна проводиться в специализированной клинике, опытным специалистом.
Вещество вертепорфин, входящее в состав препаратов-фотосенсибилизаторов, для проведения ФДТ способно повышать светочувствительность глаз и кожи пациента. Поэтому, после лечения необходимо избегать прямого солнечного воздействия и защищать глаза солнечными очками не менее 5 дней.
Спустя месяц после окончания лечения, назначается контрольный осмотр для оценки эффективности проведенной терапии.
Преимущества и недостатки метода ФДТ
Ограничение роста аномальных кровеносных сосудов в субретинальном пространстве после проведения фотодинамической терапии существенно замедляет прогрессирование процесса влажной формы возрастной макулодистрофии.
Конечно, данный метод восстановить утраченное уже зрение не поможет, но с его помощью можно затормозить дальнейшее повреждение ткани сетчатки, приводящее к ухудшению зрения. Для улучшения зрения при влажной ВМД, достижение клинического эффекта зачастую требует назначение пациентам сразу нескольких видов различной терапии.
По мнению специалистов, курс процедур ФДТ во многих случаях значительно эффективнее лазерной хирургии и имеет меньше рисков развития офтальмологических осложнений у пожилых пациентов. Ведь подобные процедуры действуют направленно на кровеносные сосуды не повреждая нервные клетки макулы и всей сетчатки. В то время, как хирургические операции с применением лазера при ВМД практически всегда сопровождаются немедленной, перманентной утерей центрального зрения — образованием слепого пятна в центральной зоне. Кроме того, подобные операции не способны остановить дальнейший рост аномальных кровеносных сосудов.
Благодаря предупреждению разрастания аномальных сосудов в субретинальном пространстве и прекращению кровотечения из них, фотодинамическая терапия снижает риск значительного ухудшения зрения. Однако при определенных типах влажной возрастной макулодистрофии проведение ФДТ не имеет значимого эффекта. Это объясняется некоторыми особенностями строения патологических сосудов и их местоположения под сетчаткой. Таким образом, результативность применения ФДТ при разных типах влажных форм возрастной макулярной дегенерации очень отличается, о чем необходимо заранее предупреждать пациента.
Торможение процесса развития возрастной дегенерации макулы после проведения фотодинамической терапии часто имеет временный характер. Спустя несколько месяцев (от 3 до 5), патологические сосуды вновь начинают кровоточить. То есть, пациентам с ВМД для получения значимого клинического эффекта, в определенное время необходимо повторять процедуру ФДТ и проводить комплексную терапию с применением всех известных методов лечения этого заболевания.
Таким образом, к основным недостаткам ФДТ можно отнести ограниченность применения метода (только для определенных форм влажной макулодистрофии), ограниченность количества случаев (особенности течения болезни) и временный эффект применения метода.

Риски и осложнения ФДТ
При вей безопасности и хорошей переносимости процедуры пациентами всех возрастов, после ее проведения иногда возникают осложнения. Так в очень редких случаях, проведение ФДТ может привести к значительному ухудшению зрения (1-4% случаев). Правда в своем большинстве, зрение в дальнейшем частично восстанавливается.
Среди других побочных эффектов проведения фотодинамической терапии, специалисты отмечают:
- Временные нарушения зрения (расплывчатость зрения, снижение его остроты, дефекты полей зрения).
- Кровотечения, отек, боль или воспалительные реакции в месте введения вертепорфина. В некоторых случаях, пациенты отмечают в том числе и боль в спине, которую относят к введению препарата.
- Повышение АД, лихорадочные состояния, вазовагальные реакции.
- Реакции фотосенсебилизации (ожоги при пребывании на солнце).
Что необходимо учитывать пациенту
В офтальмологической практике, фотодинамическая терапия сегодня считается эффективной только для определенных типов влажной возрастной макулодистрофии у пациентов с определенной формой заболевания. Поэтому стоит принимать в расчет, что кандидатами на проведение процедуры могут стать далеко не все пациенты. Целесообразность проведения ФДТ в том или ином случае определяется после проведения необходимых диагностических исследований.
Также необходимо учитывать, что эффективность процедуры и ее отдаленные последствия пока находятся на стадии изучения.
Вещество вертепорфин, как и препараты, в составе которых он находится (Визудин), относится к дорогостоящим медицинским средствам. Поэтому цена процедуры с введением одного из них достаточно высока, что увеличивает общую стоимость лечения возрастной макулярной дегенерации. Правда, принимая решение о выполнении процедуры ФДТ в комплексной терапии ВМД стоит помнить, что ее потенциальный положительный эффект, это замедление прогрессирования заболевания, а значит и предупреждения наступления необратимой слепоты.
По определению Международного общества исследователей заболеваний вульвы, дистрофия вульвы — это нарушение роста и созревания эпителия, которое приводит к образованию белых пятен. Заболевание это в настоящее время недостаточно изучено и с трудом поддается
По определению Международного общества исследователей заболеваний вульвы, дистрофия вульвы — это нарушение роста и созревания эпителия, которое приводит к образованию белых пятен. Заболевание это в настоящее время недостаточно изучено и с трудом поддается лечению.
Дистрофические заболевания вульвы встречаются у 2–10% пациенток, обращающихся за медицинской помощью в женскую консультацию. Из них от 1/2 до 2/3 пациенток — это женщины, находящиеся в постменопаузе.
К дистрофическим заболеваниям вульвы относятся плоскоклеточная гиперплазия и склеротический лишай.
Плоскоклеточная гиперплазия встречается в основном у женщин в пременопаузальном периоде и менопаузе. Она характеризуется наличием утолщения кожи в области вульвы, имеющего белый или желтый цвет. Складки вульвы могут увеличиваться, но встречается и их сморщивание, при этом сужения входа во влагалище практически не наблюдается. При исследовании биоптата вульвы микроскопически выявляется утолщенный эпидермис за счет акантоза и гиперкератоза, сосочковый слой растянут, отек не выражен, в глубоких слоях кожи наблюдается картина хронического воспаления.
Склерозирующий лишай может встречаться в любой возрастной группе, хотя чаще всего бывает у женщин после наступления менопаузы. В отличие от плоскоклеточной гиперплазии, кожа в области вульвы становится тонкой, пергаментообразной, гладкой, блестящей и хрупкой, легко трескается. Складки уплотняются, клитор закрывается плотными рубцами, вход во влагалище резко суживается. При исследовании биоптата обнаруживается нормальный эпидермис, сосочковый слой сглажен, поверхностные слои кожи отечны, наблюдается гиалинизация в глубоких слоях кожи, как и при плоскоклеточной дистрофии, а также хроническое воспаление. Отмечается отсутствие подкожной жировой клетчатки.
Смешанная дистрофия встречается в 15% случаев и характеризуется наличием у пациенток как признаков плоскоклеточной гиперплазии, так и участков со склерозирующим лишаем [1, 2].
Длительное течение, способность к малигнизации с частыми рецидивами и неудовлетворительными результатами лечения ведет зачастую к социальной дезадаптации пациенток, а также к снижению качества их жизни.
Несмотря на свою актуальность, проблема лечения дистрофических заболеваний вульвы до сих пор не решена, что обусловлено недостаточной эффективностью существующих методов терапии, длительностью течения заболевания, тяжестью клинических проявлений, а также вероятностью злокачественной трансформации вульвы [3–5].
Увеличение частоты возникновения рака вульвы на фоне предшествующих дистрофических процессов поднимает значимость проблемы современной диагностики и профилактики развития злокачественной трансформации.
В последние годы отмечается увеличение числа дистрофических заболеваний вульвы, склеротического лишая и плоскоклеточной гиперплазии вульвы, на фоне которых по данным разных авторов в 9–49% случаев возникают злокачественные опухоли [6–8]. Возможность предотвратить развитие опухолевого процесса с помощью оптимизации лечения дистрофических заболеваний вульвы заставляет гинекологов прорабатывать новые методы диагностики и лечения данной патологии.
К сожалению, в настоящее время не существует абсолютного консервативного метода лечения дистрофических заболеваний наружных половых органов, который мог бы предотвратить рецидив заболевания и развитие злокачественной опухоли.
Более того, несмотря на широкий арсенал применяемых методов консервативного лечения этой патологии, эффективность их остается относительно невысокой [9]. Так, методы консервативного симптоматического лечения, включающие в себя также современные физиотерапевтические подходы, уменьшают основной клинический симптом — зуд наружных половых органов, не обеспечивая полного устранения местных морфологических изменений на слизистой вульвы, не дают длительных ремиссий и требуют продолжительных сроков лечения.
Хирургическое лечение, несмотря на более высокую эффективность в сравнении с другими методами, отличается травматичностью, высокой частотой послеоперационных осложнений, неудовлетворительными косметическими и функциональными результатами [10–13].
.jpg) | .jpg) |
.jpg) | .jpg) |
.jpg) | .jpg) |