Дозировка метипреда при красной волчанке
За последние два десятилетия благодаря рациональному использованию кортикостероидных гормонов (КГ) и цитотоксических иммунодепрессантов (ЦИ) удалось значительно улучшить жизненный прогноз больных системной красной волчанкой (СКВ). Проведение пульс-терапи
За последние два десятилетия благодаря рациональному использованию кортикостероидных гормонов (КГ) и цитотоксических иммунодепрессантов (ЦИ) удалось значительно улучшить жизненный прогноз больных системной красной волчанкой (СКВ). Проведение пульс-терапии метилпреднизолоном (МП) и циклофосфаном (ЦФ) у больных с волчаночным нефритом, поражением центральной нервной системы (ЦНС) и цитопеническим кризом способствует ускорению сроков достижения клинического улучшения. Патофизиологическим обоснованием для применения ударных доз метилпреднизолона является его способность активно влиять на систему иммунитета и подавлять воспалительные реакции. Один из важнейших эффектов ударных доз КГ — подавление активности нейтрофилов и моноцитов и способность вызывать транзиторную перераспределительную лимфопению. Угнетающее воздействие мегадоз кортикостероидов на функцию В-лимфоцитов приводит к стойкому снижению продукции иммуноглобулинов, а следовательно, и аутоантител, а также к уменьшению образования патологических иммунных комплексов. Из других важных компонентов механизма действия ударных доз КГ заслуживают внимания воздействие на систему цитокинов-интерлейкинов-1,6, фактора некроза опухоли, металлопротеиназ и липокортина, ингибиция экспрессии и функциональной активности Fc и СЗ рецепторов мононуклеарных фагоцитов.
Консервативная терапия с использованием подавляющих доз преднизолона и цитостатиков, назначаемых внутрь, у некоторых больных улучшает клиническую картину, но почти не влияет на жизненный прогноз, особенно в случаях прогрессирующего волчаночного нефрита, церебрального криза и геморрагического пневмонита. Однократное трехдневное применение ПТ МП может за сравнительно короткое время уменьшить клиническую и лабораторную активность при нефротическом синдроме. Однако 5-летняя выживаемость пациентов, как правило, не превышает 60%. Другими словами, ударные дозы МП прекрасно зарекомендовали себя в качестве фактически ургентной терапии, с успехом применяющейся в ситуациях, непосредственно угрожающих жизни пациента, при нарастании симптоматики и в случаях неэффективности или невозможности использования консервативной схемы лечения.
Практически при всех прогрессирующих хронических заболеваниях, в том числе и аутоиммунных, жизненный и социальный прогноз в огромной степени зависит от системного, программного подхода к терапии.
Различные схемы и программы интенсивной терапии у больных СКВ стали появляться уже с середины 80-х годов и сводились к назначению ПТ в ежемесячном режиме в течение полугода. Несколько позже появилась схема программного назначения ПТ в комбинации с циклофосфаном: 1 г циклофосфана может быть добавлен к стандартной пульс-терапии обычно на 2-3-й день лечения или дополнительно к метипреду при ежемесячном режиме. Показанием для комбинированного использования циклофосфана и метипреда является манифестная высокоактивная СКВ с выраженными иммунологическими нарушениями. Программное применение пульс-терапии ЦФ у больных быстро прогрессирующим люпус-нефритом впервые в стране предложила группа исследователей во главе с профессором И. Е. Тареевой. Согласно этой методике, ЦФ вводится внутривенно из расчета 1 г на 1 м 2 поверхности тела 1-2 раза в месяц в течение года. По сравнению с пероральным назначением ЦФ эта программа позволяет добиться хороших и стабильных результатов более чем у 70% больных с прогрессирующим нефритом. Особенно важным представляется то, что внутривенное введение мегадоз ЦФ оказывает значительно меньшее токсическое воздействие на эпителий мочевого пузыря и костный мозг, практически не вызывая геморрагических циститов и агранулоцитоза.
Другое направление интенсивной терапии ревматических заболеваний — экстракорпоральные методы лечения: плазмаферез (ПФ) и практически все сорбционные технологии, гемо- и плазмосорбция. В современном исполнении ПФ осуществляется с помощью центрифужной или мебранной технологии с удалением 40-60 мл плазмы на 1 кг веса больного. Для замещения потери белка используется альбумин или свежезамороженная плазма. Стандартные курсы ПФ состоят из 3-6 процедур, проводимых последовательно или с короткими интервалами, с суммарной эксфузией плазмы до 15 л.
Интерес к ПФ у ревматологов возник на рубеже 60-80-х годов после фундаментальных исследований, посвященных иммунокомплексной природе СКВ, изучению механизмов иммунокомплексного поражения органов и тканей и патогенетической роли антител к нативной ДНК. Представлялось вполне рациональным уменьшить степень тканевых повреждений за счет удаления из циркуляции иммунных комплексов (ЦИК), антител к ДНК (а-ДНК), криоглобулинов и цитокинов.
Первые попытки применения терапевтического ПФ у больных СКВ продемонстрировали возможности этого метода в первую очередь в ситуациях, когда кортикостероидная и иммуносупрессивная терапия оказывается неэффективной, при наличии высокого уровня ЦИК, а-ДНК, криоглобулинемии, цитопениях. Выявлена прямая зависимость между адекватным удалением из циркуляции патологических белковых структур и клиническим эффектом, изучены механизмы деблокирования РЭС и повышения естественного клиренса.
Эффективность плазмафереза (от нескольких процедур до многократно повторяемых серий при неблагоприятном течении СКВ) хорошо известна и доказана в ходе многочисленных, в основном зарубежных, исследований 80-90-х годов. Пока не получено убедительных данных об эффективности ПФ у больных люпус-нефритом. Результаты проведенных в США и Канаде открытых и контролируемых испытаний весьма противоречивы.
Идея синхронной ИТ материализовалась уже в 80-х годах и является практически неотъемлемой частью лечения некоторых системных васкулитов, синдрома Гудпасчера, Вегенера, Хаммана-Ричи, криоглобулинемической пурпуры и поражения центральной и периферической нервной системы при болезни Шегрена. Первые успешные попытки применения синхронной ИТ у больных СКВ были предприняты в 1984 году в Японии, России и Германии: за рубежом — плазмаферез в комбинации с ЦФ, в России — ПФ в комбинации с пульс-терапией МП и ЦФ.
В Институте ревматологии начиная с середины 80-х изучалась эффективность синхронного применения ПФ и пульс-терапии МП и ЦФ у 56 больных СКВ с неблагоприятным жизненным прогнозом. Методика проведения синхронной интенсивной терапии (СИТ) заключалась в следующем: в течение первого месяца больным проводились три процедуры ПФ с удалением не менее 1500 мл плазмы за сеанс, интервалы между процедурами составляли 5-6 дней. После каждой процедуры назначался внутривенно 1 г метипреда, а после второй процедуры к МП добавлялся 1 г ЦФ. Далее в течение года через каждые 3 месяца проводилась одна процедура ПФ с последующим введением 1 г МП и 1 г ЦФ. Основу группы составляли молодые женщины, в подавляющем большинстве с небольшим сроком заболевания, с развернутой клиникой СКВ. Почти у каждого пациента наблюдался прогрессирующий волчаночный нефрит, более чем у половины — нефротический синдром, церебропатия, у трети больных на фоне криоглобулинемии наблюдался распространенный генерализованный васкулит кожи и слизистых оболочек. Высокая клиническая активность сопровождалась значительным повышением уровня антител к ДНК, ЦИК и гипокомплементемией.
Особо следует подчеркнуть, что у половины больных этой группы стандартная терапия, включавшая в себя массивные дозы кортикостероидов и иммунодепрессантов, была неэффективной, а почти трети пациентов адекватная терапия вообще не проводилась.
Многолетнее наблюдение за этой группой больных по окончании 12-месячной СИТ позволило сделать заключение о ее высокой эффективности. Среди этих пациентов 5-летняя выживаемость составила 81%. Наиболее показательными оказались результаты применения СИТ в группе из 12 подростков, у которых течение волчанки, как правило, приобретает фатальный характер. За весь период наблюдения состояние, близкое к клинико-лабораторной ремиссии, было отмечено у 8 из 12 больных, у 2 пациентов эпизодически наблюдались кратковременные обострения СКВ. Ежедневная доза преднизолона составляла от 2,5 до 15 мг, у одной пациентки кортикостероиды были полностью отменены. Большинству больных удалось вернуться к нормальной жизни, учебе, посильной работе, некоторые пациентки вышли замуж и имеют здоровых детей.
Таким образом, программа синхронной интенсивной многомесячной терапии оказывает значительное влияние на клинико-лабораторные проявления и существенно улучшает жизненный и социальный прогноз у больных СКВ с прогностически неблагоприятным вариантом течения. Синхронное назначение ПФ и внутривенное введение ударных доз МП и ЦФ могут использоваться по жизненным показаниям в случаях так называемого волчаночного криза — при тромбоцитопенической пурпуре, церебральной коме, развитии тромбозов, инфарктов и инсультов у больных с антифосфолипидным синдромом и геморрагическим пневмонитом. В этих ситуациях проведение СИТ обычно ограничивается 3-4 последовательными процедурами — вплоть до купирования ургентной ситуации. В случаях с заведомо неблагоприятным долгосрочным жизненным прогнозом — прогрессирующий гломерулонефрит или поражение ЦНС, язвенно-некротический васкулит, острое начало болезни у подростка — требуется проведение длительных программ СИТ.
Нам представляется, что возможности программной СИТ далеко не исчерпаны. Перспективным может оказаться добавление в схему внутривенного иммуноглобулина, моноклональных антител и интерферонов, применение которых способно блокировать образование аутоантител и патологических ЦИК. Весьма актуальным остается индивидуальный подбор программы с более частым (ежемесячным, еженедельным) назначением плазмафереза и ПТ. Особенно важным аспектом, обеспечивающим возможность проведения более длительных и полноценных курсов экстракорпоральных процедур, является внедрение новых технологий обработки плазмы, таких, как каскадная фильтрация и иммуносорбция, применение которых позволяет сводить к минимуму потерю альбумина и селективно удалять из циркуляции патологические аутоантитела и иммунные комплексы.
Инструкция
Таблетки, 4 мг и 16 мг
Одна таблетка содержит
активное вещество - метилпреднизолон 4 мг или 16 мг,
вспомогательные вещества: лактозы моногидрат, крахмал кукурузный, желатин, магния стеарат, тальк.
Таблетки круглой формы, с плоской поверхностью, со скошенными краями, белого или почти белого цвета, с риской на одной стороне, диаметром от 6.9 до 7.3 мм (для дозировки 4 мг).
Гормональные препараты для системного использования (исключая половые гормоны). Кортикостероиды для системного использования. Глюкокортикостероиды. Метилпреднизолон.
Код АТХ Н02АВ04
Фармакокинетика
Биодоступность метилпреднизолона при приеме внутрь обычно составляет более 80%, но может быть и ниже при назначении больших доз.
Пик концентрации в сыворотке крови наблюдается через 1–2 часа, средний период полувыведения – 2–3 часа.
Cвязь метилпреднизолона с протеинами плазмы составляет 77%, связь с транскортином несущественна. Объем распределения – 1–1,5 л/кг. Метилпреднизолон метаболизируется до неактивных метаболитов. Специфические CYP-ферменты, обеспечивающие его преобразование, не известны. Средний клиренс составляет 6,5 мл/кг/мин. Продолжительность противовоспалительного эффекта – 18–36 часов. Около 5% препарата выводится из организма с мочой.
Фармакодинамика
Эффект Метипреда, как и других глюкокортикоидов, реализуется через взаимодействие со стероидными рецепторами в цитоплазме. Cтероидрецепторный комплекс транспортируется в ядро клетки, соединяется с ДНК и изменяет транскрипцию генов для большинства белков. Глюкокортикоиды угнетают синтез многочисленных белков, различных ферментов, вызывающих деструкцию суставов (при ревматоидном артрите), а также цитокинов, играющих важную роль в иммунных и воспалительных реакциях. Индуцируют синтез липокортина – ключевого белка нейроэндокринного взаимодействия глюкокортикоидов, что приводит к уменьшению воспалительного и иммунного ответа.
Глюкокортикоиды, включая Метипред, подавляют или препятствуют развитию тканевого ответа ко многим тепловым, механическим, химическим, инфекционным и иммунологическим агентам. Таким образом, глюкокортикоиды действуют симптоматически, уменьшая проявления заболевания без воздействия на причину. Противовоспалительный эффект препарата как минимум в 5 раз превышает эффективность гидрокортизона.
Эндокринные эффекты Метипреда включают подавление секреции АКТГ, ингибирование продукции эндогенного кортизола, при длительном применении вызывает частичную атрофию коры надпочечников. Влияет на метаболизм кальция, витамина D, углеводный, белковый и липидный обмен, поэтому при длительном применении может наблюдаться увеличение содержания глюкозы в крови, уменьшение плотности костной ткани, явления мышечной атрофии и дислипидемии. Препарат также способствует повышению артериального давления и модуляции поведения и настроения. Метипред практически не обладает минералокортикоидной активностью.
- ревматоидный артрит, в том числе ювенильный ревматоидный артрит, анкилозирующий спондилит
- системная красная волчанка, ревматическая болезнь, в том числе острый ревмокардит, системный дерматомиозит (полимиозит), узелковый периартериит
- тяжелые, инвалидизирующие аллергические состояния, при которых неэффективна обычная терапия: бронхиальная астма, контактный дерматит, атопический дерматит, сывороточная болезнь, сезонный или стойкий аллергический ринит, реакция гиперчувствительности на лекарственные средства
- ирит, иридоциклит, задний увеит и ретробульбарный неврит
- язвенный колит, болезнь Крона
- саркоидоз легких, аспирационный пневмонит
- приобретенная (аутоиммунная) гемолитическая анемия, идиопатическая тромбоцитопеническая пурпура
- лейкемия (острая и лимфатическая), лимфосаркома, лимфома, злокачественная миеломная болезнь
- для подавления реакции отторжения трансплантата
Начальная доза зависит от заболевания и степени его тяжести. Пероральная стартовая доза для взрослых обычно составляет от 8 до 96 мг в день. Доза должна быть уменьшена по достижении положительного клинического ответа. Пероральная поддерживающая доза должна быть минимальной, для взрослых обычно 4–12 мг в сутки один раз в утренние часы. Для детей рекомендуются более низкие дозы. При длительном лечении может быть адекватным прием препарата утром один раз через день.
4 мг метилпреднизолона является эквивалентом 5 мг преднизолона, 4 мг триамцинолона и 0,75 мг дексаметазона.
Показания к применению
Рекомендованная начальная суточная доза
Системная красная волчанка
48 мг до нормализации СОЭ на протяжении 1 недели
До 64 мг за один прием или до 100 мг через сутки
Гематологические заболевания, в т.ч. лейкемия
до 48 мг при обострении
до 3,6 мг/кг/сутки
32-48 мг через день
Детям: при недостаточности надпочечников внутрь 0,14 мг/кг или 4 мг/м2 в сутки в 3 приёма, по другим показаниям — внутрь 0,417–1,67 мг/кг или 12,5–50 мг/м2 в трех разделенных дозах
Развитие тяжелых побочных реакций зависит от величины дозы и длительности лечения. Побочные реакции обычно развиваются при длительном лечении препаратом, на протяжении короткого периода риск их возникновения маловероятен.
- развитие и обострение бактериальных, вирусных и грибковых инфекций, рецидив туберкулеза, иммуносупрессия
- повышение общего количества лейкоцитов при снижении количества эозинофилов, моноцитов и лимфоцитов, тромбоцитоз
- угнетение гипоталамо-гипофизарно-надпочечниковой системы, замедление роста, задержка полового развития у детей, нарушения менструального цикла, нарушения выработки половых гормонов (аменорея), синдром Кушинга, гирсутизм,
- повышение аппетита, увеличение массы тела, снижение толерантности к углеводам, повышение потребности в инсулине и пероральных сахароснижающих препаратах, гиперлипидемия, отрицательный азотистый баланс, гипокальциемия, гипокалиемия, гипокалиемический алкалоз, задержка натрия и жидкости в организме
- головная боль, головокружение, раздражительность, тревожность, лабильное настроение, бессонница, эйфория, депрессия, склонность к суициду, мания, галлюцинации, психическая зависимость, психозы, обострение шизофрении, деменция, судорожные припадки, когнитивная дисфункция (включая амнезию и спутанность сознания), повышение внутричерепного давления
- повышение внутриглазного давления, глаукома, отек диска зрительного нерва, катаракта, утончение роговицы и склеры, вирусные и грибковые инфекционные обострения глаз, экзофтальм
- инфаркт миокарда, артериальная гипо- или гипертензия, брадикардия, желудочковая аритмия, асистолия (в результате быстрого введения препарата), атеросклероз, тромбоз, васкулит, сердечная недостаточность
- аллергические реакции, которые включают анафилактический шок с летальным исходом, изменение реакций на кожные пробы
- тошнота, рвота, неприятный привкус во рту, метеоризм, эзофагит, язва пищевода, кандидоз пищевода, язва желудка и двенадцатиперстной кишки с перфорацией и кровотечением, панкреатит, перфорация желчного пузыря, местный илеит, язвенный колит
- повышение активности АЛТ, АСТ и щелочной фосфатазы
- замедление регенерации, атрофия кожи, петехии, гематомы, стрии, телеангиэктазия, угревая сыпь, экхимоз, пурпура, гипер- или гипопигментация, постстероидний панникулит, что характеризуется появлением эритематоза, горячих подкожных утолщений в течение 2 недель после отмены препарата
- остеопороз, переломы позвоночника и длинных костей, асептический остеонекроз, миопатия, мышечная слабость, атрофия мышц, разрыв сухожилий
- повышение риска возникновения уролитов, лейкоцитурия, эритроцитурия, без имеющегося повреждения почек, никтурия
- недомогание, стойкая икота при применении препарата в высоких дозах
- недостаточность коры надпочечников, которая может привести к летальным случаям в стрессовых ситуациях, таких как хирургические вмешательства, травма или инфекция, если доза Метипреда не увеличена
- при резкой отмене препарата возможен синдром отмены. Тяжесть симптомов зависит от степени атрофии надпочечников: головокружение, головная боль, анорексия, тошнота, боль в брюшной полости, слабость, изменения настроения, летаргия, жар, миалгия, артралгия, ринит, коньюнктивит, болезненный зуд кожи, потеря веса. В более тяжелых случаях – тяжелые психические нарушения и повышение внутричерепного давления, стероидный псевдоревматизм у пациентов с ревматизмом, смерть.
- гиперчувствительность к компонентам препарата
- туберкулез, другие острые и хронические бактериальные или вирусные инфекции (без должной химиотерапевтической защиты)
- системные грибковые инфекции
Антикоагулянты: при совместном применении с глюкокортикоидами может отмечаться усиление и уменьшение действия антикоагулянтов. Парентеральное введение Метипреда строго потенцирует тромболитическое действие антагонистов витамина К (флуиндион, аценокумарол).
Салицилаты и другие нестероидные противовоспалительные препараты: одновременное назначение салицилатов, индометацина и других нестероидных противовоспалительных препаратов может повышать вероятность изъязвления слизистой оболочки желудка. Метипред может способствовать уменьшению уровня салицилатов в сыворотке крови, увеличивая их почечный клиренс. Необходима осторожность при уменьшении дозы Метипреда при длительном одновременном применении.
Гипогликемические препараты: Метипред может частично подавлять гипогликемический эффект пероральных противодиабетических средств и инсулина.
Индукторы микросомальных ферментов печени: например, барбитураты, фенитоин, примидон, карбамазепин и рифампицин увеличивают системный клиренс метилпреднизолона, тем самым уменьшая эффекты метилпреднизолона практически в 2 раза.
Ингибиторы CYP3A4: например, эритромицин, кларитромицин, кетоконазол, дилтиазем, апрепитант, итраконазол и тролеандомицин увеличивают элиминацию и уровень метилпреднизолона в плазме крови, что может привести к усилению терапевтических и побочных эффектов Метипреда.
Эстрогены: могут усиливать эффекты Метипреда, замедляя его метаболизм. Не рекомендуется регулировать дозы Метипреда женщинам, принимающим пероральные контрацептивы, которые могут способствовать не только увеличению периода полувыведения, но и развитию атипичных иммуносупрессивных эффектов Метипреда.
Фторхинолоны: одновременное применение может привести к повреждению сухожилий.
Амфотерицин, диуретики и легкие слабительные средства: Метипред может увеличивать выведение калия из организма у пациентов, получающих одновременно эти препараты.
Иммунодепрессанты: Метипред обладает аддитивным иммуносупрессивным действием, что может повышать терапевтические эффекты или риск развития различных побочных реакций при приеме совместно с другими иммунодепрессантами. Только некоторые из этих эффектов можно объяснить фармакокинетическими взаимодействиями.
Глюкокортикоиды, в том числе Метипред улучшают противорвотную эффективность других противорвотных препаратов, используемых параллельно при терапии противораковыми препаратами, вызывающими рвоту.
Глюкокортикоиды, в том числе Метипред могут повышать концентрацию такролимуса в плазме при их совместном применении, при отмене кортикостероидов концентрация такролимуса в плазме повышается.
Иммунизация: препарат может редуцировать иммунизирующую эффективность вакцин и увеличивать риск неврологических осложнений. Применение терапевтических (иммуносупрессивных) доз глюкокортикоидов совместно с живыми вирусными вакцинами может увеличить риск развития вирусных заболеваний.
Антихолинэстеразные средства: у больных миастенией применение препарата и антихолинэстеразных средств может вызывать мышечную слабость.
Другие: сообщалось о двух серьезных случаях острой миопатии у пожилых пациентов, получающих доксакариума хлорид и метилпреднизолон в высоких дозах. При длительной терапии глюкокортикоиды могут уменьшать эффект соматотропина.
Описаны случаи возникновения острой миопатии при применении кортикостероидов у больных, которые одновременно получают лечение блокаторами нервно-мышечной передачи (например, панкурониум).
При одновременном применении Метипреда и циклоспорина были отмечены случаи возникновения судорог. Поскольку одновременное введение этих препаратов вызывает взаимное торможение метаболизма, вероятно судороги и другие побочные эффекты связаны с применением каждого из этих препаратов в качестве монотерапии, при их совместном применении могут возникать чаще.
Применение препарата следует прекращать постепенно.
Препарат должен применяться с осторожностью и под врачебным контролем у больных артериальной гипертензией, застойной сердечной недостаточностью, психическими расстройствами, больных сахарным диабетом (или диабетом в семейном анамнезе), панкреатитом, заболеваниями желудочно-кишечного тракта (пептическая язва, местный илеит, язвенный колит или другие воспалительные заболевания кишечного тракта или дивертикулиты с повышенным риском кровотечения и перфорации), больных с остеопорозом, миастенией, герпесом глаз, гипотиреоидизмом, кортикостероид-индуцированной миопатией в анамнезе, печеночной и почечной недостаточностью, циррозом печени, эпилепсией, абсцессом или другими пиогенными инфекциями, глаукомой, пациентам со склонностью к тромбофлебиту. Также необходимо соблюдать осторожность при назначении препарата пациентам, которые недавно перенесли инфаркт миокарда. Глюкокортикоиды могут затруднять диагностику осложнений желудочно-кишечного тракта, так как они вызывают уменьшение болевого синдрома, а также маскировать латентный период гиперпаратиреоидизма.
Метипред может потенцировать ульцерогенное действие салицилатов и других нестероидных противовоспалительных препаратов.
Пациенты с нарушением свертываемости крови должны находиться под врачебным контролем. При совместном применении Метипреда и антикоагулянтов увеличивается риск желудочного изъязвления и кровотечения. Глюкокортикоиды также могут уменьшать действие антикоагулянтов. Режим дозирования антикоагулянтов должен обязательно сопровождаться контролем протромбинового времени, а именно: международного нормализованного индекса (МНИ).
Метипред, как и другие глюкокортикоиды, могут способствовать обострению инфекционных заболеваний. Существует риск рецидива туберкулеза, осложнений ветряной оспы и опоясывающего герпеса.
Не следует применять живые вакцины пациентам, которые принимают кортикостероиды для системного применения в больших дозах в течение периода индукции иммуносупрессии. Терапевтическая реакция на другие виды вакцин также может быть ослаблена. С осторожностью применять в течение 8 недель до и после вакцинации, при лимфадените после прививки БЦЖ, при иммунодефицитных состояниях, в том числе при СПИДе или ВИЧ-инфицировании.
При длительной терапии Метипредом необходимо рассмотреть вопрос о назначении бифосфонатов больным остеопорозом или с факторами риска его развития. Факторами риска остеопороза являются возраст старше 65 лет, частые переломы в анамнезе или в семейном анамнезе, ранняя менопауза (до 45 лет), пременопаузальная аменорея и небольшая масса тела. Риск развития остеопороза можно минимизировать путем регулирования дозы Метипреда, снижая её до самого низкого терапевтического уровня.
Длительный прием глюкокортикоидов подавляет гипофизарно-надпочечниковую систему, что приводит к развитию вторичной недостаточности кортикоадреналового ответа, что может приводить к обострению заболеваний и развитию осложнений при различных условиях, например при острых травмах, заболеваниях или хирургическом вмешательстве. Высокие дозы Метипреда значительно снижают риск развития перечисленных осложнений.
Для минимизации побочных эффектов полную суточную дозу Метипреда нужно принимать утром в соответствии с циркадным ритмом эндогенной выработки кортизола.
Больным с гипотиреозом или тяжелыми заболеваниями печени следует снижать дозу Метипреда.
Пожилым пациентам препарат должен назначаться с осторожностью из-за повышенного риска развития побочных эффектов (пептическая язва, остеопороз и изъязвление кожи).
При длительном применении глюкокортикоидов терапию следует прекращать постепенно, на протяжении нескольких недель, во избежание синдрома отмены и серьезных осложнений, включая летальность. Долгосрочная терапия не должна прекращаться внезапно и в случае беременности.
Препарат содержит лактозы моногидрат, что следует учитывать больным с непереносимостью лактозы.
Беременность и период лактации
Препарат проникает через плаценту и выделяется в молоко в период кормления грудью.
Во время беременности необходимо тщательно взвешивать пользу терапии Метипредом для матери и потенциальный риск для плода. Длительное применение во время беременности вызывает нарушение роста плода. Имеется опасность развития атрофии коры надпочечников у плода, что может потребовать проведения заместительной терапии у новорожденного. Глюкокортикоиды также могут повышать риск мертворождаемости.
Необходимо избегать кормления грудью при продолжительной системной терапии Метипредом.
Использование в педиатрии
При приеме у детей дозу и длительность терапии врач определяет индивидуально, в зависимости от возраста и тяжести протекания заболевания.
При длительном приеме у детей возможно замедление роста и задержка полового развития.
Особенности влияния лекарственного средства на управление транспортными средствами и механизмами
Учитывая побочные действия препарата (риск возникновения нарушений настроения, психики, судороги, головная боль) при применении препарата следует воздержаться от управления автотранспортом или другими потенциально опасными механизмами.
Симптомы: препарат не вызывает острой интоксикации. При хронической интоксикации, которая проявляется надпочечниковой супрессией, возможно усиление побочных эффектов препарата.
Лечение: необходимо постепенно уменьшить дозу, рекомендуется промывание желудка и прием активированного угля, симптоматическое лечение.
Специфического антидота не существует.
По 30 таблеток во флакон из полиэтилена высокой плотности (ПЭВП) белого цвета с завинчивающейся крышкой из ПЭВП, защищенной от случайного вскрытия.
По 1 флакону вместе с инструкцией по медицинскому применению на государственном и русском языках вкладывают в картонную коробку.
Хранить при температуре от 15 °С до 25 °С.
Хранить в недоступном для детей месте!
Не использовать по истечении срока годности
Учебная медицинская литература, онлайн-библиотека для учащихся в ВУЗах и для медицинских работников
Системная красная волчанка (СКВ) — системное полисиндромное воспалительное заболевание соединительной ткани, развиваюшееся преимущественно у девушек и молодых женщин на фоне генетически обусловленного дефекта иммунорегуляторных процессов, приводящего к неконтролируемой продукции антител к собственным клеткам и их компонентам.
Лечебная программа при СКВ.
- Режим.
- Диета.
- Лечение гормональными иммунодепрессантами.
- Лечение негормональными иммунодепрессантами.
- Иммунотерапия.
- Интенсивная терапия.
- Лечение аминохинолиновыми соединениями.
- Применение НПВС.
- Лечение антикоагулянтами и антиагрегантами.
- Эфферентная терапия.
- Лечение люпус-нефрита.
- Диспансеризация.
1. Режим
Режим больного СКВ зависит от характера течения, степени активности заболевания, выраженности системных проявлений. Лечение в фазе обострения проводится в стационаре, при тяжелом течении (особенно при развитии диффузного миокардита, эндокардита; люпус-нефрита), высокой активности процесса рекомендуется постельный режим; в случае диффузного миокардита — строгий постельный режим до улучшения состояния, показателей гемодинамики и ликвидации недостаточности кровообращения.
При хроническом течении СКВ и минимальной активности процесса лечение проводится амбулаторно.
2. Лечебное питание
В питании больного следует предусмотреть достаточное количество витамина С, витаминов группы В, ненасыщенных жирных кислот. При развитии недостаточности кровообращения, поражении почек необходимо ограничить потребление поваренной соли, жидкости.
3. Лечение гормональными иммунодепрессантами
Этиологическое лечение СКВ в настоящее время невозможно. Патогенетическая терапия является ведущей и направлена на подавление иммунокомплексной патологии.
Гормональные иммунодепрессанты — глюкокортикоиды — являются лекарствами первого ряда при СКВ.
В. А. Насонова указывает, что обоснована необходимость применения длительной терапии глюкокортикоидами, позволяющей сохранить или продлить жизнь многим больным, значительно улучшить прогноз этого заболевания — от безнадежного до вполне удовлетворительного. Следует учесть, что неадекватное прерывистое лечение глюкокортикоидами сопровождается развитием синдрома отмены с последующими еще более тяжелыми обострениями.
Адекватное лечение глюкокортикоидами в подавляющих дозах, длительное применение их в поддерживающих дозах дает возможность добиться длительной ремиссии. Эффект глюкокортикоидов обусловлен их способностью подавлять иммунокомплексный воспалительный процесс и аутоиммунные реакции.
Абсолютным показанием к назначению глюкокортикоидов является острая, подострая форма СКВ и обострение хронической СКВ. Из всех глюкокортикоидных препаратов наибольшее значение имеет преднизалон, обладающий достаточно высоким терапевтическим эффектом и вызывающий сравнительно нетяжелые побочные реакции при многолетнем приеме. Лучшей переносимостью и хорошим терапевтическим эффектом обладает метилпреднизолон (урбазон). Он значительно реже, чем другие глюкокортикоиды, вызывает поражение ЖКТ (стероидные эрозии и язвы).
Согласно данным В. А. Насоновой, лечение СКВ преднизолоном проводится следующим образом. Доза препарата зависит от остроты течения и активности процесса.
При остром течении с самого начала заболевания, а при подостром и хроническом течении при II и III ст. активности патологического процесса назначаются глюкокортикоиды.
Преднизолон в подавляющей дозе 40-50 мг в сутки назначают при остром и подостром течении (III ст. активности), а при нефротическом синдроме или менингоэнцефалите — в дозе 60 мг в сутки и более.
При подостром течении II ст. активности, а также при хроническом течении II-III ст. активности подавляющая доза может быть меньше 30-40 мг, при I ст. активности — 15-20 мг в сутки. Продолжительность приема преднизолона в подавляющей дозе определяется степенью выраженности клинико-лабораторных признаков (обычно не менее 3 месяцев, а при необходимости — до 6 месяцев и более). В случаях длительной терапии большими дозами глюкокортикоидов можно применять следующую альтернирующую методику приема этих препаратов. При снижении клиниколабораторных признаков активности до II ст. (обязательно исчезновение полиартрита, полисерозита, миокардита) суточную дозу преднизолона можно давать следующим образом: 20 мг утром между 8 и 9 ч после завтрака, два приема по 10 мг в дневные часы (в 12 и 14 ч) после легкого обеда. Достигнув эффекта, дозу преднизолона снижают постепенно: сначала дневную (в 14 ч), затем назначаемую в полдень (в 12 ч), затем утреннюю (после 8 ч утра) (табл. 12).
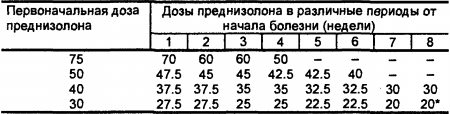
Табл. 12. Примерная схема снижения доз преднизолона (в мг) при достижении терапевтического эффекта. * Далее очень медленно — по 2.5 мг через 1-3 месяца (по показателям общего состояния больного и лабораторных исследований).
Чрезвычайно важен подбор поддерживающей дозы преднизолона, т.е. той наименьшей дозы, которая позволяет поддерживать клинико-лабораторную ремиссию. Преднизолон в поддерживающей дозе 5-10 мг в сутки назначается годами. Для уменьшения побочных явлений преднизолона (кушингоидный синдром, атрофия мышц, артериальная гипертензия, гипокалиемия, остеопороз коры надпочечников) при длительной терапии принимаются удвоенные поддерживающие дозы через день.
Критериями эффективности лечения преднизолоном являются: уменьшение активности патологического процесса, устранение или значительное уменьшение выраженности висцеральных проявлений, особенно со стороны почек, стабилизация течения заболевания.
Величина поддерживающей дозы глюкокортикоидов является одним из критериев глубины клинико-лабораторной ремиссии:
чем меньше поддерживающая доза, тем надежнее ремиссия. Величина поддерживающей дозы 15-20 мг может указывать на активность процесса и на необходимость увеличения дозы, а также, возможно, на целесообразность применения цитостатиков.
Причины неэффективности глюкокортикоидноЙ терапии: нерегулярность приема, неадекватная доза, позднее начало лечения, тяжелая степень иммунокомплексной органной патологии.
При отсутствии преднизолона можно применять триамцинолон, дексаметазон, исходя из паритета : 1 таблетка этих препаратов равна 1 таб летке преднизолона.
О побочных системных действиях глюкокортикоидной терапии см. гл. “Лечение ревматоидного артрита”.
4. Лечение негормональными иммунодепрессантами
Негормональные иммунодепрессанты обладают противовоспалительным эффектом, способностью подавлять иммунокомплексный противовоспалительный процесс и аутоантителообразование.
Показания к назначению цитостатиков:
- высокая активность процесса и быстропрогрессирующее течение;
- активный нефротический и нефритический синдромы;
- генерализованный васкулит (поражение легких, ЦНС, язвенное поражение кожи);
- недостаточная эффективность глюкокортикоидноЙ терапии;
- необходимость быстро уменьшить подавляющую дозу преднизолона из-за плохой переносимости и выраженности побочных действий (подростковый и климактерический возраст больных, значительная и быстрая прибавка в массе тела, тяжелая артериальная гипертензия, стероидный сахарный диабет, психоз, выраженный остеопороз с признаками спондилопатии, аваскулярные некрозы костей);
- необходимость уменьшить поддерживающую дозу преднизолона, если она превышает 15-20 мг в сутки;
- глюкокортикостероидная зависимость.
Наиболее часто применяют азатиоприн (имуран) и циклофосфамид в дозе 1-3 мг на 1 кг массы тела, т.е. от 100 до 200 мг в сутки в сочетании с 30 мг преднизолона. Указанные дозы назначают в течение 2-2.5 месяца (обычно в стационаре), а затем переходят на поддерживающие дозы 50-100 мг в сутки в течение многих месяцев и лет. К этому времени обычно удается снизить дозу глюкокортикоидов.
Критериями эффективности лечения цитостатиками являются:
- исчезновение или уменьшение клинических признаков болезни, в первую очередь нефрита;
- исчезновение или уменьшение кортикостероидной зависимости;
- стойкое снижение активности СКВ и отсутствие в дальнейшем рецидивов;
- предотвращение прогрессирования люпус-нефрита.
Наиболее эффективным цитостатиком при лечении СКВ является циклофосфамид. При высокой активности патологического процесса целесообразно начать лечение с циклофосфамида, но учитывая наибольшую его активность через 4-5 недель следует перейти на азатиоприн или лейкеран для дальнейшего лечения (В. А. Насонова, 1989).
В последние годы стали применять одновременно несколько цитосгатиков: азатиоприн + циклофосфами д (1 мг/кг в д ень внутрь) в сочетании с малыми дозами преднизолона; комбинация азатиоприна внутрь с внутривенным введением циклофосфамида (по 1000 мг/м 2 поверхности тела каждые 3 месяца). При таком комбинированном лечении замедляется прогрессирование люпус-нефрита. Предложена также методика только внутривенного введения циклофосфамида п о 1000 м г/м 2 1 раз в месяц в первые полгода, затем по 1000 мг/м 2 каждые 3 месяца в течение полутора лет на фоне низких доз преднизолона. М. М. Ивановой (1994) установлено, что циклофосфамид более эффективно снижает протеинурию и уменьшает изменения мочевого осадка, синтез антител к ДНК, азатиоприн — наиболее эффективен при диффузном поражении кожи.
О побочных действиях цитостатиков см. в гл. “Лечение ревматоидного артрита”.
5. Иммунотерапия
Разрабатываются следующие методы иммунотерапии СКВ: применение антиидиотипических моноклональных анти-СD4-антител при люпус-нефрите; внутривенное введение иммуноглобулинов (по 0.4 г/кг в сутки в течение 5 дней при выраженных формах СКВ с тромбоцитопенией); лечение любензаритом (подавляет синтез антител к ДНК, ингибирует синтез IgM-ревматоидного фактора); внутривенное введение рекомбинантных препаратов интерферона (а, у) ежедневно в течение 3 недель, а затем дважды в неделю в течен ие 2 м есяцев.
6. Интенсивная терапия
К интенсивной терапии СКВ относятся: пульс-терапия ударными дозами метилпреднизолона, комбинированная пульс-терапия метилпреднизолоном и циклофосфаном.
Показания:
- неэффективность пероральной (даже массивной) глюкокортикоидноЙ терапии, особенно при нефротическом синдроме;
- быстрое прогрессирование болезни и неэффективность обычной терапии СКВ.
Методика пульс-терапии : вводят внутривенно капельно п о 1000 мг метилпреднизолона в 100 м л изотонического раствора натрия хлорида в течение 3 дней подряд. В капельницу добавляют 5000 ЕД гепарина.
Во время пульс-терапии и после нее больные продолжают принимать внутрь ту же дозу преднизолона, что и прежде.
Под влиянием пульс-терапии быстро улучшается функциональное состояние почек, исчезают эритематозная сыпь на лице, капилляриты, полиартрит, в целом наблюдается выраженная положительная клиническая динамика.
Во время пульс-терапии возможны побочные явления: повышение АД, зуд и гиперемия кожи, судорожные подергивания, нарушения ритма сердца, описаны случаи внезапной остановки сердца. Учитывая это, пульс-терапия преднизолоном назначается строго по показаниям и в ходе ее проведения необходимо тщательно контролировать работу сердца.
R. Lugmani (1993) рекомендует после пульс-терапии применять циклофосфамид в дозе 200 мг в неделю в течение 3-6 месяцев в сочетании с преднизолоном в дозе 20-25 мг в сутки.
Этот вид интенсивной терапии применяется при СКВ с тяжелым, торпидным к лечению нефротическим синдромом и генерализованным васкулитом.
Методика: в первый день внутривенно капельно в 100 мл изотонического раствора натрия хлорида в течение 30-40 мин вводя т 1000 мг метилпреднизолона и 1000 мг циклофосфана, в последующие два дня больному вводят капельно по 1000 мг м етилпреднизолона, в капельницу добавляют 5000 ЕД гепарина.
Больным с высоким АД вводят гипотензивные и мочегонные средства. Начиная с четвертого дня, больным назначается преднизолон в той же дозе, что до пульс-терапии, но не ниже 40 мг в сутки в сочетании со средними дозами цитостатиков.
Метод комбинированной пульс-терапии метилпреднизолоном и циклофосфаном высокоэффективен, приводит к значительному клиническому улучшению, особенно это заметно у больных с нефротическим синдромом (снижается или нормализуется АД, повышается диурез, уменьшаются альбуминурия и отеки).
Побочные действия те же, что при пульс-терапии метилпреднизолоном, кроме того, возможны выпадение волос, лейкопения.
7. Лечение аминохинолиновыми соединениями
Механизм действия аминохинолиновых соединений описан в гл. “Лечение ревматоидного артрита”.
Эти препараты назначают больным хронической СКВ прежде всего при поражении кожи, суставов: делагил по 0.25-0.5 г в сутки и плаквенил по 0.2-0.4 г в сутки. Лечение продолжается длительно — месяцы, годы.
Кроме того, аминохинолиновые соединения могут применяться при люпус-нефрите. В. А. Насонова рекомендует в этом случае плаквенил по 0.2 г 4-5 раз в день (всего 0.8-1 г) в течение длительного времени — до года и более.
Аминохинолиновые соединения могут применяться в сочетании с глюкокортикоидами, что позволяет уменьшить дозы препаратов. При лечении аминохинолиновыми соединениями возможны побочные явления: лейкопения, анемия, алопеция, дегенерация сетчатки, диспептические явления. Лечение проводится под контролем анализа крови и исследования состояния глазного дна.
8. Применение НПВС
НПВС обладают выраженным противовоспалительным действием, умеренным иммунодепрессантным эффектом, стабилизируют лизосомальные мембраны.
НПВС назначаются при подостром течении (в ранней стадии) и хроническом течении СКВ, преимущественно при наличии артрита. Эти препараты применяются в обычных терапевтических дозах (как при ревматоидном артрите) длительно, до исчезновения воспаления в суставах и нормализации температуры тела. Однако при лечении НПВС необходимо учитывать нередкое развитие побочных эффектов (см. гл. “Лечение ревматоидного артрита”).
9. Лечение антикоагулянтами и антиагрегантами
Антикоагулянты и антиагреганты в комплексной терапии СКВ применяют при наличии поражения почек, ДВС-синдрома, при нарушениях микроциркуляции.
Из антикоагулянтов рекомендуется гепарин — 10,000-20,000 ЕД в сутки (4 инъекции под кожу живота) в течение нескольких месяцев.
В качестве антиагрегантов используются курантил в суточной дозе 150-200 мг, трентал — 400-600 мг в течение нескольких месяцев.
10. Эфферентная терапия
К эфферентной терапии относятся плазмаферез и гемосорбция.
Плазмаферез — метод эфферентной, экстракорпоральной терапии, направленной на освобождение организма от продуктов метаболизма, циркулирующих иммунных комплексов путем удаления плазмы больного.
Показанием к назначению плазмафереза при СКВ является наиболее тяжелое течение, когда обычная терапия глюкокортикоидами, включая и пульс-терапию метилпреднизолоном, а также применение цитостатиков, оказывается неэффективной.
На курс лечения рекомендуется от 3 до 5 процедур плазмафереза при однократном удалении 800-1000 мл плазмы.
Гемосорбция — экстракорпоральный метод очищения крови путем пропускания ее через колонку с гранулами активированного угля. Метод обладает иммунокорригирующим действием, а также повышает чувствительность клеток крови и тканей к действию глюкокортикоидов.
Показания к гемосорбции при СКВ:
- сохраняющаяся активность СКВ, несмотря на большие дозы глюкокортикоидов и цитостатиков;
- активный люпус-нефрит;
- упорный суставной синдром;
- васкулиты кожи с изъязвлениями;
- невозможность увеличения дозы глюкокортикоидов из-за развившихся осложнений.
М. М. Иванова (1985), учитывая высокую эффективность и хорошую переносимость гемосорбции, рекомендует проводить ее на ранней стадии болезни для более активного воздействия на иммунопатологическую реактивность.
На курс лечения рекомендуется от 3 до 5 процедур гемосорбции, проводимых еженедельно с применением отечественных активированных углей ИГИ, АДБ, ГСУ.
Плазмаферез и гемосорбция проводятся на фоне приема глюкокортикоидов и цитостатиков.
11. Лечение люпус-нефрита
Люпус-нефрит у больных СКВ может принимать тяжелое течение и определять прогноз.
Основными методами лечения люпус-нефрита являются:
- лечение глюкокортикоидами с начальной суточной дозой преднизолона 60-80 мг;
- пульс-терапия метилпреднизолоном;
- комбинированная терапия глюкокортикоидами и цитостатиками;
- пульс-терапия метилпреднизолоном и циклофосфаном;
- лечение аминохинолиновыми соединениями;
- применение гепарина и антиагрегантов;
- плазмаферез, гемосорбция;
- диета № 7 с коррекцией содержания белка в зависимости от уровня его потерь с мочой за сутки при нефротическом синдроме.
М. М. Иванова (1995) предлагает при недостаточной эффективности пульс-терапии проводить лечение метилпреднизолоном внутривенно по 250 мг в сутки в течение еще 2-3 недель.
При развитии у больного ХПН лечение проводится та к, как это описано в гл. “Лечение хронической почечной недостаточности”.
12. Диспансеризация
Диспансеризация больных СКВ осуществляется ревматологом, а при его отсутствии — терапевтом.
Частота наблюдений врачом: при минимальной активности — 2 раза в год, при II ст. активности — 4 раза в год.
ЛОР-врач, стоматолог, гинеколог офтальмолог осматривают больных 2 раза в год; невропатолог, психиатр, нефролог — по показаниям.
Перечень и частота необходимых лабораторных и инструментальных исследований при диспансеризации:
- клинический анализ крови, общий анализ мочи — 4-6 раз в год;
- число тромбоцитов — 2 раз а в год;
- при применении цитостатических препаратов — ежемесячный контроль анализов, рентгенография (флюорография) органов грудной клетк и 2 раза в год;
- рентгенография суставов — по показаниям;
- биохимическое исследование крови (фибриноген, серомукоид, белковые фракции, мочевина) — не реж е 2 раз в год;
- ЭхоКГ и ФКГ — по показаниям;
- исследование крови на содержание волчаночных клеток и антинуклеарного фактора — 2 раза в год.
Основным лечением является применение глюкокортикоидов и цитостатиков в индивидуально подобранных дозах; при III ст. активности — обязательно стационарное лечение.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Читайте также:


