Анаэробной инфекции и в высоких концентрациях бактерицид
Анаэробная инфекция – инфекционный процесс, вызываемый спорообразующими или неспорообразующими микроорганизмами в условиях, благоприятных для их жизнедеятельности. Характерными клиническими признаками анаэробной инфекции служат преобладание симптомов эндогенной интоксикации над местными проявлениями, гнилостный характер экссудата, газообразующие процессы в ране, быстро прогрессирующий некроз тканей. Анаэробная инфекция распознается на основании клинической картины, подтвержденной результатами микробиологической диагностики, газожидкостной хроматографии, масс-спектрометрии, иммуноэлектрофореза, ПЦР, ИФА и др. Лечение анаэробной инфекции предполагает радикальную хирургическую обработку гнойного очага, интенсивную дезинтоксикационную и антибактериальную терапию.
Общие сведения
Анаэробная инфекция – патологический процесс, возбудителями которого выступают анаэробные бактерии, развивающиеся в условиях аноксии (отсутствия кислорода) или гипоксии (низкого напряжения кислорода). Анаэробная инфекция представляет собой тяжелую форму инфекционного процесса, сопровождающуюся поражением жизненно важных органов и высоким процентом летальности. В клинической практике с анаэробной инфекцией приходится сталкиваться специалистам в области хирургии, травматологии, педиатрии, нейрохиругии, отоларингологии, стоматологии, пульмонологии, гинекологии и других медицинских направлений. Анаэробная инфекция может возникнуть у пациентов любого возраста. Доля заболеваний, вызываемых анаэробной инфекцией, точно не известна; из гнойных очагов в мягких тканях, костях или суставах анаэробы высеваются примерно в 30% случаев; анаэробная бактериемия подтверждается в 2-5% случаев.

Причины анаэробной инфекции
Анаэробы входят в состав нормальной микрофлоры кожи, слизистых оболочек, желудочно-кишечного тракта, органов мочеполовой системы и по своим вирулентным свойствам являются условно-патогенными. При определенных условиях они становятся возбудителями эндогенной анаэробной инфекции. Экзогенные анаэробы присутствуют в почве и разлагающихся органических массах и вызывают патологический процесс при попадании в рану извне. Анаэробные микроорганизмы делятся на облигатные и факультативные: развитие и размножение облигатных анаэробов осуществляется в бескислородной среде; факультативные анаэробы способны выживать как в отсутствии, так и в присутствии кислорода. К факультативным анаэробными бактериями принадлежат кишечная палочка, шигеллы, иерсинии, стрептококки, стафилококки и др.
Облигатные возбудители анаэробной инфекции делятся на две группы: спорообразующие (клостридии) и неспорообразующие (неклостридиальные) анаэробы (фузобактерии, бактероиды, вейллонеллы, пропионибактерии, пептострептококки и др.). Спорообразующие анаэробы являются возбудителями клостридиозов экзогенного происхождения (столбняка, газовой гангрены, ботулизма, пищевых токсикоинфекций и др.). Неклостридиальные анаэробы в большинстве случаев вызывают гнойно-воспалительные процессы эндогенной природы (абсцессы внутренних органов, перитонит, пневмонию, флегмоны челюстно-лицевой области, отит, сепсис и др.).
Основными факторами патогенности анаэробных микроорганизмов служат их количество в патологическом очаге, биологические свойства возбудителей, наличие бактерий-ассоциантов. В патогенезе анаэробной инфекции ведущая роль принадлежит продуцируемым микроорганизмами ферментам, эндо- и экзотоксинам, неспецифическим факторам метаболизма. Так, ферменты (гепариназа, гиалуронидаза, коллагеназа, дезоксирибонуклеаза) способны усиливать вирулентность анаэробов, деструкцию мышечной и соединительной тканей. Эндо- и экзотоксины вызывают повреждение эндотелия сосудов, внутрисосудистый гемолиз и тромбоз. Кроме этого, некоторые клостридиальные токисины обладают нефротропным, нейротропным, кардиотропным действием. Также токсическое влияние на организм оказывают и неспецифические факторы метаболизма анаэробов - индол, жирные кислоты, сероводород, аммиак.
Условиями, благоприятствующими развитию анаэробной инфекции, являются повреждение анатомических барьеров с проникновением анаэробов в ткани и кровеносное русло, а также снижение окислительно-восстановительного потенциала тканей (ишемия, кровотечение, некроз). Попадание анаэробов в ткани может происходить при оперативных вмешательствах, инвазивных манипуляциях (пункциях, биопсии, экстракции зуба и др.), перфорации внутренних органов, открытых травмах, ранениях, ожогах, укусах животных, синдроме длительного сдавления, криминальных абортах и т. д. Факторами, способствующими возникновению анаэробной инфекции, выступают массивное загрязнение ран землей, наличие инородных тел в ране, гиповолемический и травматический шок, сопутствующие заболевания (коллагенозы, сахарный диабет, опухоли), иммунодефицит. Кроме этого, большое значение имеет нерациональная антибиотикотерапия, направленная на подавление сопутствующей аэробной микрофлоры.
В зависимости от локализации различают анаэробную инфекцию:
- центральной нервной системы (абсцесс мозга, менингит, субдуральная эмпиема и др.)
- головы и шеи (пародонтальный абсцесс, ангина Людвига, средний отит, синусит, флегмона шеи и т. д.)
- дыхательных путей и плевры (аспирационная пневмония, абсцесс легкого, эмпиема плевры и пр.)
- женской половой системы (сальпингит, аднексит, эндометрит, пельвиоперитонит)
- брюшной полости (абсцесс брюшной полости, перитонит)
- кожи и мягких тканей (клостридиальный целлюлит, газовая гангрена, некротизирующий фасциит, абсцессы и др.)
- костей и суставов (остеомиелит, гнойный артрит)
- бактериемию.
Симптомы анаэробной инфекции
Независимо от вида возбудителя и локализации очага анаэробной инфекции, различным клиническим формам свойственны некоторые общие черты. В большинстве случаев анаэробная инфекция имеет острое начало и характеризуется сочетанием местных и общих симптомов. Инкубационный период может составлять от нескольких часов до нескольких суток (в среднем около 3-х дней).
Типичным признаком анаэробной инфекции служит преобладание симптомов общей интоксикации над местными воспалительными явлениями. Резкое ухудшение общего состояния больного обычно наступает еще до возникновения локальных симптомов. Проявлением тяжелого эндотоксикоза служит высокая лихорадка с ознобами, выраженная слабость, тошнота, головная боль, заторможенность. Характерны артериальная гипотония, тахипноэ, тахикардия, гемолитическая анемия, иктеричность кожи и склер, акроцианоз.
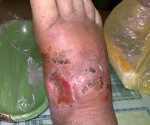
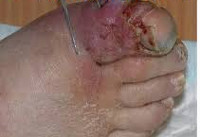
При раневой анаэробной инфекции ранним местным симптомом выступает сильная, нарастающая боль распирающего характера, эмфизема и крепитация мягких тканей, обусловленные газообразующими процессами в ране. К числу постоянных признаков относится зловонный ихорозный запах экссудата, связанный с выделением азота, водорода и метана при анаэробном окислении белкового субстрата. Экссудат имеет жидкую консистенцию, серозно-геморрагический, гнойно-геморрагический или гнойный характер, неоднородную окраску с вкраплениями жира и наличием пузырьков газа. На гнилостный характер воспаления также указывает внешний вид раны, содержащей ткани серо-зеленого или серо-коричневого цвета, иногда струпы черного цвета.
Течение анаэробной инфекции может быть молниеносным (в течение 1 суток с момента операции или травмы), острым (в течение 3-4 суток), подострым (более 4 суток). Анаэробная инфекция часто сопровождается развитием полиорганной недостаточности (почечной, печеночной, сердечно-легочной), инфекционно-токсического шока, тяжелого сепсиса, являющихся причиной летального исхода.
Диагностика
Для своевременной диагностики анаэробной инфекции большое значение имеет правильная оценка клинических симптомов, позволяющая своевременно оказать необходимую медицинскую помощь. В зависимости от локализации инфекционного очага диагностикой и лечением анаэробной инфекции могут заниматься клиницисты различных специальностей – общие хирурги, травматологи, нейрохирурги, гинекологи, отоларингологи, челюстно-лицевые и торакальные хирурги.
Методы экспресс-диагностики анаэробной инфекции включают бактериоскопию раневого отделяемого с окраской мазка по Грамму и газожидкостную хроматографию. В верификации возбудителя ведущая роль принадлежит бактериологическому посеву отделяемого раны или содержимого абсцесса, анализу плевральной жидкости, посеву крови на аэробные и анаэробные бактерии, иммуноферментному анализу, ПЦР. В биохимических показателях крови при анаэробной инфекции обнаруживается снижение концентрации белков, увеличение уровня креатинина, мочевины, билирубина, активности трансаминаз и щелочной фосфатазы. Наряду с клиническими и лабораторными исследования, выполняется рентгенография, при которой обнаруживается скопление газа в пораженных тканях или полостях.
Анаэробную инфекцию необходимо дифференцировать от рожистого воспаления мягких тканей, полиморфной экссудативной эритемы, тромбоза глубоких вен, пневмоторакса, пневмоперитонеума, перфорации полых органов брюшной полости.
Лечение анаэробной инфекции
Комплексный подход к лечению анаэробной инфекции предполагает проведение радикальной хирургической обработки гнойного очага, интенсивной дезинтоксикационной и антибактериальной терапии. Хирургический этап должен быть выполнен как можно раньше – от этого зависит жизнь больного. Как правило, он заключается в широком рассечении очага поражения с удалением некротизированных тканей, декомпрессии окружающих тканей, открытом дренировании с промыванием полостей и ран растворами антисептиков. Особенности течения анаэробной инфекции нередко требуют проведения повторных некрэктомий, раскрытия гнойных карманов, обработки ран ультразвуком и лазером, озонотерапии и т. д. При обширной деструкции тканей может быть показана ампутация или экзартикуляция конечности.
Важнейшими составляющими лечения анаэробной инфекции являются интенсивная инфузионная терапия и антибиотикотерапия препаратами широкого спектра действия, высокотропными к анаэробам. В рамках комплексного лечения анаэробной инфекции находят свое применение гипербарическая оксигенация, УФОК, экстракорпоральная гемокоррекция (гемосорбция, плазмаферез и др.). При необходимости пациенту вводится антитоксическая противогангренозная сыворотка.
Прогноз и профилактика
Исход анаэробной инфекции во многом зависит от клинической формы патологического процесса, преморбидного фона, своевременности установления диагноза и начала лечения. Уровень летальности при некоторых формах анаэробной инфекции превышает 20%. Профилактика анаэробной инфекции заключается в своевременной и адекватной ПХО ран, удалении инородных тел мягких тканей, соблюдении требований асептики и антисептики при проведении операций. При обширных раневых повреждениях и высоком риске развития анаэробной инфекции необходимо проведение специфической иммунизации и противомикробной профилактики.
[youtube.player]
Анаэробная инфекция – инфекционный процесс, вызываемый спорообразующими или неспорообразующими микроорганизмами в условиях, благоприятных для их жизнедеятельности. Характерными клиническими признаками анаэробной инфекции служат преобладание симптомов эндогенной интоксикации над местными проявлениями, гнилостный характер экссудата, газообразующие процессы в ране, быстро прогрессирующий некроз тканей. Анаэробная инфекция распознается на основании клинической картины, подтвержденной результатами микробиологической диагностики, газожидкостной хроматографии, масс-спектрометрии, иммуноэлектрофореза, ПЦР, ИФА и др. Лечение анаэробной инфекции предполагает радикальную хирургическую обработку гнойного очага, интенсивную дезинтоксикационную и антибактериальную терапию.
Анаэробная инфекция
Анаэробная инфекция – патологический процесс, возбудителями которого выступают анаэробные бактерии, развивающиеся в условиях аноксии (отсутствия кислорода) или гипоксии (низкого напряжения кислорода). Анаэробная инфекция представляет собой тяжелую форму инфекционного процесса, сопровождающуюся поражением жизненно важных органов и высоким процентом летальности. В клинической практике с анаэробной инфекцией приходится сталкиваться специалистам в области хирургии, травматологии, педиатрии, нейрохиругии, отоларингологии, стоматологии, пульмонологии, гинекологии и других медицинских направлений. Анаэробная инфекция может возникнуть у пациентов любого возраста. Доля заболеваний, вызываемых анаэробной инфекцией, точно не известна; из гнойных очагов в мягких тканях, костях или суставах анаэробы высеваются примерно в 30% случаев; анаэробная бактериемия подтверждается в 2-5% случаев.

Причины и характеристика анаэробной инфекции
Анаэробы входят в состав нормальной микрофлоры кожи, слизистых оболочек, желудочно-кишечного тракта, органов мочеполовой системы и по своим вирулентным свойствам являются условно-патогенными. При определенных условиях они становятся возбудителями эндогенной анаэробной инфекции. Экзогенные анаэробы присутствуют в почве и разлагающихся органических массах и вызывают патологический процесс при попадании в рану извне. Анаэробные микроорганизмы делятся на облигатные и факультативные: развитие и размножение облигатных анаэробов осуществляется в бескислородной среде; факультативные анаэробы способны выживать как в отсутствии, так и в присутствии кислорода. К факультативным анаэробными бактериями принадлежат кишечная палочка, шигеллы, иерсинии, стрептококки, стафилококки и др.
Облигатные возбудители анаэробной инфекции делятся на две группы: спорообразующие (клостридии) и неспорообразующие (неклостридиальные) анаэробы (фузобактерии, бактероиды, вейллонеллы, пропионибактерии, пептострептококки и др.). Спорообразующие анаэробы являются возбудителями клостридиозов экзогенного происхождения (столбняка, газовой гангрены, ботулизма, пищевых токсикоинфекций и др.). Неклостридиальные анаэробы в большинстве случаев вызывают гнойно-воспалительные процессы эндогенной природы (абсцессы внутренних органов, перитонит, пневмонию, флегмоны челюстно-лицевой области, отит, сепсис и др.).
Основными факторами патогенности анаэробных микроорганизмов служат их количество в патологическом очаге, биологические свойства возбудителей, наличие бактерий-ассоциантов. В патогенезе анаэробной инфекции ведущая роль принадлежит продуцируемым микроорганизмами ферментам, эндо- и экзотоксинам, неспецифическим факторам метаболизма. Так, ферменты (гепариназа, гиалуронидаза, коллагеназа, дезоксирибонуклеаза) способны усиливать вирулентность анаэробов, деструкцию мышечной и соединительной тканей. Эндо- и экзотоксины вызывают повреждение эндотелия сосудов, внутрисосудистый гемолиз и тромбоз. Кроме этого, некоторые клостридиальные токисины обладают нефротропным, нейротропным, кардиотропным действием. Также токсическое влияние на организм оказывают и неспецифические факторы метаболизма анаэробов — индол, жирные кислоты, сероводород, аммиак.
Условиями, благоприятствующими развитию анаэробной инфекции, являются повреждение анатомических барьеров с проникновением анаэробов в ткани и кровеносное русло, а также снижение окислительно-восстановительного потенциала тканей (ишемия, кровотечение, некроз). Попадание анаэробов в ткани может происходить при оперативных вмешательствах, инвазивных манипуляциях (пункциях, биопсии, экстракции зуба и др.), перфорации внутренних органов, открытых травмах, ранениях, ожогах, укусах животных, синдроме длительного сдавления, криминальных абортах и т. д. Факторами, способствующими возникновению анаэробной инфекции, выступают массивное загрязнение ран землей, наличие инородных тел в ране, гиповолемический и травматический шок, сопутствующие заболевания (коллагенозы, сахарный диабет, опухоли), иммунодефицит. Кроме этого, большое значение имеет нерациональная антибиотикотерапия
, направленная на подавление сопутствующей аэробной микрофлоры.
В зависимости от локализации различают анаэробную инфекцию:
- центральной нервной системы (абсцесс мозга, менингит, субдуральная эмпиема и др.)
- головы и шеи (пародонтальный абсцесс, ангина Людвига, средний отит, синусит, флегмона шеи и т. д.)
- дыхательных путей и плевры (аспирационная пневмония, абсцесс легкого, эмпиема плевры и пр.)
- женской половой системы (бартолинит, сальпингит, аднексит, эндометрит, пельвиоперитонит)
- брюшной полости (абсцесс брюшной полости, перитонит)
- кожи и мягких тканей (клостридиальный целлюлит, газовая гангрена, некротизирующий фасциит, абсцессыи др.)
- костей и суставов (остеомиелит, гнойный артрит)
- бактериемию.
Симптомы анаэробной инфекции
Независимо от вида возбудителя и локализации очага анаэробной инфекции, различным клиническим формам свойственны некоторые общие черты. В большинстве случаев анаэробная инфекция имеет острое начало и характеризуется сочетанием местных и общих симптомов. Инкубационный период может составлять от нескольких часов до нескольких суток (в среднем около 3-х дней).
Типичным признаком анаэробной инфекции служит преобладание симптомов общей интоксикации над местными воспалительными явлениями. Резкое ухудшение общего состояния больного обычно наступает еще до возникновения локальных симптомов. Проявлением тяжелого эндотоксикоза служит высокая лихорадка с ознобами, выраженная слабость, тошнота, головная боль, заторможенность. Характерны артериальная гипотония, тахипноэ, тахикардия, гемолитическая анемия, иктеричность кожи и склер, акроцианоз.
При раневой анаэробной инфекции ранним местным симптомом выступает сильная, нарастающая боль распирающего характера, эмфизема и крепитация мягких тканей, обусловленные газообразующими процессами в ране. К числу постоянных признаков относится зловонный ихорозный запах экссудата, связанный с выделением азота, водорода и метана при анаэробном окислении белкового субстрата. Экссудат имеет жидкую консистенцию, серозно-геморрагический, гнойно-геморрагический или гнойный характер, неоднородную окраску с вкраплениями жира и наличием пузырьков газа. На гнилостный характер воспаления также указывает внешний вид раны, содержащей ткани серо-зеленого или серо-коричневого цвета, иногда струпы черного цвета.
Течение анаэробной инфекции может быть молниеносным (в течение 1 суток с момента операции или травмы), острым (в течение 3-4 суток), подострым (более 4 суток). Анаэробная инфекция часто сопровождается развитием полиорганной недостаточности (почечной, печеночной, сердечно-легочной), инфекционно-токсического шока, тяжелого сепсиса, являющихся причиной летального исхода.
Диагностика анаэробной инфекции
Для своевременной диагностики анаэробной инфекции большое значение имеет правильная оценка клинических симптомов, позволяющая своевременно оказать необходимую медицинскую помощь. В зависимости от локализации инфекционного очага диагностикой и лечением анаэробной инфекции могут заниматься клиницисты различных специальностей – общие хирурги, травматологи, нейрохирурги, гинекологи, отоларингологи, челюстно-лицевые и торакальные хирурги.
Методы экспресс-диагностики анаэробной инфекции включают бактериоскопию раневого отделяемого с окраской мазка по Грамму и газожидкостную хроматографию. В верификации возбудителя ведущая роль принадлежит бактериологическому посеву отделяемого раны или содержимого абсцесса, анализу плевральной жидкости, посеву крови на аэробные и анаэробные бактерии, иммуноферментному анализу, ПЦР. В биохимических показателях крови при анаэробной инфекции обнаруживается снижение концентрации белков, увеличение уровня креатинина, мочевины, билирубина, активности трансаминаз и щелочной фосфатазы. Наряду с клиническими и лабораторными исследования, выполняется рентгенография, при которой обнаруживается скопление газа в пораженных тканях или полостях.
Анаэробную инфекцию необходимо дифференцировать от рожистого воспаления мягких тканей, полиморфной экссудативной эритемы, тромбоза глубоких вен, пневмоторакса, пневмоперитонеума, перфорации полых органов брюшной полости.
Лечение анаэробной инфекции
Комплексный подход к лечению анаэробной инфекции предполагает проведение радикальной хирургической обработки гнойного очага, интенсивной дезинтоксикационной и антибактериальной терапии. Хирургический этап должен быть выполнен как можно раньше – от этого зависит жизнь больного. Как правило, он заключается в широком рассечении очага поражения с удалением некротизированных тканей, декомпрессии окружающих тканей, открытом дренировании с промыванием полостей и ран растворами антисептиков. Особенности течения анаэробной инфекции нередко требуют проведения повторных некрэктомий, раскрытия гнойных карманов, обработки ран ультразвуком и лазером, озонотерапии и т. д. При обширной деструкции тканей может быть показана ампутация или экзартикуляция конечности.
Важнейшими составляющими лечения анаэробной инфекции являются интенсивная инфузионная терапия и антибиотикотерапия препаратами широкого спектра действия, высокотропными к анаэробам. В рамках комплексного лечения анаэробной инфекции находят свое применение гипербарическая оксигенация, УФОК, экстракорпоральная гемокоррекция (гемосорбция, плазмаферез и др.). При необходимости пациенту вводится антитоксическая противогангренозная сыворотка.
Исход анаэробной инфекции во многом зависит от клинической формы патологического процесса, преморбидного фона, своевременности установления диагноза и начала лечения. Уровень летальности при некоторых формах анаэробной инфекции превышает 20%. Профилактика анаэробной инфекции заключается в своевременной и адекватной ПХО ран, удалении инородных тел мягких тканей, соблюдении требований асептики и антисептики при проведении операций. При обширных раневых повреждениях и высоком риске развития анаэробной инфекции необходимо проведение специфической иммунизации и противомикробной профилактики.
[youtube.player], MD, FACP, Charles E. Schmidt College of Medicine, Florida Atlantic University;
Maria T. Vazquez-Pertejo
, MD, FCAP, Wellington Regional Medical Center
Last full review/revision January 2018 by Larry M. Bush, MD, FACP; Maria T. Vazquez-Pertejo, MD, FCAP
Сотни разновидностей неспорообразующих анаэробов – часть нормальной флоры кожи, ротовой полости, ЖКТ и влагалища. Если взаимоотношения микроорганизмов-комменсалов нарушаются (например, при хирургическом вмешательстве или другой травме, нарушенном кровоснабжении либо некрозе тканей), некоторые из этих бактерий совместно могут вызвать инфекции с высокой тяжестью заболевания и смертностью. После внедрения в основном месте инфекция может развиваться локально или с кровеносным током достичь отдаленных участков организма.
Поскольку аэробные и анаэробные бактерии часто присутствуют в одном и том же зараженном месте, необходимы соответствующие процедуры по выявлению и посеву, чтобы не просмотреть анаэробы.
Анаэробы могут быть основной причиной инфекции при следующих заболеваниях:
Заболевания плевральной полости и легких
Интраабдоминальные, гинекологические заболевания, заболевания ЦНС, верхних дыхательных путей и кожные заболевания
Этиология
Основными анаэробными грамположительными кокками, участвующими в смешанных анаэробных инфекциях, являются
Эти анаэробы являются частью нормальной флоры полости рта, верхних дыхательных путей и толстого кишечника.
Основные анаэробные грамотрицательные бациллы, участвующие в смешанных анаэробных инфекциях:
Группа бактерий B. fragilis – часть нормальной микрофлоры кишечника и включает анаэробные болезнетворные микроорганизмы, которые наиболее часто выделяются при интраабдоминальных и тазовых инфекциях. Микроорганизмы родов Prevotella и Fusobacterium являются частью нормальной микрофлоры полости рта и толстого кишечника.
Патофизиология
Смешанные анаэробные инфекции обычно характеризуют следующим образом:
Они имеют тенденцию проявляться как локализованные скопления гноя (абсцессы и флегмоны).
Уменьшение давления кислорода и низкий окислительно-восстановительный потенциал, преобладающие в бессосудистых и некротических тканях, критичны для их выживания.
В случае бактериемии она обычно не приводит к диссеминированному внутрисосудистому свертыванию (ДВС).
Клостридиальные инфекции могут привести к септическому шоку, но это не относится к большинству других анаэробных инфекций.
Некоторые анаэробные бактерии обладают явными вирулентными факторами. Факторы вирулентности B. fragilis играют роль в частом выявлении этих бактерий в клинических образцах, несмотря на их относительную редкость в нормальной микрофлоре по сравнению с другими Bacteroides sp. У этого организма есть капсула полисахаридная, которая, очевидно, стимулирует формирование гнойного очага. В экспериментальной модели интраабдоминального сепсиса показано, что B. fragilis может вызвать абсцесс самостоятельно, тогда как другим Bacteroides sp требуется синергическое воздействие другого организма. Другой фактор вирулентности, мощный эндотоксин, задействован при септическом шоке, связанном с тяжелым фарингитом Fusobacterium.
Заболеваемость и смертность при анаэробном и смешанном бактериальном сепсисе столь же высоки, как и при сепсисе, вызванном отдельным аэробным микроорганизмом. Анаэробные инфекции часто осложняются глубоким некрозом ткани. Общий уровень смертности при тяжелом интраабдоминальном сепсисе и смешанных анаэробных пневмониях является высоким. Бактериемия B. fragilis приводит к высокой смертности, особенно среди людей пожилого возраста и пациентов с раком.
Клинические проявления
У пациентов обычно отмечаются лихорадка, озноб и развитие тяжелых критических состояний; шок, как правило, отсутствует. ДВС может развиться при сепсисе Fusobacterium.
Для информации по определенным инфекциям (и симптомам), вызванным смешанными анаэробными организмами, смотрите Р у к оводство (The Manual) и Нарушения, часто вызываемые смешанными* анаэробными организмами.
Анаэробы редко вызывают ИМП, септический артрит и инфекционный эндокардит.
[youtube.player]Проблема лечения гнойно-воспалительных заболеваний, являющаяся одной из самых древних в хирургии, продолжает оставаться актуальной, что определяется распространенностью такого вида патологии, длительными сроками лечения больных и высокой летальностью. Основные принципы любого метода лечения гнойно-некротических процессов — раннее удаление девитализированных тканей, подавление деятельности микрофлоры в очаге поражения, ускорение репаративной регенерации.
Бактериостатические антибиотики приостанавливают размножение бактерий, бактерицидные — убивают микробную клетку. К бактериостатическим антибиотикам относят тетрациклины, левомицетин, некоторые макролиды и линкозамины, к бактерицидным — пенициллины, цефалоспорины, аминогликозиды, фторхинолоны, современные макролиды, рифампицин, ванкомицин. При назначении комбинированной антибиотикотерапии сочетание средств с бактерицидной и бактериостатической активностью считается нецелесообразным.
Нежелательно применение бактериостатиков, приостанавливающих размножение бактерий, у больных со сниженным иммунитетом (при тяжелых инфекциях, иммунодепрессивной терапии, сепсисе), от состояния которого зависит окончательное разрушение микробной клетки.
Бета-лактамные антибиотики (содержащие бета-лактамное кольцо) оказывают бактерицидное действие, нарушая синтез клеточной стенки бактерий.
Природные пенициллины являются препаратами выбора при пиогенной стрептококковой и клостридиальной инфекции (а также при лечении актиномикоза и сифилиса) и сохраняют активность против анаэробных и грамотрицательных аэробных кокков, фузобактерий и бактероидов (за исключением В. fragilis). В средних и высоких дозах в комбинации с аминогликозидами они эффективны при энтерококковой инфекции. Природные пенициллины утратили активность против стафилококков, в большинстве случаев (60-90 %) продуцирующих ферменты (бета-лактамазы), разрушающие антибиотики пенициллинового ряда.
Пенициллины выводятся в основном с мочой через почечные канальцы (80-90 %) и путем клубочковой фильтрации (10-20 %) как в биологически активной форме (50—70 %), так и в виде метаболитов. В зависимости от тяжести инфекции средние суточные дозы бензилпенициллина могут колебаться от 8—12 млн до 18—24 млн ЕД, достигая 30—60 млн ЕД при лечении газовой гангрены. Феноксиметилпенициллин, предназначенный для приема внутрь, применяют при легкой инфекции (как правило, в амбулаторной практике) и поддерживающей терапии после курса лечения бензилпенициллином.
Пенициллины, устойчивые к пенициллиназам (полусинтетические пенициллины), по праву считаются наиболее результативными антибиотиками при лечении стафилококковой инфекции у больных, не имеющих аллергии к пенициллинам. Они достаточно эффективны против стрептококков и несколько уступают бензилпенициллину в активности против анаэробов; экскретируются с мочой и желчью. Метициллин имеет ограниченное применение, так как может вызывать интерстицильный нефрит. При инфекциях средней тяжести рекомендуется оксациллин в дозе 1 г внутривенно через каждые 4 ч, при тяжелых инфекциях назначают 9—12 г/сут.
Аминопенициллины (ампициллин, амоксициллин) относятся к полусинтетическим пенициллинам второй генерации. Спектр их действия охватывает многие (но не все) штаммы Е. Coli, Proteus mirabilis, Salmonella, Shigella, H. Influenzae, Moraxella spp. Препараты активны против пенициллиназопродуцирующих стафилококков, но в комбинации с ингибиторами бета-лактамаз (клавулановая кислота, сульбактам) комплексные препараты лишены этого недостатка; накапливаются в моче и желчи и не дают нефротоксического эффекта.
Карбоксипенициллины (карбенициллин, тикарциллин) и уреидопенициллины (азлоциллин, мезлоциллин, пипераииллин) относятся к третьей и четвертой генерациям полусинтетических пенициллинов, активны против грамположительных и грамотрицательных бактерий, а также против синегнойной палочки и бактероидов. При синегнойной инфекции целесообразно сочетание этих антибиотиков с гента-мицином (синергизм действия), но растворы двух препаратов нельзя смешивать, так как возможна их инактивация.
Комбинированные полусинтетические пенициллины: ампициллин/сульбактам, амоксициллин/клавулановая кислота, тикарциллин/клавулановая кислота (тиментин) устойчивы к бета-лактамазам и активны против продуцирующих бета-лактамазы штаммов стафилококка, энтеробактерий и других грамотрицательных возбудителей. Для лечения тяжелых инфекций не рекомендуется использовать полусинтетические пенициллины в качестве монотерапии. Выводятся почками (80-85 %) и печенью (15-20 %).
Монобактамы занимают особое место среди бета-лактамных антибиотиков, так как их активность распространяется только на грамотрицательные бактерии кроме Acinetobacter, Pseudomonas cepacia, Pseudomonas maltopillia, включая продуцирующие бета-лактамазу штаммы. Азтреонам неэффективен при анаэробной инфекции и почти не действует на грамположительные аэробы. Его можно использовать при инфекциях мягких тканей, костей и суставов, перитоните, сепсисе. Ввиду малой токсичности этот антибиотик часто применяют вместо аминогликозидов у больных с нарушением функции почек и у пожилых пациентов.
Карбапенемы — имепенем (тиенам), мелопинем (меронем) тоже относятся к группе новых бета-лактамных антибиотиков, устойчивых к бета-лактамазам, и имеют самый широкий спектр антибактериальной активности, подавляя до 90 % всех аэробных и анаэрорбных микроорганизмов. Они неэффективны против метициллинрезистентных стафилококков, но являются препаратами выбора при лечении перитонита, панкреонекроза и других тяжелых госпитальных инфекций, вызванных Acinetobacter spp. и P. aeruginosa.
Цефалоспорины имеют широкий спектр действия и выраженную активность против пенициллиназопродуцирующих стафилококков. Цефалоспорины первой генерации (цефазолин, цефалогин, цефалексин и др.) более активны против грамположительных бактерий. Цефалоспорины второй генерации (цефуроксим, цефоксигин, цефамандол, цефакмор, цефметазол и др.) дополнительно воздействуют на грамотрицательные возбудители (за исключением Prseudomonas spp. Acinetobacter spp.), а цефотетам, цефметазол эффективны и против анаэробов (особенно Bacteroidesfragilis), что расширяет их применение при смешанных аэробо-анаэробных инфекциях.
Цефалоспорины третьей генерации (цефотаксим, цефтазим, цефоперазон, цефтриаксон и др.) отличаются еще более выраженной активностью против грамотрицательной флоры, включая P. aeruginosa (цефтазидим, цефоперазон), и в 2— 4 раза менее эффективны при стафилококковой моноинфекции. Цефалоспорины четвертой генерации (цефепим, цефпиром) пока не нашли достойного применения в отечественной практике, хотя спектр их активности против грамотрицательной флоры сопоставим с карбапенемами.
Аминогликозины также относятся к антибиотикам широкого спектра действия с бактерицидной активностью против грамположительных кокков (хотя неправильно начинать с них лечение стафилококковой инфекции) и многих грамотрицательных бактерий (Enterobacteriaceae, Pseudomonas spp., Acinetobacter spp.), что позволяет использовать их, в частности, в комбинации с бета-лактамными антибиотиками для лечения тяжелых госпитальных инфекций. Разделяют аминогликозиды первого поколения (стрептомицин, канамицин, мономицин, неомицин), второго (гентамицин, тобрамицин, нетилмицин), третьего (амикацин, сизомицин).
Аминогликозиды первого поколения практически утратили свое значение в лечебной практике (за исключением стрептомицина во фтизиопульмонологии и при лечении энтерококкового эндокардита в комбинации с бензилпенициллином, а также неомицина внутрь при предоперационной подготовке кишечника). Аминогликозиды плохо проникают через гематоэнцефалический барьер, в желчь, костную ткань; в плевральной, перикардиальной, асцитической жидкости, бронхиальном секрете, мокроте создаются недостаточные концентрации, аминогликозиды выводятся с мочой.
Наблюдения последних лет свидетельстувуют, что однократное введение аминогликозидов в суточной дозе предпочтительнее многократных инъекций в связи с более выраженным бактрицидным действием на возбудитель и меньшей частотой побочных эффектов.
Макролиды [эритромицин, азитромицин (сумамед), рокситромицин (рулид), мидакамицин (макропен) и др.] относят к бактериостатическим препаратам, но в высоких дозах и малой осемененности микроорганизмами действуют бактерицидно. К ним чувствительны стрептококки, стафилококки и грамотрицательные анаэробы (кроме В. fragilis), а при легком и среднетяжелом течении стафилококковой инфекции они являются препаратами выбора у больных с аллергией к пенициллинам и цефалоспоринам. К эритромицину быстро развивается устойчивость микрофлоры.
Тетрациклины действуют бактериостатически на многие грамположительные и грамотрицательные микроорганизмы, но в результате быстро развивающейся устойчивости и плохой переносимости при лечении стационарных больных их практически не используют. К этой группе относятся тетрациклин, окситетрациклин и полусинтетические тетрациклины — доксициклин (вибрамицин), миноциклин.
Фторхинолоны [ципрофлоксацин, ломофлоксацин, олоксацин (таривид), пефлоксацин, сларфлоксацин и др.] разрушают клетки многих штаммов грамотрицательных бактерий (включая P. aeruginosa), стафилококков и избирательно — стрептококков, не действуют на анаэробы, фекальный энтерококк и отдельные виды псевдомонад. Они хорошо всасываются при приеме внутрь, что обеспечивает достижение терапевтических концентраций в биологических жидкостях и тканях, но при тяжелой инфекции инфузионное введение препарата предпочтительнее. Экскретируются с мочой, где достигаются высокие уровни антибиотиков. К фторхинолону высокочувствительны стафилококк и внутриклеточные бактерии, микобактерия туберкулеза
Химические антибактериальные препараты
При лечении гнойно-воспалительных заболеваний эффективны сульфаниламидные препараты, оказывающие бактерицидное действие на грамположительную и грамотрицательную флору. Наибольшее значение имеют сульфаниламиды длительного (сульфапиридазин, сульфадиметоксин) или сверхдлительного (сульфален) действия. Максимальная концентрация в крови препаратов длительного действия после однократного приема снижается на 50 % через 24-48 ч, а с мочой выделяется 50 % препарата через 24—56 ч. Снижение терапевтической концентрации сульфалена на 50 % происходит через 65 ч, а бактериостатическая концентрация сохраняется в течение 7 сут. Препараты применяют также в комплексе с антибиотиками при лечении гнойных заболеваний мягких тканей, железистых органов, остеомиелита, гнойных ран.
Сульфапиридазин и сульфапиридазин-натрий назначают внутрь по схеме, курс лечения 5—7 дней. Сульфапиридазин-натрий в виде 3—10 % раствора применяют для промывания ран; 10 % раствор препарата на поливиниловом спирте используют местно для санации гнойных очагов. Сульфален назначают внутрь, внутривенно вводят в тех же дозах (специальные ампулы по 0,5 г).
Активное антибактериальное действие оказывают препараты сульфаниламидов в комбинации с производными диаминопиримидина (бактрим, бисептол).
Из производных нитрофуранов для лечения гнойно-воспалительных заболеваний применяют фурагин калия внутривенно 300—500 мл (0,3-0,5 г) 0,1 % раствора, используют на курс 3— 7 вливаний. Местно используют для санации гнойных полостей.
Химические антисептики применяют местно, они позволяют создать высокую концентрацию непосредственно в очаге гнойного воспаления. Препараты более устойчивы к воздействию продуктов воспаления или некроза, чем антибиотики. Антибактериальную активность антисептиков повышают физические факторы — дренирование, ультразвук, энергия лазера, плазмы; некротические — протеолитические ферменты, гипохлорит натрия; биологические средства (бактериофаги) и др.
Антисептики имеют широкий антибактериальный спектр действия, дают бактерицидный или бактериостатический эффект. Устойчивость микроорганизмов к ним относительно низкая, распространение этих форм небольшое. Препараты плохо всасываются, но стабильны при длительном хранении и редко проявляют побочные действия (раздражающее или аллергическое).
Наиболее эффективные антисептики, применяемые в хирургической практике, — поверхностноактивные вещества (ПАВ):
• хлоргексидин биглюконат.
Рабочие концентрации 0,02—0,5 %;
• катапол, рабочая концентрация 0,1-0,4 %;
• мирамистин — в концентрации 0,01 %;
Спектр действия ПАВ — аэробы, анаэробы, грибы.
Йодистые препараты:
• повидон-йод (йодопирон, бетадин).
Рабочая концентрация — 0,1— 1,0%;
• йодинол — готовый раствор.
Спектр действия йодных препаратов — аэробы, анаэробы, грибы.
Производные хинолина и хиноксалина:
• риванол (этакридалактат) — 0,05—0,2 %;
• диоксидин — 0,5—1,0 %.
Препараты действуют на аэробную и анаэробную флору.
Нитрофурановые производные:
• фурацилин 1:5000;
• фурагин К (фуразидим) — 1:13 000.
Спектр действия — аэробы и анаэробы.
Электрохимические растворы:
• рипохлорит натрия 0,03—0,12 %.
Спектр действия — аэробы, анаэробы, грибы.
Перечисленные препараты дают выраженный антибактериальный, в основном бактерицидный эффект при местном применении в лечении ран (промывание, смачивание тампонов), санации слизистых оболочек. Подобные препараты используют для обработки рук хирурга. Препараты применяют для внутриполостного введения, при эмпиемах, но для санации гнойных полостей больших размеров, серозная оболочка которых обладает выраженной сорбционной способностью (брюшина), возможно использование лишь препаратов, пригодных для внутривенного введения (фурагин калия, диоксидин, гипохлорит натрия). Проточное, проточно-промывное дренирование, перитонеальный диализ позволяют избежать общетоксического действия препаратов из-за всасывания их в кровь.
Гноеродная флора не обладает абсолютной чувствительностью к антисептикам, хотя она достаточно высока к некоторым из них. Так, по Г.Е. Афиногенову и М.В. Краснову (2003), к хлоргексидину, диоксидину, катаполу, йодопирину S. aureus чувствителен в 69—97 % штаммов. Наибольшая чувствительность отмечена к катаполу (97 %). E. coli наиболее чувствительна к диоксидину и катаполу (78 %), а к хлоргексидину и йодопирону в 55—58 %. Proteus spp. наиболее чувствителен к хлоргексидину и диоксидину (90 и 84 %), а к йодопирону — лишь в 35 %, к катаполу — в 40 %. Ps. aeruginosa наиболее чувствительна к диоксидину (92 %), к хлоргексидину, йодопирону (52-62 %).
Эффективность антисептиков повышается при их совместном применении или при сочетании со средствами физической антисептики.
Распределение в организме, органотропность антибиотиков
В идеальном случае концентрация пепарата в очаге поражения должна обеспечивать бактерицидный эффект. Между концентрациями антибиотиков в крови и тканях, как правило, существует определенная зависимость, которая определяется общей диффузионной способностью препарата. Высокую диффузионную способность имеют такие препараты, как левомицетин, эритромицин, олеандомицин. Для тетрациклина она составляет 50 %, для аминогликозидов — около 30 %, для пенициллинов — 10-30 %.
Так, при концентрации в крови эритромицина, равной 1—3 мкг/мл, его содержание в легких составляет 30 %, в костях — до 15 %. При концентрации пенициллина в крови 0,5-3 ЕД в брюшной полости она достигает 30-50 %, в плевральной — 20-30 %, в костях — 30—50 %. Накопление препарата в очаге воспаления определяется также тропностью антибиотиков к органам и тканям.
Высокой тропностью к легочной ткани обладают пенициллины, макролиды, тетрациклины, аминогликозиды, монобактамы, фторхинолоны. Среднюю степень тропности отмечают у линкозаминов, фузидина.
Высокую тропность к плевре, способность накапливаться в плевральном экссудате проявляют рифампицин, монобактамы, среднюю тропность имеют фторхинолоны, тетрациклины, фузидин, макролиды, низкая тропность у полимиксинов, линкозаминов.
Средней тропностью к клетчатке средостения обладают фторхинолоны.
Высокую тропность к костной ткани проявляют линкозамины, цефалоспорины, фузидин, фторхинолоны; среднюю — тетрациклины (монобактамы обладают тропностью к костной ткани грудины, фузидин — к хрящевой ткани), низкую — пенициллины, макролиды.
Высокая тропность к мышечной ткани у цефалоспоринов, макролидов, монобактамов, фторхинолонов; средняя — у линкозаминов, рифампицина, низкая — у макролидов.
К лимфоидной ткани, лимфатическим узлам высокую тропность проявляют макролиды, фторхинолоны.
Среднюю тропность к ткани молочной железы проявляют фузидин, который выделяется с молоком.
Высокой тропностью к ткани печени, желчи обладают пенициллины. фторхинолоны, макролиды, средней — аминогликозиды, цефалоспорины, макролиды. К ткани поджелудочной железы высокую тропность проявляют карбопенемы, среднюю — аминогликозиды, фторхинолоны, рифампицин.
[youtube.player]Читайте также:



