Война бактерий с вирусами
Бактериофаги – это вирусы, которые поражают только бактерий. В ходе инфекции они влияют на все процессы жизнедеятельности бактериальной клетки, фактически превращая ее в фабрику по производству вирусного потомства. В конце концов клетка разрушается, а вновь образованные вирусные частицы выходят наружу и могут заражать новые бактерии.
Несмотря на огромное число и разнообразие природных фагов, встречаемся мы с ними редко. Однако бывают ситуации, когда деятельность этих вирусов не остается незамеченной. Например, на предприятиях, где производят сыры, йогурты и другие молочно-кислые продукты, часто приходится сталкиваться с вирусной атакой на бактерии, сбраживающие молоко. В большинстве таких случаев фаговая инфекция распространяется молниеносно, и полезные бактерии гибнут, что приводит к значительным экономическим потерям (Neve et al., 1994).
Именно благодаря прикладным исследованиям в интересах молочной промышленности, направленным на получение устойчивых к бактериофагам штаммов молочно-кислых бактерий, был открыт ряд механизмов, с помощью которых бактерии избегают инфекции. Параллельно были изучены способы, с помощью которых вирусы, в свою очередь, преодолевают бактериальные системы защиты (Moineau et al., 1993).
Кто защищен – тот вооружен
На сегодня известно пять основных, весьма хитроумных механизмов защиты, которые бактерии выработали в непрестанной борьбе с вирусами: изменение рецептора на поверхности клетки; исключение суперинфекции; системы абортивной инфекции; системы рестрикции-модификации и, наконец, системы CRISPR-Cas.
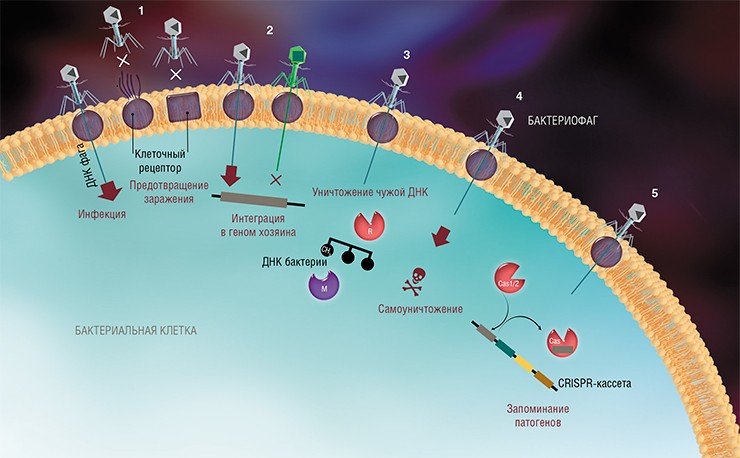
К средствам противовирусной защиты бактерий относятся и системы рестрикции-модификации, в которые входят гены, кодирующие два белка-фермента – рестриктазу и метилазу. Рестриктаза узнает определенные последовательности ДНК длиной 4—6 нуклеотидов и вносит в них двуцепочечные разрывы. Метилаза, напротив, ковалентно модифицирует эти последовательности, добавляя к отдельным нуклеотидным основаниям метильные группы, что предотвращает их узнавание рестриктазой.
Врага нужно знать в лицо
Системы CRISPR-Cas являются уникальным примером адаптивного иммунитета бактерий. При проникновении в клетку ДНК фага специальные белки Cas встраивают фрагменты вирусной ДНК длиной 25—40 нуклеотидов в определенный участок генома бактерии (Barrangou et al., 2007). Такие фрагменты называются спейсерами (от англ. spacer – промежуток), участок, где происходит встраивание, – CRISPR-кассета (от англ. Clustered Regularly Interspaced Short Palindromic Repeats), а сам процесс приобретения спейсеров – адаптацией.
Чтобы использовать спейсеры в борьбе с фаговой инфекцией, в клетке должен происходить еще один процесс, управляемый белками Cas, названный интерференцией. Суть его в том, что в ходе транскрипции CRISPR-кассеты образуется длинная молекула РНК, которая разрезается белками Cas на короткие фрагменты – защитные криспрРНК (крРНК), каждая из которых содержит один спейсер. Белки Cas вместе с молекулой крРНК образуют эффекторный комплекс, который сканирует всю ДНК клетки на наличие последовательностей, идентичных спейсеру (протоспейсеров). Найденные протоспейсеры расщепляются белками Cas (Westra et al., 2012; Jinek et al., 2012).
Системы CRISPR-Cas обнаружены у большинства прокариот – бактерий и архей. Хотя общий принцип действия всех известных систем CRISPR-Cas одинаков, механизмы их работы могут существенно отличаться в деталях. Наибольшие различия проявляются в строении и функционировании эффекторного комплекса, в связи с чем системы CRISPR-Cas делят на несколько типов. На сегодняшний день описаны шесть типов таких неродственных друг другу систем (Makarova et al., 2015; Shmakov et al., 2015).

Наиболее изученной является система CRISPR-Cas I типа, которой обладает излюбленный объект молекулярно-биологических исследований – бактерия кишечная палочка (Esсherichia coli). Эффекторный комплекс в этой системе состоит из нескольких небольших белков Cas, каждый из которых отвечает за разные функции: разрезание длинной некодирующей CRISPR РНК, связывание коротких крРНК, поиск, а затем разрезание ДНК-мишени.
Гонка вооружений
Бактериофаги, как факторы среды, вызывают направленные изменения в геноме бактерий, которые наследуются и дают бактериям явное преимущество, спасая от повторных инфекций. Поэтому системы CRISPR-Cas можно считать примером ламарковской эволюции, при которой происходит наследование благоприобретенных признаков (Koonin et al., 2009)
Некоторые бактериофаги реагируют на наличие в бактериальной клетке систем CRISPR-Cas выработкой особых анти CRISPR-белков, способных связываться с белками Cas и блокировать их функции (Bondy-Denomy et al., 2015). Еще одно ухищрение — обмен участков генома вируса, на которые нацелена система CRISPR-Cas, на участки геномов родственных вирусов, отличающихся по составу нуклеотидной последовательности (Paez-Espino et al., 2015).

Благодаря постоянному совершенствованию биоинформатических алгоритмов поиска, а также включению в анализ все большего количества прокариотических геномов, открытие новых типов CRISPR-Cas систем является делом недалекого будущего. Предстоит также выяснить и детальные механизмы работы многих недавно открытых систем. Так, в статье, опубликованной в 2016 г. в журнале Science и посвященной анализу системы CRISPR-Cas VI типа, описан белок С2с2, образующий эффекторный комплекс с крРНК, который нацелен на деградацию не ДНК, а РНК (Abudayyeh et al., 2016). В будущем такое необычное свойство может быть использовано в медицине для регулирования активности генов путем изменения количества кодируемых ими РНК.
Изучение стратегий борьбы бактерий с бактериофагами, несмотря на свою кажущуюся фундаментальность и отвлеченность от задач практической медицины, принесло неоценимую пользу человечеству. Примерами этого могут служить методы молекулярного клонирования и редактирования геномов – направленного внесения или удаления мутаций и изменения уровня транскрипции определенных генов.
Благодаря быстрому развитию методов молекулярной биологии всего лишь через несколько лет после открытия механизма действия систем CRISPR-Cas была создана работающая технология геномного редактирования, способная бороться с болезнями, ранее считавшимися неизлечимыми. Доступность и простота этой технологии позволяют рассматривать ее как основу для медицины, ветеринарии, сельского хозяйства и биотехнологий будущего, которые будут базироваться на направленных и безопасных генных модификациях.
Нет никаких сомнений, что дальнейшее изучение взаимодействия бактерий и их вирусов может открыть перед нами такие возможности, о которых мы сейчас даже не подозреваем.
Abudayyeh O. O., Gootenberg J. S., Konermann S. et al. C 2c2 is a single-component programmable RNA-guided RNA-targeting CRISPR effector // Science. 2016. V. 353: aaf5573.
Barrangou R., Fremaux C., Deveau H. et al. CRISPR provides acquired resistance against viruses in prokaryotes // Science. 2007. V. 315. P. 1709–1712.
Bikard D., Marraffini L. A. Innate and adaptive immunity in bacteria: mechanisms of programmed genetic variation to fight bacteriophages // Curr. Opin. Immunol. 2012. V. 1 P. 15–20.
Bondy-Denomy J., Garcia B., Strum S. et al. Multiple mechanisms for CRISPR-Cas inhibition by anti-CRISPR proteins // Nature. 2015. V. 526. P. 136–139.
Calendar R., Abedon S. T. The Bacteriophages // 2nd Ed., Oxford University Press. 2006.
Datsenko K. A., Pougach K., Tikhonov A. et al. Molecular memory of prior infections activates the CRISPR/Cas adaptive bacterial immunity system // Nat. Commun. 2012. V. 3. P. 945
Jiang W., Marraffini L. A. CRISPR-Cas: New Tools for Genetic Manipulations from Bacterial Immunity Systems // Annu. Rev. Microbiol. 2015. V. 69. P. 209–28.
Jinek M., Chylinski K., Fonfara I., et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity // Science. 2012. V. 337. P. 816–821.
Koonin E. V., Wolf Y. I. Is evolution Darwinian or/and Lamarckian? // Biol. Direct. 2009. V. 4. P. 42.
Lopez-Pascua L., Buckling A. Increasing productivity accelerates host-parasite coevolution // J. Evol. Biol. 2008. V. 3. P. 853–860.
Makarova K. S., Wolf Y. I., et al. An updated evolutionary classification of CRISPR-Cas systems // Nat. Rev. Microbiol. 2015. V. 11. P. 722–736.
Moineau, S., Pandian S., Klaenhammer T. R. Restriction/modification systems and restriction endonucleases are more effective on lactococcal bacteriophages that have emerged recently in the dairy industry // Appl. Envir. Microbiol. 1993. V. 59. P. 197–202.
Neve H., Kemper U., et al. Monitoring and characterization of lactococcal bacteriophage in a dairy plant // Kiel. Milckwirtsch. Forschungsber. 1994. V. 46. P. 167–178.
Nuñez J. K., Harrington L. B., et al. Foreign DNA capture during CRISPR-Cas adaptive immunity // Nature. 2015a. V. 527. P. 535–538.
Nuñez J. K., Kranzusch P. J., et al. Cas1-Cas2 complex formation mediates spacer acquisition during CRISPR-Cas adaptive immunity // Nat. Struct. Mol. Biol. 2014. V. 21. P. 528–534.
Nuñez J. K., Lee A. S., Engelman A., Doudna J. A. Integrase-mediated spacer acquisition during CRISPR-Cas adaptive immunity // Nature. 2015b. V. 519. P. 193–198.
Paez-Espino D., Sharon I., et al. CRISPR Immunity Drives Rapid Phage Genome Evolution in Streptococcus thermophilus // MBio. 2015. V. 6: e00262–15.
Shmakov S., Abudayyeh O. O., Makarova K. S., et al. Discovery and Functional Characterization of Diverse Class 2 CRISPR-Cas Systems. // Mol. Cell. 2015. V. 60. P. 385–397
Tan D., Svenningsen S. L., Middelboe M. Quorum sensing determines the choice of antiphage defense strategy in Vibrio anguillarum. // mBio 2015. V. 6: e00627–15.
Westra E. R., van Erp P. B., Künne T., et al. CRISPR immunity relies on the consecutive binding and degradation of negatively supercoiled invader DNA by Cascade and Cas3 // Mol. Cell. 2012. V. 46. P. 595–605.
Работа поддержана грантом РФФИ (№ 16-34-01176)

МОСКВА, 19 янв – РИА Новости. Биологи нашли свидетельства того, что вирусы обладают некой формой коллективного разума и умеют распознавать "метки", которые оставляют в клетках их конкуренты и родичи, и руководствоваться ими при принятии решений, говорится в статье, опубликованной в журнале Nature.
"Эти бктериофаги (вирусы, поражающие бактерий), содержат в себе две программы поведения. Одна заставляет клетку производить огромное количество своих копий и запускает в ней программу самоуничтожения, а при включении второй он интегрируется в ее ДНК и уходит в "глубокое подполье" с возможностью возрождения в будущем", — объясняет Нонья Париенте (Nonia Pariente), молекулярный биолог и редактор журнала Nature Microbiology.
Солдаты вечной войны
Болезни и инфекции не являются чем-то, чем страдает только человек и другие многоклеточные существа – между бактериями и вирусами уже несколько сотен миллионов лет идет беспрерывная война на выживание. Следы этой войны можно встретить повсеместно – в каждом миллилитре морской воды содержится до миллиарда "боевых вирусов"-бактериофагов, и примерно 70% морских микроорганизмов заражены ими.
За миллиарды лет эволюции вирусы научились обходить внимание защитных систем микробов, а последние – разработали своеобразный генетический "антивирус", систему CRISPR-Cas9, которая находит следы вирусной ДНК в геноме микроба и заставляет его совершить суицид для защиты соседних бактерий. Вирусы ответили на эти меры "эволюционной обороны", создав анти-антивирус, подавляющий CRISPR-Cas9, и биологическая гонка вооружений продолжилась.
Ротем Сорек (Rotem Sorek) из Института науки Вейцманна в Реховоте (Израиль) и его коллеги нашли еще один крайне интересный пример "оружия", изобретенного вирусами, изучая то, как работает бактериофаг phi3T, заражающий обычных бацилл (Bacillus subtilis).
Изначально ученые пытались понять совсем другую вещь – то, как микробы оповещают друг друга о присутствии вируса и готовятся к отражению его атаки. Как считали ученые, зараженные бактерии выделяют в окружающую среду специальные сигнальные молекулы, которые сигнализируют другим микробам в их колонии об опасности.
Для проверки этой Сорек и его коллеги вырастили колонию бацилл, заразили их phi3T, после чего отфильтровали жидкость, которую выделяли микробы во время заражения колонии. Часть этого раствора биологи добавили в новую колонию бактерий, предполагая, что те сигнальные молекулы, которые их погибшие товарки выделяли в питательную среду, подготовят их к новой атаке вирусов и защитят от заражения. Реальность оказалась совершенно иной.
Тайные сигналы
Выяснилось, что короткие белковые молекулы arbitrium, которые биологи выделили из этого раствора, на самом деле были предназначены для общения вирусов друг с другом, а не бактерий, и их "авторами" были не микробы, а их непрошенные гости.

Эти молекулы, как показали эксперименты израильских генетиков, заставляют вирус "переключиться" с одной программы размножения на другую. В присутствии arbitrium вирусы "уходят в подполье", встраиваясь в ДНК бактерий вместо того, чтобы бурно размножаться в них и уничтожать клетки.
Переключение программы происходит по той причине, что arbitrium блокирует работу вирусного белка AimR, отвечающего за запуск процедуры размножения вирусной ДНК и растворения стенок бактерии.
Зачем это нужно вирусам? Подобная система сигналов, как объясняют ученые, работает как своеобразная форма коллективного разума вирусов, который позволяет им гибко координировать свое поведение. Когда вирусов мало, им выгоднее активно размножаться, заражая новых бактерий и убивая их, однако со временем их становится слишком много и бактерии начинают коллективно реагировать на заражение, или же число бацилл падает до крайне низких значений.
В этот момент вирусы переключаются на альтернативную программу заражения, используя сигналы, подобные arbitrium, и "скрываются в толпе", выжидая новый удобный момент для заражения. По словам Сорека, его команда обнаружила более сотни других молекул, похожих на arbitrium и AimR, в других вирусах-бактериофагах, что говорит о том, что многие или даже все вирусы умеют "общаться" с себе подобными.
Возможно, что аналогичные системы существуют и в вирусах, заражающих человека, и их наличие могло бы объяснить, как ВИЧ и ряд других ретровирусов прячутся в клетках при попытке их изгнать из организма. Если ученым удастся найти молекулу, которая заставит ВИЧ навечно "окопаться" в клетке и не выходить оттуда, то проблема борьбы с ним будет решена.
Живем в кольце врагов — вирусы, бактерии и прочая зараза, которая то и дело переходит в наступление, превращает здоровых людей в больных, убивает. Зловредный коронавирус Covid-19 — свежий тому пример.
Коронавирус против человечества: новые инфекции усиливают наш иммунитет
Казалось бы, человечество давно должно было бы исчезнуть, пав в неравных боях с инфекционными заболеваниями. Но оно до сих пор живо. Почему?
- Все эпидемии, как и любые войны, рано или поздно заканчиваются, - говорит Павел Воробьев, доктор медицинских наук, профессор, председатель правления Московского городского научного общества терапевтов. - И нынешняя не исключение. Скоро пойдет на убыль. Если уже не пошла.
И это, по словам ученого, не столь уж удивительно. По крайней мере, для него. Поскольку относительно мирное наше сосуществование с вирусами и бактериями предопределено природой. Геном человека примерно на половину состоит из ДНК вирусов, которые встраивалась туда в процессе эволюции. А бактерий в нашем организме больше, чем клеток самого организма. Разнообразные микробы помогают переваривать пищу, вырабатывают всякие полезные вещества, укрепляют иммунитет.
С бактериями, которые, иной раз перемещаясь из привычных мест обитания в несвойственные им, начинают вредоносную деятельность, вступают в борьбу защитные силы самого организма и антибиотики, созданные человеком. Бактерии сопротивляются, вырабатывая устойчивость к антибиотикам и атакам защитных сил, но пока проигрывают в этом противостоянии. Выработанный в итоге иммунитет побеждает болезнь. Если организм, конечно, не слишком истощен, не испорчен прожитыми годами и нехорошими излишествами.

Попытки убить вирус физически не самые действенные. Иммунитет - надежнее.
- Создается впечатление, будто бы так оно и есть на самом деле, - отвечает ученый.
КОШМАРЫ МИНУВШИХ ДНЕЙ
Самые страшные вирусные эпидемии в истории человечества
Испанский грипп 1918 года: от 50 до 100 миллионов жертв

Заразившимися "испанкой" были переполнены госпитали.
Скептики сходство эпидемий отрицают, уверяя, что вирусы — прежний и нынешний — хоть и родственники, но все-таки очень разные. Равно, как и заболевания ими вызванные.

Болели "испанкой" не долго: 3 дня - и освобождали место для вновь прибывших.
Оспа: от 300 до 500 миллионов жертв в ХХ веке

Оспа "косила" людей с глубокой древности.
Оспу победила вакцинация. Самый последний случай заболевания зафиксирован в 1978 году. Тогда заразилась британская женщина, работавшая медицинским фотографом. Заразилась в вирусной исследовательской лаборатории. И умерла.
СПИД: около 35 миллионов жертв с начала эпидемии
Синдром приобретенного иммунного дефицита (СПИД) вызывают вирусы иммунного дефицита человека ( ВИЧ ). Считается, что поражать людей они начали с 60-х годов прошлого века - мутировали из тех, которые жили в африканских обезьянах.

СПИД еще не побежден: эпидемия продолжается.
О первых случаях заболевания СПИДОМ заговорили в 1981 году после того, как в США объявили о 30 случаях. Сам вирус был выявлен и изучен в 1983 году. В 2008 году ученые, сделавшие открытие, получили Нобелевскую премию. На удивление, и ВИЧ похож на коронавирус — тоже эдакий шарик с пупырышками.
Первоначально считалось, что СПИД поражает исключительно геев и наркоманов. В итоге же оказалось, что никто не застрахован.
ЭТО БЫЛО НЕДАВНО
Свиной грипп 2009 года: примерно 500 тысяч жертв
Похоже, что 11 лет назад проявил себя мутировавший в очередной раз H1N1. Происхождение этого штамма, способного передаваться от человека к человеку, неизвестно. Но заболевание впервые приобрело массовый характер в Мексике и США.
Летом 2009 года ВОЗ объявила свиной грипп пандемией и присвоила ему шестой - наивысший - уровень опасности.

Вирус свиного гриппа может. где-нибудь "отсидеться", мутировать и опять напасть на людей.
Симптомы свиного гриппа и обычного совпадают — головная боль, жар, кашель, насморк. Вирусы внешне похожи, как все те, которые погубили почти миллиард человек по всему миру.
Все знают вирусы, которые поражают человека: вирус гриппа, вирус иммунодефицита человека, из самых известных еще вирус оспы, от которого, к счастью, удалось избавиться, вирус полиомиелита — много-много разных вирусов. Полезно понимать, что вирусы — это не изобретение эукариотического мира. До того как появились вирусы, заражающие эукариоты, существовало множество вирусов, которые заражают бактерии. Вирусы бактерий называются бактериофагами или просто фагами и существуют очень давно.
Картинка ровно такая же, как с нашими вирусами. Бактериофаг не сам проникает в бактерию, а впрыскивает туда свою ДНК, переключает все информационные процессы бактериальной клетки на изготовление новых бактериофагов. То есть он отключает синтез собственных белков и заставляет бактерию синтезировать белки фага. Постепенно бактерия превращается в мешочек с вирусными частицами, который затем лопается, бактериофаги выходят наружу, заражают новые бактерии — это довольно эффективный процесс. Ясно, что если бы так было, то бактерий бы не осталось: фаги заразили бы все бактерии, и они бы умерли. Этого не происходит, потому что у бактерий есть множество разнообразных механизмов защиты. Это еще одно проявление войны, которая происходит в микромире, теперь уже между бактериями и бактериофагами. Механизмы защиты есть очень разные и довольно остроумные. Примерно понятно, как они могли выработаться в ходе эволюции: можно наблюдать промежуточные стадии, которые оказались полезными, поэтому сохранились до наших времен.

Можно разрушить вирусную ДНК. Вирус присоединяется к белку на поверхности клетки, опознает таким способом бактерию, впрыскивает туда свою собственную ДНК, а клетка ее тут же разрушает. Для того чтобы разрушить ДНК вируса, надо ее узнать, отличить ДНК вируса от своей собственной ДНК, бактериальной. Это делается разными способами, например при помощи системы рестрикции-модификации, которую мы очень интенсивно используем в генной инженерии.
Второй способ. Есть фаги, которые модифицируют всю ДНК целиком. После этого ДНК такого фага не может узнать вообще никакая клеточная система. Клетки модифицируют свои системы, чтобы, наоборот, узнавать модифицированные буквы и не узнавать немодифицированные. За счет маленьких изменений белков и того, что они узнают, все время происходит гонка вооружений.
Для того чтобы опознать ту бактерию, которую ему надо заразить, фаг связывается с каким-то конкретным белком на поверхности бактерии. Это белок бактериальный, он для чего-то нужен (например, белок, транспортирующий что-то полезное). Но в ситуации, когда много фагов, которые узнают этот рецептор, он становится вредным, потому что это те ворота, через которые проникает фаг. Бактериальная клетка может либо вообще избавиться от такого белка, либо его модифицировать за счет точечных мутаций. Имеется в виду не то, что бактериальная клетка задумалась и решила поменять свой рецептор, чтобы фаги ее не узнавали. Происходят случайные мутации, и те из них, которые препятствуют распознаванию фагом, оказываются полезными в ситуации большой зараженности, и такие бактерии получают эволюционное преимущество.

Наконец, самый красивый и альтруистический пример ― это самоубийство, когда бактерия, которая заражена фагом, не продуцирует новых фаговых частиц, а просто совершает самоубийство, разлагается. Для этого тоже есть специальные молекулярные механизмы, что называется системой токсин-антитоксин. Представьте себе, что у вас есть два белка. Один ядовитый, его в клетке мало, он продуцируется с маленькой интенсивностью, но он долгоживущий, то есть молекул мало, но каждая из них живет долго. Второй белок — антитоксин, он может связаться с токсином и его заингибировать, то есть токсин больше не действует. Молекул антитоксина много, так чтобы свободных молекул токсина не образовалось даже случайно, но они короткоживущие. Молекулы в избытке, они быстро разлагаются, и клетка все время много их делает.
На первом этапе заражения фаг переключает все клеточные механизмы на синтез новых фагов, в частности механизмы синтеза токсина и антитоксина. Клетка перестает продуцировать собственные белки, заканчивается продукция токсина и продукция антитоксина. Что происходит? Токсин долгоживущий, значит, молекулы токсина как были, так и остались, они никуда не делись. Антитоксин разлагается, это происходит быстро, а новые молекулы антитоксина не производятся. Теперь появились свободные молекулы токсина, токсин отравляет клетку, и она умирает, не успев сделать новых фагов.
Почему такой механизм эволюционно мог закрепиться? Как может закрепиться такой механизм самоубийства? Казалось бы, клетке от этого ничего хорошего, она бы в любом случае умерла. Дело в том, что обычно бактериальные клетки не существуют изолированно. Бактериальные клетки живут колониями, и все клетки в колонии идентичны генетически. Метафорически можно рассматривать такую колонию как генетически однородный единый организм. Тогда отдельным клеткам оказывается полезно совершить самоубийство, потому что с точки зрения набора генов они все одинаковы. Если какая-то из клеток умерла, но ценой этого сохранились все остальные, то эволюционно это очень полезно, они все генетически идентичны. Для бактерии как вида неважна судьба отдельных клеток, вид все равно сохранил штамм — набор идентичных бактерий. Можно это сопоставить с обычной иммунной системой людей: наши иммунные клетки погибают в процессе борьбы с заражением, но благодаря этому сохраняется весь организм.
Еще один механизм, по времени открытый самым последним. Он будет очень широко использоваться, в генной инженерии уже используются отдельные компоненты этого механизма. Это очень похоже на человеческий иммунитет, потому что система адаптивная. Система рестрикции-модификации и система токсин-антитоксин работают всегда, но в индивидуальной бактерии адаптации под новые фаги не происходит. Бактерии адаптируются на эволюционных временах, когда за счет точечных мутаций происходит подстройка.

Это действительно удивительная система, она была открыта буквально в последние годы. Она эволюционно очень красивая и оказалась очень полезна в генной инженерии, потому что механизм точного опознавания фрагмента ДНК можно использовать для того, чтобы модифицировать геномы людей, растений, животных — кого угодно. Люди очень много это изучают, в частности в Сколтехе под руководством Константина Северинова, в том числе имея в виду индустриальное применение.

Китайские коронавирус – это биологическое оружие, созданное китайской армией в биологической лаборатории города Ухань. Причиной эпидемии, которая угрожает миру, стала утечка вируса из лаборатории. Ситуация настолько серьезная, что ВОЗ был вынужден объявить международную тревогу в связи с угрозой пандемии.
Сообщается, что в геноме уханьского коронавируса найдены фрагменты от ВИЧ, а это означает, что вирус был создан искусственно. По этой ссылке опубликована расшифровка генома.
Опасный китайский вирус представляет собой генетически модифицированный вирус типа Bat-SARS, которым и манипулировала китайская армия.
Два отдельных компонента генетического секвенирования из ВИЧ-1, вируса, вызывающего СПИД, были добавлены к Bat-SARS-подобному коронавирусу в лаборатории, что позволяет ему заражать легкие человека через рецепторы ACES2, атаковать человека изнутри и разрушать способность организма бороться с инфекцией, уменьшая лейкоциты человека.
Т.о. китайский (или уханьский) вирус на самом деле является военным биологическим оружием.
Эксперты указывают, что в природе не существует способа, чтобы коронавирус летучей мыши мог случайно получить генетические последовательности ВИЧ, не вызывая мутацию вирусной оболочки. Единственный способ, которым вирусная оболочка могла бы получить генетику ВИЧ и при этом оставаться на 100% идентичной образцу (полученному в 2018 году), это если гены ВИЧ были добавлены в лаборатории.
Американские источники сообщают, что первоначальный коронавирус типа Bat-SARS был идентифицирован армией Китая через Институт военной медицины, командование Наньцзяна, в 2018 году. Два года спустя вирус был изменен таким образом, который не может произойти в природе без генетической манипуляции.
По всей видимости утечка нового коронавируса произошла случайно. В результате под угрозу поставлены жизни сотен миллионов людей по всему миру.
Те меры, которые принимают власти Китая по изоляции людей и населенных пунктов лишь подтверждают, что речь идет не о природной вспышке болезни, а о биологическом оружии, об опасности которого очень хорошо осведомлены власти Китая.
В течение первого месяца коммунистический режим в Китае поместил под карантин 56 млн. человек в 19 городах. Это беспрецедентная по масштабам военная операция. При этом к тому времени число умерших, по официальным данным, насчитывало всего 25 человек.
Зачем Китаю блокировать 19 городов и изолировать 56 миллионов человек от, казалось бы, банальной болезни? Дело в том, что власти Китая знают, чем на самом деле заражены люди и что этот вирус распространяется очень быстро, т.к. является боевым биологическим оружием массового поражения.
На сегодня установлено, что заболевание имеет уровень инфицирования 83%. Это означает, что если 100 человек заразились вирусом, то 83 человека заболеют от него. Болезнь распространяется воздушно-капельным путем, через контакты и очень заразная.
Ряд источников утверждают, что вирус может жить вне человека, в воздухе или на поверхности, минимум 5 дней и максимум 28 дней. Так что, если зараженный человек идет в магазин или супермаркет, или в общественный туалет, или в школу, офис, склад, или где угодно, касается продуктов на полках и кладет что-нибудь обратно, чихает или кашляет, его вирус попадает на продукты, на полки в этом магазине или супермаркете, ванной, школе, офисе, на складе и т. д.
И если вы подходите к зараженному месту через несколько минут, часов или даже дней, берете тот же предмет, или даже чувствуете запах в туалете, где побывал зараженный вы заразитесь в 83% случаях.
Более того, утверждается, что этим вирусом можно заразиться через глаза.
Если здоровый человек войдет в помещение, где находился зараженный человек, который нескольким минутами ранее кашлял там или чихал, то микроскопические частички остаются в воздухе какое-то время и не оседают. Таким образом они попадают человеку в глаза. А т.к. как человек постоянно моргает вирус попадает ему в слезный проток.
Тем временем в Китае ситуация ухудшается с каждым днем. В соцсетях распространяются видео, на которых китайские власти заколачивают досками квартиры местных жителей, чтобы они не могли выйти на улицу.
В изолированных городах не хватает еды. Власти пытаются организовать доставку еды с помощью роботов, чтобы избежать любого контакта с людьми, находящимися на карантине. Сообщают, что миллионы людей не могут поесть по нескольку дней. Все это вызывает беспорядки.
Все чаще появляются данные о массовых драках на улицах. Люди подозревают друг друга в том, что они заразные и не желают видеть чужаков в своих районах и дворах.
Появились данные о том, что власти начали сжигать дома и квартиры, в которых обнаруживаются умершие люди. Их сжигают вместе с трупами.
В еще неизолированных городах ситуация также обостряется. Больниц и врачей не хватает. Люди выстраиваются в многокилометровые очереди чтобы попасть в больницу. Происходят стычки за медицинские маски.
На момент публикации данной статьи власти Китая сообщили, что за последние 24 часа (2 февраля 2020 г.) вирусом заразились 2700 человек (из тех, кого проверяли). То есть, каждый час заражются 112 человек. А если учесть, что проверить всех невозможно, то реальные цифры зараженных свидетельствуют о катастрофической ситуации, которая угрожает всему миру.
Читайте также:


