Вирусы не имеют митохондрий
ДНК митохондрий и РНК вирусов могут маскировать эффекты от мутаций, попавших в хромосомные гены – по крайней мере, в дрожжах.
Когда в 2003 году геном человека, наконец, полностью прочитали, многие надеялись, что нас теперь ждёт настоящая лавина медицинских инноваций, основанных на корректировке работы самых разных генов. Действительно, многие болезни случаются от того, что либо сам белок несёт в себе некий дефект, либо организм производит этот белок не там и не в тех количествах, которые требуются для нормальной жизни. Такие дефекты и аномалии часто происходят из-за того, что что-то случилось в ДНК, а раз мы ДНК теперь знаем от и до, значит, знаем, где и что нужно исправить.
Но впоследствии оказалось, что управление активностью генов намного сложнее, чем полагали. Во-первых, в самой ДНК есть участки, которые сильнейшим образом влияют на активность других зон генома, и про многие из таких участков раньше либо вовсе не знали, либо их влияние недооценивали. Например, буквально два месяца назад учёные из международного исследовательского консорциума FANTOM (Functional Annotation of the Mammalian genome) подвели итоги многолетних поисков регуляторных последовательностей в ДНК человека, и цифры, конечно, не могут не впечатлять: промоторных регуляторных элементов оказалось 180 000, а энхансерных регуляторных элементов — 44 000.
Во-вторых, на синтез белка могут влиять разнообразные регуляторные РНК, которых оказалось целое море. В-третьих, основания в ДНК могут быть модифицированы специальными эпигенетическими метками, которые опять же влияют на генетическую активность. Есть и другие механизмы, которые вмешиваются в работу генов, причём исследователи не перестают находить тут что-то новое.
Сначала исследователи решили, что всё дело в некоем РНК-вирусе, который путешествовал по клеткам дрожжей: геном этого вируса, представленный двуцепочечной РНК, вполне мог влиять на работу дрожжевого генома. Но потом генетики задумались, а не могут ли на работу ядерного генома влиять собственные внехромосомные элементы, заключённые в митохондриях?
Митохондрии называют силовыми станциями клетки, в них происходит образование главной энергетической молекулы, АТФ, внутри которой энергия запасена в удобной для употребления форме. При этом у митохондрий есть собственная ДНК со своими генами, и митохондриальный геном довольно сильно отличается от генома ядерного. Это, кстати, послужило одной из главных предпосылок теории о симбиотическом происхождении митохондрий – согласно ей, митохондрии когда-то были самостоятельными бактериями, которые со временем перешли в подчинение предкам эукариот, при этом сильно упростившись.
Чтобы проверить, может ли ДНК митохондрий влиять на ДНК ядра, исследователи поступили следующим образом: они удалили митохондрии из клеток одного дрожжевого штамма и позволили им вступить в половые отношения с клетками другого штамма, у которых все митохондрии были при себе. У дрожжей, как известно, кроме вегетативного размножения почкованием или делением, есть и половое размножение со слиянием гаплоидных клеток, но в эксперименте ядра у слившихся клеток дрожжей не объединялись, оставаясь разделёнными. Затем исследователи заставляли получившуюся двуядерную клетку делиться, но так, чтобы ядра от одного штамма оказывались вместе с митохондриями другого штамма. Понятно, что одним из дрожжевых штаммов был тот, у которого из хромосом вырезали какие-то гены. Ядро такого штамма комбинировали с митохондриями от разных прочих линий дрожжей; кроме того, картину потом ещё и усложнили, добавляя в клетки вышеупомянутый вирус.
Один из главных выводов, который из всего этого следует, состоит в том, что изменения в хромосомах и, например, наличие вируса в клетке могут влиять на жизнь организма не порознь, а вместе, дополняя и усиливая друг друга. При этом исследователи говорят только лишь о влиянии вирусной РНК, то есть жизнедеятельность самого вируса (например, процессы, сопровождающие сборку вирусных частиц и т.д.), тут ни при чём.
Кроме того, дрожжи с удалёнными генами порой росли с той же активностью, что и обычные дрожжи, то есть внехромосомные элементы, ДНК митохондрий и РНК вируса, маскировали негативный эффект от генетической операции. Понятно, что это может иметь непосредственное отношение к тому, как на нас действуют мутации, унаследованные или благоприобретённые – влияние таких мутаций может сильно меняться под влиянием тех же митохондрий или каких-то вирусов, оказавшихся в наших клетках.
Ещё раз подчеркнём, что речь идёт не просто о суммировании эффектов от митохондрий и от хромосом, но о синергетическом влиянии. (Хотя, конечно, эти результаты следует проверить хотя бы на клетках животных.) Всё это ещё сильнее запутывает картину генетической регуляции, но это такая парадоксальная наука, что чем больше в ней запутываешься, тем ближе оказываешься к истине.
Внутреннюю организацию клетки животных и растений можно сравнить с коммуной, где все равны и каждый выполняет одну, очень специфическую роль, создавая сбалансированный ансамбль. И вот только одна структура, митохондрия, может похвастаться множественностью внутриклеточных функций, которые определяют ее уникальность и обособленность, граничащие с некоторой самодостаточностью.
До сих пор идут споры, существуют ли эукариотические (имеющие ядра) клетки без митохондрий. Пока четко доказанных подтверждений тому нет, считается, что ядерных клеток без митохондрий не существует
Эту структуру открыли в середине XIX века, и в течение 150 лет почти все считали, что ее единственная функция — быть энергетической машиной клетки. Грубо говоря, организм получает питательные вещества, которые после определенной деградации доходят до митохондрии и дальше происходит окислительная деградация питательных веществ, сопряженная с запасанием энергии в виде богатой энергией фосфорной связи в молекуле АТФ. Организм повсеместно использует энергию АТФ, расходуя ее на проведение нервного сигнала, мышечное сокращение, образование тепла, синтез нужных клеточных компонентов, уничтожение ненужных веществ и пр. В сутки в организме человека генерируется АТФ, весом равная весу самого человека, и в основном это заслуга митохондрий. До сих пор идут споры, существуют ли эукариотические (имеющие ядра) клетки без митохондрий. Пока четко доказанных подтверждений тому нет, считается, что ядерных клеток без митохондрий не существует.
Постулат доминирующей в клетке энергетической функции митохондрии как-то оставлял в тени уже давно высказанную и всеми поддерживаемую теорию бактериального происхождения митохондрий. В простой трактовке она выглядит так: около 600 млн лет назад в клетку т. н. гетеротрофов внедряется бактерия, которая умеет утилизировать кислород. Есть точка зрения, что появление внутри клетки нового типа бактерий было вызвано постоянным увеличением в атмосфере Земли кислорода, начавшим поступать из мирового океана в атмосферу около 2,4 млрд лет назад. Высокая окислительная способность кислорода представляла опасность для внутриклеточных органических и неорганических элементов, и появляются бактерии, уничтожающие кислород в присутствии ионов водорода с образованием воды. Таким образом внутри клетки содержание кислорода уменьшается, а с ним и уменьшается вероятность нежелательного окисления клеточных компонентов, что, наверно, полезно для клетки.
Однако попадание в ядерную клетку бактерий давало им и ряд преимуществ, в частности, оно дало им эволюционную нишу с ограниченным объемом и окруженную мембраной. Можно было обеспечить больший запас различных веществ, которые можно "складировать" не внутри ограниченного собственного объема, а снаружи, но в пределах своей "собственности", где они не будут разворованы другими организмами. Это соображение подтверждается в условиях, когда клетка вдруг перестает получать кислород и питательные вещества (например, при прекращении кровотока в участок ткани, что происходит при инфарктах и инсультах). Митохондрия в этих условиях уже не может быть энергетической машиной клетки (производить АТФ без кислорода трудно) и превращается в паразита — она начинает поглощать АТФ для того, чтобы обеспечить генерацию разницы мембранных потенциалов на своей мембране и поддержать свои собственные процессы. Для чего это нужно митохондрии — пока не понятно, но полуавтономный статус митохондрии в клетке тут проявляется особенно заметно — подобное поведение в кризисных условиях выглядит довольно эгоистичным. Не для того ли она производит АТФ в количествах, превышающих нужды клетки, чтобы обеспечить себе "подушку безопасности" в условиях кризиса?
Попадание бактерий во внутриклеточную нишу обеспечивало и защиту от внешних врагов (а основные враги для бактерии — вирусы, то есть фаги). При этом было позволено выпускать сигнальные защитные вещества в ограниченный внутриклеточный объем; когда же бактерии существовали в "океане", выпуск таких сигнальных веществ был нерациональным — они немедленного разбавлялись в нем. Жизнь внутриклеточных бактерий в этой нише дала определенные преимущества: бактерии производят энергию и организуют в своей мембране белок, который выбрасывает в цитоплазму клетки синтезированный АТФ, чем клетка и пользуется. В итоге вроде бы наступает баланс: клетка дает митохондрии питательные субстраты, митохондрия дает клетке энергию,— что укрепляет теорию симбиотического взаимоотношения бактерий (они уже становятся митохондриями) с остальными частями клетки. Основными аргументами, подкрепляющими бактериальное происхождение митохондрий, является большое сходство химического состава бактерий и митохондрий и сходство элементов биоэнергетики. Одним из родоначальников эндосимбиотической теории происхождения митохондрий можно считать русского ботаника Константина Мережковского, который в конце XIX — начале ХХ века предположил, что хлоропласты (структуры растительных клеток, отвечающие за фотосинтез) имеют бактериальное происхождение. Позже аналогичное предположение было сделано и для митохондрий.
Из сказанного видно, что понятие симбиоза и некоторого "эгоистического" поведения митохондрий довольно размыто. Да и идеалистическая картина симбиоза была "омрачена" в самом конце ХХ века открытием, что митохондрии, выпуская сигнальные молекулы, отдающие приказ на уничтожение клетки, отвечают за ее гибель. То есть вроде бы все по пословице "сколько волка ни корми. ". Однако надо взглянуть на ситуацию с другой стороны. Нужна ли клеточная смерть организму? Да, но не для всех клеток. Это обязательный процесс для тех клеток, которые постоянно делятся — иначе будет разрастание ткани, которое может быть нежелательным. Принципиально это и для предотвращения и лечения различного опухолеобразования. А вот для тех клеток, которые не очень умеют делиться, например, для нейронов или кардиомиоцитов, смерть не полезна. Если же рассматривать этот вопрос с позиции самих митохондрий, это выглядит как почти неприкрытый шантаж: или ты обеспечиваешь меня всем, что я хочу, или я убью тебя. С позиции же организма, все хорошо, когда митохондрия убивает неправильную клетку, и плохо, если убивает хорошую и нужную.
Основными аргументами, подкрепляющими бактериальное происхождение митохондрий, является большое сходство химического состава бактерий и митохондрий и сходство элементов биоэнергетики
Приведенные выше рассуждения — это явный конфликт эволюционной стратегии и человеческой логики, пытающейся оценить ситуацию с позиции субъекта, внутри которого живут существа, способные из друзей превратиться во врагов. Этот конфликт не мешает исследователям понимать, что митохондрия, хоть она и "помнит", что была бактерией, активно участвует в функционировании клетки; важная роль митохондрий объясняет необходимость предоставления им привилегий. В определенных условиях они превращаются в источник наследуемых или приобретенных заболеваний — в частности, тех, которыми занимается митохондриальная медицина. Таких заболеваний — очень тяжелых и почти не поддающихся лечению — больше сотни. Да и помимо них есть великое множество болезней, предположительно обусловленных неправильным функционированием митохондрий. Существуют теории митохондриального происхождения рака, болезни Паркинсона, Альцгеймера и других — с весьма достойным научным подтверждением.
Сегодня выяснилось, что большинство болезней сопровождается сбоем в работе внутриклеточной машины проверки качества митохондрий, своеобразного ОТК, отбраковывающего плохие митохондрии и отправляющего их на внутриклеточное переваривание (митофагию). Сбой возникает, например, при старении организма, и ОТК пропускает неправильные митохондрии. В результате в клетке начинают сосуществовать хорошие и плохие митохондрии. Когда же доля плохих превышает некоторый порог, наступает т. н. "фенотипическое проявление" болезни, которая до сих пор носила невидимый, латентный характер.
Можно сделать два вывода. Во-первых, без митохондрий ядерные клетки существовать не могут. Во-вторых, чтобы защитить клетку от поражения (чем бы оно ни было вызвано: химией, физикой или просто временем), надо "договориться" с митохондриями, то есть обеспечить им "достойное" существование. Это означает не только постоянную подпитку их активности за счет доставки питательных субстратов и кислорода, но и предоставление им своеобразной медицинской страховки, которая при необходимости обеспечит восстановление их структуры и функций и/или правильную утилизацию поврежденных митохондрий. Отсутствие утилизации поврежденных митохондриальных структур может привести к "заражению" здоровых структур, что непременно повлечет за собой заболевание.
Сейчас трансплантация органов стала вполне рутинной процедурой, хотя все еще сложной и дорогостоящей. Развивается и клеточная терапия, то есть пересадка стволовых клеток. А вот о возможности пересадки здоровых митохондрий говорить только начинают. Проблем много, но ключевая роль митохондрий в жизнедеятельности клетки стоит того, чтобы их решить. Часто достаточно вылечить митохондрии — и вылечится клетка. Недавно для лечения последствий инсульта головного мозга оказалось достаточным обеспечить должное функционирование митохондрий почек. То есть налицо "разговоры" (по-английски это звучит более научно — cross-talk ) между органами, и почка со своими митохондриями помогает восстановлению головного мозга.
На каком языке "общаются" органы, еще предстоит выяснить,— пока предполагают химический язык общения. Хорошая и здоровая почка со своими здоровыми митохондриями вырабатывает и посылает в кровь эритропоэтин (тот самый, приемом которого увлекались спортсмены и который не только стимулирует выработку эритроцитов, но и мобилизует общий метаболизм, что повышает выносливость). Эритропоэтин обладает сильными нейрозащитными свойствами. Стоит повредить почку, скажем, неумеренным приемом антибиотиков (антибиотики убивают и митохондрии, потому что они — бывшие бактерии), и последствия инсульта головного мозга становятся более драматическими. Так на базе фундаментальных открытий начинает просматриваться стратегия лечения болезней.
Есть великое множество болезней, предположительно обусловленных неправильным функционированием митохондрий
Возьмем, к примеру, сепсис — бактериальную инфекцию, одну из ведущих причин человеческой смертности. Сейчас уже можно — правда, пока шепотом — говорить и о "митохондриальном сепсисе", когда в кровь попадают компоненты митохондрий. Это не менее опасно, чем бактериальный сепсис, так как приводит к гиперактивации иммунного ответа (так называемый синдром системного воспаления, SIRS ) и возможной гибели организма.
Как уже было упомянуто, естественными врагами бактерий являются вирусы. Это также верно и для митохондрий. Недавно открытая бактериальная система защиты от вирусов CRISPR ( clustered regularly interspaced short palindromic repeats ), имеющая все признаки элементарно организованной иммунной системы, заставила задуматься: нет ли иммунной системы у митохондрий? У бактерий эта иммунная система устроена следующим образом: в бактериальном геноме (структурно очень похожем на митохондриальный) располагаются своего рода библиотеки, или антивирусные базы данных — куски генов тех вирусов, с которыми эта бактерия когда-либо встречалась. При считывании информации с этих участков синтезируются так называемые малые РНК. Эти РНК связываются с внедрившимися в бактерию вирусными нуклеиновыми кислотами, а затем такой комплекс расщепляется внутрибактериальными ферментами с нейтрализацией вируса. В чистом виде подобных структур в митохондриальном геноме обнаружено не было, кроме одного-единственного случая, описанного еще на заре исследования CRISPR-системы. Однако мы обнаружили отдельные случаи включения вирусных последовательностей в митохондриальный геном (вирусов гепатита B и гриппа), хотя и довольно редкие для того, чтобы говорить о системе. С другой стороны, наибольшее количество различных структур в геноме мы обнаружили в митохондриях растений, чей геном в разы больше митохондриального генома животных. Это особенно любопытно, учитывая, что растения в целом гораздо больше полагаются на противовирусную защиту на основе интерферирующих РНК, чем животные, поскольку не обладают особыми иммунными клетками, свободно перемещающимися по организму в кровотоке. Кроме того, не стоит забывать, что митохондрии делегируют значительную часть функций клетке, включая передачу части своего генетического материала в клеточное ядро, оставляя себе только "контрольный пакет акций", обеспечивающий их контроль над ключевыми функциями. Вполне возможно, что подобные клеточные библиотеки также были переданы в ядро — явление передачи малых РНК из цитоплазмы внутрь митохондрий известно. А значит, среди них могут быть и иммунные РНК. С другой стороны, возможно, что митохондрии полностью передали функции защиты клетке, довольствуясь возможностью убить клетку, которая их плохо защищает.
Приняв тезис "митохондрии помнят, что они были бактериями", мы можем поменять многое в стратегии базового научного мышления и практической медицинской деятельности, так или иначе связанных с митохондриями. А учитывая количество функций, выполняемых митохондриями в клетке, это большая часть всех биомедицинских задач: от рака до нейродегенеративных заболеваний.
Проблем много, но ключевая роль митохондрий в жизнедеятельности клетки стоит того, чтобы их решить. Часто достаточно вылечить митохондрии — и вылечится клетка
- 542
- 0,4
- 4
- 3



Спонсором приза зрительских симпатий выступила компания BioVitrum.
Истина — не догма, но танец.
Бхагаван Шри Раджниш
Имена американца Говарда Тейлора Риккетса и чеха Станислава Провачека двумя трагическими страничками вписаны в ежедневник мировой микробиологии. Оба исследователя погибли от одного и того же тяжелого заболевания — сыпного тифа, — пытаясь получить вакцину от его возбудителя, названного впоследствии их именами [1] — Rickettsia prowazekii, риккетсия Провачека.
Но знали ли Риккетс и Провачек, умирая, что заразившая их опасная бактерия — родственник тех митохондрий, которые до последнего снабжали их клетки энергией? Вполне возможно, для многих читателей это и сейчас окажется сюрпризом. Однако это так. Не знали они и того, что степень такого родства более чем век спустя станет предметом ожесточенных споров между биологами.
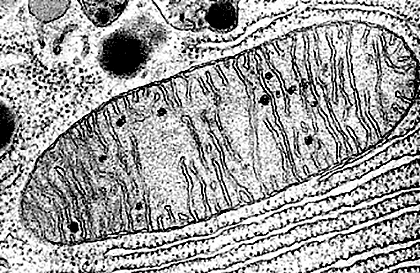
Рисунок 1. Митохондрия под электронным микроскопом. Можно разглядеть обе мембраны и хорошо изображенные складки внутренней мембраны — кристы.
Митохондрии — это органеллы эукариотических клеток, снабжающие их энергией за счет кислородного дыхания. Под электронным микроскопом митохондрия при первом беглом взгляде напоминает нарезной батон (рис. 1).
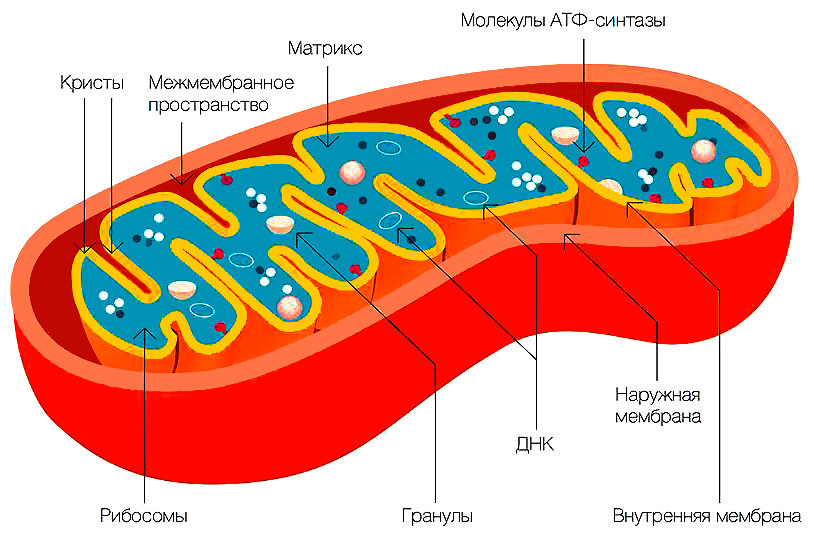
Рисунок 2. Строение митохондрии
А пока ацетат прокручивается в ненавистном многим студентам цикле Кребса (рис. 5), как в еще более чудовищной окислительной мясорубке, где полностью разбирается на протоны, электроны и углекислый газ. Вся эта орава протонов и электронов также загрузится на молекулярных переносчиков — нашего знакомого НАД и его близкого коллегу ФАД (флавинадениндинуклеотид).
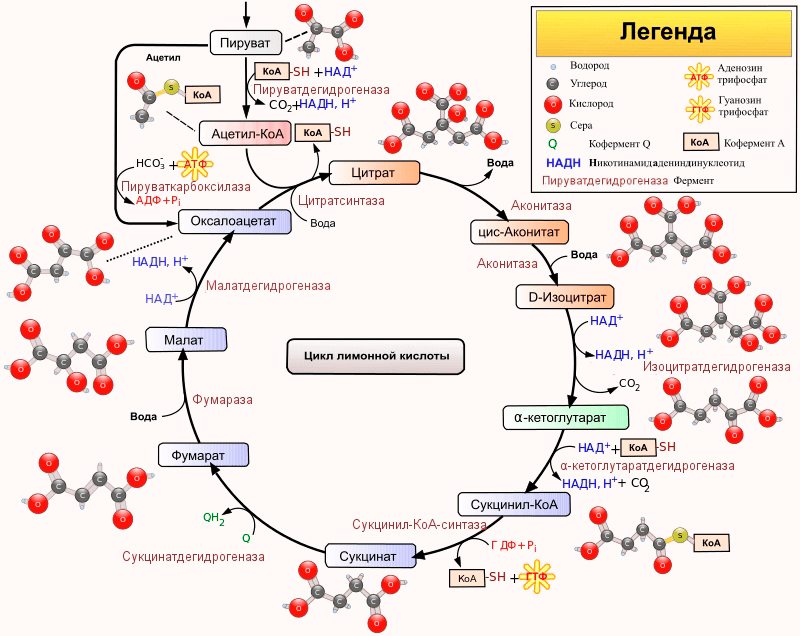
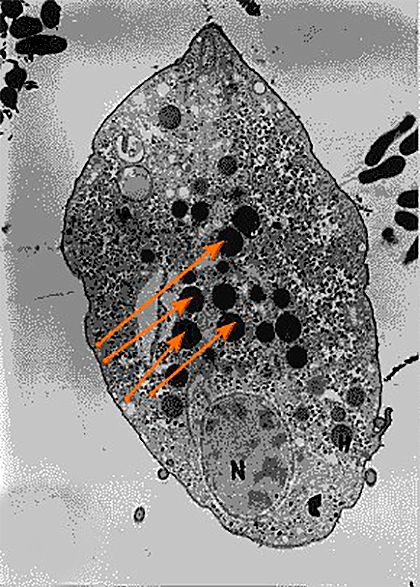
Рисунок 6. Клетка трихомонады с гидрогеносомами (обозначены оранжевыми стрелками)
Такого фермента нет в клетках эукариот, в том числе у людей. Но, как мы уже упоминали, гидрогеносомы с этим ферментом есть у многих патогенных простейших. Именно на этом основано действие таких лекарственных препаратов, как метронидазол, орнидазол, тинидазол, которыми лечат трихомониаз и некоторые другие протозойные инфекции. В клетке паразита нитрогруппа препарата восстанавливается, получая электроны от восстановленного ферредоксина (напоминаем, что как раз его продуцирует фермент гидрогеносом пируват:ферредоксин-оксидоредуктаза). В результате получается химически очень активное соединение, повреждающее ДНК паразита [5].
И в течение как минимум 20 лет происхождение гидрогеносом было точно не установлено, и с митохондриями их не связывали. Хотя кое-какие подозрения уже были — обычными биохимическими методами у анаэробных простейших обнаруживали ферменты, характерные для митохондрий (!) и содержащиеся где-то внутри клетки в мембранных органеллах. Это следовало из того, что такие ферменты после растирания клеток в пюре и центрифугирования попадали в так называемую микросомальную фракцию. Откуда они там взялись? Потом, по мере развития технологий секвенирования и анализа генов, выяснилось, что в геноме у некоторых простейших, не имеющих митохондрий, откуда-то взялись гены явно митохондриального происхождения [7].
Сейчас стало почти ясно, что гидрогеносомы произошли от митохондрий, утративших свой маленький геном (он весь перешел в ядро) и дыхательную функцию [5], [7]. Зачем тебе митохондрии, если тебе не надо дышать? По идее, незачем, но хорошая штука, жалко. Переделаем их немного — и пусть вырабатывают водород.
Переделать митохондрии в гидрогеносомы — хорошая идея, так как для реакций окисления пировиноградной кислоты с образованием водорода нужны железосерные кластеры, про которые мы уже говорили при обсуждении ферредоксина. Стоп, а что вообще за кластеры такие?
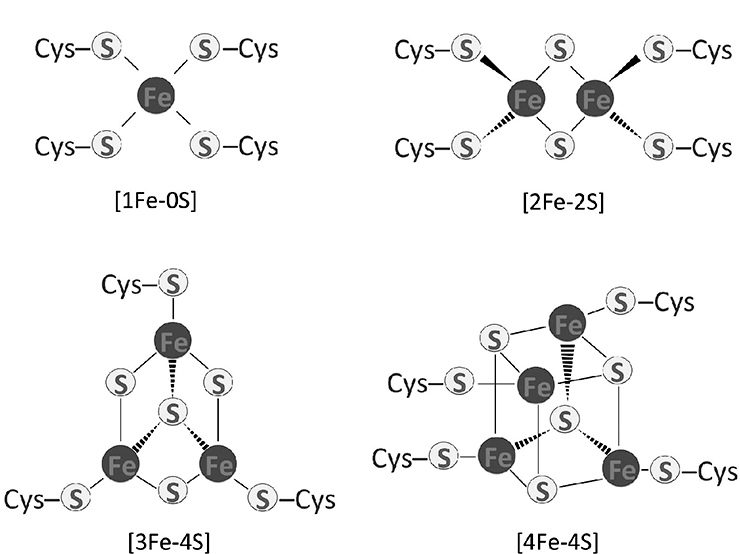
Рисунок 7а. Формулы различных типов железосерных кластеров
[26], рисунок с изменениями
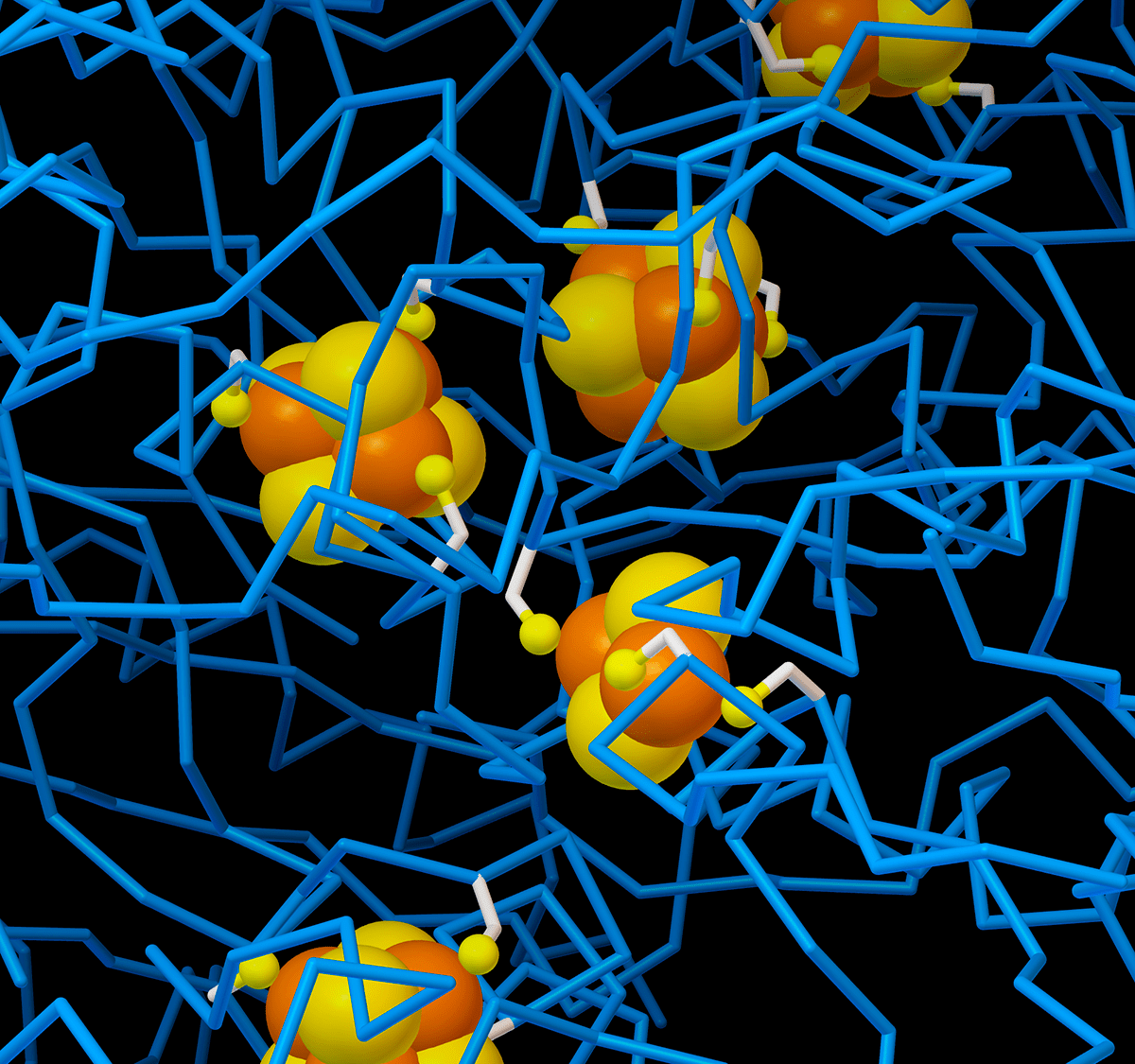
Рисунок 7б. Трехмерная модель железосерных кластеров в комплексе I дыхательной цепи бактерии Thermus thermofilus (сера на рисунке желтая, железо — оранжевое, весь белок — голубой). Здесь представлены два типа кластеров: 2Fe—2S и 4Fe—4S.
Как мы уже говорили, железосерный кластер довольно легко окисляется и восстанавливается, что делает его отличным переносчиком электронов. и одновременно ахиллесовой пятой белка и клетки! Из-за ранимости в окислительно-восстановительных реакциях белки с железосерными кластерами не могут синтезироваться в присутствии кислорода. На заре эволюции об этом можно было не задумываться — и так в атмосфере кислорода не было. Но сейчас-то есть! А железосерные белки нужны. И где же синтезировать их в аэробной, то есть дышащей кислородом, клетке? Элементарно, Ватсон! В матриксе митохондрий. Как бы это странно не звучало.
Перечисленные выше факты свидетельствуют об одном: митохондрии, пусть иногда в редуцированном виде, по всей видимости, характерны для всех эукариот. И — самое главное — были у их общего предка. Если кто-то впоследствии и отказался от дыхания с помощью митохондрий, то это произошло уже впоследствии. Первый эукариот был с митохондриями. И, скорее всего, они появились в истории Земли всего единожды. Но как?
Это напоминает экспертизу на установление отцовства. Раньше приходилось ориентироваться на группу крови, зная особенности ее наследования, что не исключало ошибки (кандидаты на отцовство могут оказаться вообще с одинаковыми группами крови и генами этих групп). Сейчас экспертиза проводится на основе сравнения ДНК, что гораздо точнее.
Кстати, те же расчеты подтверждают монофилетичность митохондрий, то есть происхождение их от общего предка [5]. Это еще раз свидетельствует о том, что приобретение митохондрий было однократным событием, раз и навсегда.
А что, если само по себе поглощение митохондрий толкнуло жизнь на новую ступеньку? Если оно само по себе обеспечило эукариот всем, включая ядро?
А что, если тот, кто заглотил, тоже был прокариотом? То есть археоном или бактерией?
Филум — это крупная таксономическая группа у прокариот и одноклеточных эукариот, в первом грубом приближении соответствует типу у животных (напоминаем, что мы с вами относимся к типу хордовых). То есть, говоря о филумах, мы на самом деле имеем в виду огромные эволюционные расстояния. В исследованиях такого масштаба приходится мыслить категориями астрономического размера.
Но в 2015 году ситуация изменилась — вышла статья в журнале Nature [16], где группа исследователей представила результаты обработки геномов, найденных в донном осадке .
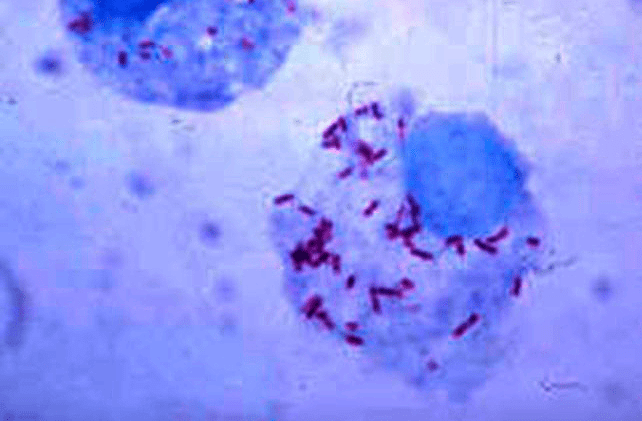
Рисунок 8. Возбудитель сыпного тифа — риккетсия Провачека — в клетке
Эрлихии паразитируют не только внутри животных клеток, но и в трематодах, и не прочь забраться даже внутрь некоторых амеб. А вольбахии живут внутри клеток насекомых (но не прочь и в круглых червях поквартировать), весьма выгодно используя их в своих интересах [20], даже меняя хозяину пол. Чем не кандидат на роль заглоченного предка митохондрий? Может, он и не пострадавший вовсе, а прирученный незаконный пришелец, перешедший от воровства АТФ к работе на хозяина?
И на самом деле во многих исследованиях, где исследователи сравнивают гены и белки в поисках ближайших родственников и общих предков, бактерии порядка Rickettsiales оказываются ближайшими родственниками митохондрий [20]. Больше того, в некоторых исследованиях митохондрии оказываются вообще одомашненной разновидностью Rickettsiales, то есть одной из веток этого порядка [20]. Казалось бы, все сходится?
Но не спешите радоваться. Дело в том, что не всё так просто в биоинформатике.
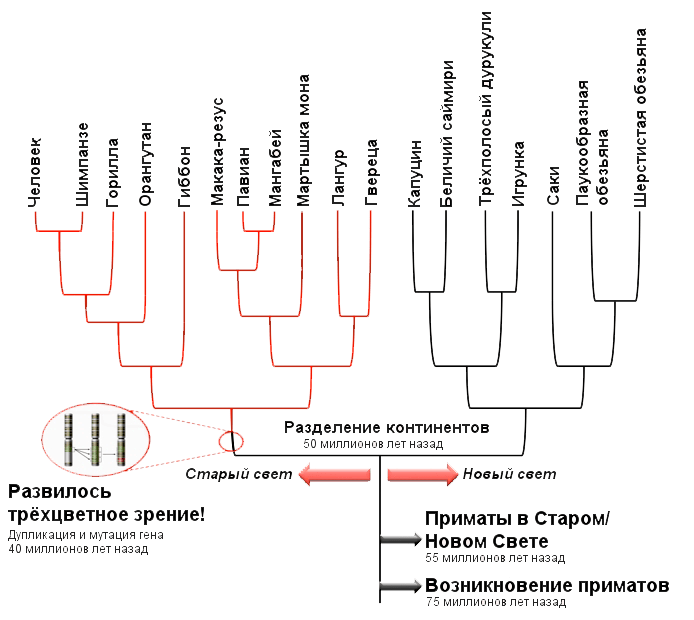
Рисунок 9а. Пример филогенетического дерева для опсинов (зрительных белков) приматов. Здесь дерево дано уже с цветовыми выделениями и пометками.
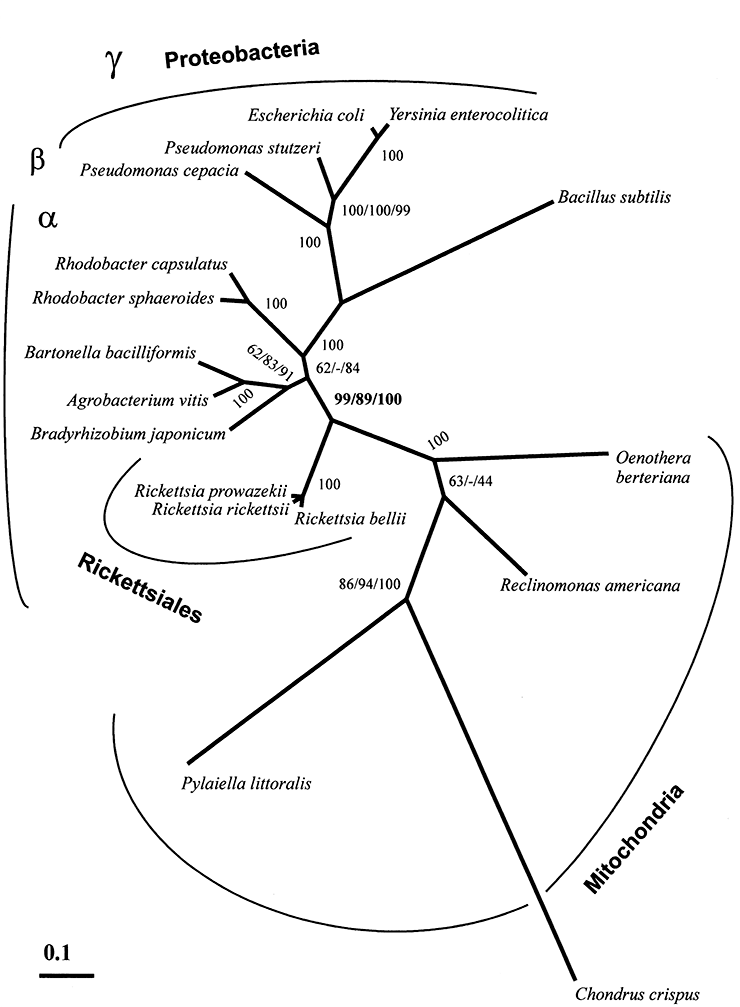
Рисунок 9б. Одно из филогенетических деревьев, реконструируемых для митохондрий и создающих впечатление их близкого родства с риккетсиями
Но если не риккетсии и вольбахии, то кто же? Чтобы все же ответить на этот вопрос, авторы разных исследований рассматривали его с разных углов, применяя замысловатый математический аппарат для точных филогенетических вычислений.
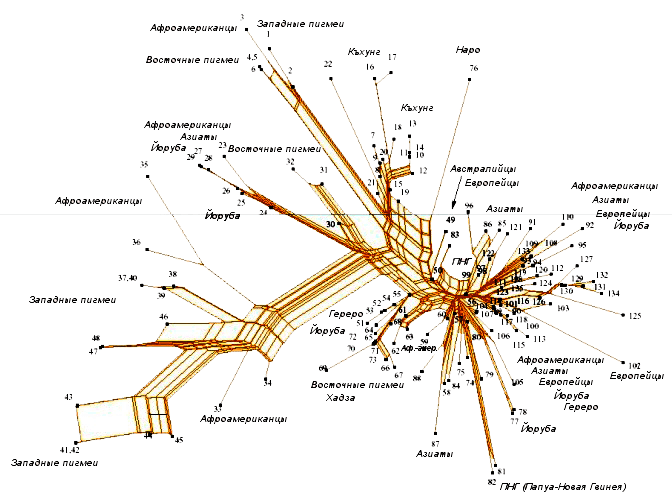
Рисунок 10. Пример филогенетической сети для митохондриальной (опять митохондрии!) ДНК различных популяций людей [27]. Предлагаю сравнить общий вид с филогенетическими деревьями с рисунка 9. Правда, менее ясно? Но более информативно.
Рисунок 11. Сетевые эволюционные модели для митохондриальных АТФ-синтаз, выстроенные бразильскими исследователями. Куда запутаннее деревьев, зато более точно.
В результате — никаких намеков на родство с риккетсиями и им подобными! Бразильские ученые обнаружили, что филогенетически митохондрии ближе всего к свободноживущим видам: фотосинтезирущим пурпурным бактериям семейства Rhodospirillaceae, бактериям семейства Rhodobacterales и ризобиям, образующим симбиоз с растениями и помогающим им усваивать азот [24]. Более того, авторы сообщают, что по результатам их анализа митохондрии оказались близкородственны всем подряд альфа-протеобактериям, кроме риккетсий [24]! Неожиданно. И как-то непонятно, хотя заставляет задуматься.
Благодарности
Автор выражает благодарность студентке лечебного факультета Тверского государственного медицинского университета Виктории Исхаковой за помощь в адаптации рисунков.
Ученые из Австралии обнаружили бактерию, которая, возможно, является предком современных митохондрий — клеточных органелл, снабжающих нас энергией. Эта бактерия была названа Midichloria mitochondrii - в честь таинственных мидихлорианов, дарующих силу джедаям из "Звездных войн". Данная находка еще раз подтвердила справедливость теории симбиогенеза.

Напомню, что, согласно теории симбиогенеза, часть органелл эукариотической (то есть имеющей ядро) клетки, такие, например, как митохондрии (обеспечивающие последние стадии процесса дыхания), пластиды (обеспечивающие фотосинтез) и, возможно, жгутики и реснички (обеспечивающие движение), когда-то были независимыми прокариотическими (то есть лишенными ядра) организмами. Потом же, где-то примерно два миллиарда лет тому назад, они вступили в симбиоз с только-только появившимися эукариотами.
Именно в таком виде эта гипотеза впервые высказана отечественным биологом К. С. Мережковским в 1909 году и затем обоснована А. С. Фаминцыным (тем самым ученым, который доказал, что лишайники являются "продуктом" симбиоза гриба и водоросли). В дальнейшем эта теория была забыта, и ее "второе рождение" произошло лишь в 60-х годах прошлого столетия — концепцию "извлекла на свет", дополнила и систематизировала американская исследовательница Линн Маргулис.
Все те, кто занимался разработкой данной гипотезы, представляли себе путь симбиоза примерно так: большая и хищная эукариотическая клетка (впрочем, есть версия, что это был крупный и прожорливый прокариот) время от времени пожирала прокариот. Большая часть из них благополучно переваривалась, но некоторые оставались в целости и сохранности. Постепенно они поняли, что жить в "чреве кита" не так-то и плохо — и безопаснее, и пища есть. А эукариотические "обжоры" также осознали выгоду своего положения — новые жильцы умели использовать кислород для более эффективной схемы дыхания, а также свет для получения энергии синтеза органических веществ.
В итоге с бывшей "пищей" был заключен своеобразный "арендный договор": безопасность и питание в обмен на работу на благо всей клетки. С тех пор митохондрии и пластиды живут внутри эукариотических клеток и, что самое приятное, квартиранты и хозяева друг на друга не жалуются — наоборот, очень довольны сотрудничеством. Что касается жгутиков, то с ними происходила похожая схема, правда, их прокариотических предков никто не глотал. Считается, что они просто "пристроились" на мембрану эукариотической клетки, а хозяин, оценив, что те помогают ему двигаться, не стал их прогонять.
Правда, доказать симбиогенез в случае жгутиков достаточно не просто. Конечно, в природе существует такой забавный жгутиконосец, как Mixotricha paradoxa, который имеет на своей мембране более 250 тысяч бактерий Treponema spirochetes, прикрепленных к поверхности своей клетки, и обеспечивающих движение хозяина. Тем не менее, это всего лишь доказывает возможность симбиоза, но не его факт. Дело в том, что строение жгутиков и их отношения с другими органеллами не дают повода заподозрить их в том, что когда-то они были самостоятельными организмами.
А вот с пластидами и митохондриями здесь куда проще. Во-первых, у них имеется двойная мембрана. Это можно трактовать как свидетельство того, что когда-то они были пойманы эукариотической клеткой. В этом случае внешняя мембрана является фагоцитозным пузырьком, в который любой одноклеточный охотник перед съедением заключает своих жертв, а внутренняя — их собственная мембрана. Во-вторых, у них есть собственная ДНК, весьма похожая на бактериальную, а не на эукариотическую, а также собственные рибосомы для синтеза белка (тоже бактериального типа). В-третьих, они могут самостоятельно размножаться делением.
Кроме того, имеются и косвенные доказательства (то есть доказательства того, что это в принципе возможно). Так, например, амебы рода Pelomyxa, обитающие в болотах, не содержат митохондрий и образуют симбиоз с бактериями, перерабатывающими метан. Вышеупомянутый Mixotrichaparadoxa тоже не имеет митохондрий — их функции в его организме выполняют сферические аэробные бактерии (относящиеся, кстати, к четырем различным видам). А одноклеточная жгутиковая водоросль Cyanophora paradoxa вместо нормальных пластид содержит цианеллы — органоиды, напоминающие типичные хлоропласты красных водорослей, но отличающиеся от них наличием тонкой клеточной стенки, содержащей пептидогликан (это вещество обычно в клеточных стенках фотосинтезирующих цианобактерий).
Итак, как видите, доказательств хватает. Правда, есть и спорные моменты — например, тот факт, что многие важные белки митохондрий и хлоропластов кодируются ядерными генами, синтезируются на рибосомах цитоплазмы и только потом доставляются аж сквозь две мембраны в органеллы. Более того, в их геномах нет соответствующих генов для их синтеза. Однако этому есть объяснение — не исключено, что эти гены в процессе эволюции симбиоза были просто "импортированы" в ДНК хозяина-эукариота (бактерии ведь часто встраивают свои гены в другие организмы). И сделано это было для того, чтобы обеспечить этим очень важным участкам ДНК лучшую сохранность.
Другим "затруднением" этой теории является то, что до сих пор не найден организмы, максимально похожие на предков митохондрий и пластид. Однако, похоже, недавно и эту сложность удалось преодолеть. В 2004 году Натан Лоу и его коллеги из Сиднейского университета (Австралия) открыли бактерию, чрезвычайно похожую на митохондрий. Это существо с позволения Джорджа Лукаса назвали Midichloria mitochondrii - в честь таинственных симбиотических микроорганизмов мидихлорианов, дарующий Силу джедаям из "Звездных войн".
Выяснилось, что эти бактерии относятся к группе риккетсий (Rickettsiae) — внутриклеточных паразитов, к которым относятся возбудители многих болезней (например, сыпного тифа и лихорадки скалистых гор). Так же поступают и M. Mitochondrii, однако у них есть еще одна удивительная особенность — они, проникая в клетку, не остаются в цитоплазме, а забираются прямо… в митохондрии (видимо, для того, что бы проведать потомков).
Изучив геном "мидихлорианов", исследователи увидели, что эти организмы располагают полным набором генов для создания бактериальных жгутиков. Это говорит о том, что их предки, видимо, имели свободноживущую подвижную стадию жизненного цикла, которая находила клетки хозяев и проникала в них (ведь самому внутриклеточному паразиту жгутик уже не нужен). Кроме того, ученые нашли у M. mitochondrii гены ферментов, которые обеспечивают существование бактерий в условиях недостатка кислорода. Значит, их предки обитали в среде, весьма бедной этим необходимым для многих живых существ элементом.
Исходя из этого, исследователи предложили альтернативную историю превращения бактерий в митохондрии. По их мнению, предки нынешних "клеточных электростанций" были активно двигающимися паразитами, которые сами искали хозяев, то есть древних эукариот. А специальные ферменты помогали им переносить недостаток кислорода в тех местах, где они жили. Какое-то время эукариоты пытались защищаться от риккетсий, ну, а потом видимо, решили, что выгоднее заключить с ними "сделку", что и произошло. В итоге через миллионы лет паразиты и хозяева так привыкли друг к другу, что уже не смогли существовать порознь.
Что же, версия вполне правдоподобная. Кроме того, она объясняет еще один спорный момент теории симбиогенеза — отсутствие у митохондрий любых следов клеточной стенки. Но если они произошли от риккетсий, то ее просто не было изначально, поскольку у данных бактерий клеточная стенка отсутствует. Что касается возможности превращения паразитизма в симбиоз, то в природе такое случается часто — вспомнить хотя бы нашу кишечную флору, многие обитатели которой пришли в человеческий организм как паразиты, но со временем превратились в симбионтов…
Читайте самое интересное в рубрике "Наука и техника"
Читайте также:


