Вирусы могут участвовать в злокачественном
16 февраля 1970 года скончался человек, который доказал, что причиной рака могут быть вирусы — американский патолог Фрэнсис Пейтон Роус. В 1969 году получил за свои исследования в области рака и за открытие онкогенных вирусов Нобелевскую премию, которую разделил с Чарльзом Хаггинсом.
К вирусной теории рака за последние 100 с лишним лет несколько раз менялось отношение. Однако сегодня известно точно: некоторые вирусы вызывают рак, и у них даже есть для этого все необходимые механизмы. MedAboutMe выяснял, как распространенные вирусы становятся причиной рака.
Вирусная теория рака

О вирусах наука узнала в 1890-х годах. Открытие вирусов — это тот замечательный случай в науке, когда все факты указывают на существование объекта, но получить этот объект, увидеть его невозможно — из-за несовершенства технологий. Самые лучшие фильтры, с помощью которых ученые уверенно выделяли бактерий, пропускали более мелкие по размеру вирусы.
В 1903 году французский ученый А. Боррель первым предположил, что вирусы могут быть причинами раковых опухолей. Через несколько лет исследователи О. Банг и В. Эллерман пришли к выводу, что лейкоз у кур — результат вирусной инфекции.
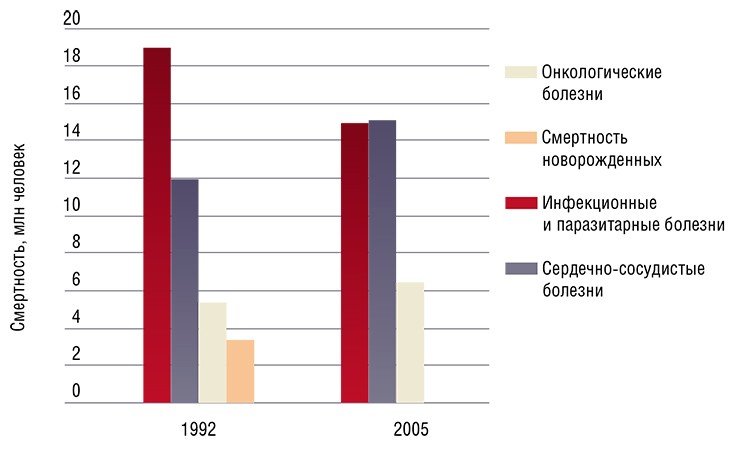
На сегодняшний день известно не так уж много вирусов, которые приводят к развитию злокачественных опухолей — всего 15% случаев рака у человека имеют вирусную природу, у животных этот показатель существенно выше.
Как вирус приводит к раку?

Известно, что вирус использует геном и ресурсы клетки, чтобы синтезировать компоненты, необходимые ему для сборки новых вирусных частиц. При этом возможна реализация одной из двух стратегий. Если при этом происходит разрушение клетки — мы наблюдаем инфекционный процесс, распространение вируса по организму. Если же геном вируса определенным образом интегрируется с геномом клетки-хозяина, последняя перестает подчиняться системам, регулирующим ее рост и размножение. Как следствие, развивается злокачественная опухоль, растущая по своим законам.
Немалая часть онковирусов — это ретровирусы. Их геном представляет собой одноцепочечную РНК. Когда РНК вируса проникает в клетку, она становится матрицей для двухцепочечной ДНК, которая, в свою очередь, и будет встраиваться в геном клетки-хозяина.
Некоторые из онковирусов имеют в геноме онкогены, контролирующие процесс трансформации клетки с измененным геномом из обычной в злокачественную. Другие онковирусы обладают генами, которые активируют нужные участки генома клетки-хозяина, задействованные в процессах клеточного деления и дифференциации.
Онкогенные вирусы и болезни
Все заболевания, вызываемые онковирусами, отличает характерная черта: с момента заражения до появления первых симптомов может пройти 10-40 лет, то есть эти болезни имеют продолжительный латентный период.
Какие же вирусы могут стать причиной развития онкологических болезней у человека?
Вирус Т-клеточного лейкоза взрослых (ATLV), или Т-лимфотропный вирус человека (HTLV), вызывает заболевание, которое встречается на паре островов Японского моря и у представителей негритянской расы в некоторых странах Карибского бассейна. Наблюдения показали, что даже если пациенты с этой разновидностью лейкоза встречаются в других странах мира, выявляется их связь с указанными регионами.
Следует отметить, что раком заболевает только 5% инфицированных людей, остальные являются носителями вируса. В геноме этого ретровируса имеется 2 копии одноцепочечных РНК. В организме жертвы на их основе синтезируется ДНК, которая интегрируется в геном клетки. Основу опухоли составляют CD4-лимфоциты.
Эта болезнь проявляется после 50 лет — отсюда и уточнение в названии. Для нее характерны увеличение печени и селезенки, лимфатических узлов, поражения кожи, разрушение костной ткани.
Оставьте свой email, чтобы всегда получать важную информацию и сервисы для сохранения вашего здоровья
Конспирологическими версиями коронавирус начал обрастать с первых дней своего появления на свет. Covid-19 заявил о себе в Ухани, а там как раз располагается Уханьский институт вирусологии, где в 2015 году была оборудована первая в материковом Китае лаборатория четвертого - самого высокого уровня биобезопасности (BSL-4). Пазл, как говориться, сложился. Поначалу конспирологи заботливо взращивали версию о том, что коронавирус избирательно поражает представителей монголоидной расы (непонятно зачем нужно было выводить такой вирус китайским вирусологам), но теперь мы на примере России и других стран знаем, что это неправда. Другая популярная теория утверждала, что Covid-19 это бактериологическое оружие. Но затем энтузиасты к этой версии охладели: кому нужно оружие, которое практически безопасно для молодых людей призывного возраста, а угрожает представителям возрастной категории 65+?
Сторонники теории заговора сосредоточились на версии о том, что SARS-CoV-2 (это название вируса, а Civid19 - болезнь, которую вирус вызывает) случайно “сбежал” из лаборатории во время научных экспериментов. Тем более, что вскоре конспирологи получили возможность опереться на научную основу.
В 2015 году в журнале Nature Medicine вышла статья об успешном эксперименте по созданию искусственного коронавируса, который способен поражать легкие человека и практически не лечится. В исследовании участвовали специалисты Университета Северной Каролины ( США ), Института микробиологии Цюриха ( Швейцария ) и Уханьского института вирусологии (Китай). Сторонники теории заговора восприняли эту публикацию, как камин-аут: ученые сами признались, что сконструировали вирус-химеру, который четыре года спустя вырвался на свободу и терроризирует все человечество!
Искусственный вирус генетически далек от коронавируса, который нас заражает
Подробный разбор этой гипотезы на своей странице в “Фейсбуке” и YouTube-канале провел известный популяризатор научного знания, кандидат биологических наук, старший научный сотрудник сектора молекулярной эволюции Института проблем передачи информации РАН Александр Панчин. К нему мы и обратились за комментарием.
- Коронавирус SARS-CoV-2, который вызвал сегодняшнюю пандемию, не может быть “сбежавшим” из Уханьской лаборатории искусственным вирусом сконструированным в 2015 году, - объясняет Александр Панчин. - Это легко доказать, сравнив геномы того и другого вируса. В статье 2015 года подробно описывается, как ученые делали свой вирус. В качестве основы исследователи взяли штамм SARS-CoV MA15 (в природе существует множество разновидностей коронавируса - Ред) и внесли туда ген, который кодирует шиповидный белок другого коронавируса летучей мыши - SHC014-Cov. Шиповидный белок помогает вирусу проникать внутрь клетки, из-за этих шипов - короны, коронавирусы и получили свое название. Получившийся гибрид назвали SHC014-MA15. Если конспирологическая теория верна, то последовательность аминокислот белков искусственного вируса SHC014-MA15 должна совпадать с SARS-CoV-2, который сейчас всех заражает. Но этого не происходит. Я проводил сравнение с помощью компьютерной программы BLAST.
- Что это такое?
- Эта программа чем-то напоминает всем хорошо знакомый контекстный поиск офисной программы Word - ищет совпадения и различия в “буквах” (только в геноме буквами обозначается последовательность аминокислот или нуклеотидов - Ред). Так вот шиповидный белок искусственного вируса, имеет лишь 77.31% сходства с SARS-CoV-2. Это очень большое расхождение. Если мы посмотрим на другие белки - например полипроеин 1аb, то увидим такие же большие различия. Для сравнения разные вариации SARS-CoV-2 имеют между собой сходства от 97.8 до 100%. Что это значит? Это значит, что искусственный вирус эволюционно очень далек от коронавируса, который вызвал пандемию.

Кандидат биологических наук, старший научный сотрудник сектора молекулярной эволюции Института проблем передачи информации РАН Александр Панчин
Какая мутация сделала его таким опасным?
- Но ведь могли быть и другие версии искусственно созданных вирусов, статьи о которых не публиковались. И в качестве деталей конструктора могли использовать вирусы-исходники, которые не так радикально отличались. Существуют ли признаки, по которым точно можно отличить искусственно сконструированный вирус (даже если он более тщательно “склеен”) от мутировавшего естественным путем?
- Cамый близкий родственник SARS-CoV-2 это штамм коронавируса летучих мышей RaTG13 - его шиповидный белок дает 97.41% сходства, а полипротеин 1ab - 98.53% сходства. Он был открыт в 2013 году, сам людей не заражал, и в 2015 году для создания искусственного вируса не использовался. Если мы сравним геном нового человеческого SARS-COV-2 с геномом коронавируса мыши RaTG13 с то опять же не увидим никаких признаков чужеродных вставок. При этом геном SARS-COV-2 все же отличается по всей своей длинне от геномов всех остальных известных коронавирусов, так что пока нет даже кандидата на "исходник", с которым работали бы гипотетические генные инженеры. Мы видим у SARS-CoV-2 признаки эволюции, а не дизайна.
- Какая мутация сделала коронавирус таким опасным?
- Мы не знаем точно, какая именно мутация сделала коронавирус таким заразным для людей. Упомянутый выше коронавирус RaTG13 людей не заражает, промежуточные варианты пока не найдены. Были работы про изучение мутаций в участке, который кодирует шиповидный белок, использующийся вирусом для проникновения в клетки. Вероятно, эти мутации сыграли свою роль, но не факт, что ими все ограничивается.
Зачем нужны вирусы-химеры
- А зачем ученые создавали искусственный вирус? Это выглядит как-то подозрительно…
- Идея таких экспериментов вполне понятна: мы хотим заранее знать какие эпидемии могут нам угрожать и какие меры можно принять? Пытаемся понять, как вирусы могут мутировать? Учимся заранее придумывать лекарства, чтобы их создание занимало не 10 лет, как это обычно бывает в практике клинических исследований новых препаратов, а хотя бы год или полгода. Как раз тут нет ничего подозрительного.
- В зарубежных СМИ приводят косвенные доказательства того, что вирус мог “сбежать” из Уханьской лаборатории: в ноябре 2019 года в самом начале вспышки институт открыл вакансии для вирусологов для работы с коронавирусом летучих мышей. Называют имя пропавшей аспирантки лаборатории, которая гипотетически могла быть тем самым “нулевым” пациентом, который вынес вирус наружу…
- То, что в Уханьском институте были специалисты, которые работали с коронавирусами из летучих мышей, никогда не скрывалось, это общеизвестный факт. Коронавирусы уже перескакивали от летучих мышей к людям, как было в случае атипичной пневмонии. Та же статья в Nature Medicine 2015 года была ровно про то, что такое перескакивание может случиться снова. Поэтому странно приводить это, как довод в пользу конспирологической теории. Заявление о том, что кому-то известен нулевой пациент вызывает у меня большие сомнения. Такое очень сложно выяснить. Я бы даже сказал, что абсолютно не решен вопрос о том, действительно ли все началось именно в Ухане ? Мы даже не знаем напрямую ли люди получили коронавирус от летучих мышей или с переходом от каких-то других млекопитающих (как вариант рассматривают панголинов). Потребуется немало времени, чтобы выяснить, как именно произошло первое заражение. Выстраивать на этой почве какие-то теории просто абсурдно.
По-видимому, есть вирусы, которые паразитируют на человеке, размножаясь ограниченно в группах клеток и не причиняя видимого вреда своему хозяину. Однако при определенных условиях они могут мутировать с образованием более патогенных вариантов. В этом случае возникает острая вирусная инфекция, которая заканчивается, когда в организме сформируется специфический иммунитет к патогену.
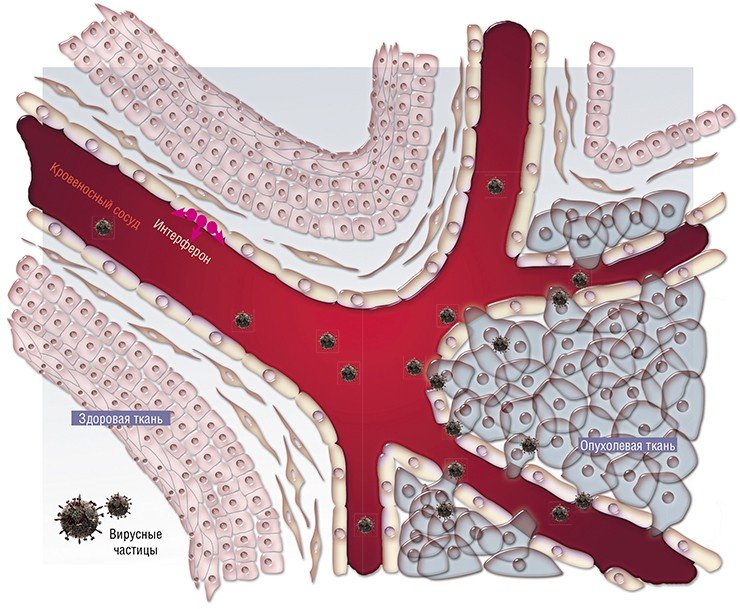
Но несмотря на относительно слабую изученность вирусного сообщества человека, практически сразу после открытия вирусов был обнаружен удивительный факт: у онкобольных вирусная инфекция может повлиять на протекание злокачественного процесса. Были зафиксированы случаи улучшения состояния таких пациентов и даже наступление длительной ремиссии после перенесенного вирусного заболевания либо вакцинации.
На основе этой информации еще в начале XX в. родилась идея использовать вирусы в борьбе с раковыми заболеваниями человека.
Взлеты и падения
Возможность создания принципиально новой формы терапии онкологических заболеваний, основанной на присущей вирусам способности убивать клетки, в которых он размножается, была впервые показана в середине прошлого века на примере рака шейки матки (Newman, 1954).
В результате удалось выделить и типировать ряд непатогенных для людей энтеровирусов, на основе которых были созданы живые энтеровирусные вакцины для профилактики сезонных вирусных заболеваний. При этом в ряде случаев удалось наблюдать положительный клинический эффект и в отношении злокачественных заболеваний, вплоть до полного исчезновения первичной опухоли и метастазов.

В ходе дальнейших исследований вакцинотерапию получили более полутора тысяч больных на поздних стадиях опухолевого процесса, и у части из них было отмечено улучшение состояния (Ворошилова, Ваганова, 1969; Ворошилова и др., 1977; Ворошилова, 1988).
Но уже в начале 1990-х гг. онколитические вирусы вновь стали объектом пристального внимания исследователей после публикации работы, посвященной лечению глиобластомы модифицированным вирусом простого герпеса (Martuza, 1991).
За последующие десятилетия благодаря выдающимся достижениям в молекулярной биологии и генетике и стремительному развитию биотехнологических методов исследования удалось проделать огромную экспериментальную работу по описанию специфических взаимодействий онколитических вирусов с раковымм клетками и выявить перспективные для терапии вирусные штаммы и типы опухолей, которые они могут поражать.
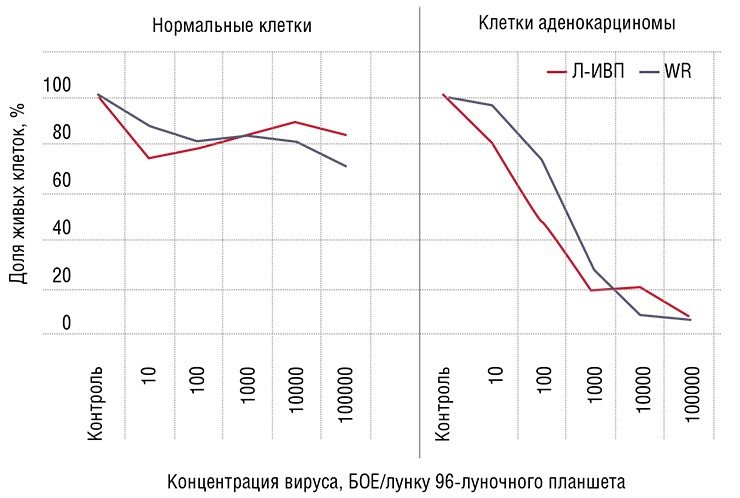
Почему же вирусы – и не какая-нибудь специфическая группа, а все в целом – поражают в первую очередь именно опухолевую ткань? Причин этому несколько.
Таким образом, первая причина высокой чувствительности раковых клеток к вирусам – их физическая доступность.
Вторая причина связана со способами размножения самих инфекционных агентов. Дело в том, что вирусы в этом смысле не самодостаточны и используют для размножения ресурсы зараженной клетки. Обычно это происходит тогда, когда клетка сама находится в процессе деления и в ней присутствуют все ферменты, необходимые для репликации генетического материала и синтеза белков.
Некоторые вирусы имеют специальные механизмы, которые позволяют перевести клетку из покоящегося состояния в делящееся (к ним относятся и так называемые онкогенные вирусы, например, вирус папилломы, который вызывает рак шейки матки именно за счет стимуляции клеточного деления). Однако очень многие вирусы могут размножаться только в уже активно делящихся клетках, например, клетках слизистой (которая, как известно, в первую очередь поражается при сезонных вирусных инфекциях). И в этом смысле раковые клетки, главное занятие которых – деление, особенно беззащитны перед вирусной интервенцией.
Здоровые – в безопасности
Таким образом, раковые клетки по милости самой природы служат готовой мишенью для вирусов. С использованием современных биотехнологий сегодня можно создавать вирусные препараты, которые будут специфически поражать и уничтожать только раковые клетки, не затрагивая здоровые.
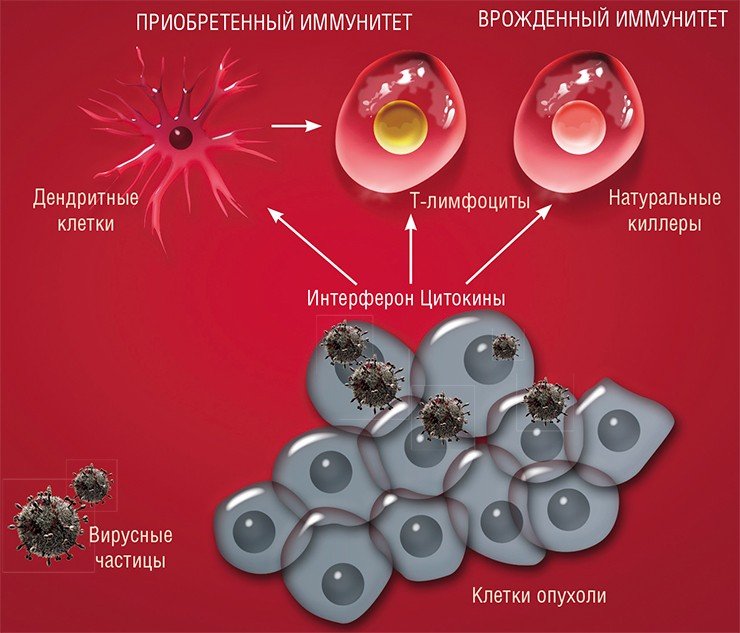
Поэтому мишенью вируса должны стать хаотичные скопища активно делящихся клеток. При этом в первую очередь будут поражаться наименее дифференцированные, наиболее злокачественные клетки. Здоровые же дифференцированные клетки будут защищены от проникновения такого дефектного вируса механизмами противовирусной защиты.
Персональный подход
Для решения этой задачи, в частности, проводится селекция вирусов на их способность размножаться в различных культурах раковых клеток. На основе анализа генетической структуры таких вирусов можно определить, какие из приобретенных вирусом мутаций делают его наиболее действенным в отношении определенного типа опухолевых клеток.
Имея панель таких онколитических вирусов, можно будет, взяв биопсию опухоли от конкретного пациента, подобрать для него наиболее эффективный набор вирусных штаммов. Причем эту процедуру можно повторять по мере лечения, поскольку сама опухоль может меняться, ускользая от действия онковируса. В таком случае сможет помочь уже другой вариант вируса, а так как он будет отличаться по антигенной структуре от предыдущего, то не уничтожится под действием механизмов противовирусного иммунитета, сформировавшегося в ходе предыдущего лечения.
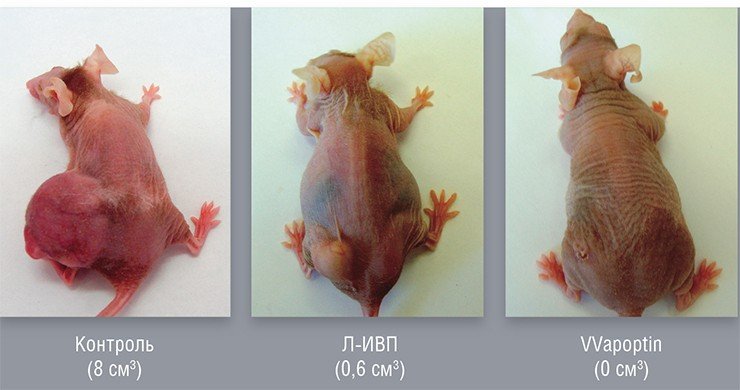
Онколитические вирусы можно дополнительно вооружить и генами, продуцирующими в раковой клетке белки, опасные лишь для этих клеток. Например, белок апоптин, выделенный из вируса птичьей анемии, по еще не совсем понятному механизму вызывает самоубийство исключительно только раковых клеток. На основе вируса осповакцины генно-инженерным способом уже создан такой штамм, способный эффективно уничтожать клетки опухоли человека, подсаженные лабораторным мышам.
Еще одна проблема терапии с помощью онколитических вирусов связана с разработкой наиболее эффективных способов их введения в организм. Ведь на пути вируса в организме встает много барьеров. К примеру, та же печень, являющаяся своего рода мощнейшим антивирусным фильтром.
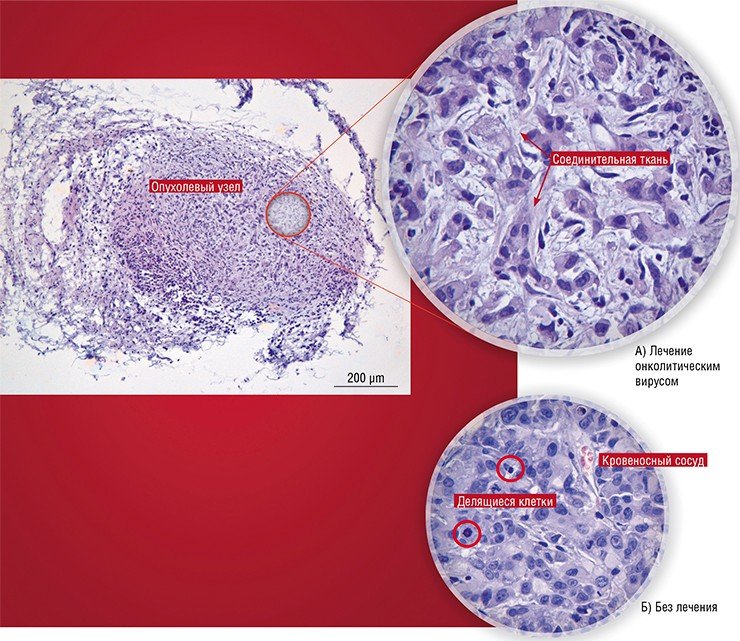
За и против
В настоящее время, несмотря на все успехи в изучении онколитических свойств вирусов, их применение в онкотерапии является, скорее, исключением, чем правилом.
Так, разработанный в США препарат сегодня применяется с согласия пациента при лечении глиобластомы в качестве дополнительной терапии. В Китае лицензирован и успешно применяется для терапии карцином один из штаммов аденовируса, несущий две генетические делеции (Yu, 2007).
В Латвии после распада СССР были продолжены работы по изучению онколитических вирусов, начатые в рамках противополиомиелитных исследований. В результате на основе одного из энтеровирусов был создан и сегодня используется на практике препарат Ригвир, направленный против меланом, который можно вводить непосредственно в кровяное русло.
Всего же сегодня в мире проходят клинические испытания свыше тридцати разнообразных онколитических вирусных препаратов. И основная проблема здесь не столько научная, сколько экономическая. Дело в том, что терапия рака (в первую очередь химиотерапия) – это большие деньги. В условиях сложившегося и процветающего рынка химиотерапевтических препаратов применение новых, пусть даже и более безопасных биотерапевтических средств потребует весьма дорогостоящей перестройки всей системы лечения. А это не может не затронуть интересы крупных фармацевтических компаний.
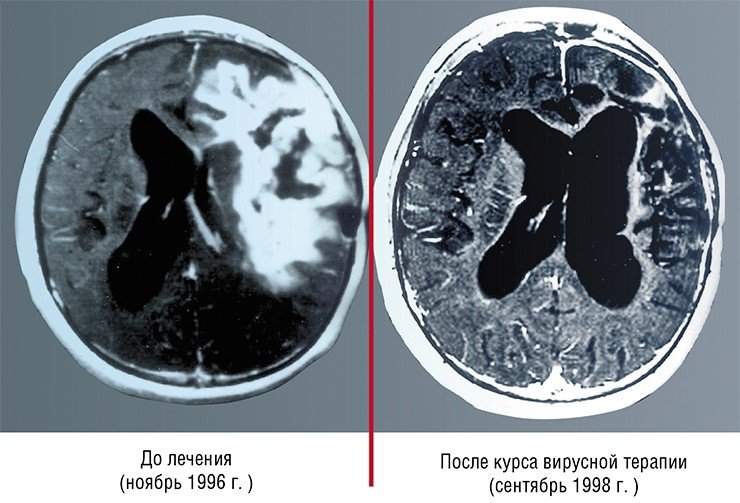
Стратегия таких компаний в отношении нарождающихся разработок в области онколитических вирусов неоднозначна. Так, права на один из первых онколитических препаратов ONYX-015 вместе с самой компанией-разработчиком были приобретены одной известной фармацевтической фирмой, после чего исследования по этой теме были закрыты. С другой стороны, по¬скольку полностью остановить прогресс в этой области невозможно, уже сегодня во многих фармацевтических компаниях создаются подразделения, занимающиеся изучением вирусных онколитиков. Оптимизма добавляет и тот факт, что за последние пятнадцать лет число работ по этой тематике растет как снежный ком.
Одновременно с прогрессом в создании вирусных противораковых средств в обществе, как и в случае пресловутых генетически модифицированных организмов (ГМО), возникают разнообразные фобии и слухи. Они во многом базируются на недостаточной осведомленности широкой общественности в сути дела и раздуваются благодаря действиям некоторых заинтересованных компаний.
Действительно, вопрос о безвредности тех или иных вирусов пока изучен не до конца. Поэтому приходится мириться с тем, что на пути к широкому внедрению этих очень перспективных методов лечения рака будут вставать многие преграды. В любом случае, исследователи должны действовать очень обдуманно, осторожно взвешивая все возможные последствия.
Но, как учит история науки, подобные проблемы всегда вставали на пути любого нового перспективного метода лечения и, как правило, успешно преодолевались.
Сейчас крепнет уверенность, что знания, накапливающиеся в области вирусологии, иммунологии, биологии клетки и других смежных дисциплин, позволят (и уже позволяют!) создавать такие варианты вирусов, которые будут не только эффективно и избирательно уничтожать раковые клетки, не затрагивая нормальные, но еще и стимулировать в организме естественные механизмы противоопухолевой защиты.
В будущем основой для терапии рака могут стать искусственные вирусы. Уже сейчас дальней целью разработок московских и новосибирских специалистов является создание модульной вирусной системы (в будущем – полностью синтетической) – своего рода молекулярного конструктора, из которого исследователь по желанию сможет собрать из отдельных генетических компонентов нужный вариант онколитического вируса.
Такие синтетические вирусы не должны структурно напоминать природные. Это важно потому, что схожие вирусы способны рекомбинировать друг с другом, обмениваясь участками своего генома, благодаря чему терапевтический вирус может приобрести неполезные гены и, соответственно, нежелательные, опасные свойства. Можно разработать такой синтетический вирус, который по функциям и общему плану строения будет похож на природный, но по нуклеотидной последовательности будет настолько от него отличаться, что утратит способность к рекомбинации со своими природными собратьями.
Ворошилова М. К. Полезные для организма непатогенные штаммы энтеровирусов: профилактическое и лечебное их применение. М.,1988. С. 24–29.
Качко А. В. и др. Рекомбинантная плазмидная ДНК pAd5 f, несущая фрагмент генома аденовируса 5 типа с делецией в гене Е 1 В 55 К, и штамм мутантного аденовируса Adel2, обладающий селективной противоопухолевой активностью. Патент РФ № 2194755 (467) 05.03.01.
Качко А. В. и др. Варианты аденовируса типа 5 с делениями в ранних генах: способность к селективной репликации в р53 дефектных опухолевых клетках человека // Молекулярная биология. 2003. № 37 (5). С. 868–875.
Martuza R. L.et al. Experimental therapy of human glioma by means of a genetically engineered virus mutant//Science. 1991. V. 252. P. 854–856.
Первый за Уралом
Победители первого конкурса научных мегагрантов Правительства РФ, направленных на поддержку исследований под руководством ведущих ученых в российских вузах, были названы в октябре 2010 г. Всего на конкурс подавалось 507 заявок, которые были рассмотрены международными экспертами и утверждены Советом по грантам. Победители, среди которых оказался и Новосибирский национальный исследовательский государственный университет, получили финансирование в размере 150 млн рублей
Новосибирский национальный исследовательский государственный университет (НГУ) получил в 2010 г. три мегагранта правительства РФ, один из которых под руководством д.б.н., профессора П. М. Чумакова, предназначался для создания университетской лаборатории по исследованию онколитических вирусов.

В 2010—2012 гг. за счет средств мегагранта и софинансирования в НГУ реконструированы помещения для проведения практических занятий по микробиологии и частично – по аналитической химии. На этой базе был создан исследовательский комплекс из лаборатории микробиологии и вирусологии (руководитель П. М. Чумаков) и лаборатории бионанотехнологий (руководитель – проректор по научной работе НГУ, д.б.н., профессор С. В. Нетесов).
В вирусологическом боксе, оснащенном всем необходимым современным оборудованием для высокопроизводительной работы с непатогенными вирусами и их геномами, могут одновременно проводить исследования три сотрудника. Весной 2013 г. заканчивается реконструкция помещений для генно-инженерных работ, секвенирования геномов, а также биоинформационных и биотехнологических исследований.

В штат лабораторий вошли на долговременной основе несколько специалистов – докторов и кандидатов наук, а также аспиранты и студенты, ориентированные на научные исследования и разработки в самых современных областях микробиологии и молекулярной биологии. Во-первых, это изучение молекулярного разнообразия геномов вирусных возбудителей желудочно-кишечных и респираторных заболеваний человека и животных на территории азиатской части России. Во-вторых – создание онколитических рекомбинантных вирусов, а также бактерий, производящих рекомбинантные биологически активные белки человека, которые на сегодня признаются одними из самых перспективных противораковых препаратов.
Таким образом, принимая во внимание наличие в Научно-образовательном комплексе по наноматериалам и наносистемам НГУ нескольких суперсовременных электронных микроскопов, можно с утверждать, что в университете вступил в строй первый за Уралом современный лабораторный мини-комплекс по изучению микроорганизмов и разработке на их основе новых биомедицинских приложений.
Работы по этой тематике планируется проводить в сотрудничестве с передовыми биотехнологическими компаниями Новосибирской области и всего Сибирского федерального округа, а также, в случае взаимной заинтересованности, и с ведущими зарубежными предприятиями аналогичного профиля.
* Этот уровень биологической безопасности, по зарубежной классификации, используется для работы с возбудителями заболеваний человека, представляющими умеренную опасность для персонала и окружающей среды
Открытие вирусов
В 1892 году Д.И. Ивановский (см. Рис. 1), изучая мозаичную болезнь табака (см. Рис. 2), установил, что причиной заболевания является некое инфекционное начало, содержащееся в листьях больных растений, которое проходит через фильтр, задерживающий обыкновенные бактерии. Если профильтрованный сок внести в листья здоровых растений, то они также заболевают мозаичной болезнью.

Рис. 1. Д.И. Ивановский

Рис. 2. Мозаичная болезнь табака
В 1898 году независимо от Ивановского аналогичные результаты получил голландский микробиолог М. Бейеринк. Однако он предположил, что мозаичную болезнь табака вызывают не мельчайшие бактерии, а некое жидкое заразное начало, которое он назвал фильтрующим вирусом.
Размеры вирусов определяются нанометрами (20-200 нм), поэтому их изучение началось после открытия электронного микроскопа. В настоящее время описаны вирусы практически всех групп живых организмов.
Строение вирусов
Вирусы – неклеточные формы жизни. Они состоят (см. Рис. 3) из фрагмента генетического материала (РНК или ДНК), составляющего сердцевину вируса, и защитной оболочки, которая называется капсид. У некоторых вирусов (герпес, грипп) есть дополнительная липопротеидная оболочка – суперкапсид, которая возникает из плазматической мембраны клетки-хозяина.

Рис. 3. Строение вируса
Вирусы не способны к самостоятельной жизнедеятельности. Они могут проявлять свойства живого, только попав в клетку-хозяина. Они используют потенциал и энергию этой клетки для создания своих новых вирусных частиц, следовательно, вирусы являются внутриклеточными паразитами.
Размножение вирусов
Обычно вирус связывается с поверхностью клетки-хозяина и проникает внутрь. Каждый вирус ищет своего хозяина, то есть клетки строго определенного вида. Например, вирус – возбудитель гепатита (желтуха) проникает и размножается только в клетках печени, а вирус эпидемического паротита (свинка) – только в клетках околоушных слюнных желез человека.
Проникнув внутрь клетки-хозяина, вирусная ДНК или РНК начинает взаимодействовать с ее генетическим аппаратом таким образом, что клетка начинает синтезировать белки, свойственные вирусу (см. Рис. 4).

Рис. 4. Схема репродукции вируса
При заражении ретровирусом (например, вирус иммунодефицита человека (ВИЧ)), у которого в качестве генетического материала используется молекула РНК, наблюдается другая картина. При попадании ретровируса в клетку-хозяина происходит обратная транскрипция. То есть на основе вирусной РНК синтезируется вирусная ДНК, которая встраивается в ДНК человека. Такой тип взаимодействия вируса с клеткой называется интегративным, а встроенная в состав хромосомы клетки ДНК вируса называется провирусом. Далее провирус реплицируется (удваивается) в составе хромосомы и переходит в геном дочерних клеток. Однако под влиянием некоторых физических и химических факторов провирус может выщепляться из хромосомы клетки и переходить к продуктивному типу взаимодействия, то есть синтезировать новые вирусные частицы.
При заражении ВИЧ человек чувствует себя здоровым, пока вирусный генетический материал встроен в хромосому человека. Однако при выщеплении этого вирусного генетического материала из клетки она начинает образовывать новые вирусные частицы, вследствие чего развивается смертельное заболевание – синдром приобретенного иммунодефицита (СПИД).
Вирусы являются возбудителями большого количества заболеваний человека: корь, грипп, оспа, краснуха, энцефалит, свинка, гепатиты, СПИД. Известен также целый ряд заболеваний растений, вызываемых вирусами, например мозаичная болезнь табака, томатов, огурцов или скручивание листьев картофеля. Всего описано около 500 видов вирусов, поражающих клетки позвоночных животных, и около 300 вирусов растений. Некоторые вирусы участвуют в злокачественном перерождении клеток и тем самым провоцируют онкологические заболевания.
ДНК- и РНК-содержащие вирусы
В зависимости от содержащегося генетического материала вирусы подразделяются на ДНК-содержащие и РНК-содержащие.
Одноцепочные РНК-содержащие вирусы подразделяются на:
1. Плюс-нитевые (положительные). Плюс-нить РНК этих вирусов выполняет наследственную (геномную) функцию и функцию информационной РНК (иРНК).
2. Минус-нитевые (отрицательные). Минус-нить РНК этих вирусов выполняет только наследственную функцию.
К РНК-содержащим вирусам относятся более 
вирусов, вызывающих респираторные заболевания, а также вирус гриппа, кори, краснухи, свинки, ВИЧ. Также существует специфическая группа вирусов – арбовирусы, которые переносятся членистоногими.
Двухцепочные ДНК-содержащие вирусы вызывают такие заболевания, как папиллома человека или герпес, гепатит В (гепатит А и гепатит С вызывается РНК-содержащими вирусами).
ДНК-содержащие вирусы поражают также растения. Они вызывают, например, золотую мозаику бобов или полосатость у кукурузы.
Вирус гепатита С
По своему строению вирус гепатита С – это РНК-содержащий вирус, имеющий сферическую форму, сложно устроенный (см. Рис. 5).
В качестве генетического материала такой вирус содержит линейную однонитчатую молекулу РНК.

Рис. 5. Гепатит С
Вопреки бытующим предрассудкам, подцепить вирус гепатита C невозможно через социальные контакты (поцелуи, объятия), через продукты или воду, через грудное молоко. Вы ничем не рискнете, если разделите с носителем вируса трапезу или напитки. Заразиться гепатитом C можно при контакте с кровью инфицированного человека либо половым путем.
В настоящее время для лечения гепатита С используют два препарата: Интерферон альфа и Рибавирин.
Бактериофаги

Рис. 6. Бактериофаг (Источник)
Особую группу вирусов составляют бактериофаги (или просто фаги), которые заражают бактериальные клетки (см. Рис. 6). Фаг укрепляется на поверхности бактерии при помощи специальных ножек и вводит в ее цитоплазму полый стержень, через который проталкивает внутрь клетки свою ДНК или РНК. Таким образом, генетический материал фага попадает внутрь бактериальной клетки, а капсид остается снаружи. В цитоплазме начинается репликация генетического материала фага, синтез его белков, построение капсида и сборка новых фагов. Уже через 10 мин после заражения в бактерии формируются новые фаги, а через полчаса бактериальная клетка разрушается, и из нее выходят около 200 заново сформированных вирусов – фагов, способных заражать другие бактериальные клетки (см. Рис. 7). Некоторые фаги используются человеком для борьбы с болезнетворными бактериями, вызывающими холеру, дизентерию, брюшной тиф.

Рис. 7. Схема размножения бактериофага (Источник)
Список литературы
- Каменский А.А., Криксунов Е.А., Пасечник В.В. Общая биология 10-11 класс Дрофа, 2005.
- Биология. 10 класс. Общая биология. Базовый уровень / П.В. Ижевский, О.А. Корнилова, Т.Е. Лощилина и др. – 2-е изд., переработанное. – Вентана-Граф, 2010. – 224 стр.
- Беляев Д.К. Биология 10-11 класс. Общая биология. Базовый уровень. – 11-е изд., стереотип. – М.: Просвещение, 2012. – 304 с.
- Агафонова И.Б., Захарова Е.Т., Сивоглазов В.И. Биология 10-11 класс. Общая биология. Базовый уровень. – 6-е изд., доп. – Дрофа, 2010. – 384 с.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
Домашнее задание
Если вы нашли ошибку или неработающую ссылку, пожалуйста, сообщите нам – сделайте свой вклад в развитие проекта. 

Читайте также:


