Вирусы использование в промышленности
Паразиты, бактерии и вирусы были бичом человечества на протяжении всей его истории, но также изменили ее и повлияли на нашу эволюцию. Паразиты помогли нашей иммунной системе обрести необходимый стимул и заработать, а смиренные бактерии целиком и полностью определили правила жизни на этой планете. Иногда кажется, что мы, люди, просто игрушки в их руках. Есть мнение, что пришельцы из далеких миров могут не понять, кто на этой планете настоящий хозяин. В любом случае микроорганизмы делают невероятные вещи, чтобы помочь человечеству.

Африканские вирусы помогли нам выжить

Кроме того, они, возможно, сыграли роль в том, что среди конкурирующих видов гоминид именно Homo sapiens вышли на первое место. В то время как наш вид развивался, разного рода заболевания и паразиты нападали на генетическое разнообразие и отсеивали непригодные модели. Как только первый Homo sapiens покинул континент, он привез с собой свои инфекционные колонии и паразитов.
Вирусные паразиты распространились на других гоминид типа Homo neanderthalensis (неандертальцев), у которых не было заранее выработанной системы защиты от новых заболеваний и структура носа, которая была менее эффективной при фильтрации воздуха и удерживании новых вирусов. Другие виды гоминид вымерли, поскольку не были приспособлены к выживанию в условиях, в которых могли выживать вредные микроорганизмы. Моделирование показало, что если у неандертальцев уровень смертности был хотя бы на 2% выше, чем у людей, этого было бы достаточно, чтобы они вымерли спустя 1000 лет конкуренции. Хотя заболевания, конечно, не были единственным фактором, они сыграли большую роль.
Большинство моделей эволюции человеческих заболеваний утверждают, что их основная часть развивалась в течение эпохи неолита, после того как человек перебрался из Африки и население увеличилось. Таким образом, есть некоторые доказательства этого избирательного вирусного давления. Многие из этих ранних вирусов были так успешны, что их гены буквально стали частью нашей ДНК. К примеру, человеческий геном содержит борнавирус, который стал его частью около 40 миллионов лет назад. В общей сложности ученые выделили около 100 000 элементов человеческой ДНК, которые могли быть частью вирусов, так называемая мусорная ДНК. Вирусы, которые составляют большую часть нашей мусорной ДНК, называются эндогенными ретровирусами.
Современное использование пиявок и личинок

Тем не менее в 70-80-х годах пиявки вернулись. Косметические и реконструктивные хирурги выяснили, что их можно эффективно использовать для кровопускания из опухших лиц, черных глаз, конечностей и прочего. Они также полезны при повторном присоединении небольших частей тела вроде ушей и лоскутов кожи, поскольку отсасывают кровь, которая может свернуться и прервать процесс заживления. Пиявки спасают людей от ампутации и даже могут облегчить боль при остеоартрите. Даже ветеринары иногда используют их.
Личинки, с другой стороны, являются природными очистителями. Они прекрасно подходят для разъедания мертвой или зараженной плоти, открывая здоровые ткани в процессе так называемой хирургической обработки раны. Также они оказались эффективным средством для лечения язв, гангрен, рака кожи и ожогов.
Паразиты и иммунная система совместно защищают нас от аллергии

Самая интересная часть в том, что как только паразиты и безвредные микроорганизмы, присутствующие в воде и почве, были в значительной степени удалены из своей естественной среды внутри нас в процессе развития цивилизации и медицины, наша иммунная система фактически сверхкомпенсировала эту утрату, что привело к аллергии и увеличению шансов возникновения астмы и экземы.
Первым гипотезу старых друзей предложил Грэм Рук из Университетского колледжа в Лондоне в 2003 году.
Некоторые люди доводят гипотезу старых друзей к ее логическому заключению: если удаление паразитов из общества приводит к проблемам со здоровьем, нужно вернуть их назад. В 2008 году профессор неврологии Университета Висконсина Джон Флеминг провел клиническое исследование, в ходе которого заражал некоторых пациентов с рассеянным склерозом паразитирующими червями и проверял эффективность этого метода. В течение трех месяцев у пациентов, которые в среднем имели 6,6 активных очагов среди нервных клеток мозга, уровень заболевания упал примерно в два раза. Когда испытание закончилось, количество очагов вернулось к 5,8 за два месяца.
Паразитарная терапия все еще находится в фазе эксперимента, и, скорее всего, на данный момент имеет негативные последствия, которые перевешивают позитивные. В настоящее время врачебные комиссии классифицируют червей как биологические продукты, которых нельзя продавать, пока не будет доказана их безопасность. Только один вид, Trichuris suis, был одобрен для тестирования нового препарата.
Виротерапия
Методика аналогична той, которая используется для выведения генно-модифицированных растений, только в качестве носителя гена используется вирус. Он уже давно признан в качестве наиболее эффективного средства переноса генов. Эта система используется для производства полезных белков в генной терапии и имеет большой потенциал для лечения иммунологических заболеваний, таких как гепатит и ВИЧ.
Еще в 1950-х годах стало известно, что у вирусов есть потенциал для лечения рака, но появление химиотерапии замедлило прогресс в этом направлении. Сегодня виротерапия на поверку оказывается весьма эффективным средством борьбы против опухолей, поскольку не повреждает здоровые клетки вокруг нее. Клинические испытания онколитической виротерапии показали низкую токсичность и перспективные признаки эффективности. В 2013 году препарат под названием TVEC стал первым лекарством на основе вируса для борьбы с опухолями на поздней стадии.
Использование вирусов для лечения бактериальных инфекций

Поскольку фаги нарушают метаболизм бактерий и уничтожают их, уже давно признано, что они могут играть определенную роль в лечении широкого спектра бактериальных заболеваний. Но из-за инноваций в сфере антибиотиков, фаготерапию снова положили на полку, пока рост резистентных к антибиотикам бактерий не вызвал повышенный интерес в этой области.
Отдельные виды фагов, как правило, эффективны только против небольшого диапазона бактерий или даже одного конкретного вида (основного хозяина), что изначально рассматривалось как недостаток. Но поскольку мы узнали больше о полезных аспектах нашей природной флоры, недостаток превратился в преимущество. В отличие от антибиотиков, которые, как правило, убивают бактерии без разбора, бактериофаги могут атаковать вызывающие заболевание организмы, не нанося вред нашей естественной флоре.
В то время как бактерии могут вырабатывать устойчивость как к антибиотикам, так и к фагам, разработка новых штаммов фагов займет всего несколько недель, а не лет. Фаги также могут проникать в тело, находить цель, а когда бактерии будут уничтожены, прекращать воспроизводство и вскоре вымирать.
Вакцины
Когда вакцина вводится, возбудитель начинает работать, что недостаточно, чтобы размножиться в таком размере, чтобы вызвать заболевание. Тело производит иммунный ответ, убивает возбудителя или разрушая токсин, ответственный за болезнь. Иммунная система организма теперь знает, как бороться с болезнью и будет помнить, если возбудитель снова проникнет в тело. Другими словами, ученые выяснили, как заставить возбудитель помочь своей цели защититься от него. Они даже сделали несколько шагов к разработке вакцин для нескольких форм рака и вируса гепатита B (который вызывает рак печени), вируса папилломы человека типа 16 и 18 (который вызывает рак шейки матки) и метастатический рак предстательной железы у некоторых мужчин.
Благодаря вакцинам, несколько заболеваний были вынуждены виртуально исчезнуть. Оспа остается наиболее известным примером, но полиомиелит, который хоть и не полностью уничтожен, стоит на втором месте. Несколько других заболеваний могут уйти хоть сейчас, если бы вакцины не было так трудно доставить в слаборазвитые страны.
Бактериальная утилизация отходов
Мертвые останки животных и растений, наряду с экскрементами всех организмов, содержат жизненно важные питательные вещества и запасенную энергию. Без возможности вернуть эти питательные вещества, имеющиеся источники были бы быстро исчерпаны. К счастью, многие виды бактерий выбирают именно эти источники энергии, разбивая их на свои маленькие молекулы и возвращая их в почву, откуда они затем повторно входят в пищевую цепочку.
В дополнение к этому процессу люди нашли массу способов использования его аналогов. Бактерии используются в очистке сточных вод, управлении промышленными отходами и очистке нефтяных разливов, утекших фармацевтических препаратов и сточных вод. Они также полезны в развитии аквахозяйств, борьбе с водорослями и биотуалетах. Исследователи и инженеры постоянно ищут способы применения бактерий. Возможно, их даже приспособят для расщепления пластиковых отходов.
Мы бы погибли без кишечных бактерий
Чем больше мы узнаем о полезных штаммах бактерий кишечника, тем больше мы можем включить эти знания в здоровый образ жизни. После того как было установлено, что некоторые кишечные бактерии могут играть определенную роль в ожирении, особую популярность приобрели пробиотики. Пробиотики — это бактерии, которые заменяют ферментированные пищевых продукты и в настоящее время продаются в виде добавок. Бактерии типа некоторых видов бифидобактерий могут создавать высококислотную среду, в которой менее полезные микроорганизмы выжить не могут. Жирная пища и стресс также могут играть роль в здоровье нашей желудочной флоры, убивая полезные бактерии и давая развернуться вредным бактериям, которые вызывают газы, вздутие живота и синдром повышенной кишечной проницаемости.
Бактерии кожи могут быть на передовой иммунитета
Одной из наиболее распространенных бактерий кожи является Staphlococcus epidermis. Известно, что она играет важную роль в борьбе с Leishmania major, причиной опасной болезни под названием лейшманиоз, которая рождает незаживающие язвы. Хорошая бактерия вызывает иммунный ответ под названием IL-1, который тело не может производить самостоятельно. Эти стафилококки стали обязательной частью нашего существования.
Прокариоты, которые населяют пищеварительный тракт, также охватывают и всю наружную поверхность на коже. Наряду с остальной частью нашей полезной микрофлоры кожи, они стали частью нас, когда конкурировали с менее доброжелательными микроорганизмами за право жить. Наряду с иммунными клетками нашей кожи, они защищают нас от болезнетворных бактерий и патогенных грибов, которые хотят в нас жить. Это позволяет нашим органам тратить меньше энергии, защищая наш экстерьер, и больше сосредоточиваться на вещах типа борьбы с вирусами и предраковыми клетками.
Хотя нам еще многому нужно поучиться у них и больше узнать об этих полезных бактериях, в будущем бактерии кожи будут использоваться целенаправленно.
Жизни не было бы без цианобактерий

Цианобактерии были первыми фотосинтезаторами в мире. Они использовали энергию солнца вместе с химическими веществами в первых океанах и инертный азот в атмосфере для пропитания. В качестве продукта отходов они производили кислород, который был ядом практически для любой другой формы жизни в то время. В течение примерно 300 миллионов лет все эти кислородные отходы образовали атмосферу, какой мы ее знаем, в течение архейских и протерозойских эр.
Иногда, в течение протерозоя или в начале кембрийского периода, эти бактерии формировали симбиотические отношения с некоторыми клетками эукаритот, давая клеткам пищу в обмен на стабильные условия, которые можно было назвать домом. Это были первые растения. Невероятное событие эндосимбиоза до сих пор считается одним из важнейших в становлении первой жизни.
Для борьбы с вредителями и болезнями растений используют грибы, бактерии, вирусы, гельминтов и простейших.
1. Патогенность, способность вызывать болезненные явления.
2. Вирулентность – быстро размножаться в тканях насекомого и вызывать смерть.
3. Способность проникать в организм насекомого пассивно (с пищей) и активно (через покровы тела).
4. Сохранность в природе.
Использование грибов.Наиболее патогенны для насекомых фикомицеты – облигатные паразиты. Известно около 400 видов энтомопатогенных грибов. Многие лесные насекомые поражаются плесенью гриба белая мюскардина (препарат боверин). Кроме того, различают розовую и зеленую мюскардину (в зависимости от цвета мицелия). Эти грибы вызывают мускардиноз насекомых (погибшие насекомые уменьшаются в размерах, сморщиваются и покрываются белым мучнистым налетом, состоящим из грибницы и конидий). Для массового выращивания грибов применяют твердые среды растительного происхождения (картофель, кукурузу, мельничные отходы), которые стерилизуют под давлением и затем засевают соответствующей грибной культурой. Грибы выращивают при определенной температуре, высушивают, размалывают и используют в виде препаратов. Микозы (грибные заболевания) не являются острозаразными, в естественных условиях не вызывают эпизоотий и поражают, в основном, ослабленных насекомых.
Использование бактерий получило широкое распространение. Они применяются в виде бактериальных препаратов. Технология их приготовления заключается в массовом накоплении спор путем стерильного выращивания бактерий в жидких средах. Затем споры отделяют от жидкости сепарированием, смешивают с нейтральным наполнителем и высушивают. Бактериальные препараты не имеют специфического запаха, не отпугивают насекомых, не повреждают растений, практически неопасны для людей и животных. Они готовятся на основе спорообразующих кристаллоносных энтомопатогенных бацилл группы бациллюс турингиензис (Bacillus thuringiensis Berliner). Характерным для этой группы бацилл является образование в спорангиях рядом со спорой протеиновых кристаллов белкового токсина очень токсичных для насекомых, в основном для чешуекрылых.
Наряду с эндотоксином бактерии в процессе жизнедеятельности вырабатывают экзотоксин, по химической природе близкий к нуклеотидам. Он накапливается в культуральной жидкости после отделения от нее спор и кристаллов бактерии и вызывает специфические задержки линьки у личинок насекомых и уродства у имаго, токсичен для многих групп насекомых.
Поражение гусениц вредителей происходит при попадании спор и кристаллов в кишечник вместе с пищей. Проглотив первые порции корма, гусеницы прекращают питание вследствие действия эндотоксина. Затем начинается размножение попавших внутрь тела гусениц бацилл, сопровождающееся образованием токсичных для насекомых веществ (главным образом экзотоксинов).
У погибших гусениц наблюдается разложение внутреннего содержимого: сквозь легко разрывающиеся покровы вытекает бурая жидкость, содержащая споры бацилл и кристаллы эндотоксина.
Бактериальные препараты выпускаются промышленностью в виде смачивающихся порошков и паст. В 1 г порошка содержится не менее 30 млрд. спор и столько же кристаллов, в 1 г пасты – не менее 20 млрд. спор. Гарантийный срок хранения 1 год. Инертным наполнителем обычно служит каолин. Бактериальные препараты применяют методом мелкокапельного авиационного или наземного опрыскивания насаждений.
В зависимости от температурных условий (при температуре ниже 18°С развитие бацилл сильно замедляется, отмирание гусениц затягивается и многие из них выздоравливают), активности препаратов и физиологического состояния вредителя гибель гусениц начинается по истечении 2-3 суток после обработки, а массовая смертность обычно бывает в интервале от 3-5 до 7-10 дней.
Эффективность препаратов во многом зависит от дисперсности дробления рабочей жидкости, определяющей густоту покрытия обрабатываемой поверхности растений.
Широкое применение имеют: лепидоцид (против соснового шелкопряда, непарного шелкопряда, златогузки, шелкопряда-монашенки), лепидобактоцид (хвоелистогрызущих гусениц младших возрастов), битоксибациллин против листоверток, шелкопряда, пядениц, златогузки). Лепидоцид, препарат, вырабатываемый на основе бактерии Bacillus thuringiensis, var. kurstaki (спорово-кристаллический комплекс). Битоксибациллин - экзотоксин Bacillus thuringiensis, var. thuringiensis(спорово-кристаллический комплекс).
Эффективность бактериальных препаратов при различных способах использования в борьбе с вредителями колеблется в пределах 70—90%.
Использование вирусов. Вирусы вызывают заболевания (вирозы) на стадии личинки у многих видов чешуекрылых и пилильщиков. Возникающие очаги инфекции обычно действуют несколько лет, обеспечивая вторичное инфекцирование и гибель гусениц в течение нескольких последующих поколений.
Основная вирусная болезнь насекомых – полиэдроз (известно около 170 видов). Он сопровождается появлением в клетках различных тканей многочисленных внутриядерных белковых включений, имеющих форму многогранников (полиэдров). Полиэдры устойчивы к действию неблагоприятных факторов (химикатов, солнечного света, ферментов и др.) и сохраняют жизнеспособность находящихся в них вирусов многие годы. Размеры полиэдров колеблются в пределах 0,3-15 мкм. В белковом матриксе полиэдров расположены вирионы в форме палочек длиной 200-400 и шириной 20-50 мкм. Вирус передается через яйца (трансовариально) и специфичен для каждого вида насекомого. Больные насекомые становятся малоподвижными, прекращают питание, их покровы приобретают светлую окраску, утончаются, и через их разрывы вытекает мутная, непахнущая, беловатая жидкость.
Для приготовления вирусных препаратов зараженных полиэдрозом гусениц высушивают, затем их содержимое соответствующим образом обрабатывают. Вирусные препараты используют для борьбы с сибирским шелкопрядом (вирин-ГСШ), сосновыми пилильщиками (вирин-Диприон), шелкопрядом монашенкой (вирин-ПШМ).
Вирин-Диприон представляет собой суспензию, состоящую из полиэдров. Ее разбавляют водой и используют для опрыскивания очагов сосновых пилильщиков.
- 16318
- 12,7
- 2
- 5
Обратите внимание!
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
Эволюция и происхождение вирусов
В 2007 году сотрудники биологического факультета МГУ Л. Нефедова и А. Ким описали, как мог появиться один из видов вирусов — ретровирусы. Они провели сравнительный анализ геномов дрозофилы D. melanogaster и ее эндосимбионта (микроорганизма, живущего внутри дрозофилы) — бактерии Wolbachia pipientis. Полученные данные показали, что эндогенные ретровирусы группы gypsy могли произойти от мобильных элементов генома — ретротранспозонов. Причиной этому стало появление у ретротранспозонов одного нового гена — env, — который и превратил их в вирусы. Этот ген позволяет вирусам передаваться горизонтально, от клетки к клетке и от носителя к носителю, чего ретротранспозоны делать не могли. Именно так, как показал анализ, ретровирус gypsy передался из генома дрозофилы ее симбионту — вольбахии [7]. Это открытие упомянуто здесь не случайно. Оно нам понадобится для того, чтобы понять, чем вызваны трудности борьбы с вирусами.
Из давних письменных источников, оставленных историком Фукидидом и знахарем Галеном, нам известно о первых вирусных эпидемиях, возникших в Древней Греции в 430 году до н.э. и в Риме в 166 году. Часть вирусологов предполагает, что в Риме могла произойти первая зафиксированная в источниках эпидемия оспы. Тогда от неизвестного смертоносного вируса по всей Римской империи погибло несколько миллионов человек [8]. И с того времени европейский континент уже регулярно подвергался опустошающим нашествиям всевозможных эпидемий — в первую очередь, чумы, холеры и натуральной оспы. Эпидемии внезапно приходили одна за другой вместе с перемещавшимися на дальние расстояния людьми и опустошали целые города. И так же внезапно прекращались, ничем не проявляя себя сотни лет.
Вирус натуральной оспы стал первым инфекционным носителем, который представлял действительную угрозу для человечества и от которого погибало большое количество людей. Свирепствовавшая в средние века оспа буквально выкашивала целые города, оставляя после себя огромные кладбища погибших. В 2007 году в журнале Национальной академии наук США (PNAS) вышла работа группы американских ученых — И. Дэймона и его коллег, — которым на основе геномного анализа удалось установить предположительное время возникновения вируса натуральной оспы: более 16 тысяч лет назад. Интересно, что в этой же статье ученые недоумевают по поводу своего открытия: как так случилось, что, несмотря на древний возраст вируса, эпидемии оспы не упоминаются в Библии, а также в книгах древних римлян и греков [9]?
Строение вирусов и иммунный ответ организма

Рисунок 1. Первооткрыватель вирусов Д.И. Ивановский (1864–1920) (слева) и английский врач Эдвард Дженнер (справа).

Почти все известные науке вирусы имеют свою специфическую мишень в живом организме — определенный рецептор на поверхности клетки, к которому и прикрепляется вирус. Этот вирусный механизм и предопределяет, какие именно клетки пострадают от инфекции. К примеру, вирус полиомиелита может прикрепляться лишь к нейронам и потому поражает именно их, в то время как вирусы гепатита поражают только клетки печени. Некоторые вирусы — например, вирус гриппа А-типа и риновирус — прикрепляются к рецепторам гликофорин А и ICAM-1, которые характерны для нескольких видов клеток. Вирус иммунодефицита избирает в качестве мишеней целый ряд клеток: в первую очередь, клетки иммунной системы (Т-хелперы, макрофаги), а также эозинофилы, тимоциты, дендритные клетки, астроциты и другие, несущие на своей мембране специфический рецептор СD-4 и CXCR4-корецептор [13–15].

Одновременно с этим в организме реализуется еще один, молекулярный, защитный механизм: пораженные вирусом клетки начинают производить специальные белки — интерфероны, — о которых многие слышали в связи с гриппозной инфекцией. Существует три основных вида интерферонов. Синтез интерферона-альфа (ИФ-α) стимулируют лейкоциты. Он участвует в борьбе с вирусами и обладает противоопухолевым действием. Интерферон-бета (ИФ-β) производят клетки соединительной ткани, фибробласты. Он обладает таким же действием, как и ИФ-α, только с уклоном в противоопухолевый эффект. Интерферон-гамма (ИФ-γ) синтезируют Т-клетки (Т-хелперы и (СD8+) Т-лимфоциты), что придает ему свойства иммуномодулятора, усиливающего или ослабляющего иммунитет. Как именно интерфероны борются с вирусами? Они могут, в частности, блокировать работу чужеродных нуклеиновых кислот, не давая вирусу возможности реплицироваться (размножаться).

Причины поражений в борьбе с ВИЧ
Тем не менее нельзя сказать, что ничего не делается в борьбе с ВИЧ и нет никаких подвижек в этом вопросе. Сегодня уже определены перспективные направления в исследованиях, главные из которых: использование антисмысловых молекул (антисмысловых РНК), РНК-интерференция, аптамерная и химерная технологии [12]. Но пока эти антивирусные методы — дело научных институтов, а не широкой клинической практики*. И потому более миллиона человек, по официальным данным ВОЗ, погибают ежегодно от причин, связанных с ВИЧ и СПИДом.

Рисунок 5. Схема развития феномена ADE при вирусных инфекциях. а — Взаимодействие между антителом и рецептором FcR на поверхности макрофага. б — Фрагмент С3 комплемента (компонент комплемента, после присоединения которого весь этот комплекс приобретает способность прилипать к различным частицам и клеткам) и рецептор комплемента (complement receptor, CR) способствуют присоединению вируса к клетке. в — Белки комплемента С1q и С1qR способствуют присоединению вируса к клетке (в составе молекулы C1q имеется рецептор для связывания с Fc-фрагментом молекулы антитела). г — Антитела взаимодействуют с рецептор-связывающим сайтом вирусного белка и индуцируют его конформационные изменения, облегчающие слияние вируса с мембраной. д — Вирусы, получившие возможность реплицироваться в данной клетке посредством ADE, супрессируют противовирусные ответы со стороны антивирусных генов клетки. Рисунок с сайта supotnitskiy.ru.
Подобный вирусный механизм характерен не только для ВИЧ. Он описан и при инфицировании некоторыми другими опасными вирусами: такими, как вирусы Денге и Эбола. Но при ВИЧ антителозависимое усиление инфекции сопровождается еще несколькими факторами, делая его опасным и почти неуязвимым. Так, в 1991 году американские клеточные биологи из Мэриленда (Дж. Гудсмит с коллегами), изучая иммунный ответ на ВИЧ-вакцину, обнаружили так называемый феномен антигенного импринтинга [23]. Он был описан еще в далеком 1953 году при изучении вируса гриппа. Оказалось, что иммунная система запоминает самый первый вариант вируса ВИЧ и вырабатывает к нему специфические антитела. Когда вирус видоизменяется в результате точечных мутаций, а это происходит часто и быстро, иммунная система почему-то не реагирует на эти изменения, продолжая производить антитела к самому первому варианту вируса. Именно этот феномен, как считает ряд ученых, стоит препятствием перед созданием эффективной вакцины против ВИЧ.

Открытие биологов из МГУ — Нефёдовой и Кима, — о котором упоминалось в самом начале, также говорит в пользу этой, эволюционной, версии.

Сегодня не только ВИЧ представляет опасность для человечества, хотя он, конечно, самый главный наш вирусный враг. Так сложилось, что СМИ уделяют внимание, в основном, молниеносным инфекциям, вроде атипичной пневмонии или МЕRS, которыми быстро заражается сравнительно большое количество людей (и немало гибнет). Из-за этого в тени остаются медленно текущие инфекции, которые сегодня гораздо опаснее и коварнее коронавирусов* и даже вируса Эбола. К примеру, мало кто знает о мировой эпидемии гепатита С, вирус которого был открыт в 1989 году**. А ведь по всему миру сейчас насчитывается 150 млн человек — носителей вируса гепатита С! И, по данным ВОЗ, каждый год от этой инфекции умирает 350-500 тысяч человек [33]. Для сравнения — от лихорадки Эбола в 2014-2015 гг. (на состояние по июнь 2015 г.) погибли 11 184 человека [34].
* — Коронавирусы — РНК-содержащие вирусы, поверхность которых покрыта булавовидными отростками, придающими им форму короны. Коронавирусы поражают альвеолярный эпителий (выстилку легочных альвеол), повышая проницаемость клеток, что приводит к нарушению водно-электролитного баланса и развитию пневмонии.

Рисунок 8. Электронная микрофотография воссозданного вируса H1N1, вызвавшего эпидемию в 1918 г. Рисунок с сайта phil.cdc.gov.
Почему же вдруг сложилась такая ситуация, что буквально каждый год появляются новые, всё более опасные формы вирусов? По мнению ученых, главные причины — это сомкнутость популяции, когда происходит тесный контакт людей при их большом количестве, и снижение иммунитета вследствие загрязнения среды обитания и стрессов. Научный и технический прогресс создал такие возможности и средства передвижения, что носитель опасной инфекции уже через несколько суток может добраться с одного континента на другой, преодолев тысячи километров.
Бактериофаги – это вирусы, которые поражают только бактерий. В ходе инфекции они влияют на все процессы жизнедеятельности бактериальной клетки, фактически превращая ее в фабрику по производству вирусного потомства. В конце концов клетка разрушается, а вновь образованные вирусные частицы выходят наружу и могут заражать новые бактерии.
Несмотря на огромное число и разнообразие природных фагов, встречаемся мы с ними редко. Однако бывают ситуации, когда деятельность этих вирусов не остается незамеченной. Например, на предприятиях, где производят сыры, йогурты и другие молочно-кислые продукты, часто приходится сталкиваться с вирусной атакой на бактерии, сбраживающие молоко. В большинстве таких случаев фаговая инфекция распространяется молниеносно, и полезные бактерии гибнут, что приводит к значительным экономическим потерям (Neve et al., 1994).
Именно благодаря прикладным исследованиям в интересах молочной промышленности, направленным на получение устойчивых к бактериофагам штаммов молочно-кислых бактерий, был открыт ряд механизмов, с помощью которых бактерии избегают инфекции. Параллельно были изучены способы, с помощью которых вирусы, в свою очередь, преодолевают бактериальные системы защиты (Moineau et al., 1993).
Кто защищен – тот вооружен
На сегодня известно пять основных, весьма хитроумных механизмов защиты, которые бактерии выработали в непрестанной борьбе с вирусами: изменение рецептора на поверхности клетки; исключение суперинфекции; системы абортивной инфекции; системы рестрикции-модификации и, наконец, системы CRISPR-Cas.
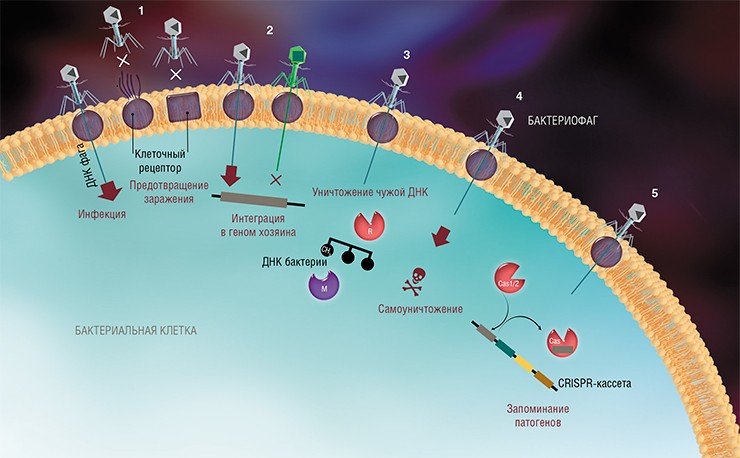
К средствам противовирусной защиты бактерий относятся и системы рестрикции-модификации, в которые входят гены, кодирующие два белка-фермента – рестриктазу и метилазу. Рестриктаза узнает определенные последовательности ДНК длиной 4—6 нуклеотидов и вносит в них двуцепочечные разрывы. Метилаза, напротив, ковалентно модифицирует эти последовательности, добавляя к отдельным нуклеотидным основаниям метильные группы, что предотвращает их узнавание рестриктазой.
Врага нужно знать в лицо
Системы CRISPR-Cas являются уникальным примером адаптивного иммунитета бактерий. При проникновении в клетку ДНК фага специальные белки Cas встраивают фрагменты вирусной ДНК длиной 25—40 нуклеотидов в определенный участок генома бактерии (Barrangou et al., 2007). Такие фрагменты называются спейсерами (от англ. spacer – промежуток), участок, где происходит встраивание, – CRISPR-кассета (от англ. Clustered Regularly Interspaced Short Palindromic Repeats), а сам процесс приобретения спейсеров – адаптацией.
Чтобы использовать спейсеры в борьбе с фаговой инфекцией, в клетке должен происходить еще один процесс, управляемый белками Cas, названный интерференцией. Суть его в том, что в ходе транскрипции CRISPR-кассеты образуется длинная молекула РНК, которая разрезается белками Cas на короткие фрагменты – защитные криспрРНК (крРНК), каждая из которых содержит один спейсер. Белки Cas вместе с молекулой крРНК образуют эффекторный комплекс, который сканирует всю ДНК клетки на наличие последовательностей, идентичных спейсеру (протоспейсеров). Найденные протоспейсеры расщепляются белками Cas (Westra et al., 2012; Jinek et al., 2012).
Системы CRISPR-Cas обнаружены у большинства прокариот – бактерий и архей. Хотя общий принцип действия всех известных систем CRISPR-Cas одинаков, механизмы их работы могут существенно отличаться в деталях. Наибольшие различия проявляются в строении и функционировании эффекторного комплекса, в связи с чем системы CRISPR-Cas делят на несколько типов. На сегодняшний день описаны шесть типов таких неродственных друг другу систем (Makarova et al., 2015; Shmakov et al., 2015).
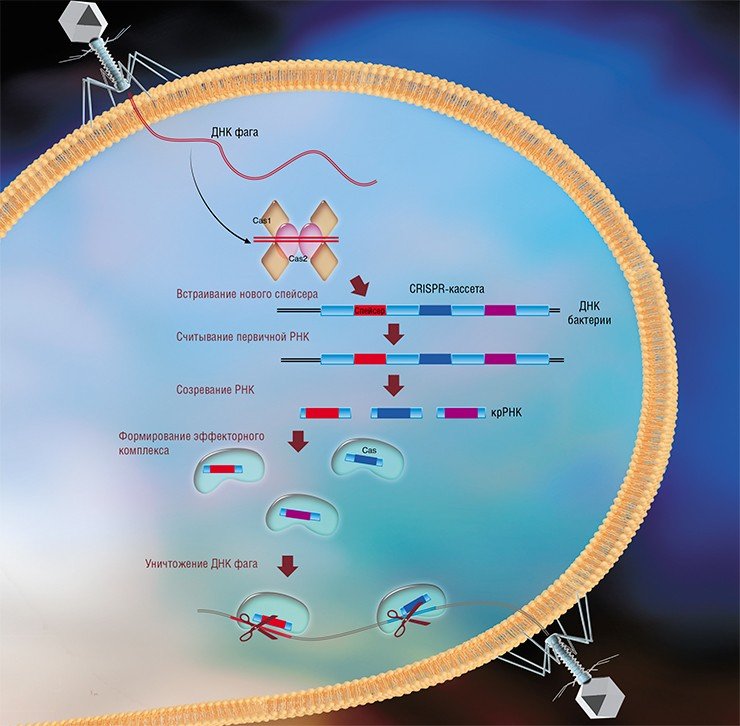
Наиболее изученной является система CRISPR-Cas I типа, которой обладает излюбленный объект молекулярно-биологических исследований – бактерия кишечная палочка (Esсherichia coli). Эффекторный комплекс в этой системе состоит из нескольких небольших белков Cas, каждый из которых отвечает за разные функции: разрезание длинной некодирующей CRISPR РНК, связывание коротких крРНК, поиск, а затем разрезание ДНК-мишени.
Гонка вооружений
Бактериофаги, как факторы среды, вызывают направленные изменения в геноме бактерий, которые наследуются и дают бактериям явное преимущество, спасая от повторных инфекций. Поэтому системы CRISPR-Cas можно считать примером ламарковской эволюции, при которой происходит наследование благоприобретенных признаков (Koonin et al., 2009)
Некоторые бактериофаги реагируют на наличие в бактериальной клетке систем CRISPR-Cas выработкой особых анти CRISPR-белков, способных связываться с белками Cas и блокировать их функции (Bondy-Denomy et al., 2015). Еще одно ухищрение — обмен участков генома вируса, на которые нацелена система CRISPR-Cas, на участки геномов родственных вирусов, отличающихся по составу нуклеотидной последовательности (Paez-Espino et al., 2015).
Благодаря постоянному совершенствованию биоинформатических алгоритмов поиска, а также включению в анализ все большего количества прокариотических геномов, открытие новых типов CRISPR-Cas систем является делом недалекого будущего. Предстоит также выяснить и детальные механизмы работы многих недавно открытых систем. Так, в статье, опубликованной в 2016 г. в журнале Science и посвященной анализу системы CRISPR-Cas VI типа, описан белок С2с2, образующий эффекторный комплекс с крРНК, который нацелен на деградацию не ДНК, а РНК (Abudayyeh et al., 2016). В будущем такое необычное свойство может быть использовано в медицине для регулирования активности генов путем изменения количества кодируемых ими РНК.
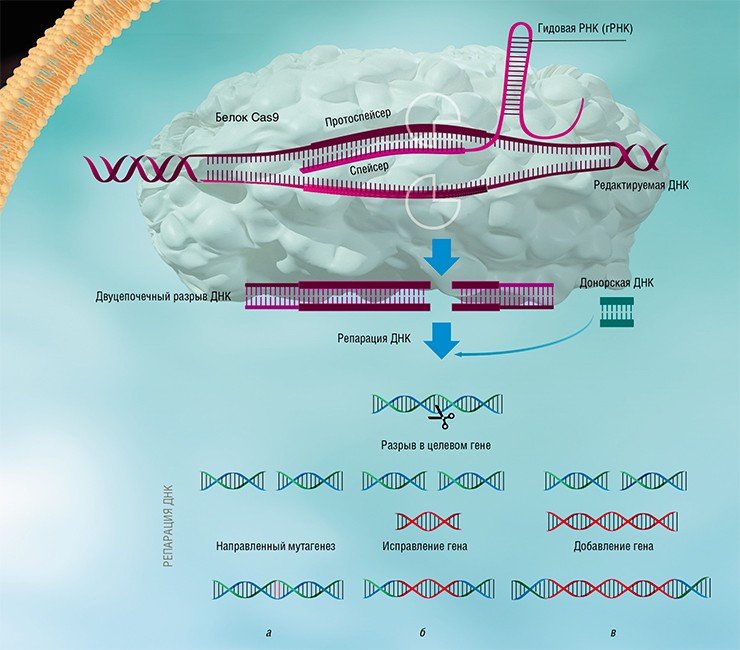
Изучение стратегий борьбы бактерий с бактериофагами, несмотря на свою кажущуюся фундаментальность и отвлеченность от задач практической медицины, принесло неоценимую пользу человечеству. Примерами этого могут служить методы молекулярного клонирования и редактирования геномов – направленного внесения или удаления мутаций и изменения уровня транскрипции определенных генов.
Благодаря быстрому развитию методов молекулярной биологии всего лишь через несколько лет после открытия механизма действия систем CRISPR-Cas была создана работающая технология геномного редактирования, способная бороться с болезнями, ранее считавшимися неизлечимыми. Доступность и простота этой технологии позволяют рассматривать ее как основу для медицины, ветеринарии, сельского хозяйства и биотехнологий будущего, которые будут базироваться на направленных и безопасных генных модификациях.
Нет никаких сомнений, что дальнейшее изучение взаимодействия бактерий и их вирусов может открыть перед нами такие возможности, о которых мы сейчас даже не подозреваем.
Abudayyeh O. O., Gootenberg J. S., Konermann S. et al. C 2c2 is a single-component programmable RNA-guided RNA-targeting CRISPR effector // Science. 2016. V. 353: aaf5573.
Barrangou R., Fremaux C., Deveau H. et al. CRISPR provides acquired resistance against viruses in prokaryotes // Science. 2007. V. 315. P. 1709–1712.
Bikard D., Marraffini L. A. Innate and adaptive immunity in bacteria: mechanisms of programmed genetic variation to fight bacteriophages // Curr. Opin. Immunol. 2012. V. 1 P. 15–20.
Bondy-Denomy J., Garcia B., Strum S. et al. Multiple mechanisms for CRISPR-Cas inhibition by anti-CRISPR proteins // Nature. 2015. V. 526. P. 136–139.
Calendar R., Abedon S. T. The Bacteriophages // 2nd Ed., Oxford University Press. 2006.
Datsenko K. A., Pougach K., Tikhonov A. et al. Molecular memory of prior infections activates the CRISPR/Cas adaptive bacterial immunity system // Nat. Commun. 2012. V. 3. P. 945
Jiang W., Marraffini L. A. CRISPR-Cas: New Tools for Genetic Manipulations from Bacterial Immunity Systems // Annu. Rev. Microbiol. 2015. V. 69. P. 209–28.
Jinek M., Chylinski K., Fonfara I., et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity // Science. 2012. V. 337. P. 816–821.
Koonin E. V., Wolf Y. I. Is evolution Darwinian or/and Lamarckian? // Biol. Direct. 2009. V. 4. P. 42.
Lopez-Pascua L., Buckling A. Increasing productivity accelerates host-parasite coevolution // J. Evol. Biol. 2008. V. 3. P. 853–860.
Makarova K. S., Wolf Y. I., et al. An updated evolutionary classification of CRISPR-Cas systems // Nat. Rev. Microbiol. 2015. V. 11. P. 722–736.
Moineau, S., Pandian S., Klaenhammer T. R. Restriction/modification systems and restriction endonucleases are more effective on lactococcal bacteriophages that have emerged recently in the dairy industry // Appl. Envir. Microbiol. 1993. V. 59. P. 197–202.
Neve H., Kemper U., et al. Monitoring and characterization of lactococcal bacteriophage in a dairy plant // Kiel. Milckwirtsch. Forschungsber. 1994. V. 46. P. 167–178.
Nuñez J. K., Harrington L. B., et al. Foreign DNA capture during CRISPR-Cas adaptive immunity // Nature. 2015a. V. 527. P. 535–538.
Nuñez J. K., Kranzusch P. J., et al. Cas1-Cas2 complex formation mediates spacer acquisition during CRISPR-Cas adaptive immunity // Nat. Struct. Mol. Biol. 2014. V. 21. P. 528–534.
Nuñez J. K., Lee A. S., Engelman A., Doudna J. A. Integrase-mediated spacer acquisition during CRISPR-Cas adaptive immunity // Nature. 2015b. V. 519. P. 193–198.
Paez-Espino D., Sharon I., et al. CRISPR Immunity Drives Rapid Phage Genome Evolution in Streptococcus thermophilus // MBio. 2015. V. 6: e00262–15.
Shmakov S., Abudayyeh O. O., Makarova K. S., et al. Discovery and Functional Characterization of Diverse Class 2 CRISPR-Cas Systems. // Mol. Cell. 2015. V. 60. P. 385–397
Tan D., Svenningsen S. L., Middelboe M. Quorum sensing determines the choice of antiphage defense strategy in Vibrio anguillarum. // mBio 2015. V. 6: e00627–15.
Westra E. R., van Erp P. B., Künne T., et al. CRISPR immunity relies on the consecutive binding and degradation of negatively supercoiled invader DNA by Cascade and Cas3 // Mol. Cell. 2012. V. 46. P. 595–605.
Работа поддержана грантом РФФИ (№ 16-34-01176)
Читайте также:


