Вирусы генная и клеточная инженерия
Как создать убийцу
Смертельный вирус, созданный генными инженерами, вырывается из пробирки. Страшная болезнь поражает экспериментаторов, их родственников и жителей беззащитного городка в сердце Америки. Эпидемия вот-вот охватит планету. И самое страшное в том, что миллионы будущих жертв ни о чем не догадываются…
Такое голливудское начало сделает честь любому бульварному изданию, только к действительности будет иметь весьма опосредованное отношение. Потому что открытие, о котором пойдет речь, как раз и позволяет предотвратить биологическую угрозу. И потому что ученые в большинстве своем – люди вменяемые, и за тридцать с лишним лет манипулирования генами ни одного голливудского сюжета не случилось. Проблемы с безопасностью бывают, иногда с трагическим исходом, но новая технология есть риск, и важно этот риск правильно оценить.
Итак, речь о генной инженерии, а также о генной терапии – внесении новых генов в человеческие клетки. Допустим, у вас есть подозрение, что некий ген-мутант вызывает рак. Что делает исследователь? Переносит кусочек ДНК с этим геном в здоровые клетки, где он встраивается в хромосому. Эти клетки специально выращивают вне организма в так называемой клеточной культуре в чашках Петри. Затем смотрим, что изменяется в клетке – к примеру, возникает рак или нет.
Таким примерно образом получена большая часть информации о том, как гены управляют нашим организмом и как организм управляет нашими генами.
Генная терапия – штука еще более многообещающая. Рак, диабет, иммунодефициты, миодистрофии – практически все болезни можно лечить, если ввести больному человеку здоровые гены. Ученые и врачи предрекают, что именно за генной терапией будущее медицины. Но…
– Для меня все началось около двух лет назад, – говорит Евгений Кандел, профессор онкологии Института имени Розвелла Парка в американском городе Буффало.– Мой друг Роберт Сильверман изучал рак простаты и обнаружил у нескольких пациентов новый вирус. Этот вирус оказался очень похож на то, что я использовал в лаборатории каждый день – на вирус лейкемии мышей. Я был шокирован.
Вирус как средство передвижения
С вирусом лейкемии мышей работают в сотнях лабораторий по всему миру. Точнее, работают не с самим вирусом, а с генными конструкциями на его основе – так называемыми векторами. Нужны они для того, чтобы переносить отдельные гены в клетки млекопитающих и наблюдать, как они там работают.
Ген – это не ящик с пивом, который можно перенести из одного места в другое, чтобы продолжить вечеринку. Это участок молекулы ДНК с началом, концом, определенной последовательностью элементов и так далее. Чтобы ее перенести из клетки в клетку, нужны специальные способы. Когда тридцать лет назад эти способы придумывали, возникла идея использовать те механизмы, которые уже придумала природа.
Самым известным из них пользуются ретровирусы (к этому семейству относится, например, ВИЧ). Действует он так: вирусная частица сливается с клеточной мембраной и выплескивает содержимое внутрь клетки человека или животного. Главное в этом содержимом – гены вируса, которые сначала встраиваются в хромосому, а затем размножаются, заставляя работать на себя всю биохимическую машину клетки, собирать новые вирусные частицы. В конце концов эти частицы выходят из клетки и заражают соседние. Так распространяется инфекция.
Смесь мыши и человека
Самым изученным был вирус лейкемии мышей (MLV) – на его основе делалось и делается множество векторов. Чтобы держать процесс под контролем, из вируса удаляют гены, которые отвечают за сборку новых частиц. Для размножения такого вируса используют специальные упаковочные клетки. Но когда этот вектор проникает в обычную клетку, способности размножаться у него уже нет.
То есть система срабатывает один раз, и встроившийся в новую клетку вектор ведет себя просто как еще один из десятков тысяч генов хозяина. Быстро, удобно, безопасно.
Главное, чтобы в новой клетке не оказалось другого вируса, попавшего туда естественным путем: он может предоставить нашему вектору недостающие механизмы размножения. До последнего времени такая встреча в человеческих клетках считалась маловероятной – откуда в них взяться мышиному вирусу?
Векторами переносят множество генов во множестве лабораторий, недавно их стали использовать в генной терапии, то есть вводить пациентам в лечебных целях.
– Новый вирус, открытый Сильверманом, назвали XMRV. Обсуждали его в основном среди онкологов, и его сходство с вирусом лейкемии мышей не вызывало большого интереса. Но я-то всю жизнь занимался созданием векторов, – говорит профессор Кандел. – И у меня возникло подозрение, что новый вирус может помогать нашим векторам размножаться и производить вирусные частицы. Мы немедленно поставили эксперименты, которые моделировали ситуацию, когда ретровирусный вектор попадает в клетку, где уже есть XMRV.
В ходе экспериментов, результаты которых недавно опубликованы в журнале PloS ONE, выяснилось, что да, вектор начинает активно размножаться и может заражать новые клетки. И это – проблема.
Лечиться от рака, умереть от инфекции
Теперь представьте, что этот человек заражен вирусом XMRV. Вектор устойчивости размножается и передается соседним клеткам, в том числе и раковым. Те соответственно становятся нечувствительны к любой химии. И вместо выздоровления мы получаем совершенно неизлечимый вариант. Да еще и с риском передачи другим.
Другой пример – случайное заражение в лаборатории. Здесь даже сложно сказать, что именно может человек подцепить, так как гены внутри векторов – абсолютно любые. Если лабораторный вектор попадет к человеку-носителю, то тот не только заболеет сам, но может и другим его передать.
Как будет распространяться новый вирус – во время секса, с кровью, через пищу? – этого никто не знает. Точно так же неизвестно, каких масштабов может быть эпидемия.
Генетическая служба безопасности
Подобных страшных, но реалистичных сценариев можно придумать много. Понятно, что от них нужна какая-то защита. Но как защищаться? Ведь генная инженерия – это хорошо, и никто от нее отказываться не собирается.
Защита при работах по манипуляции с генами поставлена неплохо, особенно там, где используют реально опасные вирусы. Но пока недостаточно изучено, какие искусственные генные конструкции уже проникли в природу – и проникли ли. И очень мало информации о том, как такие конструкции могут взаимодействовать с природными организмами и вирусами, которые в них обитают.
Многим казалось, что вопрос сам собой был снят после Асиломарской конференции 1975 года, когда генетики разработали правила безопасности. Но время идет вперед, появляются новые угрозы. Здесь возникает еще одна проблема: защищаться можно только от того, потенциальная опасность чего уже известна. Как в случае с векторами на основе вируса лейкемии мышей.
С давних пор человек мечтал о том, чтобы разводимые им животные были больше, выносливее и продуктивнее. Чтобы выращиваемые им сельскохозяйственные культуры вызревали в кратчайшие сроки, не поражались вредителями и болезнями, росли даже в условиях пониженных температур окружающего воздуха и отсутствия регулярных дождей.
Основные технологии
Основным методом достижения таких результатов является клеточная инженерия. Наиболее детально все ее приемы отработаны на некоторых микроорганизмах. Вообще, дальнейшие возможности и перспективы данного направления попросту необъятны. На данный момент ведутся углубленные разработки по выделению отдельных генов, которые и можно встраивать в организм. Проще говоря, можно будет создавать домашних животных и растения, которые бы обладали строго определенным набором признаков и имели требуемый внешний вид.
Методы клеточной инженерии
Всем растительным клеткам присуще свойство тотипотентности (это когда отдельная клетка может развиться в целый организм). В сельском хозяйстве это дает неограниченные перспективы в экспериментах по выведению новых видов полезных человеку культур. Весьма перспективна клеточная инженерия в животноводстве. В настоящее время ученые имеют громадный опыт по накоплению и хранению соматических клеток разнообразных пород животных in vitro. Особенно это касается хранения материала в условиях низких температур.
Кстати, а какие существуют методы клеточной инженерии животных? Давайте их обсудим.
Разделение эмбрионов на ранних стадиях
На сегодняшний день особенно перспективен метод разделения ранних эмбрионов. Первый толчок этому направлению дала начавшая развиваться трансплантология, методы которой позволили сохранять большое количество полученных эмбрионов. Вообще, первый удачный опыт по разделению зародышевого материала на стадии 2—8 был проведен Виллардом (в английском Кембридже). Недостаток такого метода в его трудоемкости, из-за чего данная операция может быть выполнена только в условиях хорошо оснащенного медицинского учреждения.
Проще говоря, это чрезвычайно сложная биотехнология. Клеточная инженерия в наше время использует куда более простые методы.
Позднее разделение зародышей
Так, ученые начали манипулировать зародышевым материалом только на более поздних стадиях (морула, бласто-циста). Сущность метода состоит в том, что сперва вскрывается прозрачная зона (pellucida), после чего эмбрион аккуратно разделяется надвое. Одна половинка остается на прежнем месте, в то время как вторую часть переносят в заранее подготовленную зону.

Первыми в этих опытах были американские ученые. Именно они сделали вывод, что если лишить эмбрион прозрачной оболочки, то он выживает не более чем в 15% случаев, но если слой пеллюцида сохранить, то выживаемость сразу увеличивается до 35% случаев. Наиболее оптимальные результаты получаются в том случае, если у каждой половинки разделенного эмбриона есть прозрачная оболочка и каждую часть вводят в отдельный рог матки: в современных условиях выживает до 75% эмбрионов.
Но для каких целей используется клеточная инженерия на практике? Какие результаты получают с ее помощью?
Значение клеточной инженерии в племенном деле
На сегодняшний день эта методика все более активно начинает использоваться в международном племенном деле. Сравнительно недавно была успешно опробована методика получения и внедрения эмбрионов у свиней. Исследователи считают, что клеточная инженерия может позволить увеличить количество потомков одного животного минимум на 30—35%. Но не стоит забывать и о возможности получения генетических копий.
Такие животные едва ли не на вес золота для тех ученых, которые изучают взаимодействие окружающей среды и генотипа. Дело в том, что наличие двух совершенно одинаковых особей позволяет свести к минимуму влияние внутренних факторов при изучении влияния внешней среды на организм. Кроме того, можно производить забой одного животного из пары в том случае, если для исследования требуются данные о внутреннем состоянии организма.
Все эти разработки – основные методы клеточной инженерии. Но мы забыли рассказать о важнейшем направлении этой отрасли наук, связанном с искусственной регуляцией пола сельскохозяйственных животных. Пора исправить этот недочет.
Методы регуляции пола

Конечно же, в идеале стоило бы попросту разделять спермии, которые несут Х- и У-хромосомы. Именно в этом направлении и должны развиваться исследования. Другой подход (который куда проще, а потому используется) состоит в том, чтобы извлекать ранние эмбрионы из репродуктивной системы самок, определять их пол, а затем производить их трансплантацию.
Но как ко всему этому относятся методы клеточной инженерии? Все достаточно просто.
Все дело в цитологическом методе, при помощи которого определяют тип эмбриона XX или XY. Делается это посредством изучения хроматина или же половых хромосом. В последние годы также выяснено, что выяснить пол можно, изучив специфические антитела, которые у самок и самцов совершенно разные. Есть также мнения некоторых ученых, что установить гендерную принадлежность можно, изучив активность глюкозо-6-фосфат-дегидрогеназы. Впрочем, в настоящее время наиболее эффективны цитологический и иммунологический (изучение антител) методы.
Генная инженерия
В названии данной статьи неслучайно используется словосочетание "генная и клеточная инженерия". Какими бы эффективными ни были методы коррекции клеточного материала, работа непосредственно с генами всегда будет намного более эффективной.
В настоящее время именно генетические методы постепенно завоевывают лидирующую роль в животноводстве и растениеводстве всего мира. Благодаря им селекционная работа вышла на принципиально иной уровень: отныне ученые могут не просто предполагать, какими именно качествами будет обладать создаваемая ими особь, но знать это наверняка.
Нужно сразу заметить, что все не так уж и хорошо. Имеются некоторые ограничения. Дело в том, что к генетическим манипуляциям допускается только генетический материал быков, которые могут улучшать свое потомство (улучшатели). Проблема только в том, что таких животных на сегодняшний день чрезвычайно мало. Кроме того, программы, направленные на искоренение того же мастита, пока что видимых результатов не дают. Проще говоря, генная и клеточная инженерия – далеко не панацея.

Сравнительно недавно учеными был создан метод переноса ядра после слияния кариопластов. Кроме того, методы генной и клеточной инженерии уже сейчас позволяют создавать химерические организмы на основе различных видов мекопитающих.
Гарднером вскоре был разработан принципиально новый метод, при котором производится имплантация бластомеров в бластоцисты реципиента. Бутлером данная методика была успешно отработана на лабораторных мышах. Именно на основании данных разработок впервые были получены химеры на основе организма овец.
Все описанные выше работы постепенно готовили мировую сельскохозяйственную науку к широкому внедрению методов генной инженерии. Наиболее распространенным методом на сегодняшний день является перенос генного материала в культивируемые клетки с последующим их внесением в бластоцисту.
Развернутое определение
Так в чем состоит суть генной инженерии? В середине 70-х годов прошлого века ученые сделали сенсационное открытие. Они выяснили, что некоторые микробные ферменты способны разрезать молекулу ДНК в необходимом месте. Проще говоря, появилась уникальная возможность получать генетический материал со строго заданными свойствами.
- Ген должен иметь какую-то четкую характеристику, которую и предстоит детектировать.
- Выделенный генетический материал требуется прикрепить к переносчику (вирусу, к примеру), который и произведет его трансплантацию.
Проще говоря, выделенный ген из организма донора нужно перенести в организм реципиента, для которого он является чужим. Главное в работе исследователей – не просто добиться его приживления, но и создать такие условия, при которых он будет нормально реплицироваться.
Работа с зиготой
Впрочем, в последние годы не меньшее распространение получила методика, при которой чужеродные гены инъецируют в пронуклеус зиготы животных. Впервые этот способ был апробирован на ооцитах озерных лягушек: сперва в них вводилась определенная ДНК, причем учеными сразу были отмечены интеграция и транскрипция. В 1981 году впервые был проведен интереснейший эксперимент, в ходе которого ген гаммаглобулина кролика был внесен в зиготу мыши.
Ген при этом имел вид длинного геномного тандема, содержащего стабильные участки. Любопытно, но правильно транскрибировались они только при том условии, если в них совершенно не было плазмидных компонентов. Проявление генов, которые были встроены с использованием этого метода, было подробнейшим образом изучено на лабораторных мышах.
За один год до экспериментов с зиготой мыши, в 1980 году, в пронуклеус все той же мышиной зиготы поместили плазмиду pBR322, в которой содержались фрагменты вирусов SK40 и HSV. В результате ДНК вируса была найдена у трех мышей из 78 особей, которые участвовали в эксперименте. Как ни странно, но при инъекции гена гаммаглобулина человека его интеграция наблюдалась уже у пяти мышей из 33 особей (более 15%). Этот опыт уже тогда доказал, что создание химерических организмов, которые бы сочетали в себе черты сразу нескольких видов, вполне реально.
Бринстер и его последователи с учениками произвели трансплантацию в пронуклеусы зигот мышей специально подготовленной конструкции, в состав которой входил металлотионеин мыши, а также ген тимидинкиназы. В этом случае полная интеграция была отмечена уже у 17% лабораторных животных.
Основные выводы
В настоящее время генная инженерия наконец-то стала перспективной, обсуждаемой отраслью науки. Об этом знают практически все. Но в чем же состоят задачи клеточной инженерии и работы с генетическим материалом? О, они весьма разнообразны.
Во-первых, перед учеными всего мира стоит задача усмирения, снижения голода на всей планете. Методы генной и клеточной инженерии делают вполне реальным создание таких сортов растений и видов животных, продуктивность которых будет в десятки раз превышать таковую у их диких предков.
Специалисты говорят, что именно методы генной инженерии уже в ближайшем будущем позволят не только диагностировать на предельно ранних сроках беременности генетические болезни (синдром Дауна, к примеру), но и эффективно их лечить!
В научном сообществе постоянно происходят новые открытия, позволяющие приблизиться к лечению серьезных болезней или тяжелых и неизлечимых на сегодняшний день, инфекций. Всего за несколько лет исследовательские лаборатории по всему миру освоили новую технологию, которая облегчает внесение определенных изменений в ДНК человека, животных, растений и бактерий. По сравнению с предыдущими методами модификации ДНК этот новый подход намного быстрее и проще трансформирует геном. Эта технология называется CRISPR/Cas-система, и она изменила не только то, как проводятся базовые исследования, но и то, как в будущем можно будет лечить заболевания, вызванные вирусами. Развитие этой технологии в скором времени, возможно, позволит искусственно создавать иммунитет ко многим опасным вирусам.
Что такое CRISPR: роль в борьбе с инфекциями
CRISPR — это сокращенное название Clustered Regulars Interspaced Short Palindromic Repeat (короткие палиндромные повторы, расположенные регулярными группами). Система CRISPR/Cas обнаружена в геномах бактерий и других микроорганизмов. CRISPR-кассета — это название относится к уникальным коротким фрагментам ДНК (до 48 пар нуклеотидов), частично палиндромным и повторяющимся. С ней ассоциированы участки Cas (гены, кодирующие определенные белковые молекулы). Хотя последовательности CRISPR кажутся простыми, они являются важнейшим компонентом иммунной системы бактерии или иных простых форм жизни. Иммунная система отвечает за защиту организма от инфекции и внешней агрессии. Как и тело человека, различные бактерии могут быть заражены вирусами, которые являются еще более маленькими инфекционными агентами.
Борьба бактериальных клеток против вирусов
Если вирусная инфекция угрожает бактериальной клетке, иммунная система CRISPR/Cas может помешать атаке, разрушив геном внедряющегося вируса. Любой вирус имеет внутри себя генетический материал, необходимый для продолжения репликации (размножения) вирионов внутри зараженных им клеток. Таким образом, разрушая вирусный геном, иммунная система CRISPR/Cas защищает бактерии от вирусной инфекции. Это свойство не помешало бы иметь и человеку, учитывая, что ему угрожают многочисленные вирусы, начиная от гриппа, и заканчивая ВИЧ. Если говорить просто, эта относительно небольшая система создает иммунитет, и патогенный вирус просто не может заразить клетки.
Механизмы CRISPR-опосредованного иммунитета
Пока CRISPR/Cas — это области, обнаруженные только в бактериальном геноме, которые помогают защищаться от вторжения вирусов. Их активно изучают, чтобы в дальнейшем проводить попытки создать подобный иммунитет на уровне ДНК и для людей. Структура CRISPR/Cas уникальной области, формирующей иммунитет против вирусной инфекции, состоит из:
Когда ранее неизвестный ей вирус заражает бактерию, новый спейсер, полученный из вируса, внедряется в ДНК-цепочку. При помощи лидерной последовательности запускается считывание последовательности CRISPR, информация обрабатывается, происходит запоминание и хранение информации о перенесенной агрессии.
Для уничтожения опасных мишеней используются белки или белковые комплексы, которые атакуют вирусную ДНК, разрушая ее на фрагменты. Другими словами, это своеобразный иммунитет, который позволяет увидеть и уничтожить куски чужой, вирусной ДНК, которые внедрились в клетку.
Оставьте свой email, чтобы всегда получать важную информацию и сервисы для сохранения вашего здоровья
Как бактерии сопротивляются вирусной агрессии?

Иммунная система CRISPR/Cas защищает бактерии от вирусных инфекций формируя иммунитет. Это происходит последовательно:
Помочь в лечении болезней человека
Специфичность иммунитета на основе CRISPR/Cas в распознавании и уничтожении вторгающихся вирусов годится не только для бактерий. Применение этой системы крайне полезно для медицины и борьбы с болезнями человека, которые провоцируют вирусы. Кроме того, технологи пользуются в промышленности, для защиты полезных бактерий, используемых в производстве продуктов и лекарств.
Первоначальное открытие иммунитета CRISPR было сделано исследователями компании, занимающейся производством пищевых продуктов (йогурты и сыры).
Ученые используют технологию CRISPR/Cas в лаборатории для формирования точных изменений в генах мух-дрозофил, рыб, мышей, растений и даже клеток человека. Гены — это конкретные последовательности ДНК, которые дают инструкции о том, как строить и поддерживать клетки организма, устранять определенные болезни. Изменение в последовательности даже одного гена может значительно повлиять на работу клетки и, в свою очередь, на здоровье организма. Система CRISPR/Cas позволяет ученым модифицировать определенные гены, сохраняя при этом все остальные, таким образом, проясняя связь между данным геном и определенными болезнями организма.
Если говорить образно, эта технология — своеобразный текстовый редактор, в котором ДНК — это последовательность слов, из которой вырезаются определенные фрагменты и оценивается итоговый результат. Так выявляются болезни, закодированные в том или ином гене, и ищутся методы его активации или блокировки.
08 декабря 2017
- 17464
- 14,6
- 0
- 24
Полвека назад человек вплотную приблизился к возможности примерить на себя роль творца, творца самого настоящего, способного целенаправленно наделять создаваемые им организмы нужными чертами. Научившись напрямую манипулировать генами, из селекционера он превратился в инженера. Что же подвело его к этой черте и как изменился мир после? Предлагаем заглянуть в историю генной инженерии: вспомнить важнейшие открытия, сформировавшие ее теоретическую основу и методический арсенал, поразмышлять над этическими вопросами и оценить вес генно-инженерных разработок в денежном эквиваленте.

12 биологических методов в картинках

И вот мы решили рассказать о лабораторных методах более системно, собрать воедино в одной рубрике самые главные, самые современные биологические методики. Чтоб было интереснее и нагляднее, мы густо проиллюстрировали статьи и даже кое-где добавили анимации. Мы хотим, чтобы статьи новой рубрики были интересны и понятны даже случайному прохожему. И с другой стороны — чтобы они были так подробны, что даже профессионал мог бы обнаружить в них что-то новое. Мы собрали методики в 12 больших групп и собираемся сделать на их основе биометодический календарь. Ждите обновлений!
Генетическая, или генная, инженерия — это не отдельная наука, а огромная и постоянно развивающаяся научно-технологическая платформа, вобравшая в себя самое ценное из генетики, биохимии и химической инженерии, молекулярной и клеточной биологии, микробиологии и вирусологии. Благодаря этой платформе у землян появилась возможность обсуждать такие понятия, как генетически модифицированный организм (ГМО) и генная терапия. Генная инженерия в широком смысле — это третье поколение инструментов для изменения наследственной информации. В отличие от первых двух — селекции, применяемой тысячелетиями, и индуцированного мутагенеза, создавшего с начала 20 века более двух тысяч разновидностей растений [1], — новый инструмент работает прецизионно и быстро. А потому порождает непредставимые ранее научные соблазны и коллективные фобии. Кто-то видит в генной инженерии спасение человечества, кто-то — козни дьявола, но все сходятся в одном: она изменила мир. Инструментарий и технологии генной инженерии мы разберем во второй части статьи, а пока пройдем путем, по которому шли ученые к созданию этой отрасли и ее современным достижениям (рис. 1).

История генной инженерии

Рисунок 2. Пол Берг со своей невестой Милли. Кстати, будущий нобелевский лауреат родился в семье, перебравшейся в США из маленькой деревушки под Минском.

Рисунок 3. Герберт Бойер и Стэнли Коэн — создатели первого трансгенного организма и обладатели первого генно-инженерного патента.
Существенно продвинуться в понимании природы наследственности помогли мушки дрозофилы, а затем и бактерии. В 1910-м профессор Колумбийского университета Томас Морган (рис. 4) показал, что гены расположены линейно на хромосомах и образуют группы сцепления. Этим он заслужил Нобелевскую премию [10]. Морган и его сотрудники — Бриджес, Стёртевант и Мёллер — составили первые карты хромосом, экспериментально подтвердили и развили хромосомную теорию наследственности Саттона и Бовери [11].


Рисунок 5. Они показали, что наследственная информация записана в ДНК: Колин Маклауд, Освальд Эвери, Маклин Маккарти.
В 1940-х и начале 1950-х Эдвард Тейтем, Нортон Зиндер, Джошуа и Эстер Ледерберги (рис. 6) описали основные процессы переноса генетического материала между бактериальными клетками с помощью плазмид и фагов (в частности, конъюгацию и трансдукцию). Эти мобильные генетические элементы [12] позже стали неотъемлемыми компонентами арсенала генного инженера.

Рисунок 6. Джошуа и Эстер Ледерберги. Несмотря на сексистскую атмосферу тех лет, Эстер Мириам Ледерберг заслужила искреннее восхищение коллег: в числе ее заслуг — открытие и изучение фага λ, F-плазмиды и трансдукции, введение знакомого теперь каждому микробиологу и многим генным инженерам метода реплик, организация в Стэнфорде специализированного плазмидного центра.

В том же году сотрудник Кембриджа Александер Робертус Тодд, изучавший структуру нуклеотидов, впервые химически синтезировал один из них — аденозинтрифосфат, или АТФ (сахар рибоза + азотистое основание аденин + фосфатные группы).
В 1953 году произошло эпохальное событие — установление молекулярной структуры ДНК. Верную модель обычной, B-формы, ДНК построили сотрудники Кембриджского университета Джеймс Уотсон и Фрэнсис Крик, а базисом для ее создания послужили работы рентгеноструктурщиков из Королевского колледжа Лондона — Мориса Уилкинса и Розалинд Франклин с ее аспирантом, Реймондом Гослингом (рис. 8). Дифракционное изображение кристаллизованной ДНК указывало на ее двуспиральный характер, и Франклин даже удалось рассчитать некоторые параметры этой спирали. Уотсон и Крик, заполучив материалы Франклин и держа в уме пропорции азотистых оснований, вычисленные в 1950-м Эрвином Чаргаффом, предположили, как закодирована и как передается наследственная информация. Полуконсервативный механизм репликации ДНК в знаменитом изотопном эксперименте доказали Метью Мезельсон и Франклин Сталь в 1958 году.
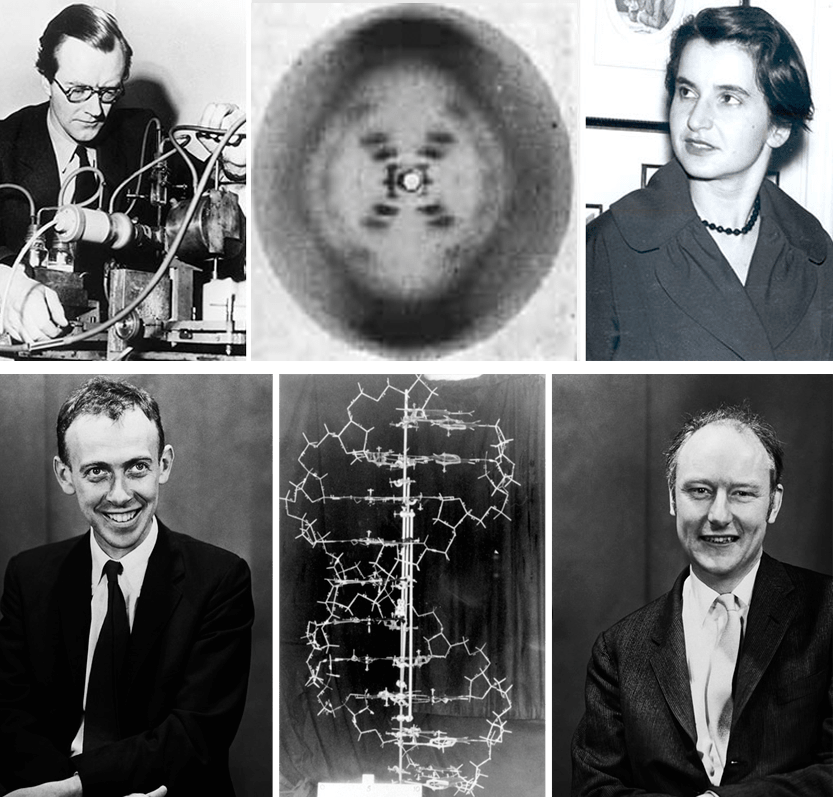
Рисунок 8. Им покорилась двойная спираль. Вверху — Морис Уилкинс и Розалинд Франклин с вошедшим в историю Фото 51 — самой удачной рентгенограммой ДНК. Внизу — Джеймс Уотсон и Фрэнсис Крик со своей моделью ДНК. Им всё-таки удалось опередить другого талантливого ученого — Лайнуса Полинга, известного своей любовью к аскорбинке и расшифровке структуры молекул.
В 1955-м Северо Очоа де Альборнос с аспиранткой, Марианной Грюнберг-Манаго (уроженкой Петрограда и будущим президентом Международного биохимического союза), выделили бактериальную полинуклеотидфосфорилазу и с ее помощью синтезировали в пробирке РНК. Позже оказалось, что синтез для этого фермента скорее хобби, основная же его работа — деградация РНК. В 1956-м Артур Корнберг (рис. 9) со своей женой Сильви выделил один из ферментов синтеза и коррекции ДНК — ДНК-полимеразу I — и получил с его помощью цепочку ДНК [15]. Как и в случае Очоа, фермент Корнберга не был главным строителем полинуклеотидных цепей, однако стал одним из основных инструментов генной инженерии.

Примерно тогда же, наконец, всплыли вопросы регуляции работы генов — те, что чуть раньше научное сообщество не хотело слышать из уст Барбары Макклинток. Жакоб вместе с Жаком Моно описали лактозный оперон и показали, что синтез ферментов контролируется внешними условиями посредством регуляторных белков, которые подавляют или активируют транскрипцию.

Рестриктазы стали жизненно важным инструментом для генной инженерии. Они нашли применение не только в технологии рекомбинантных ДНК, но и в геномной дактилоскопии и техниках секвенирования (прочтения) нуклеотидных последовательностей [16], [19]. Первые рекомбинантные ДНК получили с помощью эндонуклеазы EcoRI, правда, группы Берга и Коэна использовали ее немного по-разному. В считаные годы спрос на эти ферменты так возрос, что академические энтузиасты, выделявшие уже известные и новые рестриктазы, перестали справляться со снабжением всех желающих, и тогда за дело взялись коммерсанты: в 1975-м — New England Biolabs, а позже и другие компании. К октябрю 2017 года было выделено уже 4 155 эндонуклеаз II типа. Найти всю информацию о них и системах рестрикции-модификации в целом можно в базе данных REBASE.
Как резать и сшивать ДНК, стало более или менее ясно, но оставалась проблема универсального (не узкоспециализированного типа конъюгации или трансдукции) внесения нуклеиновых кислот в клетки. У кишечной палочки давно было замечено нежелание поглощать ДНК из среды, но в 1970-м эту проблему разрешили Мортон Мандель и Акико Хига. Обработка клеток E. coli хлоридом кальция сделала их компетентными, то есть способными принимать генетический материал извне. Немного усовершенствованный, этот метод и сейчас широко используют для трансформации бактерий. В те же 70-е изучили трансформирующие свойства Ti-плазмид в отношении растительных клеток и применили микроинъекции, а в 80-е сконструировали электропоратор и генную пушку [20]. С появлением последней стало возможным интегрировать чужеродные гены в хлоропласты.
В 1972 году сотрудники Амстердамского университета Кес Ай и Пит Борст опробовали визуализацию ДНК с помощью электрофореза в агарозном геле с буфером, содержащим бромистый этидий. Это позволило видеть не меченные изотопами молекулы ДНК, просто положив гель на УФ-трансиллюминатор.


На исходе 70-х разработали неизотопные методы мечения нуклеиновых кислот.
1982 год запомнился открытием рибозимов: Томас Чех и Сидни Альтман показали, что молекулы РНК могут обладать каталитической активностью. Помимо существенной поддержки гипотезы мира РНК, это открытие в 2000-х вылилось в создание инженерных рибозимов для генетической терапии, способных разрезать нужные РНК. Самым логичным выглядело их использование для блокирования ВИЧ и иных РНК-содержащих вирусов [23].
В том же году появилось первое трансгенное растение: Майкл Беван, Ричард Флавелл и Мэри-Дэлл Чилтон модифицировали клетки табака с помощью Ti-плазмиды, несущей химерный ген антибиотикорезистентности.
В 1989-м удалось получить первую мышь с нокаутированными генами, крыс осилили гораздо позже — в 2003-м [25].
В 1990 году калифорнийские биологи пытались сделать цветки трансгенной петунии более яркими, а получили еще более бледные. Так неожиданно себя проявила РНК-интерференция, которую позже, в 1998 году, подробно описали у червя Caenorhabditis elegans Крейг Мелло и Эндрю Файер (рис. 13). Введением небольшой двухцепочечной РНК они вызвали сайленсинг (подавление экспрессии) генов, содержащих комплементарные этой РНК участки. Благодаря малым РНК, регулирующим экспрессию генов на посттранскрипционном уровне, удались на славу гипоаллергенные томаты, табак без никотина, кофе без кофеина и многое другое. Двухцепочечные молекулы оказались более эффективными, чем одноцепочечные (простые антисмысловые РНК), механизм действия которых не относят к интерференции.

В апреле 2003 года завершились основные работы по секвенированию генома человека, которые стоили правительствам США и еще нескольких стран $3 млрд [26]. Прочтение геномов нескольких анонимных доноров вскрыло много интересных деталей. Оказалось, что обычных — кодирующих белок — генов у нас гораздо меньше, чем полагали ранее, — чуть более 20 тыс. [27]. Они составляют всего 1,5% совокупной человеческой ДНК, а остальное относят к ДНК некодирующей (хотя некоторые ее области кодируют малые регуляторные молекулы и мобильные генетические элементы) [28]. Некодирующая ДНК участвует в поддержании структуры хромосом, клеточном делении и регуляции экспрессии генов. Но самое интересное, что до 90% однонуклеотидных полиморфизмов (SNP), ассоциированных с разными заболеваниями, сосредоточены в некодирующих, преимущественно регуляторных, участках ДНК. Поэтому логическим продолжением прочтения генома человека стали проекты, посвященные его вариабельности: Human Genome Diversity, HapMap, 1000 Genomes, ENCODE.
В 2007-м фармгигант Merck успешно завершил клинические исследования рекомбинантной вакцины Gardasil, защищающей от человеческих папилломавирусов высокого онкогенного риска, способных инактивировать гены опухолевых супрессоров и провоцировать развитие карцином шейки матки и некоторых других частей тела. Антигены вирусоподобных частиц, составляющих вакцину, производятся трансгенными дрожжами. Вскоре GlaxoSmithKline выпустила аналогичную, но более эффективную вакцину Cervarix.

В 2014 году с помощью ZFN модифицировали Т-лимфоциты инфицированных ВИЧ, чем снизили вирусную нагрузку. В 2015 безнадежной пациентке с лейкемией ввели донорские Т-лимфоциты, модифицированные с помощью TALEN, чем выиграли время для трансплантации костного мозга [37]. Тогда же в Китае покусились на редактирование генома нежизнеспособных эмбрионов CRISPR-системой [38]. В 2016 опухолевые клетки пациента с агрессивной карциномой легкого атаковали его собственными Т-лимфоцитами, подправленными CRISPR-Cas9 [39], [40]. Сейчас компания Sangamo Therapeutics (США) проводит набор участников I фазы клинических исследований ZNF-терапии in vivo: речь идет об исправлении дефектных генов, вызывающих мукополисахаридозы I/II и гемофилии А/В. Другой пионер отрасли, Editas Medicine, планирует начать клинические исследования CRISPR-терапии ex vivo и in vivo [39].
В том же 2014-м Денис Малышев с коллегами из Исследовательского института Скриппс и New England Biolabs сконструировал кишечную палочку с расширенным генетическим алфавитом, которая стабильно поддерживает плазмиду с неприродной парой нуклеотидов [43]. В 2017 году эту полусинтетическую бактерию тюнинговали [44].
Ну а мы в следующей части статьи попробуем разобраться, как создают молекулярные химеры и как используют нуклеиновые кислоты для решения исследовательских и медицинских задач.
Любимые многими нашими не-учеными мечты о всегда голодных молодых ученых вряд ли нашли бы понимание у пионеров генной инженерии. Они были заняты не поиском пропитания, а интересной работой — в нормальных условиях и под руководством талантливых ученых. В итоге многие получили Нобелевские премии и миллионные состояния. А благодаря патентно-лицензионной системе миллионы они принесли и своим институтам, чтобы те лучше финансировали новые исследования.
В 1976 году Герберт Бойер и венчурный капиталист Роберт Свонсон, скинувшись по $500, основали биотехнологическую компанию Genentech. Их генно-инженерный инструментарий и сотрудничество с институтскими коллективами позволили экспрессировать в бактериях разные человеческие гены и получить таким образом терапевтически ценные белки: соматостатин, соматотропин, инсулин, ДНКазу I, интерферон-γ, моноклональные антитела. Компания оказалась на редкость доходной, и Калифорнийский и Стэнфордский университеты вели с ней нудные патентные споры, требуя миллионных компенсаций. В 2009 году фармгигант Hoffmann-La Roche приобрел Genentech за $46,8 млрд, и сейчас в компании работает почти 15 000 человек. Но самое важное для становления биотехнологической промышленности произошло в далеком 1980-м: 15 октября стоимость акции Genentech на Нью-Йоркской фондовой бирже взлетела в два раза — и за день несколькими миллионерами стало больше [51]. Более 7 млн акций подняли стоимость компании до $500 млн, а лицо Бойера украсило обложку журнала Time. И понеслось.
Американская академическая наука вступила в фазу коммерциализации. Сотрудники институтов активно налаживали связи с мировым капиталом, в том числе и организуя собственные биотехнологические компании. С 1980 по 1985 в США появилось более 400 подобных фирм. Этому благоприятствовали налоговые льготы и крупные навары с биржевых операций. На запах денег слетелись и представители Большой фармы. В Европе инвестиционный климат был похуже, но и там процесс быстро набрал обороты. Япония объявила биотехнологию национальным приоритетом, и, подучившись у американских биотехнологов, пополнила ряды лидеров индустрии. Другие страны тоже осознали стратегическую важность отрасли и по мере возможности старались уделять ей внимание [51]. Мы не будем пытаться объять необъятное, разбирая все генетические коммерческие проекты, а устроим маленькую историческую экскурсию по избранным, крупным перекресткам академической науки и генно-инженерной индустрии.
Одним из основателей Myriad Genetics был пионер секвенирования Уолтер Гилберт. Он же известен как соучредитель биотехнологического гиганта Biogen и компании Paratek Pharmaceuticals, а еще как один из первых апологетов секвенирования человеческого генома. Еще до старта известного международного проекта он анонсировал открытие Genome Corporation, в составе которой планировал первым прочитать геном человека и затем продавать расшифрованную информацию.
Удачный пример синтеза академической науки и фарминдустрии показали Артур Корнберг [15], Пол Берг и Чарльз Янофски, в 1980-м основав DNAX — институт молекулярной и клеточной биологии, который почти сразу приобрела компания Schering-Plough Pharmaceuticals (сейчас — часть Merck & Co.). DNAX предоставлял отличные кадры для разработки препаратов, и эти кадры не были ограничены в правах публикации своих результатов [53].
Крейг Мелло, одним из первых описавший РНК-войны [54], помимо основания успешной биофармацевтической компании RXi Pharmaceuticals занялся укреплением здоровья пчел с помощью РНК-интерференции. Специально созданная для этого израильско-американская фирма Beeologics в 2011 году была поглощена Monsanto.

Читайте также:


