| 17.10.2015 |
7 месяцев назад, у меня обнаружили вирус гепатита б, HBSAg+, у меня на тот момент иногда
болела печень и я пил сорбент, через 3 месяца мне сделали узи и тест на антивирусню
нагрузку, узи показало что все хорошо, а тест показал 2155 вирусную нагрузку, Алат, Аспат, Билирубин были в пределах нормы, сказали 19 января на контрольные анализ, сейчас у меня
температура часто 37.2 и побаливает немного печень. Это у меня хронический гепатит или нет
и что мне делать?
Здравствуйте. Извините, что пишу подробно течение болезни и лечение но я никогда не болел так серьезно. Мне 38 лет, никогда не пил и не курил, но при росте 170 см. Я весил 119 кг. Год тому назад отказался от хлеба, сахара и всяких майонезов, сбросил до 103 кг, сейчас уже 101.5 кг. Полтора месяца назад, у меня заболел желудок. Гастроскопия показала, что у меня эрозивный гастрит и рефлюкс-экзофагит а УЗИ показала умеренные диффузные изменения паренхимы печени и поджелудочной железы, умеренное спле.
Здравствуйте, Уважаемый Доктор! У моего мужчины около 2-х лет назад, случайно были выявлены антитела к гепатиту С, ПЦР на протяжении всего времени-ОТРИЦАТЕЛЬНЫЙ, биохимия всегда в норме, жалоб не возникало. Вот последние результаты анализов(за 1 сентября 2015 года): Anti-HCV total-положительно, Anti-HCV(подтверждающий)-положительно, Вирус гепатита С, определение РНК, генотипирование, (HCV-RNA, genotyping) в плазме крови-отрицательно, Вирус гепатита С, определение РНК кач. (HCV-RNA, qualitative) .
Здравствуйте! Пожалуй начну сначала. В конце сентября заболела бронхитом, проколола 7 дней антибиотик. Через неделю после начала болезни температура в течении дня держалась 37-37.2. Терапевт направила к женскую консультацию. Та осмотрели, поинтересовались когда были последние месячные(1 сентября), направили на узи. Узи показало что все хорошо, (матка немного меньше нормы, эндометри1 6мм 2 фаза), врач сказала жди месячных. После узи прошло 20 дней, но ни признаков, ни месячных нет. Записалась еще.
Болею 2 недели температура 39, кашель с мокротой зеленого цвета, пропил курс антибиотиков не помогло, сделал снимок легких все нормально сдал экспрес тест пришли результаты лейкоцыты 18.6, СОЭ 50, палочно-ядерные нейтрофилы 9, что это может быть
![]()
![]()
Ваши персональные даннные надежно защищены. Платежи и работа сайта осуществляются c использованием защищенного протокола SSL.
Определение в крови иммуноглобулинов IgG к белкам вируса гепатита С, которое используется для диагностики этого заболевания.
Антитела к белкам гепатита С;
Antibodies to structural and non-structural proteins of HCV;
Antibodies to HCV.
Иммуноферментный анализ (ИФА).
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
- Исключить из рациона жирную пищу в течение 24 часов до исследования;
- Не курить в течение 30 минут до исследования.
Общая информация об исследовании
Гепатит С – вирусное заболевание печени, отличительной чертой которого является бессимптомное течение и высокая частота прогрессии в хронический гепатит, цирроз печени и гепатоцеллюлярную карциному. Основной путь передачи гепатита С – через кровь и ее компоненты. Группы риска по заражению ВГС:
- Медицинские работники;
- Люди, использующие инъекционные наркотики;
- Пациенты с ВИЧ;
- Люди, которым были сделаны татуировки с помощью нестерильных инструментов;
- Пациенты, получившие переливание крови или ее компонентов до 1992 г.;
- Пациенты, получившие трансфузию факторов свертывания крови до 1987 г.;
- Пациенты, получающие лечение гемодиализом в течение длительного времени;
- Дети, рождённые от матерей с ВГС.
Следует отметить, что по крайней мере в 20 % случаев источник заражения установить не удается. В России наблюдается рост заболеваемости гепатитом С: в период с 1999 по 2011 гг. заболеваемость хроническим ВГС выросла в 3 раза. Как правило, пациенты с ВГС не догадываются о своем заболевании.
Вирус гепатита С (ВГС) – РНК-вирус, принадлежащий семейству Flaviviridae. При транскрипции его генома образуется единый белок длиной около 3000 аминокислот, который затем разрезается с помощью пептидаз клетки-хозяина и вирусных пептидаз с образованием структурных и неструктурных белков:
- Структурные белки (коровый белок, Е1 и Е2, от англ. envelope glycoproteins – гликопротеины оболочки) необходимы для формирования вирусного капсида;
- Неструктурные белки (p7, NS2, NS3, NS4A, NS4B, NS5A и NS5B, от англ. non-structural – неструктурные) выполняют различные регуляторные функции.
В ответ на заражение вирусом гепатита С в организме человека начинают вырабатываться антитела – иммуноглобулины M и G, которые можно исследовать для диагностики гепатита. Следует отметить, что при гепатите С синтез иммуноглобулинов М может наблюдаться на разных стадиях заболевания, как при остром, так и при хроническом гепатите, и поэтому не имеет никакого диагностического значения. Это важное отличие диагностики гепатита С от гепатита В (выявление иммуноглобулинов М при гепатите В наблюдается только в острую стадию). Таким образом, все серологические тесты для диагностики гепатита С основаны на выявлении иммуноглобулинов G к белкам этого вируса.
Структурные и неструктурные белки иммуногенны в разной степени. Показано, что наиболее выраженными иммуногенными свойствами обладают следующие белки (в скобках указан процент пациентов с хроническим гепатитом С, у которых в крови обнаруживаются антитела к указанному белку):
Менее иммуногенны белки E2 (31 %), NS4A(28 %) и E1 (22 %). NS2 и NS5B имеют очень слабые иммуногенные свойства, и антитела к ним у пациентов с ВГС выявляются редко.
Антитела к ВПС могут быть определены в крови приблизительно через 8 недель после первичного заражения. Ложноотрицательные результаты могут наблюдаться у людей с иммунодефицитом (например, ВИЧ-инфицированных), почечной недостаточностью и эссенциальной смешанной криоглобулинемией. Ложноположительные результаты также встречаются.
Вирусы гепатита С неоднородны по генетическому составу. На этом основании выделяют 6 генотипов ВПГ, геномы которых различаются на 30-35 %, и множество подтипов, различающихся на 20-25 %. В восточной Европе и США чаще встречаются генотипы 1a и 1b, тогда как для других стран характерны другие генотипы (например, Египет – генотип 4, Южная Африка – генотип 5). Показано, что иммунный ответ пациентов, инфицированных разными генотипами ВГС, различается. Это особенно справедливо в отношении антител к белкам E1, E2, NS3, NS4A и NS5A.
Качественный и количественный состав антител к ВГС у пациента остается достаточно постоянным в течение заболевания, в том числе и после проведенного лечения.
Антитела к гепатиту С – чувствительный, но недостаточно специфичный метод диагностики этого заболевания. Поэтому серологические тесты – это скрининговые тесты диагностики гепатита. При получении положительного результата исследования антител на гепатит С обязательно проводят подтверждающее исследование – анализ на РНК вируса с помощью полимеразной цепной реакции в реальном времени (РТ-ПЦР). Кроме того, при подтверждении диагноза "гепатит С" может понадобиться генотипирование ВГС и гистологическое исследование печени или неинвазивные методы определения состояния печени (такие как ФиброМакс).
Для чего используется исследование?
- Для диагностики гепатита С.
Когда назначается исследование?
- При профилактическом обследовании, особенно если пациент принадлежит к группе риска по гепатиту С;
- в некоторых случаях при устройстве на работу.
Что означают результаты?
Выдается по компонентам:
IgG к антигену core
IgG к антигену NS3
IgG к антигену NS4
IgG к антигену NS5
- гепатит С;
- ложноположительный результат (чаще у пациентов, не относящихся к группам риска, например доноров крови).
- норма;
- ложноотрицательный результат (сопутствующая ВИЧ-инфекция, почечная недостаточность, эссенциальная смешанная криоглобулинемия).
Что может влиять на результат?
- Время, прошедшее с момента заражения;
- Состояние иммунной системы;
- Сопутствующие заболевания почек;
- Генотип вируса гепатита С.
- Это скрининговый тест. При получении положительного результата необходим дополнительный, подтверждающий тест (определение РНК вируса с помощью ПЦР);
- результаты анализа следует интерпретировать с учетом дополнительных клинических, лабораторных и инструментальных данных.
13 Гистологическое исследование гепатобиоптата (биоптата печени) с использованием стандартных методик
Кто назначает исследование?
Инфекционист, терапевт, врач общей практики.
Вирусный белок является как компонент и продукт вируса . Вирусные белки сгруппированы в соответствии с их функциями, а также группы вирусных белков включают структурные белки, неструктурные белки, регулирующие и вспомогательные белки. Вирусы являются неживыми , и они не имеют средств , чтобы воспроизвести на своем собственном. Они зависят от метаболизма их клетки - хозяина в энергию, ферменты и прекурсоры, для того , чтобы воспроизвести. Таким образом , вирусы не код для многих из своих собственных вирусных белков, но , скорее, они используют механизмы клетки - хозяина, чтобы производить вирусные белки , необходимые им для репликации.
содержание
Вирусные структурные белки
Большинство вирусных структурных белков являются компонентами для капсида и оболочки вируса.
Несколько протомеров, олигомерные (вирусные) белковые субъединицы, объединяются, чтобы сформировать капсомеры и капсомеры собрались вместе, чтобы сформировать капсид. Капсомеров может организовать в икосаэдрическом, винтовой или сложный капсид, но и во многих вирусах, такие как вирус простого герпеса, икосаэдрический капсид собран. Три асимметричные и неидентичные вирусные белковые агрегаты составляют каждый из двадцати одинаковых треугольных граней в икосаэдрическом капсиде.
Капсида некоторых вирусов заключены в мембрану , называется оболочка вируса. В большинстве случаев вирусная оболочка получается капсида из плазматической мембраны клетки - хозяина, когда вирус покидает свою клетку - хозяина с помощью процесса , называемого почкованием. Оболочка вируса состоит из липидного бислой внедренного с вирусными белками, в том числе вирусных гликопротеинов . Эти вирусные гликопротеины связываются со специфическими рецепторами и корецепторами на мембране клеток - хозяев, и они позволяют вирусам прикрепить на их клетки - мишенях. Некоторые из этих гликопротеинов включают в себя:
- Гемагглютинина, нейраминидазы, и белок М2 вируса гриппа.
- gp160, состоящий из субъединиц gp120 и gp41, в вирусе иммунодефицита человека (ВИЧ).
Вирусные гликопротеины играют важную роль в вирус-клетка слияния. Вирус-к-клетке слияние инициируется, когда вирусные гликопротеины связываются с клеточными рецепторами.
Слияние вирусной оболочки с клеточной мембраной требует высокой энергии , чтобы иметь место. Вирусные мембранные белки слияний действуют как катализаторы , чтобы преодолеть этот высокий энергетический барьер. После вирусного гликопротеина связывания с клеточными рецепторами, вирусные мембранные белки слияния претерпевают изменение в структуре конформации. Это изменение конформации затем облегчает дестабилизацию и слияние вирусной оболочки с клеточной мембраной, позволяя петлю слитого (FLS) или гидрофобные слитые пептиды (ФПС) на вирусной оболочке , чтобы взаимодействовать с клеточной мембраной. Большинство вирусной мембраны слитые белки будут в конечном итоге в шпилька-подобный конформации после слияния, в котором FLS / Рамочные и трансмембранный домен все на одной и той же стороне белка.
Вирусные гликопротеины и их трехмерные структуры, до и после слияния, позволили широкий спектр структурных конформаций, чтобы быть обнаруженным. Вирусные мембранные белки слияния, были сгруппированы в четыре разных классов, и каждый класс идентифицируются характерными структурными конформациями:
- Класс I: Пост-слитая конформация имеет четкую центральную структуру биспиральной, состоящую из сигнатуры тримера альфа-спиральных шпилек. Пример вирусного слитого белка Класса I, представляет собой гликопротеин ВИЧ, gp41.
- Класс II: Белок испытывает недостаток в центральную структуру биспиральной. Содержит характерную удлиненную бета- структуру листа эктодомена, что refolds дать тример шпилек. Примеры класса II вирусных белков слияний включают E белок вируса денге, а Запад вирус нила E белок.
- Класс III: Структурная конформация представляет собой сочетание признаков из вирусных слитых белков мембраны класса II класса I и. Пример класса III вирусных слитого белка является вирус бешенства гликопротеина, Г.
- Класс IV: Класс IV белки вирусных слитые представляют собой слитые-ассоциированный небольшие трансмембранными (FAST) белки. Они не образуют тримеры шпилек или самих шпильки структур, и они являются самыми маленькими известными вирусными белками слияния. БЫСТРО белки кодируются членами безоболочечного Reoviridae семейства вирусов.
Вирусные белки неструктурных
Вирусные неструктурные белки представляют собой белки, кодируемые геном вируса и выражены в инфицированных клетках. Тем не менее, эти белки не собираются в вириона. Во время репликации вирусов, некоторые вирусные неструктурные белки выполняют важные функции, которые влияют на сам процесс репликации. Кроме того, во время сборки вирусов, некоторые из этих белков также выполняют важные функции, которые влияют на процесс сборки. Некоторые из этих вирусных неструктурных белков являются функции образования репликона, иммуномодуляция, и трансактивация вирусных генов, кодирующих белок структурных.
Вирусные белки неструктурных взаимодействуют с белками клетки-хозяина с образованием репликон, иначе известный как комплекс репликации. В вируса гепатита С, вирусные неструктурные белки взаимодействуют с сотовой везикул мембраны транспортного белка, hVAP-33, чтобы собрать репликон. Вирусный неструктурных 4b (NS4B) белок изменяет мембрану клетки-хозяина и начинает процесс формирования комплекса репликации. Другие вирусные неструктурные белки, такие как NS5A, NS5B, и NS3, также на работу в комплексе, и NS4B взаимодействует с ними, и связывается с вирусной РНК.
Иммунный ответ хозяина на инфицированную клетку можно регулировать с помощью иммуномодулирующих свойств вирусных неструктурных белков. Вирусный неструктурных белков NS1 в вирус Западного Нила предотвращает активацию комплемента через его связывание с белком контроля комплемента, фактор H. В результате, комплемент признание инфицированных клеток снижается, а инфицированные клетки остаются невредимыми иммунной системы хозяина.
Вирусные регуляторные и вспомогательные белки
Вирусные регуляторные и вспомогательные белки имеют множество функций. Эти вирусные белки контролировать и влиять на вирусные выражения генов в вирусном геноме, в то числе вирусных структурных генов скоростей транскрипции. Вирусные регуляторные и вспомогательные белки также влиять и регулировать клеточные функции клетки-хозяина, например, регуляции генов и апоптоза.
В ДНК-вирусов и ретровирусов, вирусные регуляторные белки могут повысить вирусную транскрипцию генов, также, что эти белки могут также повысить хозяина транскрипции клеточного гена тоже.
Вирусные дополнительные белки, известные также в качестве вспомогательных белков, которые кодируются геном ретровирусов. Большинство вирусных белков аксессуара только выполнять свои функции в определенных типах клеток. Кроме того, они не имеют большого влияния на репликацию вируса. Однако, в некоторых случаях, поддерживая репликацию вирусов потребуется помощь (и функции) вирусных вспомогательных белков.
Эндогенные ретровирусные белки
Syncytin представляет собой эндогенный ретровирус белки , который был захвачен в геноме млекопитающих , чтобы позволить слияние мембран в плацентарном морфогенезе.
Сейчас известно 39 видов коронавирусов, в каждый вид могут входить десятки и сотни штаммов. Кроме того, есть еще 10 видов — кандидатов в коронавирусы. Специалисты пока только проверяют, можно ли их считать настоящими коронавирусами. У них широкий спектр хозяев среди птиц и зверей, у которых они вызывают заболевания дыхательной системы и желудочно-кишечного тракта. К людям коронавирусы приходят от животных: вирус атипичной пневмонии 2002—2003 годов SARS-CoV пришел от подковоносых летучих мышей, от которых он перескочил в мусанга, или малайскую пальмовую куницу, а из мусанга — уже в человека. (Любителям кофе малайская пальмовая куница должна быть знакома — это тот самый зверек, без которого не было бы кофе копи-лювак: мусангам скармливают кофейные зерна, которые определенным образом ферментируются в кишечнике, изменяя вкусовые свойства; кофе из зерен, которые прогнали через мусангов, считается особо изысканным и стоит весьма немалых денег.)
Еще один человеческий коронавирус известен по вспышке ближневосточного респираторного синдрома, первые случаи которого были зарегистрированы в 2012 году в Саудовской Аравии, — он получил название MERS-CoV. Этот вирус также пришел к людям от летучих мышей с промежуточной остановкой в одногорбых верблюдах (оттого его еще называют верблюжьим гриппом, что неправильно, — коронавирусы от вирусов гриппа отличаются). Умирают от него более трети заразившихся, однако заразиться им сложно: с момента появления вируса и до начала этого года в мире зарегистрировано лишь около двух с половиной тысяч случаев.
Подозревают, что и новый вирус SARS-CoV-2 тоже пришел к нам от летучих мышей.
Наконец, есть еще четыре человеческих коронавируса, два из которых, HCoV-229E и HCoV-OC43, были известны еще до атипичной пневмонии от SARS-CoV, а два других, HCoV-NL63 и HCoV-HKU1, открыли в 2004 и 2005 годах. Все четыре не вызывают ничего серьезнее мягкой простуды; хотя коронавирусная простуда встречается довольно часто — на ее счет относят 15—30% всей простуды в мире.
Но об эпидемиологии коронавирусов мы рассказывать не будем, а вместо этого поговорим о том, как они устроены и как на них реагируют наши клетки.
Обладатели белковой короны
И белок S, и белок HE сидят в мембранной липидной оболочке. Откуда она берется? Как мы помним, наши клетки окружены мембраной и внутри них существует много мембранных органелл — клеточных органов, выполняющих разные функции и ради правильной работы отделенных от остальной клетки двуслойной липидной мембраной. Ее-то вирус и заимствует, выходя из клетки, а как именно, скажем чуть ниже. Кроме S и HE в ней сидит очень много белка М, который поддерживает и структурирует мембрану, и еще немного белка E. Под липидной оболочкой с белками мы найдем геном вируса — нить молекулы РНК, которая усажена белком N: он упаковывает вирусную РНК в компактную свернутую спираль. (Белковая оболочка вирусов, непосредственно взаимодействующая с нуклеиновой кислотой, называется капсидом.) Когда РНК попадает в клетку, то на ней сразу можно синтезировать белки, и такую РНК у вирусов обозначают плюсом.
По этим признакам коронавирусы относят к РНК-содержащим вирусам, чей геном представляет собой одну-единственную плюс-цепь РНК. Так же выглядит геном у множества других вирусов, среди которых есть риновирусы (одна из самых частых причин простуды) и вирус гепатита С. В то же время коронавирусы относят к оболочечным вирусам, у которых кроме нуклеиновой кислоты и связанного с ней структурно-защитного белка (у коронавирусов это белок N) есть еще мембранная оболочка. К оболочечным вирусам еще относятся, например, вирусы герпеса, у которых наследственная информация хранится в ДНК, и ВИЧ. Как видим, по отдельности разные молекулярные черты можно найти у множества вирусов и лишь по их сочетанию отделить одну группу вирусов от другой.
Кстати, геном в виде РНК — это, можно сказать, слабость коронавирусов. В нуклеиновых кислотах время от времени появляются мутации либо из-за внешних факторов, вроде фоновой радиации, либо из-за стандартных ошибок белков, которые эти нуклеиновые кислоты копируют. Но в клеточной ДНК мутации могут быть исправлены специальными ремонтными белками. Этим же ремонтом способны воспользоваться вирусы с геномом в виде ДНК или же те, которые геномную РНК на время копируют в ДНК (такие вирусы называются ретровирусами). А в коронавирусной РНК ошибки никак не исправляются. Мутации помогают вирусам сменить хозяина, но среди мутаций есть очень много вредных, и если вирус не может никак корректировать дефекты в ДНК, они в какой-то момент могут сделать его просто нежизнеспособным.
Любые вирусы — это, грубо говоря, лишь комок молекул, пусть и сложно устроенный. Собственного обмена веществ у вирусов нет, и размножаться за пределами клетки они не могут. Вирусам с мембранной оболочкой проникнуть в клетку проще как из-за самой мембраны, так и благодаря сидящим на ней белкам: они хорошо подходят к клеточным рецепторам. Кроме того, белки мембранной оболочки, как собственно вирусные, так и те, которые вирус прихватил у клетки вместе с куском мембраны, помогают вирусу уходить от иммунной атаки. Но из-за мембраны такие вирусы более чувствительны к разным неблагоприятным факторам, вроде обезвоживания или моющих детергентов, мембрану разрушающих. Поэтому вирусы с мембранной оболочкой лучше всего передаются от хозяина к хозяину, а сидеть на какой-то поверхности и ждать, когда их оттуда снимет потенциальный хозяин, они долго не могут. Этим они отличаются от вирусов без мембраны, которые представляют собой нуклеиновую кислоту, заключенную в белковый капсид, — они более устойчивы в окружающей среде, но проникнуть в клетку для них зачастую сложнее.
Внедрение в клетку
Разные вирусы пользуются разными клеточными белками для входа. Так, вирус атипичной пневмонии SARS-CoV и относительно безобидный HCoV-NL63 связываются с ангиотензинпревращающим ферментом 2, который помогает регулировать кровяное давление, участвует в управлении иммунитетом и играет роль еще в целом ряде процессов. Но белка одного вида для входа бывает недостаточно, поэтому, например, SARS-CoV нужен еще белок TMPRSS2 — одна из сериновых протеаз, участвующая в разных биохимических реакциях. Вирус сначала связывается с одним белком на поверхности клетки, а потом второй белок на поверхности клетки режет вирусный белок S, после чего мембраны вируса и клетки соединяются.
![]()
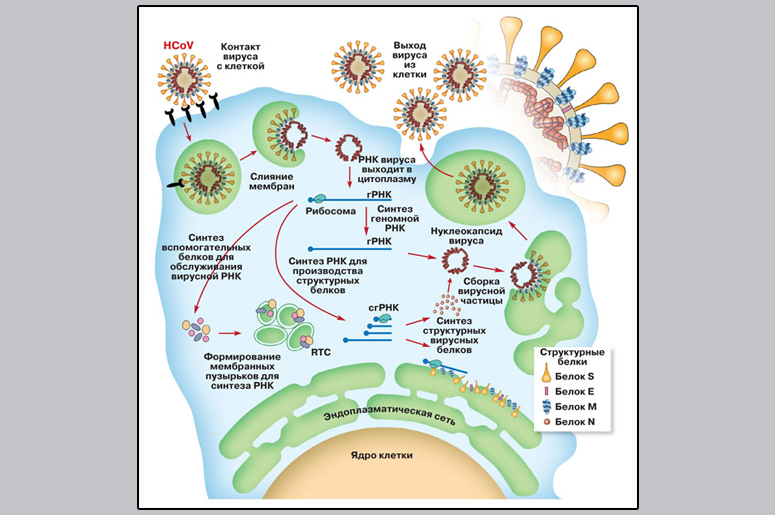
Схема жизненного цикла коронавируса. Проникнув в клетку, вирус высвобождает свою РНК, на которой рибосомы — клеточные машины для белкового синтеза — собирают вирусные белки, необходимые для формирования мембранных пузырьков и для синтеза плюс-цепи геномной РНК — гРНК. На вспомогательных мембранных пузырьках появляются вирусные белки, образующие RTC — replication transcription complex, этот комплекс выполняет репликацию (удвоение генома вируса) и транскрипцию — синтез коротких субгеномных РНК (сгРНК), предназначенных для сборки структурных вирусных белков. Структурный белок N соединяется с геномной РНК и образует нуклеокапсид вируса (геном плюс капсидный белок). На эндоплазматической сети синтезируются другие структурные белки, которые организуют вирусу липидную мембрану.
Вирус проник в клетку, и теперь он начинает копировать свой геном, то есть молекулу РНК, и синтезировать белки, нужные для копирования РНК и для формирования вирусных частиц. Кроме полных геномных РНК коронавирусы создают еще набор более коротких РНК — они синтезируются на больших геномных РНК и нужны только для синтеза белков; в вирусные частицы эти короткие РНК не попадают (точно так же ведут себя некоторые другие вирусы, которые вместе с коронавирусами объединяют в группу Nidovirales). Все вирусные РНК синтезируются в особых белковых комплексах, которые, в свою очередь, закреплены в небольших мембранных пузырьках. Эти пузырьки создает сам вирус: его белки вторгаются во внутриклеточные мембраны и фрагментируют их, создавая пузырьки-везикулы, чтобы РНК-синтезирующим комплексам было к чему пришвартоваться.
Часть насинтезированной РНК остается плавать в цитоплазме клетки — на ней синтезируется белок N, который будет упаковывать геномную вирусную РНК в спираль. Другие структурные белки, те, что потом окажутся в мембранной оболочке вируса (S, M и пр.), синтезируются на РНК, осевшей на особой внутриклеточной структуре — эндоплазматической сети, или эндоплазматическом ретикулуме (ЭР). Эндоплазматическая сеть — это огромная система мембранных канальцев, цистерн и пузырьков, на которых сидят белоксинтезирующие молекулярные машины рибосомы и собирают белки в соответствии с информацией в РНК. Готовые белки погружаются внутрь полостей ЭР, где приобретают правильную пространственную форму и потом либо переходят в клеточную цитоплазму, либо отправляются на экспорт, наружу из клетки, будучи заключены в транспортный мембранный пузырек.
Особенности внутриклеточной борьбы
О том, что у нее внутри орудует вирус, клетка может догадаться по неполадкам с внутренними мембранами — мы помним, что коронавирусы фрагментируют мембраны, чтобы дать опору своим белкам, синтезирующим РНК, и сами вирусные частицы прихватывают себе куски мембран. Кроме того, вирусные белки накапливаются в эндоплазматической сети и вызывают так называемый ЭР-стресс, то есть стресс эндоплазматического ретикулума. ЭР-стресс заставляет клетку остановить синтез белков (что, несомненно, бьет по вирусу — ведь он зависит от клеточной белоксинтезирующей машины) и активирует сигнальные молекулярные пути, которые включают программы клеточного суицида. Наконец, клетка может понять по вирусной РНК, что внутри у нее поселилась инфекция, и в ответ начать синтез интерферона первого типа. Это сигнальный белок, который выходит из клетки и оповещает всех об инфекции, в результате здоровые клетки готовятся защищаться от своей соседки, а иммунные клетки стремятся уничтожить зараженную клетку.
NS2 протеин является трансмембранным белком. Его C-конец смотрит в просвет цистерн ЭПР, вконец смотрит в цитозоль. NS2 протеин является цинк-зависимой протеазой, разрезающей NS2 и NS3 белки, то есть это аутопротеаза. При расщеплении белков освобождается N-конец NS3, что является важным моментом в репликации HCV.NS3 белок выполняет несколько различных функций.
Пока остается неизвестным, в какое время осуществляется инфицирование плода или ребенка - в пренатальном периоде, во время родов или в постнатальном периоде. Результаты нескольких специальных исследований не позволили получить убедительных данных о передаче HCV ребенку при грудном вскармливании.
NS3 способен связываться с РНК, отдавая предпочтение двухнитевым структурам. При репликации вируса NS3 белок связывается с поли-U последовательностью на 3'-конце вирусного генома своим РНК-связывающим доменом и затем происходит раскручивание двунитевой РНК, свернутой в шпильки и другие пространственные структуры.Одновременно идет гидролиз нуклеотидтрифосфатов, осуществляемый другим доменом NS3. В третьих, NS3 белок способен специфически взаимодействовать с каталитической субъединицей клеточной протеинкиназы A, участвующей в передаче клеточных сигналов.
Механизм развития: НеизвестноКлинические проявления HCV-инфекции. Поздняя кожная Порфирия
Рецептором HCV на B-лимфоцитах является молекула TAPA-1 (CD81 антиген), входящая в состав B-клеточного корецептора и относящаяся к тетраспанам, то есть белкам, 4 раза пронизывающим мембрану. Кроме того, известно, что HCV проникает в клетки в составе частиц, образуемых липопротеинами низкой плотности. Липопротеины взаимодействуют с соответствующими рецепторами, локализованными в окаймленных ямках на поверхности клеток и затем поглощаются внутрь клеток.
Кроме того, ограниченные исследования, проведенные в Европе и США, продемонстрировали, что передача ВГС от инфицированных родителей к их детям бытовым путем происходит редко или вообще не имеет места.
Строение полипротеина вируса гепатита CCore - белок капсидаE1, E2, p7 - гликопротеины оболочкиNS2 - цинк-зависимая протеазаNS3 - сериновая протеаза, хеликаза, нуклеотидтрифосфатазаNS4A - кофактор NS3NS4B - ?NS5A - определяет устойчивость клеток к интерферонуNS5B - РНК-зависимая РНК-полимераза
Различия связаны с высокой скоростью мутаций вирусного генома и могут достигать 30%. Изоляты вируса, геном которых имеет различия, достигающие 30%, относят к разным генотипам. Выявлено, по крайней мере 6 различных генотипов и более чем 30 субтипов вируса. Между субтипами различия нуклеотидной последовательности достигают 15%.
Вероятнее всего, передача ВГС половым путем действительно имеет место. но происходит относительно редко. Тем не менее из-за большого числа половых контактов между партнерами со стабильными и продолжительными сексуальными отношениями общее число новых случаев заражения ВГС половым путем может быть в конечном счете достаточно велико.
Инфицирование организма вирусами разных генотипов приводит к развитию гепатита с разной тяжестью течения. В России наиболее распространены генотипы 1b ВГС (плохо поддается терапии интерфероном-альфа) и генотип 3a ВГС .
При образовании нуклеокапсида происходит мультимеризация core-белка и его взаимодействие с вирусной РНК.
Описано несколько случаев профессионального заражения гепатитом С у медицинских работников с передачей HCV при случайных уколах использованными иглами, хотя такие случаи наблюдаются весьма редко по сравнению, например, с профессиональным заражением медработников вирусом гепатита В. Серологическое наблюдение за врачами и медсестрами, с которыми произошли такие несчастные случаи, показали, что сероконверсия при заражении ВГС происходит относительно нечасто от 0% до 10%.
HCV инфицирует не только гепатоциты, но и лимфоциты .
Гликопротеины E1 и E2 освобождаются из полипротеина за счет действия сигнальных пептидаз клетки-хозяина. Белки высоко гликозилированы. С белком E2 иногда ассоциирован небольшой протеин p7. При сборке вириона E1 взаимодействует своим C-концом с core-белком, а E2 — с NS2-протеином. При этом E1 и E2 образуют комплексы, сшитые дисульфидными связями.
В странах, которые продолжают повторно использовать плохо простерилизованные медицинские инструменты, будет продолжаться распространение HCV.
Внепеченочные проявления HCV-инфекции
Вирус гепатита С (Flaviviridae, Hepacivirus) — РНК-содержащий вирус. Долгое время исследователи предполагали существование вируса гепатита C, однако сам вирус оставался неизвестен.
Диагностика вирусного гепатита C основана на определении антител к белкам HCV с помощью иммуноферментного анализа. При остром гепатите C преимущественно определяются IgM и IgG антитела против core-белка HCV. При хроническом гепатите C определяются антитела класса IgG против структурных и неструктурных белков вируса. Кроме того, в диагностических целях определяют РНК вируса с помощью ПЦР.
Результатом взаимодействия является ингибирование молекулярных механизмов ответа инфицированных клеток на интерферон.NS5B протеин является РНК-зависимой РНК-полимеразой. Он высоко консервативен и является функционально наиболее важным компонентом репликативного ядерного комплекса, который обеспечивает репликацию/транскрипцию вирусной РНК. На позитивной нити геномной РНК транскрибируется минус-нить, которая является матрицей для синтеза (+)РНК.
NS5 регион полипротеина построен из двух больших белков — NS5A (56 кДа) и NS5B(65 кДа). Белки освобождаются из полипротеина с помощью NS3-NS4A протеазного комплекса. NS5A аутокаталитически фосфорилируется по остаткам серина. Гиперфософорилирование идет при участии NS4A протеина.
На 5'- и 3'-концах генома вируса находятся нетранслируемые регионы (HTP). 5'-HTP состоит из 340 н.о. отличается высокой консервативностью и образует упорядоченную вторичную структуру, состоящую из нескольких шпилек. Функция 5'-HTP заключается в инициации трансляции. Специфически связываясь с рибосомами и факторами трансляции клетки-хозяина, он направляет рибосому к инициирующему кодону AUG в позиции 342, после чего начинается синтез полипротеина.Полипротеин процессируется комбинацией вирусных протеиназ и протеиназ клетки-хозяина. Идентифицировано 10 белков, на которые расщепляется полипротеин. В первой трети полипротеина, начиная с М-конца, локализованы структурные белки, ближе к С-концу — неструктурные (схема).Непосредственно на N-конце полипротеина локализован core-белок, формирующий вирусный капсид. Он освобождается из полипротеина за счет клеточных протеиназ и имеет гидрофобную C-концевую последовательность.
Механизм развития: АутоиммунныйКлинические проявления HCV-инфекции :- Тиреоидит- Синдром Шегрена- Идиопатическая тромбоцитопеническая пурпура- Плоский лишай
Намечаются новые пути изучения вирусных гепатитов. Вирусный гепатит С (HCV) явился первым вирусом, который удалось идентифицировать на основе характеристики последовательности нуклеатидов, задолго до его электронно-микроскопической визуализации сывороткой больных.
Биологическая функция фосфорилирования неясна. NS5A белок высококонсервативен и обнаруживается на ядерной периплазматической мембране инфицированных клеток, где совместно с NS5B образует мембранно-связанный репликативный комплекс.NS5A протеин играет важную роль в формировании механизмов устойчивости клеток к действию интерферона. NS5A протеин взаимодействует с протеинкиназой PRK, активность которой индуцируется интерфероном.
Скорость мутаций настолько велика, что в организме одного и того же HCV-инфицированного индивидуума возникает множество вариантов вируса, отличающихся от родительского варианта. Такие варианты называют квазивидами. Основная часть возникающих мутаций связана с гипервариабельным участком E2-лротеина, расположенным между 383 и 414 ао.
Образование комплексов происходит внутри ЭПР с участием шаперона калнексина.E2 регион генома HCV является наиболее вариабельным регионом. Вариабельность является следствием беспорядочных мутаций. В ходе постоянно идущего мутационного процесса отбираются мутанты, способные уклоняться от действия нейтрализующих антител, продуцируемых иммунной системой хозяина.
Гепатит С: Переводы и новости. Вирус гепатита С (HCV)
Внутри клетки core-белок локализован на мембране ЭПР, а также в ядре клетки. Ядерный core-белок супрессирует отдельные гены клетки-хозяина. Цитоплазматический core-белок специфически подавляет апоптоз инфицированных клеток, обеспечивая длительную персистенцию вируса. Core-белок изменяет также клеточный метаболизм триглицеридов в гепатоцитах. В результате развивается стеаноз (жировое перерождение печени).
Лабораторная диагностика вирусного гепатита С в большинстве лечебных учреждений г. Москвы осуществляется в соответствии с существующими приказами и ограничивается определением иммуноглобулинов класса G к вирусу гепатита С (анти-НСV IgG) в сыворотке крови больных. Выявление данного маркера позволяет судить лишь о наличии текущей или перенесенной инфекции.Развернутый анализ на антитела к структурным и неструктурным белкам вируса гепатита С позволяет получить гораздо больше информации.
Существование такого стабильного гетеродимерного комплекса, поддерживаемого атомом цинка, подтверждено кристаллографически. NS4A белок выполняет также функцию кофактора, необходимого для гиперфосфорилирования NS5A протеина, и функцию якоря, удерживающего на мембране ядра клетки репликативный комплекс HCV. Функция NS4B протеина остается неясной, однако предполагается, что он также принимает участие в формировании репликативного комплекса.
Затем происходит формирование комплекса РНК с core-белком и его последующая транспортировка в эндоплазматический ретикулюм, где с core-белком взаимодействуют поверхностные белки E1 и E2, достраивающие вирусную частицу.
Длительное присутствие NS3 протеина в клетке может привести к злокачественной трансформации гепатоцитов и развитию гепатоклеточной карциномы.
![]()
![]()
NS4 регион полипротеина состоит из двух белков — NS4A и NS4B. Первый имеет молекулярную массу 8 кДа и при такой небольшой массе обладает несколькими функциями. NS4A протеин является кофактором для NS3 протеазы, образуя с NS3 белком единый комплекс.
Результаты большинства исследований показывают, что имеется низкая вероятность передачи инфекции от женщины, у которой обнаружены антитела к ВГС, к новорожденному ребенку. Принято считать, что хронический гепатит С может развиться примерно у 10% детей, которые были рождены HCV - положительными женщинами. Степень риска резко возрастает при наличии у матери сопутствующей ВИЧ-инфекции.
Механизм развития: Продукция или отложение иммуноглобулиновКлинические проявления HCV-инфекции :- Аутоантитела- Криоглобулинемия- Лейкоцитокластический васкулит- Мембранопролицеративный гломерулонефрит- В-клеточная лимфома- Плазмоцитома- MALT-лимфома
На HcvAdvocat при этом пишут о проведенных опытах по заражению обезъян. Обезъяны заражались гепатитом С даже через 18 часов после высыхания крови. Правда через 4 суток вирус гепатита С потерял свою вирулентность полностью.
В качестве праймеров используют олигонуклеотиды, соответствующие консервативным участкам нуклеотидной последовательности РНК вируса. Генотипы HCV также определяют с помощью полимеразной цепной реакции.
Во-первых, он участвует в процессинге полипротеина, являясь сериновой протеазой, отщепляющей от полипротеина все неструктурные белки. Причем отщепление NS3 от NS4A является аутокаталитическим процессом. Во-вторых, NS3 белок играет важную роль в репликации вируса, обладая хеликазной и нуклеотидтрифосфатазной активностью.
До настоящего времени отсутствуют убедительные выводы о частоте передачи HCV половым путем. Результаты большинства исследований, проведенных в странах Европы и Северной Америки, показали очень низкую распространенность гепатита С среди половых партнеров людей, инфицированных вирусным гепатитом С (ВГС). Кроме того, исследование методом "случай-контроль" продемонстрировали лишь незначительную повышенную степень риска инфицирования возбудителем гепатита С у людей, имеющих множественных половых партнеров.
Вполне вероятна возможность передачи HCV во время выполнения татуировки, при акупунктуре и любых повреждениях целостности кожных покровов нестерильными инструментами .
К настоящему времени точно документированы два пути передачи HCV: парентеральный и вертикальный. По оценкам экспертов более 50% случаев HCV связаны с парентеральным механизмом передачи. У части больных имело место заражение при парентеральных манипуляциях в медицинских учреждениях. Широкое использование гемотрансфузий до введения контроля за донорами способствовало распространению заболевания при использовании крови и ее препаратов. Очевиден риск передачи HCV через инъекционное оборудование. Введение одноразовых шприцев, игл, катетеров - безусловный прогресс в борьбе с HCV.
Читайте также:
 Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.
Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.
![]()