Вирусные супрессоры рнк интерференции
Справочник
- Обзоров: 126
- Биографии: 12
- Записей в дневниках: 13
- Новостей: 16
Интерференция РНК
Интерференция РНК – феномен, ведущий к посттранскрипционному молчанию генов (PTGS 2 ).
Явление RNA interference (RNAi 3 ) обнаружено Fire et al. в 1998 году у нематоды C.elegans. Было обнаружено, что введение двухцепочечной РНК (dsRNA 1 ) в нематоду приводит к замолканию генов гомологичных введеной
dsRNA 1 и образование малых РНК (siRNAs 4 ). Позже выяснилось, что этот феномен широко распространен среди большинства организмов, включая простейших, животных и растений. Интерференция РНК заключается в разрезании dsRNA 1 на короткие,
20 нуклеотидов, фрагменты, которые выполняют роль матрицы для узнавания комлементарных РНК и разрезания их на фрагменты.
Механизм RNAi 3 заключается в расщеплении двухцепочечной РНК на 21-23 пн фрагменты, которые действуют как матрица для разрушения гомологичных последовательностей РНК. Причем было установлено, что длинные dsDNA более активны чем короткие.
Попавшая в клетку dsRNA 1 узнается белком Dicer, осуществляющим разрезание длинных
двухцепочечных РНК на короткие фрагменты. Далее такие дуплексы РНК с 2-3 нуклеотидными липкими концами, полученные Dicer связываются с белковым комплексом RISC (RNA-induced silencing complex), осуществляющим разрезание комплементарных одноцепочечных РНК в месте узнавания, что исключает трансляцию этих РНК. РНК разрезается в середине места узнавания, примерно 12 пн от 3'конца siRNA 4 . Эта позиция соответствует одному обороту двуцепочечного дуплекса РНК разрезающей и РНК которая разрежется. Вирусный белок Hc-Pro ингибирует действие комплеков RNAi 3 . (рис1.).
Dicer - АТФ-азная рибонуклеаза - инициатор сайленсинга, разрезает исходную dsRNA 1 , для матрицы. Имеется геликазный домен, С-концевой сегмент связывания с РНК и РНКазныйIII. Мышиный Dicer М=215 кДа и длиной 1373 аминокислоты расположен на конце 12 хромосомы и экспрессируется в различные фазы развития от эмбриональной
до взрослого состояния. Человеческий Dicer имеет массу 218 кДа.
RISC - мультибелковый комплекс
500кДа, состоящий из нуклеиновых кислот и белков. Одна из субъединиц - Argonaute-2.
Длина некоторых интронов после процесcинга составляет
20 нуклеотидов, что может указывать на участие их в механизме RNAi 3 .
20 пн. siRNAs 4 4 . Фрагменты связываются с белковым комплексом RISC, который узнает и разрезает мРНК. Оставшийся одноцепочечный фрагмент может связываться с мРНК и служить затравкой для РНК-зависимой РНК-полимеразы (RdRP), которая достраивает мРНК до двухцепочечного
состояния, которое вновь узнается белком Dicer. И так происходит до тех пор, пока вся чужеродная мРНК не уничтожится. (Bantounas at al., 2004)
Защита от вирусов.
Интерференция РНК служит для защиты от проникновения в клетку молекулярных паразитов, таких как геномная РНК некоторых вирусов, состоящая из двух антипараллельных молекул. При запуске механизма RNAi 3 такие дуплексы служат матрицей для последующего разрушения молекул РНК, с которых будут синтезированы вирусные белки. Однако вирусы не стояли на месте и приобрели способность противостоять клеточной защите. Вирусный белок Hc-Pro ингибирует работу белковых комплексов вовлеченных в механизм RNAi 3 .
Контроль активности транспозонов.
Так же RNAi 3 служит для контролирования активности мобильных элементов. Мобильный элемент, или транспозон, это участок внутри ДНК какого-либо организма способный к копированию самого себя и встраиванию в любую часть генома. Если бы все транспозоны в клетке находились в активном состоянии они начали бы беспорядочно встраиваться в некодирующие участки генома, что может быть не так страшно, и в кодирующие участки, что неминуемо привело бы к нарушению работы генов и гибели организма. Предполагается, что механизм RNAi 3 препятствует активации транспозонов и расселению их по геному. Таким образом, взаимодействие RNAi 3 и транспозонной активности участвует в формировании структуры геномов большинства организмов. Считается, что транспозоны могут быть предками ретровирусов встроившихся когда-то в геном и существующими как внутренние паразиты. Из вышесказанного следует, что RNAi 3 служит защитой
как с внешней стороны - вирусы, так и с внутренней - транспозоны.
Метилирование ДНК
RNAi 3 -зависимое метилирование ДНК - известный феномен у растений. Ранние наблюдения специфического метилирования ДНК, зависящего от репликации РНК, у растений описаны Wessenegger et al. (1994). Эта работа демонстрирует, что метилируются короткие районы
30 пн, когда присутствует гомологичная РНК. При действии вирусного белка Hc-Pro, ингибирующего RNAi 3 , метилирование районов уменьшается. При метилировании ДНК, способность присоединять гистон ацетилазу уменьшается, что мешает разрыхлению хроматина и, соответственно, транскрипции генов. Модификации ДНК, полученные таким образом, могут наследоваться и передаваться дочерним клеткам, что может явиться механизмом клеточной памяти и регуляции развития организма.
Использование
в исследованиях.
Интерференция РНК используется исследователями для анализа функций различных генов. Если необходимо исключить из клетки какой-либо белок или несколько белков, исследователь может инъецировать двуцепочечные фрагменты РНК, комплепментарные участку мРНК, и механизм RNAi 3 удалит мРНК и предотвратит их трансляцию. Это можно проделывать на различных этапах клеточного цикла. Такой подход называется генным нокдауном. Например, таким способом было систематически инактивировано 5690 генов C.elegans для определения генов, регулирующих продолжительность жизни. В результате эксперимента был обнаружен ген митохондриальной лейцил-тРНК-синтетазы и показано, что мутации этого гена остлабляют работу митохондрий и увеличивают продолжительность жизи. Было предположено, что это результат уменьшения уровня АТФ и потребления кислорода. Введение конструкций, экспрессирующих РНК, содержащую инвертированные повторы. Такой механизм, вероятно, может происходить и в
естественных условиях.
Лечение заболеваний.
Существует два основных нарушения при развитии рака. Первое, это нарушение клеточного цикла, результатом которого является ненормальный рост клеток, и второе это потеря чувствительности к белкам вызывающим апоптоз, или клеточную смерть.
RNAi 3 может быть использована для лечения рака. Для этого можно создать нокдаун генов ответственных за клеточный цикл и противоапоптозных генов в клетках опухоли. Для избирательного действия на раковые клетки можно использовать RNAi 3 , вводя уникальные последовательности dsRNA 1 , специфичные для какого-нибудь определенного гена, или вводя их непосредственно в опухоль.
Недавние исследования ясно показали продвинутость метода RNAi 3 в подавлении роста и разрушении раковых клеток. Предпринимаются успешные попытки
введения вирусных векторов в раковые клетки, что так же способствует подавлению их роста. Однако все эти методы лечения находятся пока на предклинических испытаниях.
Болезни, вызванные вирусами и бактериями, продолжают являться основной причиной смертности людей в мире и продолжают вызывать беспокойство возможностью появления новых форм опасных заболеваний и использование их террористами. В настоящее время ВИЧ достиг эпидемических показателей в африканских странах и продолжает являться важной причиной смертности среди гомосексуалистов и наркоманов.
Способность RNAi ингибировать репликацию вирусов и других инфицирующих агентов была продемонстрирована на клеточных культурах и подает надежды на лечение этих заболеваний.
ПОСТСКРИПТУМ редакционный комментарий
Представители традиционного подхода настаивали на том, что для подавления экспрессии в культуре клеток эффективность обоих методов сравнима. По их мнению, причиной недооценки эффективности антисмысловых последовательностей является либо использование старых олигонуклеотидов первого поколения (на тот момент уже были известны более совершенные олигонуклеотиды третьего поколения), либо неправильный подбор самих последовательностей-мишеней для них.
Что касается использования интерферирующих РНК in vivo, то, по словам представителя калифорнийской биотехнологической компании ISIS Pharmaceuticals, требуется существенная оптимизация этого подхода, чтобы хотя бы встать на один уровень с антисмысловыми препаратами. Такая оценка не кажется неожиданной для исследователей из ISIS – единственной фирмы, преуспевшей в выпуске на фармацевтический рынок препарата на основе антисмысловых олигонуклеотидов – Vitravene, – использующегося для лечения кожных заболеваний.
Фирмы, разрабатывающие средства доставки, обычно оптимизируют их для обоих типов препаратов, как это делает для своих липидных систем доставки компания Neopharm из Иллинойса. При этом ведущий научный сотрудник компании считает, что в общем и целом препараты интерферирующих РНК работают лучше, чем антисмысловые.
Известно, что причиной ряда заболеваний, в том числе и онкологических, является повышенный клеточный уровень ряда микроРНК, который снижает активность экспрессии ряда клеточных генов. МикроРНК – это клеточные аналоги siРНК, который сама клетка использует для регуляции работы своих генов. Снять такую микроРНК-блокаду важных клеточных генов помогут так называемые антагонисты РНК (antagomiRNA) – антисмысловые молекулы, тем или иным способом инактивирующие клеточные микроРНК.
Есть и другие области применения, где антисмысловые РНК могут зарекомендовать себя лучше интерферирующих. Так, крепким орешком для siРНК могут оказаться некоторые вирусы. Существовавшая изначально точка зрения, что механизм РНК-интерференции является своеобразным клеточным иммунитетом от вирусных инфекций, оказалась справедливой только для вирусов растений и ряда низших животных. Несмотря на то, что с начала использования технологии РНК-интерференции появились сообщения об успешном подавлении активности таких вирусов, как ВИЧ (HIV-1), вирусы гепатита B и C, вирус атипичной пневмонии (SARS), гриппа типа А в различных экспериментальных системах, оказалось что многие из вирусов применяют активные и пассивные средства борьбы с siРНК. Многие белки, закодированные в геноме различных вирусов, являются супрессорами, то есть подавляют РНК-интерференцию. Среди них NS1 белок вируса гриппа А, белок оболочки вируса гепатита С, белок Tat вируса иммунодефицита человека, белок VP35 вируса Эбола и др.
Вообще оказалось, что многие РНК-вирусы снабжены неплохой системой защиты. РНК-геном ретровирусов (таких как вирус саркомы Рауса) оказался так плотно упакован внутри вирусной частицы, что просто недоступен для РНК-интерференции. Кстати, вирус иммунодефицита человека относится к роду лентивирусов семейства ретровирусов, и принцип сборки вирусной частицы у него очень близок к классическим ретровирусам.
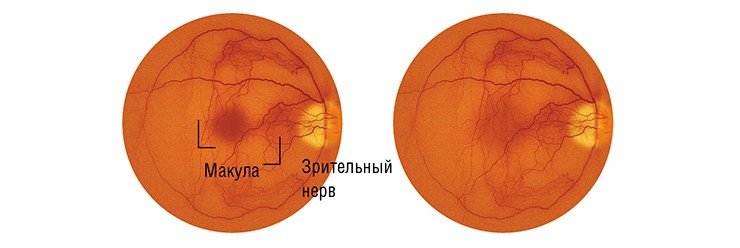
Возрастная дегенерация сетчатки или зрительная катастрофа (Age-related Macular Degeneration (AMD)) Макула (macula lutea, или желтое пятно) – это центральный участок сетчатки диаметром около 5 мм, ответственный за центральное зрение и состоящий из самых высокочувствительных клеток. Здоровая макула обеспечивает человеку приблизительно 80 % остроты зрения, и лишь 20 % зрения дает нам остальная часть сетчатки.
Дегенерация макулы – одна из главных причин безвозвратного снижения зрения у пожилых людей. Если раньше такой диагноз ставился обычно в возрасте 70—80 лет, то сейчас возрастной порог снизился до 40 до 60 лет. По данным Американской Академии Офтальмологии, в США возрастная дегенерация (AMD) является главной причиной утраты зрения после 50 лет.
При возрастной дегенерации сначала в поле зрения появляются точечные дефекты, затем в процесс вовлекаются более обширные области и, наконец, изображение в центре просто исчезает. Одним из ранних симптомов заболевания является искажение зрения, metamorphopsia – решетка из параллельных линий видится извивистой, местами изображение ее просто исчезает. Простым и эффективным инструментом для выявления этого симптома является Amsler Grid Test – центральная черная точка для фиксации зрения и решетка вокруг нее.
Возрастная дегенерация может приводить к полной утрате зрения. Пожалуй, самой большой утратой для тех, у кого зрение частично сохраняется, является невозможность видеть лица – вблизи или совсем.
Препарат SiRNA-27 – первое из лекарств серии интерферирующих РНК, допущенный до клинических испытаний. Всего из 8 siРНК препаратов, допущенных до испытаний, три направлены на лечение возрастной дегенерации сетчатки.
На сегодняшний день представляется вполне ясным, что РНК-интерференция не является конкурентом, призванным вытеснить классическую антисмысловую технологию с фармацевтического рынка. У каждого подхода есть свои сторонники и противники, и есть задачи, которые более успешно решаются в рамках той или иной технологии. Есть также и такие задачи, которые можно с большим успехом решить, применяя комбинации препаратов антисмысловых и интерферирующих РНК.
Ответ на другой вопрос: не ждет ли первоначально сверх успешную РНК-интерференцию судьба классической антисмысловой технологии, на которую два десятка лет назад возлагались огромные, но по сегодняшний день не сбывшиеся надежды, найти сложнее.
Список самых опасных врагов сегодняшней медицины, болезней – массовых убийц, препараты против которых теоретически возможно получить на основе той или иной технологии, очень близок для siРНК и антисмысловых олигонуклеотидов. Сюда входят и все виды онкологических болезней, и нейродегенеративные заболевания, такие как болезнь Альцгеймера и болезнь Хантингтона, основные сердечно-сосудистые заболевания (наследственные болезни сердца, гипертония, атеросклероз, миокардит, гипертрофия сердца и инфаркт), и болезни, связанные с нарушением работы иммунной системы (астма, псориаз, аллергические состояния, воспаления), и многие виды вирусных и невирусных гепатитов, а также ряд других вирусных инфекций.
Как экспериментальная технология нокаута генов РНК-интерференция уже на сегодня состоялась как подход, который стоит считать приоритетным для широчайшего спектра исследований. Она также существенно снижает расходы на тестирование кандидатных лекарственных препаратов в фармакологии. Станут ли siРНК-молекулы основой для нового поколения терапевтических препаратов или повторят судьбу антисмысловых олигонуклеотидов?
Литература к редакционному комментарию
Dykxhoorn D. M. and Lieberman J. The silent revolution RNA Interference as Basic Biology, Research Tool, and Therapeutic // Annual Review of Medicine, 2005. V. 56(1):401
Haasnoot J., Westerhout E. M., Berkhout B. RNA interference against viruses: strike and counterstrike // Nature Biotechnology 25, 1435 — 1443 (2007)
Sassen S., Miska E. A., Caldas C. MicroRNA—implications for cancer// Virchows Arch. 2008 January; 452(1): 1—10
Pellish R. S., Nasir A., Ramratnam B. and Moss S. F. RNA interference — potential therapeutic applications for the gastroenterologist // Alimentary Pharmacology and Therapeutics 27 (9) , 715—723, May 2008
Wu W., Sun M., Zou G.-M. and Jianjun Chen. // International Journal of Cancer: 120, 953—960, 2006
Marquez R. T. and MCcaffrey A. P. Advances in MicroRNAs: Implications for Gene Therapists// Human Gene Therapy. January 1, 2008, 19(1): 27-38. doi:10.1089/hum. 2007.147.
Wu L., Belasco J. G.. Let Me Count the Ways: Mechanisms of Gene Regulation by miRNAs and siRNAs // Molecular Cell 29, January 18, 2008:1-7
Kurreck J. Antisense technologies. Improvement through novel chemical modifications // FEBS Journal, Volume 270, Number 8, April 2003 , pp. 1628-1644(17)
Clayton J. The silent treatment. // Nature. Vol 431, 599-605, 2004
Lieberman J., Song E., Lee S. K., Shankar P. Interfering with disease: opportunities and roadblocks to harnessing RNA interference // Trends in Molecular Medicine 2003 Sep; 9(9):397—403
Tang Y., Ge Y.-z., Q Yin J. Exploring in vitro roles of siRNA in cardiovascular disease // Acta Pharmacologica Sinica, Volume 28, Number 1, January 2007, pp. 1—9(9)
De Fougerolles A. R. Delivery Vehicles for Small Interfering RNA In Vivo // Human Gene Therapy 19:125—132, February 2008
Li C. X., Parker A., Menocal E., Xiang S., Borodyansky L. and Fruehauf J. H. Delivery of RNA interference. Cell Cycle 5(18): 2103—2109, 2006 September 15
Love T. M., Moffett H. F., Novina C. D.. Not miR-ly small RNAs: big potential for microRNAs in therapy // Journal of Allergy and Clinical Immunology, 2008 Feb ;121 (2):309—19 18269923 (P,S,E,B,D)
Aboul-Fadl T. Antisense Oligonucleotides: The State of the Art // Current Medicinal Chemistry, Volume 12, Number 19, September 2005 , pp. 2193—2214(22)
- 20122
- 16,1
- 3
- 16
Ещё двадцать лет назад молекулярная биология не знала такого удивительного феномена, как РНК-интерференция. Сегодня же у учёных не вызывает сомнения, что это явление принимает участие в широчайшем спектре физиологических процессов у всех живых существ, а её молекулярные посредники — короткие РНК — по разнообразию и специфичности не уступают антителам крови. У простейших РНК-интерференция обеспечивает иммунитет, в частности — защиту от вирусов. У более развитых организмов этот механизм включается в борьбу не только (и не столько) с внешними, но и с внутригеномными паразитами, а также становится важнейшим регулятором активности генов. На сегодняшний день идентифицированы уже тысячи коротких регуляторных РНК, а механизм РНК-интерференции изучен очень подробно, однако бесспорно и то, что мы наблюдаем пока только верхушку этого айсберга.
Принцип РНК-интерференции
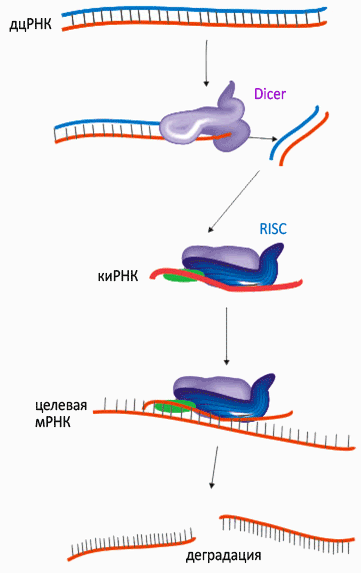
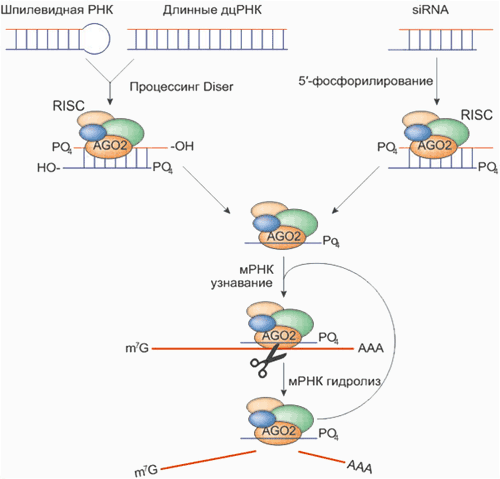
Рисунок 1. РНК-интерференция
Игрок № 1 — короткие интерферирующие РНК
| Мишень (мРНК) | -AТCGUACGCGG*AAUACUUCGAUU- |
| Смысловая киРНК | CGUACGCGG AAUACUUCGAUU-3′ |
| Анти-смысловая киРНК | 3′-UUGCAUGCGCC*UUAUGAAGCU-5′ |
Игрок № 2 — микроРНК
По мере усложнения генома микроРНК и пиРНК принимали всё большее участие в регуляции транскрипции и трансляции. Со временем, они превратились в дополнительную, точную и тонкую систему регуляции генома. В отличие от киРНК, микроРНК и пиРНК (открыты в 2001 году, см. врезку 3) не производятся из чужеродных двуцепочечных молекул РНК, а изначально закодированы в геноме организма-хозяина [8].
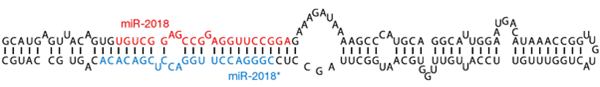
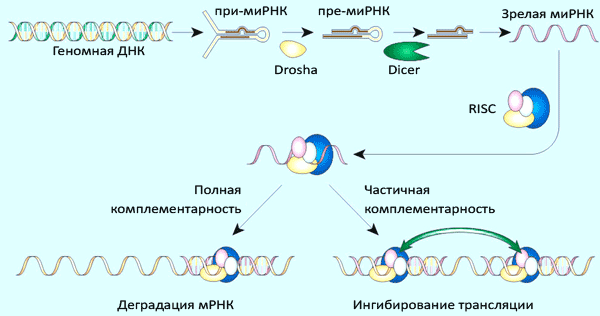
Рисунок 4. Общий механизм процессинга микроРНК и реализации её активности.
Механизм действия многих микроРНК аналогичен действию киРНК: короткая (21–25 нуклеотидов) одноцепочечная РНК в составе белкового комплекса RISC с высокой специфичностью связывается с комплементарным участком в 3′-нетранслируемой области мРНК-мишени. Связывание приводит к расщеплению мРНК белком Ago. Однако активность микроРНК (по сравнению с киРНК) уже более дифференцирована — если комплементарность не абсолютная, целевая мРНК может не деградировать, а только обратимо блокироваться (трансляции не будет). Тот же RISC-комплекс может использовать и искусственно введённые киРНК. Это объясняет, почему киРНК, сделанные по аналогии с простейшими, активны и у млекопитающих.
Таким образом, мы можем дополнить иллюстрацию механизма действия РНК-интерференции у высших (билатерально-симметричных) организмов, объединив на одном рисунке схему действия микроРНК и биотехнологически введённых киРНК (рис. 5).
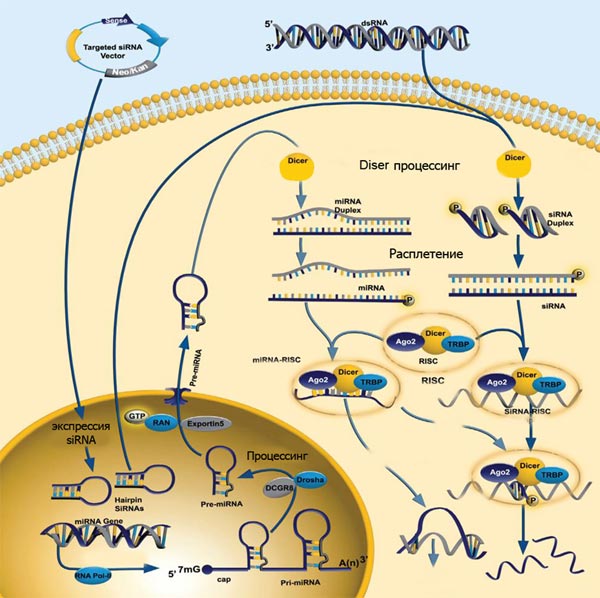
Рисунок 5. Обобщённая схема действия искусственных микроРНК и киРНК (искусственные киРНК вводятся в клетку с помощью специализированных плазмид — targeting siRNA vector).
До недавнего времени считалось, что микроРНК только подавляют — полностью или частично — работу генов. Однако недавно оказалось: действие микроРНК может кардинально отличаться в зависимости от состояния клетки! В активно делящейся клетке микроРНК, связавшись с комплементарной последовательностью в 3′-участке мРНК, ингибирует синтез белка (трансляцию). Однако в состоянии покоя или стресса (например, при росте на бедной среде) то же самое событие приводит к прямо противоположному эффекту — усилению синтеза целевого белка [11]!
Количество разновидностей микроРНК у высших организмов ещё до конца не установлено — по некоторым данным, оно превосходит 1% от числа белок-кодирующих генов (у человека, например, говорят о 700 микроРНК, и это число постоянно растет). микроРНК регулируют активность около 30% всех генов (мишени для многих из них пока не известны), причём существуют как повсеместно распространённые, так и тканеспецифичные молекулы — например, один такой важный пул микроРНК регулирует созревание стволовых клеток крови.
Широкий профиль экспрессии в разных тканях разных организмов и биологическая распространённость микроРНК говорит об эволюционно древнем происхождении. Впервые микроРНК обнаружили у нематод, и долгое время потом считали, что эти молекулы появляются лишь у губок и кишечнополостных; однако позже их открыли и в одноклеточных водорослях [11]. Интересно, что по мере усложнения организмов увеличивается также количество и гетерогенность пула микроРНК. Это косвенно свидетельствует о том, что сложность этих организмов обеспечивается, в частности, функционированием микроРНК [12]. Возможная эволюция микроРНК показана на рисунке 6.

Рисунок 6. Многообразие микроРНК у разных организмов. Чем выше организация организма, тем больше у него обнаруживается микроРНК (число в скобках). Красным выделены виды, у которых обнаружены единичные микроРНК.
Между киРНК и микроРНК можно провести чёткую эволюционную связь, опираясь на следующие факты:
Чем дальше, тем запутанней. Игрок № 3 — пиРНК
Однако в процессе эволюции природа создала ещё одну, эволюционно самую позднюю и узкоспециализированную систему на основе всё того же удачного принципа РНК-интерференции. Речь идет пиРНК (piRNA, от Piwi-interaction RNA).
Количество МГЭ нелинейно увеличивается с размером генома, и их активность необходимо сдерживать. Для этого животные, уже начиная с кишечнополостных, используют всё тот же феномен РНК-интерференции. Эту функцию также выполняют короткие РНК, однако не те, о которых речь уже шла, а третий их тип — пиРНК.
пиРНК — короткие молекулы длиной в 24–30 нуклеотидов, закодированные в центромерных и теломерных областях хромосомы. Последовательности многих из них комплементарны известным мобильным генетическим элементам, однако есть множество других пиРНК, совпадающих с участками рабочих генов или с фрагментами генома, функции которых неизвестны.
пиРНК (также как и микроРНК) закодированы в обеих цепях геномной ДНК; они весьма изменчивы и разнообразны (до 500 000 (!) видов в одном организме). В отличие от киРНК и микроРНК, они образуются одной цепью с характерной особенностью — урацилом (U) на 5′-конце и метилированным 3′-концом. Есть и другие отличия:
- В отличие от киРНК и микроРНК, они не требуют процессинга Dicer’ом.
- Гены пиРНК активны только в зародышевых клетках (во время эмбриогенеза) и окружающих их эндотелиальных клетках.
- Белковый состав системы пиРНК иной — это эндонуклеазы класса Piwi (Piwi и Aub) и отдельная разновидность Argonaute — Ago3.
Процессинг и активность пиРНК пока достаточно плохо изучены, но уже ясно, что механизм действия совершенно отличается от других коротких РНК — сегодня предложена пинг-понг модель их работы (рис. 7 и 8).
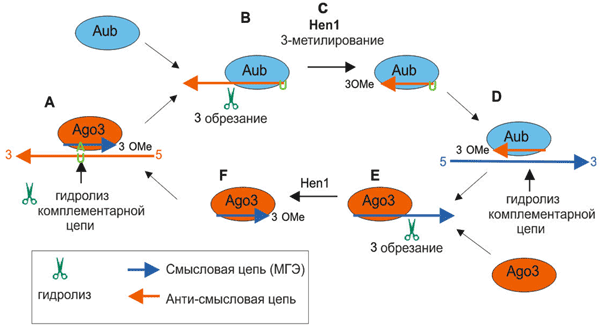
Рисунок 7. Цитоплазматическая часть процессинга пиРНК. Биогенез и активность пиРНК опосредуется семейством эндонуклеаз Piwi (Ago3, Aub, Piwi). Активность пиРНК обеспечивается обеими одноцепочечными молекулами пиРНК — смысловой и анти-смысловой, — каждая из которых ассоциирует со специфической эндонуклеазой Piwi. пиРНК узнает комплементарный участок мРНК транспозона (синяя цепь) и вырезает его. Это не только инактивирует транспозон, но и создает новую пиРНК (связанную с Ago3 с помощью метилирования метилазой Hen1 3′-конца). Такая пиРНК, в свою очередь, узнаёт мРНК с транскриптами кластера предшественников пиРНК (красная цепь) — таким способом цикл замыкается и снова вырабатывается нужная пиРНК.
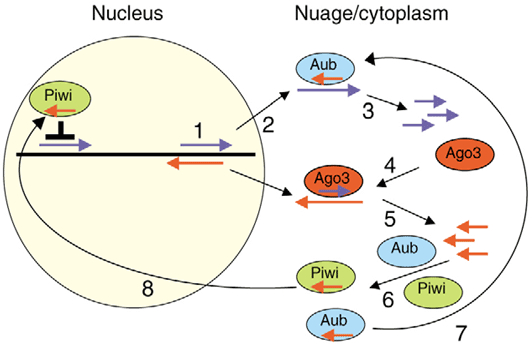
Рисунок 8. пиРНК в ядре. Кроме эндонуклеазы Aub, антисмысловую пиРНК может связывать и эндонуклеаза Piwi. После связывания комплекс мигрирует в ядро, где вызывает деградацию комплементарных транскриптов и перестройку хроматина, вызывающую подавление активности транспозонов.
Главная функция пиРНК — подавление активности МГЭ на уровне транскрипции и трансляции. Считается, что пиРНК активны только во время эмбриогенеза, когда непредсказуемые перетасовки генома особенно опасны и могут привести к гибели зародыша. Это логично — когда иммунная система ещё не заработала, клетки эмбриона нуждаются в какой-нибудь простой, но действенной защите. От внешних патогенов эмбрион надежно защищен плацентой (или оболочкой яйца). Но кроме этого необходима оборона и от эндогенных (внутренних) вирусов, — в первую очередь МГЭ.
У высших животных — в том числе и человека — система пиРНК развита очень хорошо, но встретить её можно только в эмбриональных клетках и в околоплодном эндотелии. Почему распространение пиРНК в организме столь ограничено — ещё предстоит узнать. Можно предположить, что, как и любое мощное оружие, пиРНК приносит пользу только в очень специфических условиях (во время развития плода), а во взрослом организме их активность нанесёт больше вреда, чем пользы. Все-таки, число пиРНК на порядок превосходит количество известных белков — и неспецифические эффекты пиРНК в зрелых клетках сложно предсказать.
| киРНК | микроРНК | пиРНК | |
|---|---|---|---|
| Распространение | Растения, Drosophila, C. elegans. Не найдено у позвоночных | Эукариоты | Эмбриональные клетки животных (начиная с кишечнополостных). Нет у простейших и растений |
| Длина | 21–22 нуклеотидов | 19–25 нуклеотидов | 24–30 нуклеотидов |
| Структура | Двуцепочечная, по 19 комплементарных нуклеотидов и два неспаренных нуклеотида на 3′-конце | Одноцепочечная сложная структура | Одноцепочечная сложная структура. U на 5′-конце, 2’-O-метилированный 3′-конец |
| Процессинг | Dicer-зависимый | Dicer-зависимый | Dicer-независимый |
| Эндонуклеазы | Ago2 | Ago1, Ago2 | Ago3, Piwi, Aub |
| Активность | Деградация комплементарных мРНК, ацетилирование геномной ДНК | Деградация или ингибирование трансляции целевой мРНК | Деградация мРНК, кодирующих МГЭ, регуляция транскрипции МГЭ |
| Биологическая роль | Антивирусная иммунная защита, подавление активности собственных генов | Регуляция активности генов | Подавление активности МГЭ во время эмбриогенеза |
Заключение
В заключение хочется привести таблицу, иллюстрирующую эволюцию белкового аппарата, участвующего в РНК-интерференции (рис. 9). Видно, что у простейших наиболее развита система киРНК (белковые семейства Ago, Dicer), а с усложнением организмов акцент переносится на более специализированные системы — увеличивается число изоформ белков для микроРНК (Drosha, Pasha) и пиРНК (Piwi, Hen1). При этом разнообразие ферментов, опосредующих действие киРНК, уменьшается.
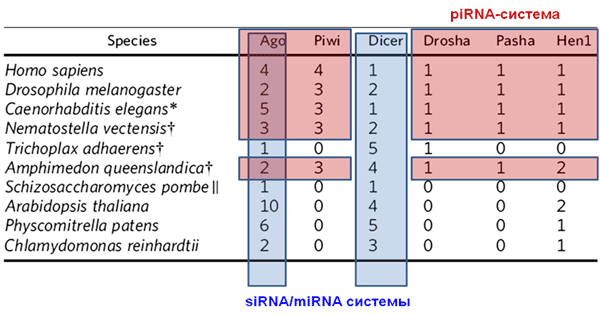
Рисунок 9. Многообразие белков, участвующих в РНК-интерференции (цифры обозначают количество белков каждой группы). Синим цветом подсвечены элементы, характерные для киРНК и микроРНК, а красным — белки, связанные с пиРНК.
Одним из способов получения новых сортов декоративных растений, например, петуний, цветы которых обладали бы более яркими бордовыми лепестками, является введение в клетки растения гена, отвечающего за синтез красного пигмента. К удивлению селекционеров, многие цветы после введения дополнительной копии гена, вместо того, чтобы усилить окраску, вовсе теряли пигмент и оказывались белыми. С этого и других похожих наблюдений, сделанных в начале 90-х годов ХХ столетия, и началась история малых интерферирующих РНК.
Длительное время исследователи не обращали особого внимания на короткие клеточные РНК, полагая, что их роль в клетке не слишком значительна. Гораздо больший интерес вызывали другие типы РНК, а именно информационные, транспортные и рибосомальные. Эти классы РНК имеют определенные размеры, часто являясь очень длинными молекулами, содержащие до 100 000 нуклеотидов.
К классу малых РНК вообще относят молекулы, содержащие от 20 до 300 рибонуклеотидов. За эффект РНК-интерференции отвечают самые короткие из них – siRNA, состоящие всего из 21-28 (у млекопитающих из 21-23) нуклеотидов. Структурной особенностью этих молекул является то, что они, в отличие от большинства других клеточных РНК, состоящих всего из одной цепи нуклеотидов, являются двухцепочечными. Нуклеотиды двух цепей siRNA спариваются друг с другом по тем же законам комплементарности, которые формируют двуцепочечные молекулы ДНК в хромосомах. Кроме того, по двум концам каждой siRNA всегда присутствуют одноцепочечные уступы из двух неспаренных нуклеотидов.
Структуру siRNA определили, выделив их из клетки. Но как siRNA появляются в клетке, например, после введения дополнительной копии гена, как это было в случае с петунией. Очевидно, в клетке должен существовать некий молекулярный механизм, который обеспечивал бы синтез siRNA, их накопление в клетке и позволял бы им выключать гены. Исходя из этих предположений, а также теоретически определив круг наиболее вероятных участников процесса РНК-интерференции, исследователи начали поиск реальных компонентов, отвечающих за ее реализацию. И хотя все детали этого процесса до сих пор неизвестны, одна из главных закономерностей была установлена: ученым удалось выявить систему ферментов, которая во многом схожа у всех многоклеточных и некоторых одноклеточных организмов (см. рис. 1).
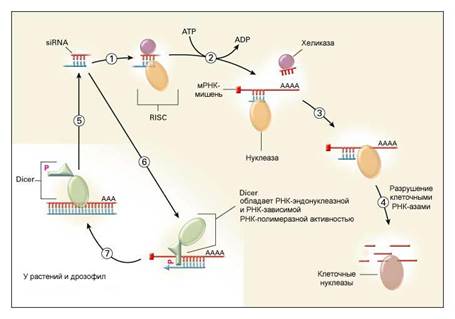
| Рис. 1 |
Если молекула siRNA по тем или иным причинам появляется в клетке, она сразу же взаимодействует со специфической клеточной системой белков, для которых появление siRNA является сигналом к такому взаимодействию.
Один из ответов на вопрос о необходимости РНК-интерференции в клетке, поставленный выше, напрашивается сам собой: с помощью siRNA клетка может защищать себя от проникновения вирусов.
У млекопитающих, в отличие от насекомых и растений, работает другая система защиты. При попадании в дифференцированную клетку млекопитающего чужой РНК, длина которой больше 30 нуклеотидов, клетка начинает синтез интерферона. Интерферон, связываясь со специфическими рецепторами на клеточной поверхности, способен активировать в клетке целую группу генов. В результате в клетке синтезируется несколько видов ферментов, которые тормозят синтез белков и расщепляют вирусные РНК. Кроме того, интерферон может действовать и на соседние, еще не зараженные клетки, блокируя тем самым возможное распространение вируса.
Действительно, открытие siRNA интересно тем, что дает новую надежду в борьбе с вирусами, в том числе с ВИЧ, а также с теми из них, кого подозревают в соучастии при развитии рака. Высокая специфичность и эффективность siRNA вместе с их низкой токсичностью оказываются как нельзя кстати. Каким же образом, применяя терапию siRNA вместе с традиционными способами антивирусной терапии, можно достичь эффекта потенцирования, когда два разных воздействия приводят к более выраженному лечебному эффекту, чем простая сумма каждого из них, применяемого по отдельности.
Для того, чтобы использовать механизм siRNA-интерференции в клетках млекопитающих, в клетки нужно ввести уже готовые двухцепочечные молекулы siRNA. Оптимальный размер таких синтетических siRNA при этом должен составлять те же 21-28 нуклеотидов. Если увеличить ее длину – клетки ответят выработкой интерферона и снижением синтеза белка. Такие синтетические двухцепочечные РНК могут попасть как в зараженные, так и в здоровые клетки, и снижение синтеза белков в незараженных клетках окажется крайне нежелательным. С другой стороны, если попытаться применять siRNA меньшие, чем 21 нуклеотид, резко снижается специфичность ее связывания с нужной мРНК и способность к формированию комплексов RISC.
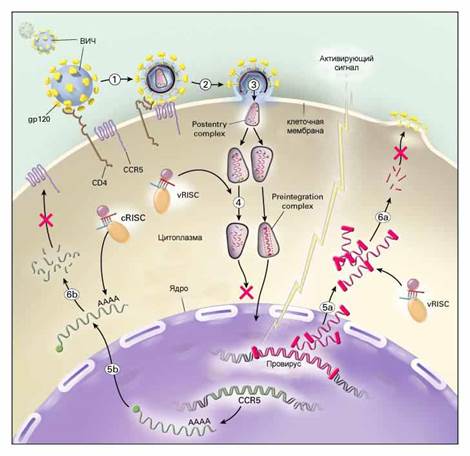
| Рис.2. | Этапы ВИЧ - инфекции, на которых ее возможно заблокировать с помощью siRNA (показаны красными крестами). |
Молекулярные биологи полагают, что так же, как и ВИЧ, можно блокировать на молекулярном уровне развитие и других заболеваний, в том числе опухолевых и инфекционных. На данный момент уже известна структура генов и, соответственно, структура мРНК многих мутантных молекул, которые участвуют, а иногда, как предполагается, и запускают развитие некоторых видов рака. Блокировав мРНК таких молекул с помощью РНК-интерференции, можно добиться по крайней мере ослабления прогрессии заболевания.
На сегодняшний день, правда, все вышесказанное относится лишь к области теории. На практике терапия siRNA встречается с затруднениями, обойти которые ученым пока не удается. Например, в случае антивирусной терапии именно высокая специфичность siRNA может сыграть злую шутку: как известно, вирусы обладают способностью быстро мутировать. Особенно отличается в этом ВИЧ, частота изменений которого такова, что у человека, заразившегося одним подтипом вируса, через несколько лет может быть выделен абсолютно непохожий на него подтип. В этом случае измененный штамм ВИЧ автоматически станет нечувствительным к siRNA, подобранной в начале терапии.
Учитывая эти затруднения, ученые разрабатывают альтернативные варианты противовирусной siRNA-терапии. В случае ВИЧ, например, показано, что блокирование процесса образования CCR5, одной из молекул-рецепторов на клеточной поверхности, необходимых для прикрепления вируса к клетке (этап 6b на рис. 2), также может предотвращать заражение ВИЧ. Преимуществом данного подхода является то, что ген CCR5 и, соответственно, его мРНК, отличается (по сравнению с ВИЧ) гораздо большей стабильностью своего нуклеотидного состава, а, значит, подобрать для нее эффективную siRNA гораздо легче.
Существенный недостаток предполагаемой siRNA-терапии у человека – ее кратковременность. Ведь siRNA действуют не на сами гены, а только лишь на их продукты – молекулы мРНК, а у человека нет той системы усиления сигнала, которая присуща растениям и насекомым (этапы 5-7 на рис. 1). Кроме того, двухцепочечные молекулы siRNA чрезвычайно неустойчивы и недолговечны, поэтому эффект терапии закончится, как только они разрушатся и будут выведены из клетки. Для того, чтобы терапия оказалась пролонгированной, необходимо вводить все новые siRNA.
Генная терапия пытается решить эту проблему, создавая специальные генетические конструкции на основе вирусных или бактериальных ДНК, в которые включены и гены, кодирующие необходимый для терапии тип siRNA. При попадании в клетку такие конструкции встраиваются в хромосомы, а гены siRNA превращаются в собственно молекулы siRNA с помощью клеточного механизма транскрипции. Таким образом, клетка сама получает возможность постоянно продуцировать новые и новые siRNA. Данные подходы уже опробованы и показали свою эффективность in vitro.
Но самым главным препятствием на пути разработки лекарств на основе siRNA являются сложности с их доставкой в клетки-мишени в пределах целого организма.
Во-первых, в крови на них действует первый эшелон защиты организма, ферменты - нуклеазы, которые разрезают потенциально опасные и необычные для нашего организма двойные цепочки РНК. Во-вторых, несмотря на свое название – малые, siRNA все же достаточно длинны, а, главное, они заряжены, что делает невозможным их пассивное проникновение в клетку. И в – третьих, один из самых главных вопросов состоит в том, как заставить siRNA проникать только в больные клетки-мишени, не затрагивая при этом здоровые.
Все поставленные выше вопросы появились задолго до открытия siRNA, и их преодоление принципиально важно не только для терапии siRNA, но и для генной терапии вообще. В решении этих вопросов исследователи уже сейчас достигли некоторого прогресса. Например, имеются попытки путем химических модификаций сделать молекулы siRNA более липофильными таким путем облегчить проникновение siRNA внутрь клетки. В свою очередь для обеспечения специфичности работы siRNA внутри только лишь определенных тканей, генные инженеры включают в состав своих конструкций специальные регуляторные участки, которые активируются и запускают считывание информации, заключенной в подобной конструкции (а значит, и синтез siRNA, если она туда включена), только в клетках определенных тканей.
Большинство экспертов сходится во мнении, что siRNA-терапия вряд ли станет панацеей от вирусов и рака. Однако создание на ее базе пусть даже не радикального, но все же действенного лекарственного средства будет очень важным шагом на пути разработки методов генной терапии. Можно сказать, что siRNA-терапия – это примерочный этап, на котором задачей экспериментаторов является отработка оптимальных условий целенаправленной доставки биомолекул в клетки пораженных тканей.
Именно в этом siRNA явились для генетиков неоценимой находкой. Если раньше на поиски удачного способа блокирования гена или приведения его в действие требовалось от нескольких месяцев до года, то с помощью siRNA практически с любым геном любого организма, последовательность нуклеотидов которого известна, эту процедуру можно осуществить в течение 1-2 недель, значительно повысив при этом специфичность блокирования. Действительно, у генетиков и молекулярных биологов есть повод для радости.
Дело в том, что геном любого многоклеточного организма включает в себя множество элементов, которые когда-то были привнесены в него в процессе эволюции извне, например, в результате встраивания вируса. Действительно, из всего материала, содержащегося в хромосомах человека, 34% приходится на долю элементов, называемых LINEs и SINEs (соответственно, Long и Short Interspersed Nuclear Elements), о функциях которых известно только то, что они могут время от времени копировать себя и перемещаться с одного места хромосомы в другое; те участки ДНК, которые достались геному человека от ретровирусов (8% генома) и транспозоны (3%) также способны менять свое место в геноме. На их фоне, как уже упоминалось в главе . всего лишь 1-2 процента генов, кодирующих собственно клеточные белки, кажутся такой же маловажной деталью, как и siRNA среди огромного разнообразия своих других, крупных молекул РНК.
Еще одна из предполагаемых природных функций siRNA – выявление неправильно обработанных копий других типов РНК в клетке.
Как осуществляются все эти функции siRNA, каковы их молекулярные детали? Откуда, например, может появляться та необходимая для запуска реакции РНК-интерференции молекула двухцепочечной РНК? Если она создается в клетке намеренно, то какие ферменты отвечают за ее создание? Какие свойства сигнализируют о том, что молекула одноцепочечной РНК чужеродная или ошибочная и подлежит уничтожению? Каковы особенности функционирования системы siRNA у разных организмов, и почему они возникли именно в таком виде? Как появляются siRNA в клетке млекопитающих, у которых пока не выявлены ферменты, ответственные за достраивание второй цепочки siRNA?
На эти и многие другие вопросы ответов пока нет.
Читайте также:
- Летний грипп что это
- Строение бактериальной клетки вирусы
- Гусев д а вирусный гепатиты
- Чем лечить вирусную простуду у ребенка 3 лет
- Какие противовирусные препараты можно принимать беременным на ранних сроках
 Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.
Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.

