Вирусная инфекция при раке легких
Инфекции — главные причины смерти при раке. Они не только часто встречаются, но нередко имеют более тяжелое течение, чем у других пациентов, менее подверженных действию терапии, и иногда вызываются организмами, которые не патогенны для здоровых людей. Такая восприимчивость является следствием подавления защитных механизмов больного, вызванного опухолью и ее лечением.
Кожа и слизистые оболочки служат барьером для инфекции. Опухолевая инфильтрация и местная лучевая радиотерапия могут привести к повреждению лимфатических или венозных сосудов, что приводит к увеличению восприимчивости к локальной инфекции. Воспроизводство эпителиальных клеток в желудочно-кишечном тракте подавляется химиотерапией, из-за чего повреждается и изъязвляется слизистая, что позволяет организмам из кишечника попасть в систему воротной вены.
Кожа повреждается внутривенными иглами и канюлями, особенно туннельными подкожными каналами. Это частые источники инфекции, которые вызываются такими кожными организмами, как Staphylococcus epidermidis. В носоглоточной полости возникают инфекции, вызванные Candida albicans.
Рак при запущенной стадии иногда связан с ухудшением функций и нейтрофилов, и моноцитов. Было описано подавление хемотаксической, фагоцитарной и бактерицидной активностей.
Ослабленная замедленная гиперчувствительность довольно распространена при запущенной болезни Ходжкина, но менее часта в других случаях злокачественных опухолей. Лимфопения неизменно вызывается действием алкилирующих агентов и массивной радиотерапией. Клеточный иммунитет особенно важен при защите организма хозяина от грибов, вирусов, туберкулеза и простейших.
Интенсивная цитотоксическая химиотерапия ведет к ухудшению образования антител к бактериальным и вирусным антигенам.
Циркулирующие бактерии удаляются фагоцитарными клетками, находящимися в синусах ретикулоэндотелиальной системы, особенно в печени и селезенке. Для этой чистки важны антитела и белки системы комплемента. Спленэкто-мия увеличивает риск серьезной бактериальной инфекции, особенно пневмококковый сепсис в детском возрасте и в меньшей степени во взрослом.
Бактериемия и септицемия у больных раком
Инфекции кровяного русла довольно часты у пациентов с гранулоцитопенией. Патогенами часто являются грамотрицательные бактерии (Escherichia coli, Pseudomonas aeruginosa), стафилококки и стрептококки. Увеличивается частота инфекций, вызванных грамположительными бактериями, особенно Staphylococcus epidermidis. Пациенты с тунельными подкожными каналами особенно подвержены поражениям этим организмом.
Жар у пациента с нейтропенией при раке — показатель присутствия бактерий в крови и под кожей. Если существует очевидный источник инфекции, например инфицированный порт для инфузий, следует взять культуру бактерий и удалить канюлю. Лечение не следует откладываеть для пациента с нейтропенией. Пациенты с лихорадочной нейтропенией с относительно низким риском развития серьезных осложнений относятся к тем, кого лечат короткими циклами химиотерапии для солидных опухолей.
Эти пациенты должны быть госпитализированы. Недавние исследования показали, что пероральный прием амоксициллина-клавуланата комбинированный с пероральным приемом ципрофлоксацина так же эффективен, как и внутривенная химиотерапия в этой группе (70% пациентов). Пациенты с высоким риском (с неконтролируемым раком или на стационарном лечении интенсивной терапией) лечатся внутривенными антибиотиками, в том числе b-лактамом и аминогликозидом или цефтазидимом.
Респираторные инфекции у больных раком
У пациента с серьезным подавлением иммунитета довольно часто возникает жар с легочным инфильтратом. Главные причины этого даны в таблице.
Осложнения в постановке диагноза могут быть значительны, поскольку тесты слюнных и кровеносных культур иногда отрицательны, а более инвазивные процедуры, такие как трансбронхиальная биопсия, невозможны из-за тромбоцитопении или общего состояния пациента.
Существуют некоторые клинические особенности, которые помогают при постановке диагноза. Кавитация наиболее часто сопровождает поражения анаэробными бактериями, стафилококками и микобактериями. Инфекции Pneumocystis вызывают заметную одышку, а на рентгенограмме грудной клетки видны билатеральные инфильтраты, обычно состоящие из хилуса. Болезнь, однако, может протекать вяло и вызвать долевое уплотнение. Цитомегаловирусные инфекции встречаются главным образом у пациентов с серьезным подавлением иммунитета, в частности в течение аллогенной ВМТ. Болезнь может также вызывать миокардит, невропатию или офтальмию.
Легочные инфильтраты обычно билатеральны. Инфекции Candida вызывают широкое разнообразие изменений в рентгенограмме. Инфекции Aspergillus обычно быстро прогрессируют. Тесты культур крови обычно отрицательны, а инфильтраты возможны в одном или двух легких.
При затруднениях в постановке диагноза можно следовать следующей схеме.
У пациентов без нейтропении или тромбоцитопении исследовать посевы крови, слюны, бронхоскопические промывания и трансбронхиальную биопсию там, где это возможно. Если кровяные и слюнные культуры отрицательны, лечить антибиотиками широкого антибактериального спектра действия (обычно в комбинации с аминогликозидом, пенициллином и метронидазолом или аналогичными соединениями). Если возможной причиной инфекции является Pneumocystis, следует давать высокие дозы котримоксазола. Если ответа нет, рассмотрите ацикловир для вируса простого герпеса и противогрибковую терапию с амфотерицином или кетоконазолом. Ацикловир не эффективен против цитомегаловирусов.
Если кровяные или слюнные тесты положительны, лечите соответствующе, но если ответа нет, рассмотрите смешанные инфекции.
Пациентам с нейтропенией или тромбоцитопенией проводят бронхоскопию, но биопсия не всегда возможна, и лечение продолжают без дальнейшего диагностического исследования. До и после бронхоскопии иногда необходимы антибиотики и переливание тромбоцитов.

Инфекции мочевыводящих путей у больных раком
Инфекции часты у пациентов с затрудненным мочеиспусканием. Затруднения могут быть вызваны опухолью или ослаблением мочевого пузыря у пациентов с компрессией спинного мозга и его корешков. Диагноз ставится после исследования уринокультуры, и лечение осуществляется антибиотиками и снятием осложнений, если это возможно.
Желудочно-кишечные инфекции у больных раком
Молочница ротовой полости (инфекция, вызываемая Candida albicans) — частое осложнение химиотерапии. Она особенно распространена у пациентов с подавленным иммунитетом, у пациентов, принимающих стероиды и тех, кого лечат антибиотиками с широким спектром действия. Рот и глотка становятся очень болезненными, а белые пятна грибков видны на эри-темной основе. У плохо питающихся пациентов инфекция может проникать глубже и распространяться по пищеводу, желудку и кишечнику. Обычно эффективен пероральный прием нистатина, амфотерицина или миконазола.
Проявление вируса простого герпеса на губах часто проблематично для пациентов с лейкопенией, и повреждения могут быть довольно обширными. В данном случае необходимо местное применение ацикловира для пациентов с подавленным иммунитетом или систематический прием ацикловира при более серьезных инфекциях.
Инфекции, вызванные Candida в пищеводе, необходимо лечить пероральным приемом суспензии нистатина, но если такое лечение неэффективно, то необходимо применение кетоко-назола или короткий курс амфотерицина. Кишечные инфекции, возникающие при поражении Candida, должны лечиться амфотерицином.
Перианальные инфекции распространены среди пациентов с нейтропенией. Всегда необходимо применять профилактические меры совместно с тщательной гигиеной промежности и смягчителями стула для предотвращения запора и анальных трещин. Распространяющиеся перинеальные (паховые) инфекции могут угрожать жизни пациента, и требуется срочное лечение внутривенными антибиотиками, действующими против грамотрицательных и анаэробных бацилл.
Менингит у больных раком
Инфекции центральной нервной системы (ЦНС) довольно редки, но у пациентов с лимфомой или лейкемией иногда развивается менингит из-за Cryptococcus neoformans. Начало заболевания индивидуально у каждого и сопровождается головной болью. Микроорганизм обнаруживают при окрашивании India ink спинномозговой жидкости (CSF).
Выявление антигенов Cryptococcus в крови и CSF возможно у большинства пациентов. Состояние многих пациентов улучшается при приеме амфотерицина, некоторые вылечиваются.
Кожные инфекции у больных раком
В отличие от инфекции, представленной на портах для вливания, наиболее частое кожное заболевание — опоясывающий лишай (varicella zoster). Возникает из-за реактивации вируса varicella zoster в ганглии дорсального корешка, вызывает кожную пузырчатую сыпь, которая особенно серьезна у людей с подорванным иммунитетом, может распространяться как ветряная оспа и вызывать фатальную пневмонию. Пациентов следует лечить ацикловиром как можно быстрее.
Больные, находящиеся на лечении по поводу злокачественных новообразований, за счет измененного иммунного статуса подвержены простудным заболеваниям, которые в свою очередь еще больше истощают защитные силы организма и затрудняют терапию основного диагноза
Острые респираторные вирусные инфекции (ОРВИ), в том числе и грипп, составляющие основную долю инфекционной патологии населения всех возрастов, представляют существенную угрозу пациентам из групп риска: пожилым, беременным, детям младшего возраста и пациентам с хроническими заболеваниями, в том числе онкологическими.
Больные, находящиеся на лечении по поводу злокачественных новообразований, за счет измененного иммунного статуса подвержены простудным заболеваниям, которые в свою очередь еще больше истощают защитные силы организма и затрудняют терапию основного диагноза.
При ОРВИ на фоне онкологического процесса лечащий врач сталкивается со следующими трудностями:
- Длительность ОРВИ у иммунокомпрометированных пациентов может достигать нескольких недель, в течение которых состояние больных значительно ухудшается, и не только по иммунным показателям.
- Инфекционный процесс заставляет откладывать очередной курс химиотерапии, что сильно сказывается на прогнозе.
- Назначение противовирусной терапии может вызвать осложнения, а в частности лекарственную гепатотоксичность, так как ее эффект накладывается на гепатотоксичное действие фармакотерапии злокачественного заболевания 1 .
Таким образом, можно сказать, что необходимость в профилактике и терапии ОРВИ у онкологических пациентов неоспорима, но последнее упомянутое обстоятельство резко ограничивает выбор конкретного средства.
Вирус-специфические препараты римантадин, занамивир и осельтамивир доказали свою эффективность, которая распространяется однако только на вирус гриппа. Кроме того, эти средства имеют ряд противопоказаний, которые зачастую делают невозможным их применение у онкологических пациентов.
В случае назначения средств, действующих на определенные вирусные белки, следует учитывать также проблему резистентности, которую вырабатывают к ним вирусы 2 . Так, появились данные о повышении до 18% частоты устойчивости вирусов гриппа А (H3N2) к осельтамивиру среди детей, получавших данный препарат для лечения гриппа 3 .
В связи с вышесказанным сегодня как никогда высока потребность в противовирусных препаратах, действующих не на инфекционный агент, а на иммунные защитные механизмы.
Оптимальное противовирусное средство, которое может быть рекомендовано для онкологической практики, должно:
- не вызывать резистентности, вероятно вследствие отличного механизма действия;
- быть безопасным, в частности при длительном применении;
- иметь минимальный риск побочных эффектов при лекарственном взаимодействии.
Указанным критериям в полной мере соответствуют иммуномодулирующие средства, благодаря чему интерес к ним клиницистов-онкологов в последние годы резко возрос.
Иммуномодуляторы – это лекарственные средства, которые обладают иммунотропной активностью и в терапевтических дозах восстанавливают эффективную иммунную защиту. Растущая опухоль вызывает существенные изменения в иммунном ответе, а проводимая химио- и лучевая терапия, а также любые оперативные вмешательства вызывают или усугубляют иммунную недостаточность 4 . Поэтому использование иммуномодуляторов, в частности для лечения сопутствующих инфекций, является оправданным.
Главной особенностью релиз-активных препаратов является способность воздействовать на биологически активные молекулы мишени (эндогенные регуляторы), модифицируя их физико-химические свойства. Эффект проявляется не только на молекулярном, но и на клеточном, органном, системном и организменном уровнях.
Так, прием Эргоферона усиливает функциональную активность макрофагов, натуральных киллеров и ИФН при помощи релиз-активных антител к ИФН-γ и CD4+. На этапе цитотоксических клеточных реакций CD8+ и CD4+ Т-лимфоцитов Эргоферон поддерживает противовирусный иммунитет при участии компонента релиз-активных антител к CD4+. На более поздних этапах релиз-активные антитела к CD4+ через стимуляцию рецепторов CD4 Тх2 поддерживают гуморальный противовирусный иммунитет.
Третий компонент Эргоферона – релиз-активные антитела к гистамину – обеспечивает противовоспалительный и антигистаминный эффекты, которые проявляются уменьшением длительности и выраженности катаральных симптомов и аллергических реакций, сопутствующих инфекционному процессу 7 . Это является важным преимуществом Эргоферона перед другими противовирусными препаратами, так как позволяет снизить потребление других средств и нивелировать риск лекарственного взаимодействия при параллельно проводящейся противоопухолевой терапии.
Эргоферон применяется в клинической практике с 2011 года, и его эффективность была доказана в ходе рандомизированных клинических исследований. На данный момент завершено 3 клинических исследования и продолжаются еще 4.
Исследований по лечению ОРВИ именно у онкологических больных не проводилось. Однако в клинической практике накоплен опыт назначения Эргоферона госпитализированным больным с солидными опухолями (Шаповалова Ю.С). Учитывая актуальность проблемы отсрочек курсов химиотерапии и продления сроков госпитализации, в 2012 г. был разработан внутрибольничный протокол лечения ОРВИ у госпитализированных пациентов с солидными злокачественными новообразованиями. В него включены следующие противовирусные препараты: для лечения гриппа – ингибиторы нейраминидазы занамивир и осельтамивир, а также римантадин, умифеновир и Эргоферон; для лечения ОРВИ – умифеновир и Эргоферон. Эргоферон применялся в виде монотерапии (37 пациентов) или в комбинации с римантадином (14 пациентов) в течение первых 48 часов от начала проявления симптомов заболевания. Все пациенты выздоровели через 5-9 дней лечения; нежелательных реакций, связанных с изучаемой терапией, отмечено не было. Учитывая благоприятный профиль переносимости Эргоферона и отсутствие гепатотоксичности, его применение может быть востребовано для лечения ОРВИ у пациентов онкологического профиля, в том числе находящихся в процессе химиотерапии.
Следует также отметить, что согласно экспериментам использование релиз-активных антител к ИФН-γ не приводит к гиперпродукции ИФН-γ. Этот факт немаловажен в свете недавних исследований, показавших, что ИФН-γ в больших дозах может приводить к увеличению метастазирования в легкие и резистентности клеток меланомы к терапии 11 .
Учитывая безопасность Эргоферона, доказанную в исследованиях высокого методологического качества, можно сделать вывод, что препарат стоит рекомендовать для лечения ОРВИ у пациентов со злокачественными новообразованиями 12 .
Как доказали результаты экспериментальных и клинических исследований Эргоферон является перспективным противовирусным препаратом с принципиально новым механизмом и мишенями воздействия, и он может помочь решить проблему лечения больных в условиях изменчивости антигенных свойств вирусов и исходно скомпрометированного иммунного статуса. Комплексный препарат, сочетающий противовирусное, иммуномодулирующее, противовоспалительное и антигистаминное действие, оказывает выраженный терапевтический эффект при ОРВИ у пациентов с онкологической патологией. Препарат имеет благоприятный профиль безопасности, и его назначение позволяет снизить лекарственную нагрузку и риск лекарственного взаимодействия с противоопухолевыми препаратами.
1 Шаповалова Ю.С. Клинико-фармакологическое обоснование и опыт применения инновационного релиз-активного препарата в лечении острых респираторных вирусных инфекций. Справочник поликлинического врача. 2015;2:38-42.
2 Heaton NS et al. Genome-wide mutagenesis of influenza virus reveals unique plasticity of the hemagglutinin and NS1 proteins. Proc Natl Acad Sci USA 2013; 25.
3 Антимикробная терапия по Джею Сэнфорду. Под ред. Д.Гилберта, Р.Меллеринга мл., Дж.Элиопулоса и др. М.: ГРАНАТ, 2013.
4 Артамонова Е.В. Модификаторы биологических реакций (иммуномодуляторы, интерфероны, интерлейкины) в терапии злокачественных опухолей. Эффективная фармакотерапия. 2014; 14: 8-21.
5 Сыроешкин А.В., Никифорова М.В., Колдина А.М., Горнак А.А., Тарабрина И.В. Лекарственные препараты на основе релиз-активных антител. Справочник поликлинического врача. 2018 (3):15-20
6 Эпштейн О.И. Сверхмалые дозы (история одного исследования). М.: Изд-во РАМН, 2008.
7 Жавберт Е.С., Дугина Ю.Л., Эпштейн О.И. Противовоспалительные и противоаллергические свойства антител к гистамину в релиз-активной форме: обзор экспериментальных и клинических исследований. Детские инфекции. 2014; 1: 40-3.
8 Архивъ внутренней медицины. 2013; 14 (6): 46.
9 Шиловский И.П., Корнилаева Г. В., Хаитов М.Р. Новые возможности в терапии респираторно-синцитиальной вирусной инфекции: данные доклинического исследования препарата Эргоферон. Иммунология. 2012; 33 (3): 144-8.
11 Taniguchi K, Petersson M, Höglund P et al. Interferon gamma induces lung colonization by intravenously inoculated B16 melanoma cells in parallel with enhanced expression of class I major histocompatibility complex antigens. Proc Natl Acad Sci USA 1987; 84 (10): 3405-9.
12 Артамонова Е.В. Модификаторы биологических реакций (иммуномодуляторы, интерфероны, интерлейкины) в терапии злокачественных опухолей. Эффективная фармакотерапия. 2014; 14: 8-21.
Ученые нашли причину появления рака. Можно ли от него защититься?
Известно, что основными причинами рака являются курение, нездоровое питание, а также воздействие инфекционных агентов, включая вирусы, бактерии и паразитов. Инфекции стоят на третьем месте среди лидирующих факторов развития опухолей и отвечают за 10 процентов смертей от этой болезни. В то же время на поверхности и внутри человеческого тела обитают миллионы микроорганизмов, чей состав уникален для каждого человека и составляет его микробиом. Микробиом влияет на здоровье человека, защищает его, но при нарушениях может спровоцировать развитие целого ряда заболеваний, включая онкологические. Микробы отвечают за уязвимость к раку, его прогрессирование и восприимчивость к лечению.
Важную роль в защите от бактерий играет слизистая оболочка, выстилающая внутреннюю поверхность пищеварительных, дыхательных и других органов. Она содержит гликопротеины — соединения, пронизывающие мембраны клеток эпителия. Эти молекулы формируют защитный слой. Степень гликозилирования (то есть уровень гликопротеинов) слизистой оболочки определяет уровень невосприимчивости к инфекциям. Однако во время заражения происходят изменения в гликопротеинах, затрагивающие как ту часть (домен), что находится внутри клетки, так и наружную. Это может либо способствовать ликвидации микроба, либо привести к инфекции и воспалению.
Когда наружная часть MUC1 связывается с бактерией, происходит отделение внутреннего домена. К нему присоединяются фосфорные остатки, что запускает целый ряд разных процессов: синтез провоспалительных факторов, адгезию (сцепление) эпителиальных клеток, их дифференциацию и программируемую клеточную смерть, называемую апоптозом.
Пока бактерии не рассматриваются как основная причина раковых заболеваний в отличие от тех же вирусов. Лишь для нескольких бактерий показано, что они могут спровоцировать развитие злокачественных опухолей через провоцирование воспалительных процессов, выделение токсинов и других повреждающих ДНК метаболитов или нарушение сигнальных путей клеток. Известны две широко распространенные бактериальные инфекции, которые могут вызывать рак. Это Helicobacter pylori, связанная с раком желудка и лимфомой, и Salmonella typhi, связанная с карциномой желчного пузыря у тех, кто страдает от хронического тифа. Но могут быть и другие инфекции, повышающие риск.
Campylobacter jejuni — одна из самых частых причин инфекционных отравлений, возбудитель кампилобактериоза. Бактерия проникает через слизистый слой в эпителиальную ткань пищеварительного тракта, провоцируя гастроэнтерит. Когда микроорганизм связывается с MUC1, гликопротеин высвобождается вместе с микробом в слой слизи. Пока неизвестно, предотвращает ли это развитие рака. Сама бактерия попадает в организм человека через загрязненную пищу и воду. В группу риска входят дети, пожилые люди, пациенты с ослабленным иммунитетом. Методом профилактики является правильное приготовление пищи.
Хроническая инфекция Helicobacter pylori приводит к язвам и раку. Показано, что муцины являются важным препятствием для бактерии. Однако внутриклеточный домен MUC1 при связывании с бактерией способен взаимодействовать с NF-kB — транскрипционным фактором, который отвечает за регулирование апоптоза и клеточного цикла. Нарушение регуляции данного сигнального пути приводит к воспалениям, аутоиммунным заболеваниям и развитию опухолей. Для профилактики инфекции специалисты рекомендуют соблюдать гигиену рук. Заражение происходит через контакт с загрязненными предметами и людьми — носителями инфекции.
Haemophilus influenzae вызывает инфекции дыхательных путей, в том числе пневмонию. При хронической обструктивной болезни легких (ХОБЛ) дыхательные пути часто колонизируются этой бактерией. Кроме того, ХОБЛ является одним из факторов риска рака легких. Показано, что взаимодействие микроба с MUC1 вызывает изменения в регуляции специфических рецепторов, которые, в свою очередь, участвуют в прогрессировании легочных аденокарцином.
Еще одним потенциальным виновником опухолей является кишечная палочка Escherichia coli, возбудитель заболеваний кишечника. При взаимодействии микроба с MUC1 возникает воспалительный процесс. Показано, что инфекции связаны с колоректальным раком и раком мочевого пузыря, но пока не совсем понятно, могут ли они быть онкогенным фактором.
Среди онкогенных вирусов достаточно известны вирус Эпштейна-Барр (вирус герпеса) и вирус папилломы человека. Первый ассоциирован с крайне агрессивной назофарингеальной карциномой (рак носоглотки), лимфомой Ходжкина (рак лимфатической системы), лимфомой Беркитта, Т-клеточной лимфомой и раком желудка. Второй может вызвать рак шейки матки, а также опухоли на гениталиях, в заднем проходе, горле и голове. При отсутствии вируса рак шейки матки не развивается, то есть это заболевание четко связано с хронической инфекцией.
Опасность представляют и другие вирусы, в том числе возбудитель гриппа, однако при подобных инфекциях MUC1 эффективно защищает слизистую от патогена. Вирус гепатита часто становится причиной рака печени.
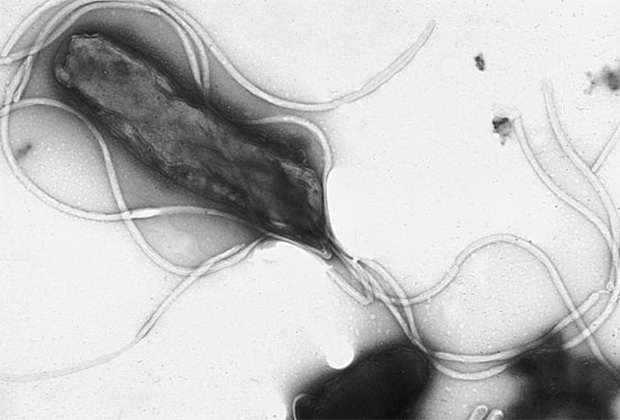
Что касается паразитов, то к онкологическим заболеваниям могут привести заражение кровяной шистосомой, которая проникает в организм человека через мочевыводящие пути. Червь провоцирует развитие плоскоклеточного рака мочевого пузыря, являясь второй ведущей причиной этого заболевания. Заражение обычно происходит в тропических регионах планеты при купании в естественных водоемах. Часто жертвами паразита становятся туристы и жители развивающихся стран с неблагополучной санитарной обстановкой. По подсчетам, во всем мире инфицировано более 207 миллионов человек.
Еще одним онкогенным паразитом является червь Opisthorchis viverrini, заражающий желчный пузырь и способствующий развитию холангиокарциномы. Этот тип опухолей редко встречается в западных странах, но распространен в Юго-Восточной Азии.
Некоторое время назад исследователи из Американского онкологического общества (ACS) пришли к выводу, что причиной половины случаев заболевания раком является нездоровый образ жизни. В целом внешние факторы среды отвечают за львиную долю онкологических заболеваний, неподконтрольными остаются лишь генетические факторы и просто случайные мутации в ДНК, на которые мы никак не можем повлиять.
Многие из воздействий можно исключить, другие — снизить до минимума. Среди этих мер обычно называют поддержание здорового веса, физические упражнения, отказ от курения и алкоголя, избегание длительного воздействия солнечных лучей и контакта с различными химическими загрязнителями. Однако теперь к этому можно добавить прививки (особенно, от ВИЧ и гепатита) и другие типы профилактики инфекционных и паразитарных заболеваний.
— Мало того, что вы один из лучших пульмонологов Европы, вы ещё и в главной группе риска сейчас по коронавирусу. Дайте, пожалуйста, рекомендации для людей вашего поколения и чуть помладше, то есть для тех, кто, как мы видим, действительно подвержен высокой летальности — и в Китае, и в Италии, и в Иране.
— Для того чтобы понять группы риска при этом заболевании: в первую очередь это люди, которые контактируют с животными, представляющими биологический резервуар. Скажем, 2002 год — это были африканские кошечки, в 2012 году это были верблюды, а сейчас немножко путается наука, до конца не установлено. Больше данных, что это определённый сорт летучей мыши — тот, который китайцы употребляют в пищу.
Вот эта летучая мышь распространяет коронавирус через испражнения. Поэтому идёт обсеменение. Допустим, рынок — морепродукты или какие-то другие продукты и так далее. Но когда мы говорим об эпидемии, то человек заражает человека. Поэтому эта фаза уже пройдена. Сейчас человек заражает человека.
Коронавирусы — очень-очень распространённая вирусная инфекция, и человек с ней встречается в жизни много-много раз. Ребёнок в течение года до десяти раз переносит заболевания, которые мы называем острой простудой. А за этой острой простудой стоят определённые вирусы.
И второе место по своей распространённости занимает как раз коронавирус. Проблема в том, что от этих вроде бы безобидных возбудителей отмахивались, никогда не могли понять причинно-следственных отношений. Если, скажем, ребёнок простыл, у него насморк, что за этим пойдёт? И так далее. Где-то в течение двух недель малыш или взрослый болеет — и всё это бесследно исчезало.
А вот в 2002-м, 2012-м и теперь уже в 2020 году ситуация качественно изменилась. Потому что те серотипы, которые стали циркулировать… они поражают эпителиальные клетки.

Эпителиальные клетки — клетки, которые выстилают дыхательные пути, желудочно-кишечный тракт и мочевыводящую систему. Поэтому у человека симптомы лёгочные, симптомы кишечные. И при исследовании анализов мочи тоже выделяют… такую нагрузку.
Но эти новые штаммы, о которых мы сейчас с вами ведём беседу, у них есть такие свойства — вступить в контакт с рецептором второго типа, ангиотензин-превращающего фермента. А с этим рецептором связано такое серьёзное проявление, как кашель.
Поэтому у больного, у которого появляются симптомы поражения нижнего отдела дыхательных путей, характерный признак — кашель. Это поражаются эпителиальные клетки самых-самых дистальных отделов дыхательных путей. Эти дыхательные трубочки очень маленькие.
— Дистальных — дальних, вы имеете в виду?
— Дальних. Маленького диаметра.
— Значит, это то, что рядом с бронхами находится у нас?
— Это бронхи, потом уже бронхиолы, респираторные бронхиолы. И когда воздух, диффузия газов идёт на поверхности альвеол, то они проходят как раз этот участок дыхательных путей.
— То есть первичный. Первое — это кашель.
— Нет, первое — это насморк, першение в горле.
— Вот говорят, что насморка как раз нет.
— Нет, это проблемы больших данных. Обработаны 74 тыс. историй болезни, и у всех ринорея (насморк. — RT) была. Когда вам так говорят — там действительно есть некоторые нюансы. Биология такая. Биологическая мишень вируса — эпителиальные клетки. Нос, орофарингеальная область, трахея, и потом мелкие бронхиолы, которые являются особенно опасными для человека. А оказалось, что, имея этот механизм, они приводят к резкому срыву иммунитета.
— Почему?
— Объяснение, которое сегодня даёт наука, — вовлекается в процесс белок, который называется интерферониндуцированный протеин-10. Вот именно с этим белком связана регуляция врождённого иммунитета и приобретённого иммунитета. Как это увидеть? Это очень глубокое поражение лимфоцитов.
— То есть у вас падают лимфоциты сразу на общем анализе?
— Да. И если там лейкоциты повысятся, тромбоциты повысятся, а более устойчивой является именно лимфопения, то есть лимфотоксический эффект самих вирусов. Поэтому сама болезнь имеет как минимум четыре очерченных этапа. Первый этап — это вирусемия. Безобидная простуда, ничего особого нет. Семь дней, девять — приблизительно в этом интервале.
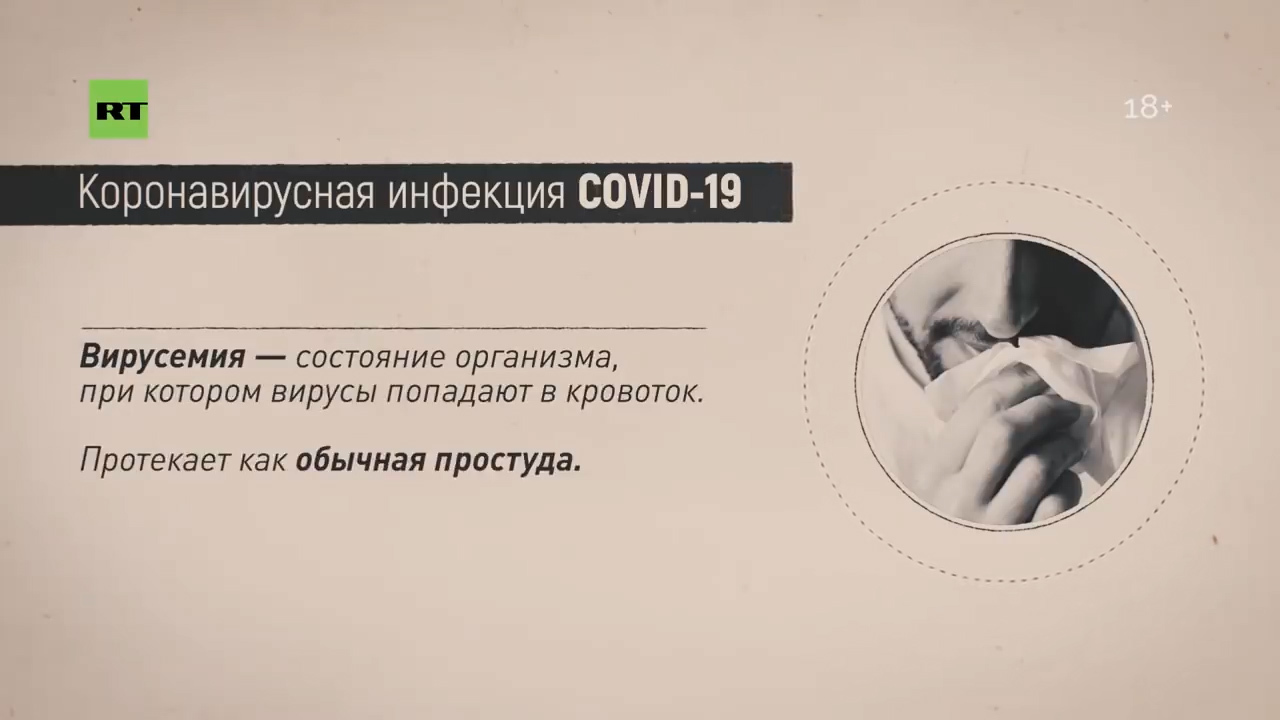
А вот начиная с девятого дня по 14-й ситуация качественно меняется, потому что именно в этот период формируется вирусно-бактериальная пневмония. После поражения эпителиальных клеток в анатомическом пространстве дыхательных путей происходит колонизация микроорганизмов, в первую очередь тех, которые населяют у человека орофарингеальную область.
— То есть уже бактерии?
— Бактерии, да. Поэтому эти пневмонии всегда вирусно-бактериальные.
— Значит, вирус, так сказать, наполняет альвеолы, где всё время живут какие-то бактерии? И они сами по себе где-то живут, в каком-то количестве?
— Вообще, мы считаем, что нижний отдел дыхательных путей стерилен. Вот так устроен механизм защиты, что именно нижний отдел дыхательных путей.
— Там ничего нет.
— Не заселён. Когда вирус внедрился и он нарушил этот барьер, там, где была стерильная среда в лёгких, начинают колонизироваться, размножаться микроорганизмы.
— То есть не вирус вызывает пневмонию? Всё равно пневмонию вызывают бактерии, конечно.
— Ассоциации: вирус — бактерии.
— Да.
— Окно, где врач должен проявить своё искусство. Потому что часто вирусемический период — как лёгкое заболевание, как лёгкая простуда, недомогание, насморк, лёгкая температура небольшая, субфебрильная. А вот период, когда кашель усилился и когда появилась одышка, — это два признака, которые говорят: стоп, это уже качественно другой пациент.
Если эта ситуация не контролируется и болезнь прогрессирует, то наступают уже более серьёзные осложнения. Мы называем это респираторным дистресс-синдромом, шоком. Человек дышать самостоятельно не может.

— Отёк лёгких?
— Понимаете, отёков лёгкого много, на самом деле, бывает. Если быть точными, мы это называем некардиогенный отёк лёгкого. Если, скажем, кардиогенный отёк лёгкого мы можем лечить с помощью определённых лекарственных препаратов, то этот отёк лёгкого можно лечить только с помощью машины механической вентиляции лёгких или продвинутых методов, таких как экстракорпоральная гемоксигенация.
Если человек переносит эту фазу, то иммуносупрессия, вызванная поражением приобретённого и врождённого иммунитета, становится губительной и у больного присоединяются такие агрессивные возбудители, как синегнойная палочка, грибы. И те случаи смерти, которые произошли, — у 50%, которые длительно находились на искусственной вентиляции лёгких, альвеолы все заполнены грибами.
Грибы появляются тогда, когда глубокая иммуносупрессия. Какая же судьба человека, который перенес всё это? То есть он перенёс вирусемию, он перенёс вирусно-бактериальную пневмонию, он перенёс респираторный дистресс-синдром, некардиогенный отёк лёгкого и он перенёс септическую пневмонию. Он будет здоров или нет? И вот, собственно говоря, сегодня мир озабочен именно этим: какая судьба у человека, у тех вот 90 тыс. китайцев, которые перенесли коронавирусную инфекцию?

— 90 тыс. — они сами по себе перенесли, они на ИВЛ не лежали, грибов у них не было. ОРЗ и ОРЗ.
— Но сама проблема — она очень важна. Потому что практическая медицина стоит перед фактом резкого роста так называемых лёгочных фиброзов. И вот у этой группы лиц, перенёсших коронарную инфекцию, в течение года формируется фиброз лёгкого.
— То есть когда лёгочная ткань уплотняется?
— Да. Как жжёная резина. Лёгкое становится как жжёная резина, если аналогию проводить.
— К вам попадает пожилой человек, у него точно диагностирован коронавирус. И он ещё не на девятом дне, то есть его ещё не надо на ИВЛ класть. Как вы его будете лечить?
— Вы знаете, в чём дело: мы таких больных пока не лечим, потому что нет лекарственных препаратов, лекарственных средств, которые надо применять в этой фазе. Панацеи нет. Потому что лекарство, которое бы действовало на вирусемию, на вирусно-бактериальную фазу, на некардиогенный отёк лёгкого, на сепсис, — панацея, такого не может быть.
Потому что, если вернуться к опыту 2002 года, когда увидели уязвимость медицинского персонала, врачам, сёстрам рекомендовали применять тамифлю и озельтамивир — антигриппозный препарат. И при определённых серотипах коронавируса, действительно, механизм внедрения в клетку тот же, как при вирусах гриппа. Поэтому показали, что эти препараты могут защитить лиц, где высокий риск развития этого заболевания.
Или же у него выявляется носительство вируса, ему дают эти препараты и так далее. Но это, я ещё раз хочу сказать, серьёзной доказательной базы не имеет. Ситуация, которая наиболее грозная, потому что она определяет судьбу человека. Простудное состояние — одно дело. А другое дело — когда вирусно-бактериальная пневмония, это принципиально другая вещь.
И здесь очень важно подчеркнуть, что только антибиотиками помочь такому больному проблематично. Здесь должна быть обязательно комбинированная терапия, которая включает средства, стимулирующие иммунитет. Это очень важный момент.
— А что вы имеете в виду? То есть, условно говоря, вы ему пропишете амоксиклав с каким-то иммуномодулятором?
— Да, обычно назначают цефалоспорины четвёртого поколения, не амоксиклав, в комбинации с ванкомицином. Такая комбинация — широкая, потому что очень быстро идёт смена грамположительной и грамотрицательной флоры. А вот какой иммуномодулирующий препарат назначить — это вопрос для научного исследования.
Итак, мы понимаем, что резко пострадает иммунитет. Мы понимаем высокую уязвимость человека к той инфекции, которая у него начинает колонизироваться в дыхательных путях. Поэтому, к сожалению, мы как бы чёткой линии не имеем. Но то, что реально может помогать таким больным в такой ситуации, — это иммуноглобулины. Потому что это заместительная терапия.
И поэтому таким больным, чтобы не разыгрался сепсис, по крайней мере, они не вошли в фазу сепсиса, назначают высокие иммуноглобулины. Американские врачи применили средство у своего больного, которое применяют при лихорадке Эбола. Это препарат группы, аналог нуклеозидов. Это группа препаратов, которые применяют при герпесе, при цитомегаловирусе и так далее.
— То есть это противовирусная или поддерживающая антивирусную терапию, да?
— Нет, это препарат, который действует всё-таки на те механизмы в клетке, которые противостоят репликации вируса. Вот у меня в руках (фотография президента США Дональда Трампа. — RT). Он собрал всю верхушку, которая могла бы высказаться по препаратам перспективным. Два вопроса, которые он поставил, он готовился к этой конференции. Первый вопрос: насколько учёные Соединенных Штатов Америки готовы к внедрению вакцины?
— Полтора года.
— Да, совершенно точно. Это два года. Он говорит: что в таком случае? Есть ли у страны препараты, которые могли бы защитить? И, собственно говоря, они сказали: да, такой препарат есть.
— Что?
— Что это за препарат? Он называется ремдесивир.

— Давайте посмотрим его.
— Вот учёные сказали, учитывая тот опыт, который есть, и обсуждения и так далее. Хотя, конечно, есть другие препараты, которые активно изучаются. Вообще, это направление очень интересное: что, собственно говоря, считается перспективным. Перспективным считается применение стволовых мезенхимальных клеток. Но в какой стадии?
— Слушайте, вот вы, как человек, который много лет этим занимается, от астмы до пневмонии, можете как-то попытаться спрогнозировать развитие этой эпидемии, например, в России?
— Вы знаете, в чём дело? Я хочу сказать, что, если Россию сравнивать с окружающим миром и брать коронавирус 2002 года, там ни одного больного не было.
— Может, мы просто не диагностировали?
— Он у нас вообще единственный сертифицированный, да?
— Вирус уже в России, как бы санэпидемслужба ни старалась. Как вы считаете, как он будет развиваться? Закончится ли он весной, например, с приходом лета?
— Знаете, мне кажется, картинка повторяет то, что было тогда. Это, если вы помните.
— Тогда — в 2002 году? То есть когда был SARS?
— Он отличается на 16, по-моему, нуклеозидов.
— Если пойдёт по этому сценарию, то нужно сказать, что где-то в апреле-мае эта проблема уже остро, по крайней мере, стоять не будет.
— Просто из-за сезонного прекращения респираторных инфекций?
— Да. Климатический фактор, целый ряд других факторов. Сейчас, когда беда, конечно, к нам приходит не из Китая, а из Европы. Те, кто возвращается из этих стран, в первую очередь из Италии, сегодня, запомните: Урбани. Это он сделал очень многое. Я считаю, это просто подвиг врача, который так много сделал. Это был вирусолог из Милана.

— Тогда, в 2002 году?
— Он эксперт ВОЗ, я с ним встречался по линии Всемирной организации здравоохранения. Он в списке был эксперт по коронавирусам. И тогда его направили в Ханой. Они распределились, ему достался Вьетнам. И во Вьетнаме, когда он приехал, была паника. Врачи перестали выходить на работу. Медицинский персонал тоже. Больные есть, а врачебного и медицинского персонала нет.
Он оценил ситуацию. С трудом ему удалось переломить её, снять эту паническую ситуацию, которая была тогда в госпитале. Ну а самое главное — он стал общаться с правительством и сказал: закрыть страну на карантин. Вот откуда всё это пошло. Это пошло от Урбани. Они начали артачиться.
— Вьетнамцы?
— Да, Вьетнам. Что это экономика, туризм и так далее. В общем, он нашёл эти слова, он убедил. И Вьетнам — первая страна, которая вышла из этого. И он посчитал, что его работа закончена. Он набрал материал для вирусологического обследования и сел в самолёт, который летел в Бангкок.
Там американские вирусологи, они должны были встретиться. А когда уже полетел, понял, что заболел. Заболел так же, как эти несчастные вьетнамцы в том госпитале. И он стал всё записывать, описывать. Вот время такое-то — моё самочувствие такое-то.
— Лететь три часа?
— Какие рекомендации вы можете дать человеку, который обнаруживает у себя… Ну то есть мы уже договорились, что вирус в общей популяции. Мы уже не можем, на самом деле, его контролировать.
— Да. Значит, такие обывательские рекомендации?
— Да, именно так.
— В первую очередь — это всё-таки хороший уход за слизистой носа и орофарингеальной областью.
— То есть покупаешь морскую воду и себе…
— Да, и промываешь тщательно. Но лоры — они очень хорошо показывают эффективный лаваж. То есть должно прийти всё-таки ощущение свободного дыхания. Второе место — это орофарингеальная область за увулой. И там тоже нужно хорошо сделать лаваж орофарингеальной области.
— То есть надо прыскать не только в нос, но и глубоко в гортань?
— Да, и прополаскивать. И не лениться делать до тех пор, пока не придёт чувство чистых, хороших дыхательных путей. Из всех путей это средство самое эффективное. Я бы посоветовал тем людям, которые могут себе позволить, приобрести небулайзер или.
— То есть такой аэрозольный, да? С ультразвуком?
— Да. И он позволяет гигиену именно верхней части дыхательных путей доводить до хорошего состояния. Когда присоединяется кашель — желательно всё-таки применить те лекарства, которые мы прописываем больным бронхиальной астмой. Это или беродуал, или вентолин, или сальбутамол. Потому что именно эти препараты улучшают мукоцилиарный клиренс, снимают спазм.
— То есть отхаркивающий? АЦЦ?
— Да, АЦЦ и флуимуцил. И чего нельзя делать — это применять глюкокортикостероиды. Этот вирус, его репликация резко нарастает.
— Что это значит?
— Глюкокортикостероиды — это преднизолон, метилпреднизолон, дексаметазон, метаметазон.
— То есть не надо колоть гормоны, условно говоря, если у вас вирусная инфекция?
— Есть ингаляционные стероиды. Но есть больные с астмой, которые заболели, находятся на этой терапии. Это уже как бы индивидуальные решения. Конечно, 2020-й войдёт в историю медицины как новая болезнь. Мы должны это признать, что мы поняли новую болезнь. Две новые пневмонии пришли. Это пневмония, которая вызывается электронными сигаретами, вейпами, и сейчас в Соединённых Штатах от этого умерли.
— . несколько тысяч подростков. Да, это известный факт, и чем лечить — непонятно. Сажаешь на ИВЛ — они умирают сразу.
— Да. Вы понимаете, в чём проблема-то? Вот у них развиваются те изменения в лёгких, которые возникают при этом. Они вроде бы схожие. Это респираторный дистресс-синдром, о котором мы с вами ведём разговор. В литературе поднимаются очень серьёзные вопросы: роль коронавирусов в трансплантологии. Одна из проблем — это облитерирующий бронхиолит, который возникает особенно при пересадке.
— Пересадке лёгких?
— Да, лёгких и костного мозга. Стволовых клеток. Вот, собственно говоря, всё хорошо сделано, всё нормально, человек ответил на эту терапию, а начинает нарастать проблема дыхательной недостаточности. И причину этих бронхиолитов поймали — это коронавирус. То есть новое знание пришло.
Читайте также:


