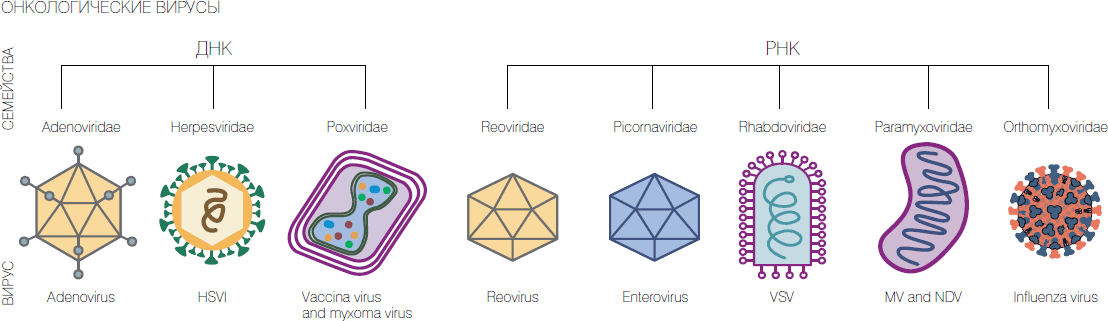
Вирус сендай против опухолей
В мире интенсивно идет разработка лекарств от онкозаболеваний на основе вирусов. В нашей стране такие работы ведутся в Новосибирском университете, ГНЦ "Вектор", Институте химической биологии и фундаментальной медицины СО РАН и Институте молекулярной биологии РАН. Нами получены рекомбинантные штаммы различных вирусов, показавшие перспективность их использования для уничтожения раковых клеток. Проблема сейчас в получении финансирования на доклинические исследования и клинические испытания.
Прогнозы писателей-фантастов редко сбываются буквально. Но с рассказом Игоря Росоховатского "Шутка госпожи природы" именно так и произошло. В нем бедняк излечился от рака, съев батат, зараженный вирусом батата, в то время как богач умирает, хотя его лечили самыми современными методами. Рассказ был опубликован в 1962 году. А в 2015 году Управление по контролю пищи и лекарств США (FDA) разрешило применение рекомбинантного герпесвируса для лечения рецидивирующей меланомы (рака кожи) и рекомбинантного ортопоксвируса для лечения опухолей печени.
Да, конечно, нынешние онколитические вирусы — не вирусы растений. Но мы видим начало сознательного использования вирусов против онкозаболеваний: к списку методов лечения рака официально добавился метод разрушения опухолей с помощью вирусов.
Сомнения и перестраховка
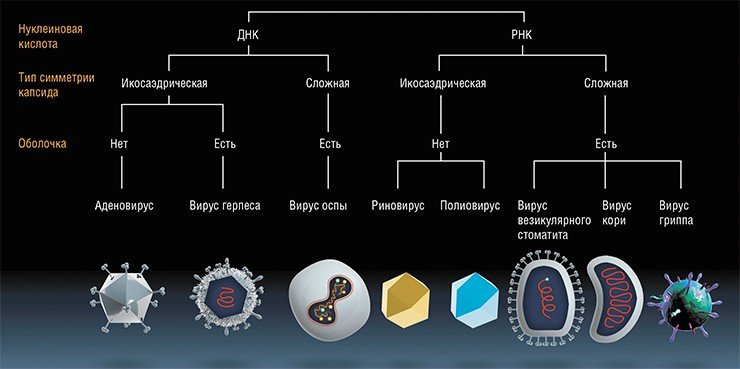
Метод нельзя назвать новым, потому что первая посвященная ему научная публикация появилась еще в 1904 году. В ней было описано использование так называемого "фиксированного" (ослабленного) штамма вируса бешенства для лечения онкобольных. Но широкого распространения метод не получил как из-за непредсказуемости результатов, так и весьма значительной реактогенности тогдашней вакцины против бешенства.
Тем не менее в течение всего ХХ века к этому методу неоднократно возвращались. В частности, начиная с 1950-х годов в разных странах применялись слабо- или вообще не патогенные штаммы вирусов лихорадки Западного Нила, желтой лихорадки, вируса бешенства, аденовирусы, вирус болезни Ньюкасла, энтеровирусы, парамиксовирусы и некоторые другие непатогенные или слабопатогенные вирусы. При этом порой онкобольные полностью выздоравливали, наблюдались и временные улучшения. Но опять же отсутствие предсказуемости результатов, научно обоснованных принципов действия вирусов на опухоли и предубеждение контролирующих органов привели почти к полному прекращению применения этого подхода.
У нас работы в данном направлении были начаты в 1970-х годах профессором М.К. Ворошиловой в Институте полиомиелита и вирусных энцефалитов под Москвой. Она применяла для лечения онкозаболеваний вакцинные штаммы вируса полиомиелита и другие штаммы непатогенных энтеровирусов и в ряде случаев добилась серьезных успехов. Но предубеждения руководящих онкологов привели к запрету ее работ.
И в нашей стране, и в ряде других стран недоверие к потенциально полезным противораковым вирусам до недавнего времени превалировало из-за боязни их патогенных свойств. При этом врачи хорошо знают, что многие химиотерапевтические препараты для борьбы с онкозаболеваниями дают массу вредных побочных реакций. Но их применяют, и никакого предубеждения у врачей к ним нет. Между тем механизм действия большинства таких препаратов рассчитан на разницу в метаболизме раковых и нормальных клеток. Так что поражают эти препараты и раковые, и некоторые здоровые, но активно метаболизирующие, делящиеся клетки.
1. Хирургическое удаление опухоли.
2. Радиотерапия — направленное разрушение опухоли специально введенными в клетки радиоактивными препаратами или направленным лучевым воздействием.
3. Химиотерапия — уничтожение опухолевых клеток специфичными к особенностям метаболизма опухолевых клеток химиопрепаратами.
4. Терапия с помощью высокоспецифичных к опухолевым антигенам или к определенным клеточным белкам моноклональных антител, которые отличают клетки с этими маркерами от нормальных клеток, метят их собой и привлекают к ним клетки иммунной системы, которые благодаря этим меткам разрушают раковые клетки.
5. Терапия с помощью антител, ингибирующих блокаторы иммунной системы (immune check-points). При этом выключаются "тормоза", не позволяющие иммунной системе бороться с опухолью, и начинает разворачиваться противоопухолевый иммунный ответ.
6. Иммунотерапия с помощью своих же Т-клеток, активированных особым образом.
7. Различные варианты лечения комбинациями упомянутых выше методов.
Первые официально испытанные вирусные онколитики
С 1990-х годов появилась теоретически намного более обоснованная концепция специальных онколитических вирусов. Впервые был выяснен, как тогда считали, механизм противораковой специфичности делеционного варианта аденовируса пятого серотипа с названием ONYX-015.
Дело в том, что в клетках человека и практически всех млекопитающих есть белок р53, который при начале каких-либо необычных процессов в клетке (в том числе при появлении в ней вирусов) запускает процесс апоптоза (запрограммированной клеточной смерти), чтобы не дать вирусу или вообще всей этой вдруг ставшей необычной клетке размножиться. Однако во многих опухолевых клетках ген белка р53 поврежден, а сам белок становится дефектным по этой своей функции, и в таких клетках ничто не сдерживает размножение вируса.
Но у аденовируса, в свою очередь, есть белок Е1В-55К, который связывает р53 и не дает ему запускать апоптоз. Таким образом, если из генома вируса удалить часть гена Е1В, где закодирован белок 55К, то такой вирус будет размножаться только в опухолевых клетках, где р53 и так не работает, а в нормальных он этого делать не сможет, так как клетки будут уходить в апоптоз и саморазрушаться.
Однако, как выяснилось позднее — в 2004 году, удаление части или целого гена E1B приводит к тому, что белок E1B-55K не выполняет еще ряд функций для размножения аденовируса. В опухолевых же клетках в его отсутствие эту функцию берет на себя не установленный до сих пор фактор. Также выяснилось, что есть много и других дефектов в клетках, которые приводят к их перерождению в раковые, и тогда такие аденовирусы не работают как лечебные препараты.
В конце 1990-х эта тематика по ряду причин пошла на спад. Тем не менее аналог ONYX-015, названный Н101 (онкорин), был официально разрешен для лечения больных с опухолями головы и шеи в Китае. Другой полученный в Китае рекомбинантный аденовирус, также с делецией гена Е1В, но с дополнительной вставкой человеческого гена р53 сейчас там также применяется для лечения онкобольных под названием гендицин.
С 1998 по 2003 год в ГНЦ вирусологии и биотехнологии "Вектор" силами лаборатории автора этой статьи был получен вариант аденовируса пятого серотипа с полностью удаленным геном Е1В и частично геном Е1А. Препарат на его основе был назван канцеролизином, было показано, что он обладает сходными с американским штаммом ONYX-015 и китайским онкорином онколитическими свойствами.
Данный штамм был проведен через полный цикл доклинических испытаний под руководством профессора ГНЦ ВБ "Вектор" А.Н. Сергеева. На основе их результатов канцеролизин был допущен к клиническим испытаниям первой фазы, которые в 2007 году прошли в РОНЦ им. Н.Н. Блохина с участием восьми пациентов-добровольцев. Испытания показали хорошую переносимость пациентами канцеролизина, а в двух случаях наблюдался и лечебный эффект, несмотря на то что у всех больных добровольцев была четвертая стадия развития болезни. К сожалению, финансирования на последующие испытания выделено в те годы так и не было, а позднее это потеряло актуальность из-за публикаций по разработкам вирусных онколитиков следующих поколений.
Канада: рекомбинантные аденовирусы и вирусы осповакцины.
Китай: препараты на основе рекомбинантных аденовирусов онкорин и гендицин.
Россия: рекомбинантные поксвирусы и аденовирусы, парамиксовирусы, энтеровирусы.
США: вирусы болезни Ньюкасла, природный и рекомбинантный вирус миксомы кроликов, рекомбинантный аттенуированный герпесвирус, рекомбинантные аттенуированные поксвирусы и аденовирусы, реовирус, вакцинный штамм вируса кори, рекомбинантный вирус везикулярного стоматита, вакцинные штаммы вирусов гриппа.
Финляндия: рекомбинантные аденовирусы.
Япония: рекомбинантные герпесвирусы.
Препараты нового поколения
В 2010 году Новосибирский государственный университет получил мегагрант на исследования под руководством известного российского молекулярного биолога П.М. Чумакова, одним из ведущих исполнителей которого стал и автор настоящей статьи. В НГУ фактически с нуля была создана хорошо оборудованная научно-исследовательская лаборатория в комплексе с практикумом по микробиологии, подготовлен и опубликован ряд обзорных статей по онколитическим вирусам, и еще в 2012 году были получены и охарактеризованы первые кандидатные онколитические штаммы.
К настоящему времени уже вне рамок мегагранта усилиями неформального коллектива из сотрудников НГУ, ГНЦ ВБ "Вектор" и ИХБФМ СО РАН получен ряд рекомбинантных штаммов вируса осповакцины с высокими онколитическими характеристиками, которые на моделях in vivo показали хорошую перспективность. Кроме того, были охарактеризованы и паспортизованы онколитические штаммы парамиксовируса Сендай и сконструированы бактериальные плазмиды с полноразмерным геномом аденовируса 6 серотипа, крайне перспективные для получения новых рекомбинантных онколитических штаммов со встройками усиливающих онколизис генов.
Таким образом, имеются все основания для проведения дальнейших работ и особенно — для полноразмерных доклинических исследований, а впоследствии и клинических испытаний этих и подобных им перспективных онколитических вирусных штаммов. Сейчас наступило время преодолеть предубеждения и дать зеленый свет для финансирования разработок этих крайне перспективных препаратов, разработанных в России.
Работы в этом направлении продолжаются не только в НГУ, профессор П.М. Чумаков развивает эти исследования на энтеровирусах и парамиксовирусах в своей лаборатории в Институте молекулярной биологии РАН имени В.А. Энгельгардта в Москве. Заинтересовались ими и в ряде клиник России.
Могут ли вирусы быть полезными
Данное направление работ за рубежом в последние десять лет получило очень мощное развитие. В октябре 2015 года в США произошел кардинальный сдвиг в отношении этого направления разработок: как уже было сказано, FDA разрешило широкие клинические испытания третьей фазы генно-инженерного штамма герпесвируса с названием имлиджик (Imlygic) для лечения больных с рецидивирующей меланомой.
В том же 2015 году аналогичное разрешение на проведение третьей фазы клинических испытаний было получено для препарата на основе рекомбинантного штамма вируса осповакцины пекса-век (Pexa-Vec), или JX-594, в отношении лечения гепатоцеллюлярной карциномы (рака печени). Данный препарат сконструирован на основе исходного штамма вируса осповакцины Wyeth, у которого для уменьшения реактогенности удален ген тимидинкиназы и встроен ген ГМ-КСФ человека. Его сейчас интенсивно исследуют на добровольцах. Результаты нескольких независимых клинических испытаний первой и второй фазы уже известны, они положительны, и поэтому клинические испытания третьей фазы для этого препарата проходят уже в нескольких десятках стран в 86 больницах, что говорит о его большой перспективности.
На последнем, 17-м Международном конгрессе по вирусологии в Сингапуре онколитическим вирусам была посвящена пленарная лекция профессора Гранта Макфаддена из США и две секции: "Вирусы как троянские кони" и "Вирусы и рак". Так что интерес к этому направлению возрос колоссально, и финансируется оно, как никогда ранее, в Канаде, США, Японии, Финляндии и других странах.
В этой связи возникает вопрос: а не может ли быть такого, что роль по крайней мере некоторых из вирусов для человеческого организма как раз и состоит в защите от раковых клеток, и лишь иногда они вызывают заболевания, выходя из-под контроля?
Такое предположение заслуживает внимания. Человечество уже очень много полезного создало из весьма вредоносных, на первый взгляд, веществ и микробов. А вирусы как лекарства очень интересны, поскольку являются высокоспецифичными микромашинами. Некоторые из них люди уже приспособили для своих нужд и применяют в качестве живых вакцин, лечебных препаратов (например, бактериофаги — вирусы бактерий вместо антибиотиков) и для избирательной борьбы с вредными насекомыми.
Сергей В. Нетесов, член-корреспондент РАН, Новосибирский государственный университет
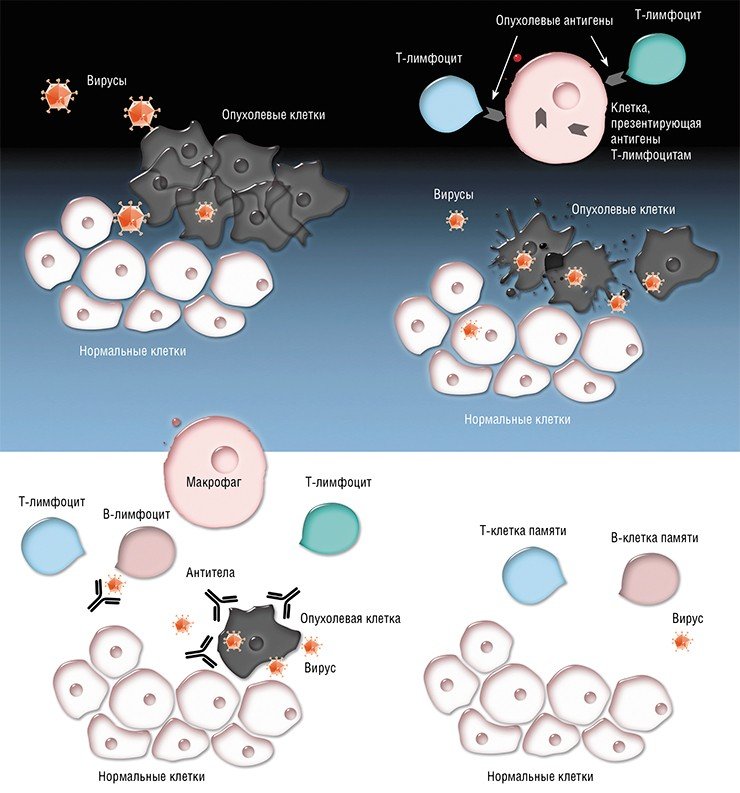
Онколитический вирус Сендай – высокоэффективое средство для осуществления виротерапии распространенного метастатического рака.
Вирус Сендай вызывает селективную гибель раковых клеток пациента как путем прямого поражения этих клеток, так и активации иммунных механизмов гибели раковых клеток.
Вирус Сендай может вызывать слияние опухолевых клеток в большие многоядерные конгломераты (симпласты), которые прекращают делиться и погибают, а также запускать массивную вакуолизацию цитоплазмы раковых клеток с их последующей гибелью.
Также Вирус Сендай может сливать дендритные и опухолевы клетки с образованием на их основе гибридных клеток – дендритом, которые активируют противоопухолевый иммунный ответ.
Вирус Сендай также активирует клетки-эффекторы противоопухолевого иммунитета — цитотоксические Т-лимфоциты, дендритные клетки и натуральные киллеры.
На поверхности опухолевых клеток есть рецепторы для вируса Сендай, которые способствуют проникновению вируса в эти клетки. В раковых клетках создаются благоприятные условия для репликации вируса Сендай в связи с тем, что в них нарушены механизмы интерфероновой защиты.
В период 1986-1995 гг. проводили онколитическую виротерапию путем введения пациенту вакцинной композиции на основе зараженных вирусом Сендай собственных опухолевых клеток больного или путем введения вируса непосредственно в опухоль. Эффективность этого способа при метастатическом раке на превышала 10%. Для ее повышения применили аутовакцину, обогащенной эндогенными белками теплового шока (БТШ70), полученными из опухолевых клеток пациента. Но в этом случае часто не удавалось получить количество эндогенных БТШ70 и целевых опухолевых антигенов, которое было бы достаточным для получения противоопухолевого иммунного ответа.
Мобилизацию эндогенных белков теплового шока можно осуществить путём воздействия на клетки лазерного излучения.
Нами установлены параметры лазерного излучения, необходимые для мобилизации эндогенного БТШ70 из клеток кожи человека. Они должны быть высокоинтенсивными, чтобы вызвать универсальную защитную реакцию клеточного стресса, но кратковременными (импульсными), чтобы не вызывать летальных повреждений клеток. Этим требованиям соответствует импульсно-периодическое излучение лазера с пиковой мощностью 1-10 кВт, излучающее в видимом и инфракрасном диапазоне.
Импульсно-периодические лазеры, излучающие в видимом и инфракрасном спектре вызывают выход эндогенных БТШ70 из клеток кожи (кератиноцитов и фибробластов) в зоне облучения. БТШ70 активируют дендритные клетки кожи, которые мигрируют в зону облучения, захватывают введенные в нее биоматериалы и доставляют их в опухоль
Вирус Сендай стимулирует выход эндогенных БТШ70 из раковых клеток. Это повышает иммуногенность опухоли и активирует противоопухолевый иммунный ответ. БТШ70, в свою очередь, способствуют репликации вируса Сендай в опухолевой клетке.
Нами был разработан способ лазерной вакцинации больных с метастатическими формами рака, который включает введение в облученные лазером участки кожи аутовакцины на основе опухолевых клеток больного.
(патент РФ №2519763).
Разработана технология получения адъювантов вакцин с помощью высокоинтенсивных электрических воздействий (Европатент ЕР-2431932)
Нами была разработана стратегия повышения эффективности виротерапии рака на основе сочетания внутрикожного применения вируса Сендай в облученные лазером участки кожи с системным введением рекомбинантного БТШ70 или его производных пролонгированного действия.
Эта стратегия значительно повышает эффективность виротерапии распространенного метастатического рака.
Экзогенный БТШ70 блокирует PD-1 и TIM-3 рецепторы цитотоксических Т-лимфоцитов, которые подавляют противоопухолевый иммунный ответ. Блокада ингибиторных PD-1 и Tim-3 рецепторов экзогенным рекомбинантным БТШ70 повышает эффективность онколитической виротерапии с использованием вируса Сендай.
Экзогенный БТШ70 и ионизирующее излучение вызывают мобилизацию эндогенного БТШ70 из раковых клеток, который затем активирует противоопухолевый иммунный ответ..
Блокада PD-1 и Tim-3 рецепторов экзогенными БТШ70 и их сочетание с лучевой терапией повышают эффективность виротерапии рака.
Этот эффект был наиболее выражен при многократном воздействии на опухоль малых доз (менее 2 Гр) ионизирующего излучения.
Локальное облучении отдельных метастатических очагов редко вызывает активацию системного противоопухолевого иммунитета.
Перспективным путем решения этой задачи является системное введении радиофармпрепаратов, которые в настоящее время в основном применяют для лечения костных метастазов и рака щитовидной железы.
В соответствии с электронной теорией рака (Сzent-Gyorgyi A., 1977) поверхность раковых клеток заряжена отрицательно в сравнении с нормальными клетками. Метастатический потенциал раковой клетки зависит от величины отрицательного поверхностного заряда (избытка электронов) на поверхности этой клетки.
При взаимодействии позитронов с электронами на поверхности раковой клетки происходит “аннигиляция” с эмиссией света в видимом диапазоне. Регистрация этой эмиссии является основой способа диагностики опухолей — позитронной эмиссионной томографии.
Аннигиляция электронов и позитронов также вызывает повреждение мембран раковых клеток, что способствует выходу из них эндогенных БТШ70 с последующей активацией иммунных механизмов гибели опухолевых клеток.
Предложен способ лечения метаболически активных форм метастатического рака с использованием позитрон-излучающего радиофармпрепарата на основе 18F-фтордезоксиглюкозы – ФДГ. Недостатком этого способа является его низкая специфичность. Физиологическое накопление ФДГ в тканях головного мозга, миокарде, а также в органах выделения может вызвать лучевое повреждение этих органов и тканей.
Для предотвращения неспецифич еского повреждения здоровых органов и тканей нами была разработана технология позитронной терапии местаста-тического рака с использованием других туморспецифичные радиофарм-препаратов, например, холина и метионина, конъюгированных с маложивущим позитрон-излучающими радионуклидом, например, 11 С.
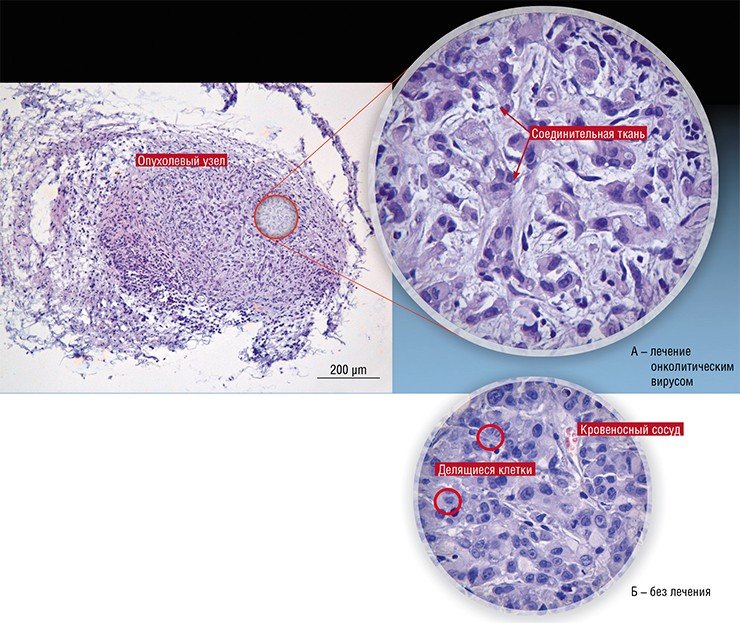
Показана высокая эффективность комбинированного применения лазерных, биологических (рекомбинантные БТШ70) и ядерных (позитронная терапия) в лечении резистентных к онколитичской виротерапии форм метастатического распространенного рака.
Применение онколитических вирусов в сочетании с бактериальными липополисахаридами (ЛПС) повышает эффективность виротерапии рака в эксперименте.
Нами разработана технология получения нетоксичных производные бактериальных ЛПС путем обработки исходных биоматериалов широкоапертурным пучком электронов.
Установлено, что нетоксичные производные Продигиозана, полученные путем его облучения широкоапертурным пучком электронов, обладают свойствами ингибиторов Tim-3 рецепторов, которые подавляют функцию цитотоксических T-лимфоцитов (CD3+CD8+клеток).
Блокада Tim-3 рецепторов нетоксичными производными продигиозана способствует активации противоопухолевого иммунитета и повышению эффективности вирусной терапии рака.
В 2015 г. в арсенале онкологов официально появился принципиально не новый, но новаторский по сути метод разрушения опухолей с помощью вирусов. Назвать его новым нельзя потому, что первые официальные публикации по его использованию, в ряде случаев успешному, появились еще в 1904—1910 гг. (Dock, 1904; De Pace, 1912). Тогда ученые описали сначала случайное, а затем и намеренное использование для лечения онкологических больных ослабленного (вакцинного) препарата вируса бешенства. Правда, широкого применения этот метод не получил, так как вакцина имела побочные эффекты, а результаты лечения было трудно предсказать.
В течение следующей сотни лет к этому методу неоднократно пытались вернуться. В 1950—1970-е гг. для лечения рака применялись непатогенные штаммы вирусов лихорадки Западного Нила, желтой лихорадки, вируса бешенства, аденовирусов, вируса болезни Ньюкасла и др. Иногда больные полностью выздоравливали, нередко случались и временные ремиссии. Но плохая предсказуемость результатов, незнание научно обоснованных механизмов действия вирусов на опухоль и предубеждения скептиков из контролирующих органов вынуждали врачей отступать.
Новая история онколитических вирусов
Позднее выяснилось, что в отсутствие гена E 1B не реализуется и вторая функция белка E1B-55K (O’Shea et al., 2004), которая состоит в переносе из ядра в цитоплазму вирусных РНК, кодирующих белки вирусной оболочки. В опухолевых клетках эту функцию берет на себя не установленный до сих пор фактор. Таким образом, механизм действия ONYX‑015 еще нуждается в дальнейшем исследовании. Кроме того, за перерождение клеток в раковые могут отвечать не только дефекты белка р53. Есть и другие механизмы ракового перерождения клеток, и в этом случае аденовирусы будут неэффективны.
Все это привело к тому, что к концу 1990-х гг. разработки онколитических вирусов снова затихли. Однако аналог ONYX‑015 под названием онкорин был разрешен для лечения некоторых типов онкобольных с опухолями головы и шеи в Китае, так же, как и рекомбинантный аденовирус с удаленным геном Е1В и дополнительной вставкой гена р53 для усиления онколитических свойств (препарат гендицин) (Guo et al., 2006).
В СССР исследования онколитических свойств вирусов были начаты в 1960—1970-х гг. в Институте полиомиелита и вирусных энцефалитов АМН СССР (Московская обл.). Кроме изучения вирусов полиомиелита и разработок вакцин против них, в институте проводились более широкие исследования, в результате которых вакцинные штаммы вируса полиомиелита были применены для лечения рака. Кроме того, были выделены и типированы несколько других непатогенных для людей энтеровирусов, у которых обнаружились онколитические свойства.
С онколитическими вирусами работала член-корр. АМН СССР доктор медицинских наук М. К. Ворошилова, и в ряде случаев ей удалось добиться серьезных успехов вплоть до полного исчезновения первичной опухоли и метастазов. Однако в 1970-х гг. ее эксперименты были запрещены. Поводом послужил недостаток данных о механизмах явления и молекулярной природе как вирусов, так и раковой опухоли. Уже после прекращения этих работ были опубликованы два ее обзора, оба – в малодоступных изданиях: русскоязычном и зарубежном (Ворошилова, 1987; Voroshilova, 1989).
Позднее профессор В. В. Кешелава, работая в разных российских онкологических клиниках, использовал в терапии некоторых видов опухолей непатогенный для человека вирус болезни Ньюкасла (Keshelava et al., 2009). Однако до широких клинических испытаний дело так и не дошло.
Новейшая история: клинические испытания
За рубежом работы с онколитическими вирусами за последние десять лет получили мощное развитие. Вначале они в основном развивались в Канаде, и канадское Агентство здравоохранения даже финансировало некоторые проекты в США.
В октябре 2015 г. Управление по контролю качества пищи и лекарств США (FDA USA) официально разрешило клинические испытания III фазы генно-инженерного штамма герпесвируса под названием имлиджик (Imlygic) для лечения больных с рецидивирующей меланомой. Штамм герпесвируса, содержащий в геноме аттенуирующие (снижающие патогенные свойства) мутации и человеческий ген гранулоцит-макрофаг-колониестимулирующего фактора для усиления противоопухолевого эффекта, был разработан американской компанией BioVex, Inc. Эту разработку и саму компанию вместе с правами на препарат в 2011 г. поглотил фармацевтический гигант Amgen. В конце 2015 г. препарат был официально разрешен к применению и в Европе.
Сейчас онколитические препараты на основе вирусов разрабатываются и начинают применяться во многих странах. В Канаде это – аденовирусы и рекомбинантные вирусы осповакцины, в Финляндии – рекомбинантные аденовирусы, в Японии – рекомбинантные герпесвирусы, в Латвии – энтеровирусы. В США – целый ряд вирусов, включая рекомбинантный аттенуированный герпесвирус, вакцинный штамм вируса кори и вакцинные штаммы вирусов гриппа. В Великобритании начинаются клинические испытания вакцинного штамма вируса гриппа на больных раком печени.
В России подобные разработки также продолжаются. В 2010 г. Новосибирский государственный университет получил мегагрант, руководителем которого стал известный российский молекулярный биолог П. М. Чумаков (сын М. К. Ворошиловой), а ведущими исполнителями – авторы этой статьи (Нетесов и др., 2013). В результате в НГУ фактически с нуля была создана хорошо оборудованная научно-исследовательская лаборатория в комплексе с практикумом по микробиологии, опубликованы обзорные статьи по онколитическим вирусам (Kochneva et al., 2012; Жираковская и др., 2012; Чумаков и др., 2012; Святченко и др., 2012), получены и охарактеризованы первые кандидатные штаммы онколитических энтеровирусов, парамиксовирусов и ортопоксвирусов.
Но пока существует недоверие к потенциально полезным противораковым вирусам, боязнь их патогенных свойств превалирует. И это удивительно, потому что широко используемые в настоящее время для борьбы с онкозаболеваниями химиопрепараты вызывают массу вредных побочных эффектов. Механизм действия большинства из них таков, что эти лекарства поражают не только раковые, но и здоровые, активно делящиеся клетки. Хорошо известно, что химиотерапия иногда приводит к преждевременной гибели больных, но ее применяют, потому что зачастую другого способа лечения онкобольных нет.
Попутно возникает еще один интересный вопрос о роли вирусов в нашей жизни. Ведь некоторые из них, как и бактерии, обитают в нашем теле, не нанося ему вреда. Может быть, роль вирусов, по крайней мере некоторых из них, как раз и состоит в защите от раковых клеток? И они лишь иногда вызывают заболевания, выйдя из-под контроля? Ответы на эти вопросы должны стать предметом будущих исследований, если мы хотим добиться прорыва в борьбе с онкозаболеваниями.
* Вакцинация против полиомиелита производилась живой вакциной Сэбина.
Святченко В.А., Тарасова М.В., Нетесов С.В. и др. Онколитические аденовирусы в терапии злокачественных новообразований: современное состояние и перспективы // Молекулярная биология. 2012. Т. 46. С. 556—569.
Dock G. Rabies virus vaccination in a patient with cervical carcinoma// Am. J. Med. Sci. 1904. V. 127. P. 563—565.
Guo J.; Xin H. Chinese gene therapy. Splicing out the West? // Science. 2006. V. 314. N. 5803. P. 1232—1235.
Kochneva G., Zonov E., Grazhdantseva A. et al. Apoptin enhances the oncolytic properties of vaccinia virus and modifies mechanisms of tumor regression // Oncotarget. V. 5. N. 22. 2014. P. 11269—11280.
КАРТОЧКА ПРОЕКТА,
ПОДДЕРЖАННОГО РОССИЙСКИМ НАУЧНЫМ ФОНДОМ
Информация подготовлена на основании данных из Информационно-аналитической системы РНФ, содержательная часть представлена в авторской редакции. Все права принадлежат авторам, использование или перепечатка материалов допустима только с предварительного согласия авторов.
Название Активация трансмембранных протеаз опухолевых клеток как причина приобретения избирательной чувствительности к онклитическому действию вируса Сендай
Руководитель Чумаков Петр Михайлович, Доктор биологических наук
Организация финансирования, регион федеральное государственное бюджетное учреждение науки Институт молекулярной биологии им. В.А. Энгельгардта Российской академии наук, г Москва
Года выполнения при поддержке РНФ 2014 - 2016
Область знания, основной код классификатора 05 - Фундаментальные исследования для медицины, 05-108 - Иммунология
Ключевые слова онколитические вирусы, трансмембранные протеазы, парамиксовирус Сендай, метастатический рак, раковая клетка, ген супрессор р53, репликация вирусов, инфекционность, терапия рака
Код ГРНТИ 34.15.00
Статус Успешно завершен
ИНФОРМАЦИЯ ИЗ ЗАЯВКИ
Аннотация
Метастатический рак по прежнему остается во многих случаях неизлечимым заболеванием. Современные подходы к химиотерапии рака приближаются к пределу своих возможностей. Однако большие надежды для медицины будущего связаны с использованием методов биотерапии рака. Проект направлен на изучение механизмов вирусного онколиза с помощью мышиного парамиксовируса Сендай. Исследование возможности использования вирусов для терапии рака представляет активно-разрабатываемое направление онкологии и вирусологии. Опухолевые клетки как правило приобретают повышенную чувствительность к вирусам, благодаря утрате механизмов противовирусной защиты а также изменению метаболизма и регуляции процессов биосинтеза. Особое значение для активного внедрения онколитических вирусов в медицинскую практику имеют вопросы безопасности таких вирусов для пациентов и экологии. В связи с этим использование непатогенных вирусов животных, обладающих онколитическим потенциалом против опухолей человека представляет несомненный интерес. Мышиный парамиксовирус Сендай непатогенен для человека и вызывает респираторное заболевание у мышей. Он способен размножаться исключительно в дыхательном эпителии, благодаря тому что созревание инфекционного вируса требует экзогенных трипсин-подобных протеаз, секретируемых легочным эпителием. В тоже время, наши исследования указывают на способность опухолевых клеток человека поддерживать продукцию инфекционно-компетентного вируса. Существующие данные указывают участие в созревании вируса трансмембранных сериновых протеаз II типа, которые активируются в ряде опухолевых клеток человека. Провидимому именно за счет активации этих протеаз вирус Сендай приобретает онкоселективность и онколитическую активность, позволяющую рассматривать его в качестве терапевтического средства. Мы планируем проведение исследования ставящего целью установления насколько часто опухоли человека приобретают чувствительность к вирусу Сендай за счет активации трансмембранных протеаз, какие типы протеаз обуславливают онкоселективность вируса, и как можно использовать это свойство для совершенствования методов терапии рака. Мы планируем разработку подхода, позволяющего предсказывать чувствительность того или иного типа рака к онколитической терапии в помощью вируса Сендай, а также отработку метода доставки инфекционного вируса в опухоль и отдаленные метастазы с помощью клеточных носителей экспрессирующих трансмембранные протеазы и способные продуцировать инфекционные вирионы.
Ожидаемые результаты
Планируемое исследование позволит установить новый ранее неизвестный механизм онкоселективности вируса Сендай и обосновать его пригодность для использования в качестве безопасного и эффективного терапевтического противоракового средства. Установление корреляции между активацией трансмембранных протеаз в опухолевых клетках человека и приобретением чувствительности к онколитическому действию вируса Сендай позволит проводить предсказания эффективности терапии с помощью вируса в отношении опухоли конкретного пациента. Планируемое исследование позволит также создать клеточную систему для эффективной доставки инфекционного вируса в опухоли и отдаленные метастазы, что позволит существенно повысить успех терапевтического воздействия. Результаты работы будут опубликованы в научных статьях и популярных изданиях для информирования общественности об успехах в области медицины.
Аннотация результатов, полученных в 2014 году
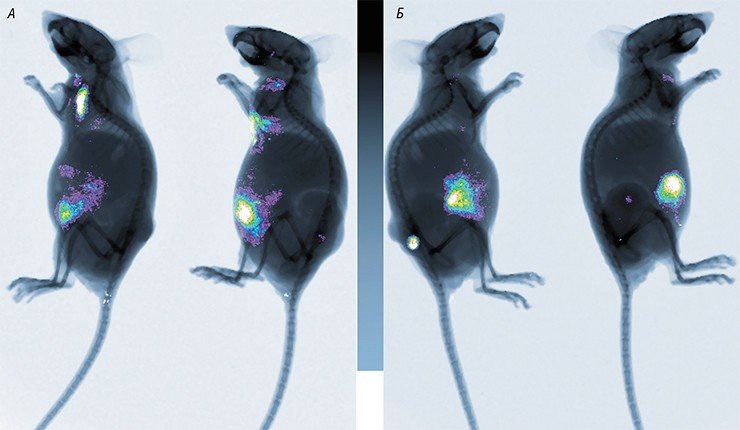
Ранее при размножении вируса Сендай на клетках почки человека или собаки было установлено, что в культуре клетки не обладают достаточной эндогенной протеазной активностью для того чтобы осуществить расщепление вирусного фузигенного белка F до активной формы F1, необходимой для проникновения вируса в клетку. Продуцируемые вирусные частицы лишены инфекционности, и поэтому для получения инфекционного вирусного стока требуется добавление экзогенного трипсина. В тоже время, известно, что вирус Сендай обладает онколитической активностью и способен разрушать опухоли как на животных моделях, так и при испытаниях на людях. В то же время, часть опухолей оказывается устойчивой к онколитическому действию вируса. Проведенные нами ранее предварительные исследования позволили предположить, что в основе чувствительности некоторых опухолей человека лежит активация эндогенных протеаз, которые способны процессировать фузигенный белок вируса Сендай и обуславливать размножение вируса в опухоли в течение нескольких инфекционных циклов. Активация эндогенных протеаз в опухолях может быть причиной для онкоселективности вируса Сендай, а предварительное выявление активации протеаз в образце опухоли пациента может позволить проведение прогнозирования по поводу индивидуальной чувствительности данной опухоли к вирусной терапии. Для проверки этой гипотезы мы провели скрининг 61 линий злокачественных клеток человека различного гистогенеза на способность продуцировать инфекционные вирионы вируса Сендай, способные к повторному заражению клеток. Было установлено, что 42 линии (68.8%) были способны продуцировать инфекционные вирионы, содержащие процессированный белок F. Среди этих линий отобраны наиболее подходящие для дальнейших исследований представители линий клеток двух типов (способные и неспособные продуцировать инфекционные вирионы). Для выявления экспрессии трансмембранных трипсин-подобных протеаз, способных осуществлять процессирование белка F, были отработаны условия для детекции транскриптов соответствующих генов с помощью ПЦР в реальном времени. Среди инфекционно-компетентных линий клеток обнаружены линии с повышением эндогенного уровня транскриптов протеазы TMPRSS2, в то время как среди инфекционно-некомпетентных линий таких изменений не выявлено. Для установления причинно-следственной связи между экспрессией протеаз и способностью продуцировать инфекционные вирионы нами были сконструированы плазмиды для выключения гена TMPRSS2 с помощью РНК интерференции (экспрессия shRNA) и геномных нокаутов (система CRISPR/Cas9). Получены данные о роли подавления гена-супрессора р53 в приобретении чувствительности клеток к вирусу Сендай. Подобраны и отработаны модели для опытом in vivo с использованием иммунодефицитных мышей, в том числе модель множественных опухолей у одного животного и их выявление с помощью компьютерной томографии. Полученные экспериментальные данные и методические разработки будут использованы на последующих этапах исследования.
1. Chumakov PM Oncolytic virus therapy: problems to be solved Acta Naturae, 2015, January (год публикации - 2015).
2. Kochneva G, Zonov E, Grazhdantseva A, Yunusova A, Sibolobova G, Popov E, Taranov O, Netesov S, Chumakov P, Ryabchikova E. Apoptin enhances the oncolytic properties of vaccinia virus and modifies mechanisms of tumor regression Oncotarget, 2014 Oct 15. pii: 2579 (год публикации - 2014).
Аннотация результатов, полученных в 2015 году
Определена способность 15 линий клеток опухолей человека различного гистогенеза поддерживать размножение вируса Сендай и секретировать инфекционно-компетентные вирионы. Установлена корреляция чувствительности линий с экспрессией ряда генов, относящихся к протеазным сигнальным путям. Помимо двух трансмембранных протеаз TMPRSS2 и TMPRSS11B с чувствительностью к вирусу положительно коррелировала экспрессия генов дипептидил пептидазы DPP9, карбоксипептидазы CPN1, напсина А NAPSA, катепсина К CTSK, катепсина А CTSA, протеазы PSA PROS1, аланил-аминопептизады ANPEP и карбоксипептидазы М CPM. Характер изменений активности генов протеаз зависел от тканевой принадлежности опухоли. Получено девять первичных культур (прошедших не более 6 пассирований) от пациентов рака молочной железы и шесть культур от пациентов рака простаты. Определена относительная чувствительность к вирусу Сендай внутри этой группы культур. С помощь. ПЦР в реальном времени определены уровни экспрессии 23 генов представителей протеазных сетей клетки, функционирующих во внеклеточном пространстве. Чувствительность культур достоверно положительно коррелировала с экспрессией четырех генов, кодирующих протеазу TMPRSS2 (наибольший вклад), карбоксипептидазу М СРМ, катепсин L2 CTSL2 и дипептидил пептидазу 4 DPP4. Для установления роли протеазы TMPRSS2 в чувствительности опухолевых клеток к вирусу Сендай проведено выключение этого гена с помощью РНК интерференции. Экспрессия этого гена существенно влияло на способности вируса размножаться в клетках CaCo2, но не в H1299, что указывает на ткане- и опухольспецифические различия в причинах приобретения чувствительности к вирусу. Изучена способность ряда клеток (куриные фибробласты из 5-дневных эмбрионов, периферические лимфоциты, активированные лимфоциты, индуцированные дендритные клетки, линий клеток MDCK экспрессирующая протеазу TMPRSS2) функционировать в качестве носителя для переноса вируса в чувствительные раковые клетки. Максимальной способностью заражать чувствительные клетки обладали дендритные клетки, меньшей - активированные лимфоциты, клетки куриных эмбрионов и трансгенные клетки MDCK экспрессирующие протеазу TMPRSS2, еще меньше – периферические лимфоциты крови. Проведено испытание различных способов доставки вируса в подкожные ксенографты опухолей человека на бестимусных мышах. При введении в хвостовую вену доставка была возможна с использованием 1000 зараженных вирусом клеток. Введение препаратов вируса внутрибрюшинно и подкожно оказалось малоэффективным. Установлено, что повышение чувствительности клеток рака легкого А549 к вирусу Сендай при выключении гена р53 коррелирует с увеличением экспрессии генов протеаз CPM, ANPEP, PLAU, MMP2, CPE, CPA4, ADAMTS5, TRHPE, FBXL2 и CPQ. По-видимому эти гены супрессируются р53 дикого типа, и при его утрате происходит активация транскрипции ряда протеаз, вызывая повышение чувствительности к вирусу Сендай.
1. Matveeva OV, Guo GS, Senin VM, Senina AV, Shabalina SN, Chumakov PM Oncolysis by paramyxoviruses: preclinical and clinical studies Molecular Therapy - Oncolytics, 2, 150017; doi:10.1038/mto.2015.17 (год публикации - 2015).
2. Matveeva OV, Kochneva GV, Netesov SV, Onikienko SB, Chumakov PM Mechanisms of Oncolysis by Paramyxovirus Sendai Acta NAturae, 7 № 2 (25) 2015 (год публикации - 2015).
3. Matveeva, O. V. Guo, Z.-S. Shabalina, S.V. Chumakov, P. M. Oncolysis by paramyxoviruses: multiple mechanisms contribute to therapeutic efficacy Molecular Therapy - oncolytics, 2, 15011; doi:10.1038/mto.2015.11; (год публикации - 2015).
Аннотация результатов, полученных в 2016 году
В течение заключительного этапа проекта по изучению роли трансмембранных протеаз в созревании онколитического вируса Сендай получены важные данные о механизме приобретения фенотипа опухолевых клеток, сопровождающегося повышенной активностью клеточных сериновых протеаз, способных процессировать F белок вируса Сендай. Вирус Сендай требует активности протеза хозяина для полного созревания и дальнейшей возможности для новообразованного вируса заражать опухолевые клетки и осуществлять онколиз. Ранее в своих исследованиях мы концентрировались на изучении изменений экспрессии самих трансмембранных протеаз в опухолевых клетках, выясняли как это коррелирует с приобретением чувствительности к вирусу и с экспрессией других генов. Однако полученные результаты были недостаточными для того чтобы делать вывод о четкой корреляции чувствительности к вирусу Сендай и изменениями экспрессии трансмембранных протеаз, по крайней мере на транскрипционном уровне. Кроме этого, применение стандартных линий опухолевых клеток имеющих разное тканевое происхождение не позволяло сделать определенные выводы, так как многие из генов могут иметь тканеспецифическую регуляцию. На данном этапе мы использовали полученную нами панель опухолевых культур ранних пассажей, полученные от пациентов рака простаты и рака молочной железы. Было исследовано 14 культур рака простаты и 8 культур рака молочной железы. Для более количественной оценки способности вируса Сендай заражать клетки нами был разработан новый количественный метод, основанный на проточной цитометрии. С помощью этого метода определена способность культур рака простаты продуцировать зрелый вирус и проведена классификация культур по их способности в той или иной степени процессировать инфекционно-активные вирионы. Во всех линиях клеток определен функциональный статус гена р53 с помощью введения р53-зависимого транскрипционного репортера и индукции активности р53 с помощью обработки 5-фторурацилом. В линиях клеток с нарушенной функциональностью р53 с помощью секвенирования фрагментов кДНК идентифицированы миссенс мутации в кодирующих участках гена р53. Наиболее характерные линии клеток, различающиеся по способности продуцировать зрелые вирионы и по состоянию гена р53 подвергнуты транскриптомному анализу. Было подтверждено, что линии клеток в большей мере способные продуцировать зрелый вирус, имеют несколько повышенный уровень экспрессии генов TMPRSS2 и TMPRSS11B. Однако наиболее сильные изменения транскрипции были обнаружены нами для генов, кодирующих ингибиторы сериновых протеаз, серпины - маспин и PAI-1. Также в клетках карциномы простаты выявлено повышение уровня экспрессии гена, кодирующего простат-специфический антиген. Интересно что два обнаруженных гена серпинов позитивно регулируются активностью гена р53. По нашим прежним опубликованным данным простат-специфический антиген находится под негативным контролем со стороны р53. Это навело на мысль что как различия в экспрессии указанных генов так и чувствительность к вирусу Сендай могут быть опосредованы статусом гена р53. Анализ экспрессии указанных генов с помощью ПЦР в реальном времени в остальных культурах опухолей простаты и молочной железы подтвердил существование строгой корреляции между экспрессией этих генов и статусом р53. Все эти три р53-регулируемых гена изменяли свою экспрессию в клетках раков простаты при выключении р53 с помощью РНК интерференции. В раках молочной железы уровни PAI-1 были существенно ниже и не регулировались р53, а уровень экспрессии PSA практически не определялся, что указывает на тканеспецифичность экспрессии этих генов. Выключение гена р53 приводило также к приобретению повышенной способности продуцировать зрелые вирионы Сендай. Таким образом мы установили, что в качестве одного из основных механизмов приобретения опухолями способности продуцировать зрелый вирус Сендай является утрата активности опухолевого супрессора р53. В результате потери функции р53 происходит утрата экспрессии ингибиторов сериновых протеаз семейства серпинов, а в случае рака простаты - к повышению экспрессии протеазы PSA. Эти изменения, очевидно, могут приводить к каскадным изменениям активности ряда протеаз, в том числе трансмембранных протеаз, принимающих участие в созревании вируса Сендай. Однако эти изменения могут плохо детектироваться на транскрипционном уровне, поскольку осуществляются за счет протеолиза. Таким образом статус гена р53 может служить одним из предикторов чувствительности опухолей человека к вирусу Сендай. Мы также провели испытание ранее разработанных нами двух клеточных моделей для системной доставки вируса Сендай в опухоли, которые основаны на клетках ранних куриных эмбрионов и индуцированных in vitro дендритных клетках человека, нагруженных предварительно вирусом Сендай. Мы установили возможность системной доставки вируса Сендай в опухоли с помощью нагруженных вирусом дендритных клеток при их внутривенном введении. Все основные цели проекта были выполнены.
1. Жирнов О.П., Манякин А.А., Россман Ю.С., Кленк Х.Д. Intravirion cohesion of matrix protein M1 with ribonucleocapsid is a prerequisite of influenza virus infectivity Virology, 492, 187–196 (год публикации - 2016).
Читайте также:


