| Группа: |
Клеточные полиомавирусов Merkel ( MCV или MCPyV ) впервые была описана в январе 2008 года в Питтсбурге, штат Пенсильвания . Это был первым пример человеческого вирусного патогена обнаружен с помощью несмещенного метагеномного секвенирования следующего поколения с техникой , названной цифровым транскриптом вычитанием . MCV является одним из семи известных в настоящее время человека онковирусов . Есть подозрение , причиной большинства случаев клеточной карциномы Меркеля , редкой , но агрессивной формой рака кожи . Приблизительно 80% клеток карциномы Меркель (MCC) опухолей было обнаружено, что инфицированы MCV. Через три года, команда исследователей из института рака Дана-Фарбер разработали антитело , которое обнаруженную экспрессию MCV в 97% опухолей MCC. MCV , как представляется , является общей, если не универсально-инфекция у детей старшего возраста и взрослых. Он находится в дыхательных путях , предполагая , что он может быть передан в дыхательных путях. Но она также может быть найден проливая от здоровой кожи, а также в тканях желудочно - кишечного тракта и в других местах, и поэтому его точный способ передачи остается неизвестным. Большинство вирусов MCV найден в опухолях MCC, однако, по крайней мере , две мутации , которые делают вирус nontransmissible: 1) Вирус интегрирован в геном хозяина в моноклональной моде и 2) вирусный Т - антиген имеют укороченные мутации , которые оставляют антиген Т не в состоянии инициировать репликацию ДНК , необходимую для распространения вируса.
Доказательства того, что MCV является причиной для большинства опухолей MCC происходит от исследований , в которых Т - антиген онкопротеины которые ингибируются от вируса. Сбить из этих вирусных белков вызывает клетки от MCV-положительных опухолей MCC умереть , тогда как не существует никакого эффекта на клетки из опухолей, которые инфицированы вирусом. Это указывает на то, что MCV необходимо поддерживать вирус-позитивных опухолевых клеток. Кроме того, клональной модель MCV вставки в геномах MCC клеток указывает на то, что вирус присутствовал в клетке Меркель , прежде чем она подверглась злокачественную трансформацию. IARC недавно классифицирован MCV как класс 2A канцероген.
содержание
классификация
![]()
![]()
![]()
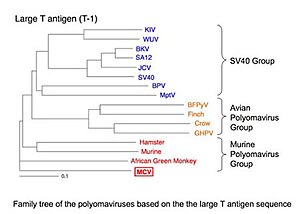
5400 пар оснований), не охватило , двухцепочечные ДНК - вирусы . MCV является пятыми полиомавирусами , который заражает человек , чтобы быть обнаруженными. Он принадлежит к мышиным полиомавирусам группы, один из трех основных кладов из полиомавирусы. (Группа названа в честь мышиной полиомы , самый ранний вирус группы , чтобы быть обнаруженным, и не означает , что MCV передается человеку от грызунов.) Несмотря на то, что было спутать с противоречивым SV40 вирусом в некоторых почтовых отправлениях в блоге, это совершенно отличные от вирусов.
MCV генетически наиболее тесно связаны с африканской зеленой обезьяны лимфотропной полиомы (ранее известный как африканской зеленой мартышки лимфотропной паповавирус), что согласуется с MCV coevolving с человека приматов.
Последовательность прототипа MCV имеет 5387 пар оснований генома, и кодирует характерные полиомавирусов гены , в то числе большого Т - антигена, малый Т - антиген, VP1 и VP2 / 3 генов [1] . MCV Т - антиген имеет аналогичные функции в Т - антигены других полиомавирусов, которые известны онкобелок , и выражается в опухолях человека. Антиген Т представляет собой сращены ген , который образует несколько различных белков в зависимости от характера сплайсинга. Оба большого и малый Т Т онкопротеины, вероятно , необходимо , чтобы превратить здоровые клетки в раковые клетки, и они действуют путем охвата опухолевых супрессоров белков, такие как белка ретинобластомы . Большой Т - антиген обладает хеликазным мотивом , необходимым для репликации вируса , который удаляется в опухолях MCC. В отличии от других полиомавирусов, MCV малого Т - антиген трансформирует клетки в пробирке путем активации колпачка в зависимости от перевода .
Вирусная причина рака Merkel клеток
Карцинома Меркель в основном встречается у пожилых лиц. Известно , что происходит при повышенной частоте у людей с иммунодефицитом , включая реципиент и человек с СПИДОМ , и эта ассоциация предполагает возможность того, что вирус или другой инфекционный агент может участвовать в возникновении рака. Саркома Капоши и лимфомы Беркитты являются примерами опухолей , известных есть вирусная этиология , которые возникают при повышенной частоте в иммуносупрессией людей. Другие факторы , связанные с развитием этой формы рака включают воздействие ультрафиолетового света .
были найдено Восемь из 10 Merkel клеток карциномы опухоли изначально тестируемой быть заражены MCV. В этих опухолях, вирус интегрирован в геном клетки рака и больше не может свободно копировать. Недавние исследования, проведенные в других лабораториях воспроизвели эти результаты: в одном исследовании 30 из 39 (77%) опухолей Merkel клеток были MCV положительными; В другом исследовании, 45 из 53 (85%) опухолей Merkel клеток были положительными.
Профилактика, диагностика и лечение
Лица, которые имеют рак Merkel клеток с этим вирусом не являются заразными для других и не инфекционных ограничений не являются оправданными. Причины этого: 1) вирус в опухолях не уже мутировал и больше не могут быть переданы от опухолей, и 2) большинство людей уже, естественно, подвергается воздействию этого вируса, как детей и молодых взрослых другими бессимптомных носителей.
На основании имеющихся данных, советы профилактики для MCC похож на другие виды рака кожи, таких как избежать солнечных ожогов и излишнего воздействия солнца вместе с использованием солнца лосьон. Это может предотвратить мутации вируса, которые увеличивают риск для MCC среди тех, кто уже инфицирован MCV. Лица с иммунодефицитом (например, СПИДа или пациентов после трансплантации) при более высоком риске для этого рака и может извлечь выгоду из периодических осмотров кожи. Появление безболезненной глыбы, которая расширяется быстро, особенно среди лиц старше 50 лет или лиц с иммунодефицитом, варранты осмотром у врача. Биопсия опухоли Merkel клетки должна легко поставить диагноз и когда поймана рано, имеет хороший прогноз через стандартное лечение. В это время нет вакцины или лекарств, которые могут предотвратить MCV инфекции или предотвратить появление рака Merkel клеток.
Обнаружение вируса все еще находится на стадии исследований и , как правило , не доступны в качестве клинического испытания. Обнаружение вирусной ДНК осуществляется с помощью ПЦР или с помощью саузерн - блоттинга . Необходимо соблюдать осторожность при интерпретации результатов ПЦРА , поскольку она склонна к ложноположительному загрязнению и значительной доле здоровых образцов кожи может питать инфекцию низкого уровня. Секвенирование генома вируса может определить , является ли или нет, присутствуют опухолевые специфические мутации.
Антитела были разработаны для окрашивания для Т-антигена в опухолевых тканях и, как представляется, специфичными для MCV-инфицированных опухолевых клеток. Анализы крови также были разработаны, которые показывают, что большинство взрослых были ранее подвержены MCV и может продолжать носить его как бессимптомной инфекции.
Рекомендации по лечению не различаются для клеток карциномы Меркеля инфицированного MCV или без MCV. Недавнее исследование по всей стране из Финляндии показывает, что MCV-позитивные опухоли имеют лучший прогноз, чем неинфицированная опухоль (хотя это не было обнаружено в других исследованиях). Если это подтвердится, то функция обнаружения вируса может обеспечить будущую выгоду для медицинского руководства. Сам вирус не известен, восприимчивы к текущим противовирусным препаратам.
Недавние исследования показали , что сурвивины онкобелок активируются MCV большого Т - белок ориентации белка клеточной ретинобластомы и что ингибиторы сурвивины могут замедлить прогрессирование опухоли в животных моделей. Клинические испытания в настоящее время организована , чтобы определить , имеет ли это какую - либо выгоду в организме человека. Важность этого открытия состоит в том , что многообещающий рациональное целевое препарат был обнаружен в течение четырех лет после первоначального обнаружения вируса , и другие новые методы лечения могут быть быстро развивается в настоящее время , что причина рака известна. MCV является мишенью для клеточных иммунных ответов, и поэтому важные научно - исследовательские работы в настоящее время сосредоточены на иммунологических методах лечения , которые могут принести пользу пациентов MCC.
Обнаружение и определение характеристик
В качестве причины для карциномы Меркеля клетки
Другие ассоциации
Возможные ассоциации с раком шейки матки, кожи плоскоклеточный рак, болезнь Боуэна, базально-клеточный рак кожи, внелегочного небольшой клеточной карциномы и EGFR мутации управляемой рака легкого немелкоклеточного поступало.
![]()
Рак Меркеля вульвы – это редкая агрессивная злокачественная опухоль, поражающая наружные женские гениталии. Проявляется быстро увеличивающимся безболезненным узлом красноватой окраски в толще или на поверхности кожи половых губ. Диагноз устанавливается на основании опроса пациентки, данных визуального осмотра, биопсии. Отличить рак Меркеля от других видов карциномы можно лишь с применением иммуногистохимического метода исследования. Лечение комбинированное, включает хирургическую операцию, лучевую терапию. Иногда назначаются противоопухолевые препараты.
МКБ-10
![]()
Общие сведения
![]()
Причины
Этиопатогенез рака Меркеля вульвы изучен мало. Считается, что инициацию развития новообразования может провоцировать как один, так и сразу несколько неблагоприятных факторов. Основными причинами возникновения заболевания считаются:
- Полиомавирусная инфекция. У 80% больных из неоплазии выделяют полиомавирус человека 5 (полиомавирус клеток Меркеля). Вирус не влечёт развития инфекции, сопровождаемой видимыми проявлениями, но его ДНК встраивается в клеточный геном, что приводит к злокачественной трансформации.
- Угнетение иммунной системы. Выраженное ослабление иммунного ответа, чаще связано с тяжёлым хроническим заболеванием, ВИЧ-инфекцией, приёмом иммуносупрессоров. У женщин с вирусом иммунодефицита риск неоплазии повышен в 13 раз, у пациенток после трансплантации – десятикратно.
- Наличие другой онкопатологии. Злокачественное новообразование другого вида и локализации увеличивает вероятность заболевания за счёт возможных общих этиологических факторов, нарушения иммунной реакции, патологических изменений кожи, связанных с противоопухолевой терапией. Так, при хроническом лимфолейкозе карцинома Меркеля выявляется в 30-50 раз чаще.
Провоцирующие факторы связаны друг с другом, ослабление иммунной реакции влечёт онкогенную активацию полиомавируса. К другим предрасполагающим условиям злокачественной трансформации клеток относятся постоянное травмирование кожи (например, при ношении тесного синтетического нижнего белья), избыточное воздействие ультрафиолета (пристрастие к загару без купальника).
Патогенез
В современной онкогинекологии наиболее распространена вирусная теория развития рака Меркеля. Заражение полиомавирусом чаще происходит у детей и подростков, пути передачи и риски точно не установлены. Далее вирус элиминируется или десятилетиями латентно существует в организме. Возникновению рака предшествует мутация вирусной ДНК под воздействием неблагоприятных факторов, её интеграция в геном клеток хозяина.
Следствием объединения становятся хромосомные аномалии и генные мутации поражённых клеток, влияющие на подавление апоптоза, бесконтрольное деление. Ранее из-за фенотипического сходства считалось, что рак происходит непосредственно из клеток, открытых Меркелем. Однако здоровые меркелевы клетки являются частью эпидермиса, а опухолевые поражают дерму и более глубокие слои, но не эпидермальный.
Этот факт, а также некоторые отличия химического состава и разнообразные варианты дифференцировки (железистая, плоскоклеточная, меланоцитарная) опухолевых клеток позволили предположить происхождение рака Меркеля из стволовых клеток. Источником карциномы являются полипотентные клетки дермы, приобретающие фенотип и специализацию нейроэндокринных при злокачественной трансформации.
Классификация
Для оценки локального поражения, возможного вовлечения регионарных лимфатических узлов и отдалённых органов используется международная классификация TNM. Степень тяжести заболевания определяется стадией:
- I стадия (T1Nx-0M0). Характеризуется местным процессом без вовлечения отдалённых органов, отсутствием видимых метастазов в регионарные лимфоузлы, размером очага не более 2 см. Стадия IA устанавливается только после гистологического подтверждения интактности лимфоузлов. Без морфологического исследования распространение соответствует IA.
- II стадия (T2-3Nx-0M0 и T4N0M0). Стадии IIA-B отличаются от IA-B только размером первичного рака (более 2, но менее 5 см). На стадии IIС размер первичного очага более 5 см, регионарные лимфоузлы и дистантные органы не поражены.
- IIIстадия(T0-4N1a,b-2M0). Характеризуется любым размером опухоли, отсутствием отдалённых метастазов, поражением регионарных лимфоузлов. На стадии IIIA имеются микроскопические метастазы (определяются при гистологическом исследовании удалённого узла), на стадии IIIB – макроскопические, видимые на УЗИ и КТ.
- IVстадия (T0-4N0-2M1). Диагностируется при наличии отдалённых метастазов при любом размере первичной неоплазии и состоянии регионарных лимфоузлов. Отдалённые метастазы в лимфоузлы, кожу, мягкие ткани обозначают M1a, лёгкие – M1b, иные органы – M1c.
Симптомы
Рак Меркеля проявляется в виде плотного безболезненного округлого узелка в области кожи лобка, вульвы. Кожа над образованием гладкая, иногда с видимым сосудистым рисунком. Цвет может варьироваться от розового до красного и красно-фиолетового. У двух третей больных опухоль представлена единичным узлом, у остальных пациентов рядом присутствуют сателлиты (дочерние или первично множественные узелки).
Размеры новообразования чаще не превышают 2 см, в 35% случаев опухоль продолжает расти и может достигать 20 см. Её контуры ровные, структура однородная. Единственным видимым свидетельством злокачественного характера неоплазии зачастую является лишь быстрый рост – в течение трёх месяцев возможно двукратное и более увеличение.
Осложнения
Наиболее опасное осложнение новообразования – метастазы, распространяющиеся по лимфатической и кровеносной системе. Обнаруживаются у 65-85% больных, на момент первичной диагностики регистрируются у 15% пациенток. Частота метастатических поражений различной локализации при этой форме рака: отдалённых участков кожи – до 30%, лёгких – 10-23%, головного мозга – 18%, костей – 10-15%, печени – 13%.
У 20% больных первичная опухоль (обычно внушительных размеров) изъязвляется, подвергается некротическому распаду. Это создаёт благоприятные условия для развития гнойно-септических осложнений, затрудняет нахождение женщины в социуме, пагубно влияет на семейные отношения ввиду неприятного запаха, постоянного подтекания сукровицы и гноя. При распаде рака нередки кровотечения из повреждённых сосудов, ослабляющие пациентку.
Диагностика
Установление диагноза рака Меркеля вульвы затруднено. Клинически развитие неоплазии больше напоминает доброкачественный процесс, правильный диагноз выставляется только 1% пациенток с нейроэндокринной карциномой кожи половых органов. Обследование проводится под руководством онкогинеколога или хирурга-онколога, обязательно включает:
- Общий осмотр. В ходе осмотра и пальпации наружных гениталий врач обнаруживает образование на коже вульвы. Заподозрить в нём рак Меркеля можно по быстрому росту опухоли, бессимптомному течению, данным анамнеза (возрасту более 50 лет, иммуносупрессии, сопутствующему лимфолейкозу).
- Лабораторная диагностика. Образец, взятый из опухолевого очага, подвергают гистологическому и иммуногистохимическому исследованию. Первое позволяет определить злокачественную природу опухоли, второе – выяснить её генотип и установить окончательный диагноз.
Для выявления регионарных и отдалённых макрометастазов назначают сцинтиграфию костей, УЗИ лимфоузлов, органов брюшной полости и малого таза, КТ грудной клетки и головы. Патологию дифференцируют с доброкачественными (дерматофибромой, липомой, атеромой) и другими злокачественными (беспигментной меланомой, плоскоклеточным раком низкой дифференцировки, метастазом мелкоклеточной карциномы лёгких) образованиями.
Лечение рака Меркеля
Поскольку карцинома данного типа мало распространена и слабо изучена, единых стандартов ее лечения не существует. Характер терапии соответствует особенностям неоплазии – интенсивный, агрессивный. Основным методом является хирургическая операция, которую нередко сочетают с лучевой терапией. Противоопухолевые препараты применяют реже.
В настоящее время в лечении рака Меркеля вульвы наряду с хирургической операцией используются как классические (лучевая терапия, химиотерапия), так и новые перспективные методы лечения, которые избирательно действуют на опухоль при минимальном влиянии на здоровые ткани. Достоинства и недостатки первых уже хорошо известны, последние детально изучаются, из них неплохо зарекомендовала себя фотодинамическая терапия.
- Лучевая терапия. Чаще назначается в качестве дополнения к операции для облучения послеоперационного рубца. Опухоль обладает высокой чувствительностью к ионизирующему излучению, поэтому радиотерапия может применяться как самостоятельный метод лечения поражённых сторожевых лимфоузлов и даже первичного очага.
- Химиотерапия. Карцинома из клеток Меркеля относительно резистентна к противоопухолевым препаратам, к тому же последние плохо переносятся возрастными пациентками, способны вызывать снижение чувствительности к последующему лучевому лечению. Поэтому химиотерапию назначают при невозможности иссечения или облучения рака, например, из-за обширного местного распространения.
- Фотодинамическая терапия. Заключается в избирательном накоплении фотосенсибилизирующего препарата раковыми клетками и их последующем разрушении под воздействием лазерного луча. Метод признан эффективным, недавно вошёл в протоколы терапии рака Меркеля в США и странах Европы. В России недостаточно доступен из-за высокой стоимости лечения.
Хирургическая операция является ведущим методом лечения рака Меркеля вульвы. При обнаружении этого вида карциномы выполняется широкое (с отступом не менее 2,5-3 см от краёв) иссечение опухоли. При вовлечении регионарных лимфоузлов резекция первичного очага дополняется лимфодиссекцией. После удаления неоплазии выполняется гистологическое исследование среза.
Широкое иссечение может быть единственным радикальным методом лечения на начальных стадиях новообразования без регионарного распространения. При наличии опухолевых клеток в краях резекции хирургическое вмешательство обязательно дополняют лучевой терапией. Удаление опухоли показано и в терминальной стадии – при её распаде. В этом случае выполняется санитарная (нерадикальная) операция с целью повышения качества жизни.
Прогноз и профилактика
Рак Меркеля вульвы агрессивнее таких же опухолей иной локализации. Прогноз зависит от стадии заболевания: пятилетний порог выживаемости после лечения удаётся преодолеть 60-80% пациенток с I стадией карциномы (на IA стадии этот показатель выше на 20%, чем при IB) и 8% на последней стадии. На исход лечения влияет возможность устранения иммунодефицитного состояния – известен случай спонтанного разрешения карциномы Меркеля на фоне успешной терапии ВИЧ.
Для предупреждения опухоли следует своевременно лечить общие заболевания, не злоупотреблять загаром, носить удобное бельё. Вторичная профилактика заключается в ранней диагностике первичной опухоли (необходима онкологическая настороженность врача, тщательное обследование кожных покровов у пациенток группы риска) и пожизненном диспансерном наблюдении больных для выявления рецидивов, вероятность которых составляет 30%.
- КЛЮЧЕВЫЕ СЛОВА: карцинома Меркеля, полиомавирус клеток Меркеля, PD-1, PDL-1, лучевая терапия, химиотерапия
Согласно классификации Всемирной организации здравоохранения карцинома Меркеля (КМ) – редкая злокачественная первичная опухоль кожи с эпителиальной и нейроэндокринной дифференцировкой [1]. Исходя из современных эпидемиологических данных США и некоторых стран Европы, заболеваемость КМ продолжает увеличиваться. По данным базы SEER (Surveillance, Epidemiology and End Results database), заболеваемость в 2006 г. составила 0,6 случая на 100 000 (0,15 случая на 100 000 в 1986 г.) (рис. 1) с преобладанием мужчин (60%). Ежегодно в США регистрируется около 1500 новых случаев КМ [2]. Эпидемиологических данных по Российской Федерации нет.
Несмотря на рост заболеваемости в мире, КМ остается редкой болезнью, что позволяет относить ее к так называемым орфанным заболеваниям.
Одним из факторов риска развития КМ, скорее всего влияющих на рост заболеваемости, является возраст старше 65 лет (рис. 2). Средний возраст большинства пациентов (71,6%) на момент постановки диагноза – 69–70 лет [3]. При этом наблюдается 5–10-кратное увеличение заболеваемости среди пациентов старше 70 лет по сравнению с пациентами в возрасте до 60 лет.
Увеличение риска развития КМ связывают с длительным пребыванием на солнце, воздействием ультрафиолетовых лучей. Подтверждение тому – частая локализация КМ на открытых, наиболее подверженных воздействию солнечных лучей участках кожи (голова и шея, конечности).
На увеличение риска развития КМ влияет и состояние иммуносупрессии. Так, КМ среди больных СПИДом наблюдается в 2,3 раза чаще, чем в обычной популяции, в пять раз чаще среди пациентов после трансплантации органа. 15,7-кратное увеличение риска КМ имеет место у пациентов с B-клеточными неоплазиями. В 50% случаев возраст таких пациентов менее 50 лет.
Пациенты, которые получают лечение метоксаленом и РUVA (фотохимиотерапия) по поводу псориаза, характеризуются 100-кратным увеличением риска КМ. Известно несколько клинических случаев спонтанной регрессии КМ после нормализации состояния иммунной системы [4, 5]. Кроме того, в литературе описаны случаи спонтанной регрессии опухоли, как правило у лиц женского пола.
В январе 2008 г. Н. Feng и соавт. представили доказательства возможного вирусного онкогенеза. Авторы исследовали образцы опухоли КМ и обнаружили новый полиомавирус, который был назван полиомавирусом клеток Меркеля [6].
После открытия L. Gross в 1953 г. мышиного полиомавируса было высказано предположение, что полиомавирусы способны вызывать развитие рака у человека [7]. Полиомавирусы могли вызывать развитие опухоли у животных, но это не означало их участие в канцерогенезе опухолей человека. Полиомавирусы часто вызывают латентные инфекции без манифестации болезни, но, например, на фоне иммуносупрессии способны провоцировать развитие опухоли.
Как правило, КМ представлена в виде единичного, безболезненного, однородного, неизъязвленного, красно-фиолетового узла. Вместе с тем иногда может наблюдаться изъязвление опухолевого образования, а также мультифокальное распространение заболевания [8].
В 50% случаев КМ локализуется в области головы и шеи, в 40% – на коже конечностей, в 10% – на коже туловища и половых органов [8]. На момент постановки диагноза у 15% пациентов уже имеются метастазы в лимфатических узлах, а у 50–70% пациентов они реализуются в более поздние сроки.
Наиболее часто КМ метастазирует в кожу (28%) и регионарные лимфатические узлы (27%), реже – в печень (13%), легкие (10%), кости (10%), головной мозг (6%) [9].
В литературе описаны редкие локализации метастатического процесса: яичко, сердце, поджелудочная железа, желудок, конъюнктива глаза, радужка, костный мозг [9–12].
КМ относится к опухолям, тактику лечения которых должна определять мультидисциплинарная команда специалистов, состоящая из хирургов, радиотерапевтов и онкологов [13].
Основным вариантом лечения первичной опухоли в отсутствие отдаленного метастазирования считается хирургический. Из-за высокой частоты местных рецидивов рекомендуется делать разрез, отступая 1–3 см от видимых краев опухоли. Традиционно рекомендуется делать отступ 2–3 см в пределах неизмененных тканей. Однако в ряде работ приводится незначительное число местных рецидивов при отступе в пределах 1,1 см [14–16]. Согласно рекомендациям NCCN (National Comprehensive Cancer Network – Национальная всеобщая онкологическая сеть) 2016 г. (version 1. 2016) целесообразно делать отступ в пределах неизмененных тканей на 1–2 см. При наличии метастатического поражения лимфатических узлов выполняется лимфоаденэктомия. В отсутствие клинических и инструментальных данных о метастатическом поражении регионарных лимфатических узлов показано выполнение биопсии сторожевого лимфоузла. Это позволяет выявить микрометастазы в регионарных лимфоузлах у 25% пациентов.
При невозможности выполнения хирургического иссечения опухоли рекомендуется подведение дозы ионизирующего излучения 60–66 Гр. Для создания адекватного дозного распределения используются тканеэквивалентные болюсы. При наличии клинически измененных лимфатических узлов и невозможности выполнения лимфодиссекции целесообразно проведение лучевой терапии на вовлеченный лимфоколлектор в дозе 60–66 Гр.
КМ чувствительна к лучевой терапии. В рекомендациях NCCN лучевая терапия рекомендована в качестве адъювантной терапии для улучшения местного и регионарного контроля роста опухоли. K. Lewis и соавт. описали значительное снижение частоты локорегионарных рецидивов (относительный риск (ОР) 0,27) и отдаленных метастазов (ОР 0,34) при проведении лучевой терапии как на ложе удаленной опухоли, так и на зоны регионарного метастазирования после радикального хирургического лечения.
T. Jouary и соавт. в 2012 г. опубликовали данные многоцентрового исследования о пользе адъювантной лучевой терапии на ложе удаленной опухоли после широкого иссечения и проведении профилактического облучения на зоны лимфооттока у 83 больных КМ I cтадии. При медиане наблюдения 58 месяцев выявлено значительное снижение частоты регионарных рецидивов в группе больных с проведенным профилактическим облучением (n = 39) по сравнению с контрольной группой (n = 44) – 0 и 16,7% соответственно (р = 0,007) [17].
Рекомендуемая доза послеоперационной лучевой терапии – 50–56 Гр с подведением дозы методом классического фракционирования. При наличии опухолевых клеток в краях резекции дозу целесообразно увеличивать до 60–66 Гр. В целях профилактики в отсутствие пораженных лимфатических узлов показано лучевое воздействие на регионарный коллектор в дозе 46–50 Гр. При проведении регионарной лимфодиссекции, наличии значительного числа пораженных лимфатических узлов, экстракапсулярном распространении опухоли доза облучения увеличивается до 50–60 Гр [18].
Рутинное использование адъювантной химиотерапии не рекомендовано. Исследования, посвященные адъювантной химиотерапии, показали увеличение количества осложнений, а также летальности, обусловленной лечением, без преимуществ в выживаемости [19].
Адъювантная химиотерапия может быть использована только у пациентов с факторами высокого риска прогрессирования заболевания: молодой возраст, состояние иммуносупрессии, метастазы в регионарных лимфатических узлах.
Режимы химиотерапии предусматривают использование препаратов платины (цисплатин или карбоплатин) и этопозида. Одновременная химиолучевая терапия может применяться в адъювантном режиме, но статистически значимых преимуществ в выживаемости при ее использовании не получено. При этом наиболее частым осложнением одновременной химиолучевой терапии являются кожные реакции – 60% и нейтропения – 40% [20–22].
Лечение метастатической болезни
Морфологическая картина КМ схожа с таковой при мелкоклеточном раке легкого (МРЛ). Не случайно в лекарственном лечении этой болезни используются схемы, применяемые при МРЛ. Это режимы с включением антрациклинов, антиметаболитов, циклофосфамида, этопозида и производных платины. Использование данных схем часто сопряжено с высокой токсичностью. Ремиссии непродолжительны, что не приводит к значительному увеличению выживаемости. Поэтому химиотерапия часто используется в качестве паллиативной терапии у пациентов с метастатической болезнью. Из-за высокой степени токсичности большинства препаратов назначение химиотерапии должно рассматриваться в каждом случае индивидуально (особенно у пожилых пациентов).
Предпринимаются попытки использования других лекарственных препаратов. Проводилось исследование II фазы по оценке клинической эффективности иматиниба при распространенной КМ (Southwest Oncology Group Study, 2009), но набор пациентов был прекращен из-за отсутствия эффекта [23]. Вероятно, отсутствие эффективности иматиниба было обусловлено некорректным набором пациентов в исследование. На примере гастроинтестинальных стромальных опухолей показано, что иматиниб работает при наличии в опухоли мутации в гене KIT, которая не была определена в рамках данного исследования.
В литературе описаны единичные случаи успешного применения пазопаниба (Вотриент – мультитаргетный киназный ингибитор) при КМ [24]. Эффективность других таргетных препаратов при КМ, в том числе препаратов, зарегистрированных для лечения низкодифференцированных нейроэндокринных опухолей, в настоящее время изучается (в основном I–II фазы исследований) (таблица).
При местно-распространенной или метастатической стадии КМ для уменьшения размеров образования или симптомов болезни успешно применяется лучевая терапия. Если выполнение хирургического иссечения опухоли не представляется возможным, рекомендуется подведение дозы ионизирующего излучения 60–66 Гр. С паллиативной целью лучевую терапию проводят разовой дозой 3 Гр 10–12 фракций.
По данным литературы, химиотерапия, молекулярно-таргетные препараты не показали высокой эффективности в терапии метастатической болезни. Назрела необходимость создания реестра больных КМ, а также проведения многоцентровых клинических исследований по лечению этого редкого заболевания.
С учетом орфанности заболевания выполнение масштабных клинических исследований затруднено. Не случайно в литературе часто встречаются описание клинических случаев, ретроспективные анализы баз данных или результаты небольших по численности клинических исследований.
Рассмотрим результаты клинического наблюдения за пациенткой К. 76 лет с третьим рецидивом КМ, которая была успешно излечена с использованием химиолучевой терапии.
В 2011 г. пациентка впервые отметила появление на коже правой щеки образование по типу атеромы, которое лечила самостоятельно антибактериальными мазями. Имел место быстрый рост образования – в течение четырех месяцев более чем в 7–10 раз. После обращения к хирургу в июне 2011 г. выполнено иссечение образования. Заключение гистологического исследования: карцинома Меркеля. В декабре 2011 г. появилось образование в проекции послеоперационного рубца. Больная обратилась к врачу. В связи с небольшими размерами уплотнения рекомендовано наблюдение. После увеличения размеров образования в июне 2012 г. выполнено его иссечение. В ноябре 2012 г. – повторное иссечение рецидива. В декабре 2012 г. появилось уплотнение в околоушной области справа. Пациентка обратилась в РОНЦ им. Н.Н. Блохина. После цитологического исследования пунктата из околоушной области справа сделано заключение: рак из клеток Меркеля. При выполнении иммуногистохимического исследования выявлена экспрессия СК20, хромогранина А, Ki67 – 40%, SSTR 2+, MCPyV 1+, р53 2+.
Учитывая рецидивирующее течение опухоли, короткие периоды ремиссии, локализацию опухоли (околоушная слюнная железа), возраст больной, низкую степень дифференцировки опухоли, специалисты по итогам мультидисциплинарного консилиума рекомендовали проведение химиолучевого лечения с индукционной химиотерапией. С 30 января по 31 мая 2013 г. больной К. выполнено шесть курсов полихимиотерапии по схеме: этопозид 100 мг/м 2 с первого по третий день внутривенно, карбоплатин AUC 5 внутривенно в первый день.
С 17 апреля по 13 июня 2013 г. пациентке проведен курс 3D-конформной дистанционной лучевой терапии. Предлучевая подготовка включала разметку зоны интереса на компьютерном томографе и 3D-планирование лучевой терапии в планирующей системе Eclipse. Лучевая терапия проводилась на аппарате Clinac 2300 C/D на мягкие ткани правой щеки ежедневно, пять раз в неделю, с использованием фотонов энергией 6 MeV, разовая очаговая доза (РОД) – 2,5 Гр, суммарная очаговая доза (СОД) – 50 Гр (55 иГр), на шейно-надподключичную зону справа ежедневно, пять раз в неделю, энергия фотонов – 6 MeV, РОД – 2,5 Гр, СОД – 40 Гр (45 иГр).
Для достижения однородности дозы ионизирующего излучения и ее увеличения в коже и мягких тканях правой щеки использовали тканеэквивалентный болюс.
Лечение пациентка перенесла удовлетворительно. Лучевые реакции: мукозит слизистой оболочки полости рта 2-й степени по шкале RTOG/EORTC; гиперемия кожи зон облучения 1-й степени по шкале RTOG/EORTC [25]. При обследовании через месяц терапии у пациентки достигнут полный регресс опухоли. Очередное контрольное обследование выполнено в марте 2016 г. (33 месяца после завершения лечения). Признаков прогрессирования болезни не зафиксировано.
Перспективы. Иммуноонкологическая терапия
Наилучшие результаты были получены при использовании иммуноонкологической терапии (анти-PD1 и анти-PD-L1). В 2015 г. появились первые данные об успешном использовании анти-PD1-препарата (пембролизумаб) в рамках многоцентрового исследования II фазы. Эти результаты были дополнены и обновлены в 2016 г. [26].
В исследование было включено 26 пациентов с метастатической или местно-распространенной неоперабельной КМ, которые ранее не получали системной терапии. Пембролизумаб вводили в дозе 2 мг/кг каждые три недели внутривенно. Частота объективного ответа среди 25 пациентов, прошедших по крайней мере одно контрольное обследование на фоне терапии, составила 56% (95%-ный доверительный интервал (ДИ) 35–76) (у четырех пациентов достигнут полный ответ, у десяти – частичный). При медиане наблюдения 33 недели (7–53) рецидивы наблюдались у двух (14%) пациентов из 14 с ответом на терапию. Продолжительность ответа варьировалась от 2,2 до 9,7 месяца. Показатель выживаемости без прогрессирования в течение шести месяцев составил 67% (95% ДИ 49–86). Из 26 пациентов 17 (65%) имели полиомавирус-позитивный статус опухоли. Частота объективного ответа среди пациентов с полиомавирус-позитивным статусом опухоли составила 62% (десять из 16 пациентов) и 44% среди пациентов с полиомавирус-негативным статусом опухоли (четверо из девяти). Нежелательные явления 3–4-й степени наблюдались у 15% пациентов. Таким образом, авторы сделали вывод о возможности использования пембролизумаба в качестве терапии первой линии у пациентов с метастатической или местно-распространенной неоперабельной опухолью.
На ASCO 2016 г. также были представлены обновленные результаты изучения анти-PD-L1-препарата (авелумаб) в качестве терапии второй и последующей линий после прогрессирования заболевания на фоне предшествующей стандартной химиотерапии [27]. Внутривенные инфузии авелумаба в дозе 10 мг/кг вводили каждые две недели. Из 88 пациентов, включенных в исследование, 40% получили две и более предшествующие линии химиотерапии (26 пациентов – две линии, десять – три и более). Частота объективного ответа достигла 31,8% (у восьми (9,1%) пациентов полный ответ, у 20 (22,7%) – частичный). Медиана продолжительности ответа не достигнута (95% ДИ 8,3 месяца – оценить невозможно). При этом у 23 (82,1%) из 28 пациентов сохранялся ответ на фоне терапии на момент проведения анализа. Медиана времени до ответа – шесть недель. Показатель выживаемости без прогрессирования в течение шести месяцев составил 40% (95% ДИ 29–50), общей выживаемости – 69% (95% ДИ 58–78). Исследователи пришли к заключению, что авелумаб эффективен у пациентов неблагоприятной группы – рефрактерной к стандартной химиотерапии.
К сожалению, на сегодняшний день анти-PD-1- и анти-PD-L1-препараты не зарегистрированы в России. Впервые в нашей стране планируется проведение на базе нашего центра (отделение биотерапии) клинического исследования препарата авелумаб у пациентов с метастатической или местно-распространенной неоперабельной КМ.
Читайте также:
 Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.
Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.