Вирус опухоли молочной железы мышей
РАКА МОЛОЧНЫХ ЖЕЛЕЗ ВИРУСЫ (син.: вирус Биттнера, фактор молока) — группа вирусов сем. Retroviridae, возбудителей рака молочных желез мышей. Первый из них был открыт в 1936 г. амер. исследователем Дж. Биттнером, к-рый обнаружил, что рак молочных желез мышей может передаваться потомству через молоко матери, содержащее особый фактор.
Вирусы рака молочных желез мышей составляют группу антигенно родственных, морфологически идентичных вирусов, относящихся к онковирусам типа В и обладающих различной онкогенной активностью. Диаметр вириона 80—120 нм. Электронно-оптически плотный асимметрично расположенный нуклеоид вириона размером ок. 50 нм, окружен одинарной мембраной. Вирусы рака молочных желез мышей содержат 30% липидов, 2% РНК и 68% белка, инактивируются при нагревании до £° 65—66° в течение 30 мин., нечувствительны к воздействию больших доз рентгеновского излучения и могут длительное время (до нескольких лет) сохраняться при замораживании до —79°, лиофилизации и в 50% нейтральном глицерине.
Подобно другим ретровирусам (см.), вирусы рака молочных желез мышей содержат одноцепочечную РНК с мол. весом (массой) ок. 10 млн. дальтон и обратную транскриптазу (ревертазу). Помимо белка этого фермента, в составе вирионов различают 5 основных белков, два из к-рых являются гликопротеидами с мол. весом 52 000 и 34 000 дальтон, а три — негликозилированными белками (28 000, 18 000 и 12 000 дальтон).

Вирионы этих вирусов в большом количестве всегда присутствуют во всех раковых опухолях молочных желез (рис., а, б), в нормальной ткани молочной железы и в молоке мышей, в т. ч. и при первой беременности молодых самок тех линий, для к-рых характерна высокая частота развития опухолей молочных желез. Вирусы проявляют инф. свойства при введении новорожденным мышам; их можно титровать по способности вызывать опухоли молочных желез. Удовлетворительные методы титрования вирусов в культуре клеток не разработаны.
Вначале было показано, что исходный штамм вируса Биттнера содержит две разновидности — S и L. Причем штамм S вызывает опухоли у самок вскоре после родов и передается только через молоко матери и лишь у тех мышей, к-рые несут специфический аллель — MSe. Другой штамм вируса — L, напротив, не передается через молоко, однако одинаково хорошо распространяется со сперматозоидами и яйцеклетками. Этот вирус обладает менее выраженными бластомогенными свойствами, чем штамм S.
Впоследствии от нескольких линий мышей был выделен третий тип вируса — Р, к-рый аналогично штамму S был высокоонкогенен и передавался как с молоком, так и со сперматозоидами и яйцеклетками. Обработка мышей, считавшихся свободными от вирусов рака молочных желез, различными химическими и физическими онкогенами, а также гормонами приводит к продукции высокоонкогенного вируса, отношение к-рого к штаммам S, L и Р окончательно не установлено.
Общепризнанно, что практически нет ни одной линии мышей, не содержащей генетической информации ретровируса типа В. Передача эндогенного вируса ' у мышей различных линий осуществляется посредством неотделимого от генетического материала половых клеток ДНК-провируса, т. е. вирусных генов, находящихся в составе хромосомной клеточной ДНК. Выявлены доминантные клеточные гены, контролирующие чувствительность к онкогенному действию вируса. У мышей с высоким уровнем возникновения спонтанных опухолей молочных желез вирусы рака молочных желез передаются через молоко (экзогенная горизонтальная передача). Этот инф. вирус, вызывающий раннее развитие рака молочной железы у мышей первого поколения, отсутствует в молоке безвирусных мышей с низким уровнем возникновения спонтанных опухолей молочной железы. Вместе с тем в ДНК клеток нормальной молочной железы этих линий животных, а также в геноме клеток других паренхиматозных органов (придатки яичка, почки, вилочковая железа) содержатся ДНК-провирусные последовательности (провирус инфекционного вируса рака молочных желез мышей), к-рые передаются вертикально половыми клетками (эндогенная вертикальная передача). Эндогенные ДНК-провирусные последовательности ассоциированы с 3 независимыми парами хромосом мышей. Так, хромосома 4 содержит 2 копии ДНК вируса. Вероятно, 4 копии ДНК-провирусных последовательностей локализованы в хромосомах 15 и 17. В процессе индукции опухолей молочной железы онкогенами или гормонами постоянный уровень экспрессии (функционирования вирусных генов) эндогенного провируса резко увеличивается, и опухолевые клетки уже содержат в 30—50 раз большую концентрацию вирусных РНК.
Т. о., возможно, что онкогенное действие гормонов и хим. онкогенов опосредовано изменением экспрессии эндогенных вирусов рака молочных желез мышей, и, вероятно, вирусы, онкогены и гормоны являются коканцерогенными факторами (совместно ускоряющими) малигнизации клеток паренхимы молочной железы. Продукция инф. частиц вирусов происходит только в клетках молочной железы или опухолей этого органа. различия в чувствительности мышей к экзогенным вирусам не связаны с организацией и экспрессией генов эндогенных вирусов.
Различные линии мышей являются носителями специфичных для каждой из них типов вирусов рака молочных желез, к-рые отличаются по биол, характеристикам: по кругу хозяев, вирулентности, способу передачи, морфологии вызываемых ими опухолей и др. Вирусы рака молочных желез крыс, кошек и собак изучены мало. С раком молочных желез у крыс и кошек ассоциируют ретровирусы типа С, а у собак вирусные частицы обнаруживаются крайне редко. Большое внимание уделяют раку молочных желез обезьян в связи с выделением из спонтанно возникшей опухоли у макаки резуса ретровируса Мейсона—Пфайзера, отнесенного впоследствии к вирусам типа Б.
Предполагают наличие и у человека вируса, аналогичного или родственного вирусам рака молочных желез мышей. Эти предположения основаны на обнаружении в ультратонких срезах клеток раковой опухоли молочных желез человека, а также в клетках эпителия вирусных частиц, в нек-рых случаях морфологически неотличимых от вирусов рака молочных желез мышей. В клетках рака молочных желез человека обнаружены основные компоненты ретровирусов, а в нек-рых случаях и вирионы. С помощью иммунол. методов были получены данные, свидетельствующие о возможном наличии у человека белков, близко-родственных или даже идентичных основным белкам вирусов рака молочных желез мышей.
Механизм онкогенного действия вирусов рака молочных желез мышей чрезвычайно сложен и окончательно не выяснен. Генетические факторы влияют на гормональный баланс, репродукцию вируса, его передачу и восприимчивость клеток. Бластомогенная активность вирусов зависит от дополнительных факторов: диеты, численности популяции мышей, температуры среды и др. Для малигнизации клеток вирусами необходима постоянная стимуляция их пролиферации и дифференцировки маммотропными гормонами; в то же время длительная обработка этими гормонами приводит к малигнизации клеток паренхимы молочной железы, содержащих в ДНК гены эндогенных и экзогенных типов вируса рака молочных желез мышей.
Библиогр.: Городи лова В. В. Специфический антиген рака молочных желез и его значение в этиологии данной опухоли, М., 1961, библиогр.; Крюкова И. Н. О возможной ассоциации онковирусов, родственных онковирусам типа В мышей, с карциномами молочных желез человека, Эксперим. онкол., т. 2, № 4, с. 13, 1980; Gross L. Oncogenic viruses, Oxford а. о., 1970.
Ретровирусы - оболочечные, сферические вирусы, которые выходят почкованием через клеточную мембрану хозяина. Они имеют приблизительно 100 нм в диаметре. Геном состоит из двух идентичных линейных односпиральных молекул РНК. Икосаэдральный нуклеокапсид содержит спиральный рибонуклеопротеид и окружен оболочкой состоящей из гликопротеидов и липидов.
Характерная особенность ретровирусов - присутствие в вирионе необычного фермента - РНК зависимой ДНК полимеразы или обратной транскриптазы(отсюда имя retro, означающее обратно). В отличие от классической транскрипции генетической информации от ДНК на РНК, фермент обратная транскриптаза готовит ДНК-копию РНК-генома ретровируса - первоначально РНК-ДНК гибрид, а затем его двухспиральную ДНК-форму. Двухспиральная ДНК-форма ретровирусного генома, называемая провирусом, интегрирует в ДНК инфицированной клетки-хозяина. Именно от провируса транслируются все ретровирусные белки. Заражение онкогенным ретровирусом не ведет к цитолизу или гибели инфицированных клеток, но провирус остается интегрированным в ДНК клетки-хозяина до конца жизни клетки и воспроизводится вместе с клеточным геномом при размножении клеток.
В то время как все онкогенные РНК-содержащие вирусы принадлежат семейству Retroviridae, не все ретровирусы онкогенны. Семейство Retroviridae классифицируется на три подсемейства.
1. Oncovirinaeвключает все онкогенные РНК содержащие вирусы (прежде называемое онкорнавирус).
Ретровирусы широко распространены; их находят почти у всех позвоночных, включая животных, птиц и рептилий. Основываясь на круге хозяев и типах вызываемых болезней, онкогенные Ретровирусы можно разделить на следующие группы:
1. Вирусы лейкозно-саркоматозного комплекса птиц. Группа антигенно родственных вирусов, которые вызывают Avian лейкозы (вирусы лимфоматоза, миелобластоза и эритробластоза) или саркому у домашних птиц (вирус саркомы Рауса, ВСР).
2. Вирусы мышиных лейкозов. Эта группа состоит из нескольких штаммов вирусов мышиной лейкемии и вирусов саркомы, названных по имени исследователи впервые описавших их (например Гросс, Френд, Молони, Раушер).
4. Вирусы лейкозов и сарком других животных.Большое количество вирусов было выделено из лейкозов и сарком различных видов животных - кошек, хомяков, крыс, морских свинок и обезьян.
Видовая специфичность. Ретровирусы обычно поражают только один вид хозяина, специфика обусловлена главным образом присутствием вирусных рецепторов на поверхности клетки-хозяина. В зависимости от их способности расти в клетках другого вида, ретровирусы делятся на 1) экотропные (размножаются только в клетках естественного хозяина); 2) амфитропные (размножаются в клетках естественного и чужих видов); и 3) ксенотропные (размножаются только в клетках чужих видов, но не в клетках естественных хозяев).
Резистентность. Ретровирусы неустойчивы, инактивируются при 56 о С в течение 30 минут, слабыми кислотами, эфиром и формалином. Они устойчивы при – 30 о С
Морфология.Ретровирусы существуют в виде четырех морфологических типов. Частицы типа А существуют только внутри клеток. Они имеют 60-90 нм в диаметре и содержат кольцевидный нуклеоид, окруженный мембраной. Они могут являться формой предшественника других типов. Типы B, C и D являются внеклеточными. Диаметр В частицы – 100-130 nm, с эксцентрическим нуклеоидом и несут поверхностные шипики. Частицы С типа имеют центральный нуклеоид и гладкую поверхностную мембрану. Частицы D типа еще не охарактеризованы. Они имеют эксцентрический нуклеоид и несут короткие поверхностные шипики.
Большинство ретровирусов – частицы С типа. Вирус рака молочных железы мыши - частица типа B, а вирус рака молочной железы обезьян Мэзон-Пфайзера - частица типа D.
Антигены.Имеется два типа антигенов – типоспецифические гликопротеидные антигены, расположенные на оболочке, и группо-специфические нуклеопротеидные антигены, расположенные в ядре вириона. Перекрестные реакции между поверхностными антигенами ретровирусов от различных видов хозяев не наблюдаются.
Геномная структура.Ретровирусы имеют относительно простую геномную структуру.
Провирус стандартного ретровируса (такого как недефектный вирус лейкоза птиц или мышей) состоит из трех генов, требуемых для вирусной репликации - gag, pol, и env. Ген gag кодирует белки нуклеокапсида, которые являются группоспецифическими антигенами, ген polкодирует РНК-зависимую ДНК-полимеразу, ген envкодирует гликопротеиды оболочки. С обоих концов провируса имеется длинный концевой повтор (LTR), непосредственно связывающийся с ДНК клетки-хозяина. LTR-участки обеспечивают контроль регуляции функции генов провируса.
Некоторые ретровирусы (трансрегулирующие вирусы) типа HTLV или HIV несут четвертый ген tat после envгена. Это – трансактивирующий ген, который регулирует функцию вирусных генов.

Авторы: Беатрис G-T Pogo, Джеймс F Холланд, Пол H Ливайн
Отдел гематологии/медицинской онкологии, Tisch института рака, Mount Sinai School of Medicine, New York, NY 10029, США, 2010
Авторы обнаружили, что ретровирусных последовательностей с 85% до 95% гомологии к mouse mammary tumor virus присутствовали в 40% спорадических случаев рака молочной железы американских женщин. Эти последовательности были обнаружены в нормальных грудей или других опухолей. Целый провирусной структура была обнаружена в 2-х опухолей. Клетки рака молочной железы в культуре было показано, содержат и пролил betaretroviral частиц. Этот вирус был места человека вирус опухоли молочной железы среди образцов, представленных на). Авторы исследовали наличие среди образцов, представленных последовательностей в различных грудь условий и географического местоположения. Здесь они сообщают, что воспалительный рак молочной железы от американских женщин показывает высокий уровень заболеваемости вирусными последовательностями (71%), чем в спорадических форм рака молочной железы. Подобных случаев было обнаружено в воспалительный рак груди-из Туниса, и во время беременности рака груди. Потому что эти условия представляют собой высоко инвазивных злокачественных новообразований, делается вывод, что среди образцов, представленных иногда ассоциируется с особенно злокачественного фенотипа.

Mouse mammary tumor virus ( MMTV ) молока путем ретровирус как HTL вирусы, Привет вирусы, и BLV . Он принадлежит к роду Betaretrovirus . MMTV ранее был известен как Биттнер вирус и ранее в "молоко фактор", ссылаясь на экстра-хромосомных вертикальной передачи мышиные рак молочной железы по приемным кормящих, продемонстрировали в 1936 году, Джон Джозеф Биттнер работая в Джексон Лаборатории в бар-Харборе, штат Мэн. Биттнер создана теория о том, что раковая агента, или "молоко фактор", может быть передан раковых матерей молодых мышей от вируса в молоко матери. [1] [2] Большинство опухолей молочной железы у мышей, вызванные mouse mammary tumor virus.

ЛУЧШИЕ ИССЛЕДОВАНИЯ СМОТРИТЕ В СПРАВОЧНИКЕ
Подпишитесь на НОВОСТИ и получайте эксклюзивную информацию о самых последних исследованиях по противостоянию раку. Информация доступна только подписчикам.

ЕЩЕ ИНТЕРЕСНЫЕ НОВОСТИ ПО ТЕМЕ






| Вирус опухоли молочной железы мыши | |
|---|---|
| классификация Вирус | |
| Группа: | |
| Подсемейство: |
содержаниеИнфекция и жизненный циклНесколько штаммов мыши являются носителями вируса эндогенно, но оно также передается вертикально через молоко от матери к щенку. Он содержится в ДНК провируса , интегрированном в ДНК молока лимфоцитов . Вирусы становятся транспортироваться через желудочно - кишечный тракт к пейеровым бляшек , где они заражают новый хозяин макрофаги , а затем лимфоциты. Вирус опухоли молочной железы мышей (MMTV) ранее был классифицирован как простой ретровирус ; Однако, недавно было установлено, что MMTV кодирует дополнительный саморегулируемой мРНК экспорта белка, Rem, с подобием к вирусу иммунодефицита человека ВИЧ - Rev белка, и , следовательно, первый комплекс мышиный ретровирус быть документированы. MMTV коды для ретровирусных структурных генов и дополнительно для суперантигена . Это стимулирует Т - лимфоциты с определенным типом V бета - цепи в их Т - клеточного рецептора , который в свою очередь стимулирует В - клеток пролиферацию , увеличивая популяцию клеток , которые могут быть заражены. В периоде полового созревания, вирус проникает в молочных железах с миграцией лимфоцитов и заражает пролиферирующий эпителиальные клетки молочных желез. Когда геном вируса вставлен в геном хозяина он тогда в состоянии расшифровывать свои собственные вирусные гены. В FU Ройсс и JM Coffin (2000) эксперименты упоминаются , что экспрессия генома вируса активируется энхансер элемент , который присутствует в U3 области длинного концевого повтора генома. Кроме того, экспрессия генома активируется специфический в клетках молочной железы. Эстроген может дополнительно активировать экспрессию вирусного генома. Экспрессия потеков гена , который присутствует в провирусе несет ответственность за производство суперантигена. ВОМЖЙ может быть переданы или через экзогенный или эндогенный маршрут. Если вирус передается экзогенно, он передается от матери мыши к ее щенкам через ее молоко. С другой стороны , щенки могут быть заражены вертикально через эндогенную инфекцию, наследуя вирус непосредственно от их матери в зародышевом. Мыши , которые заражаются таким образом , имеют более высокий уровень возникновения опухолей. Ретровирус является эндогенным для хозяина , как только провирусная ДНК вставляется в хромосомной ДНК. В результате, у мышей с эндогенными MMTV имеют Вирус размножается в каждой клетке своего тела, так как вирус присутствует в ДНК спермы или яйцеклетки , из которых мыслится животное. Гормональная отзывчивость интегрированной ДНК MMTVЭндогенный ВОМЖМ реагирует на целый ряд гормонов , которые регулируют нормальное развитие молочных желез и лактацию, реакция была продемонстрирована стероидных гормонов ( андрогенов , глюкокортикоидов и прогестины ), а также пролактина . Когда мышь достигает половой зрелости, вирус начинает выражать свою матричную РНК в эстрогена чувствительных тканей. В результате, после полового созревания всех грудных клетки будут содержать активный ретровирус и начинают размножаться в геноме и выразить вирусный РНК во всех новых клетках ткани молочной железы. Промотор MMTV в моделях рака молочной железы человекаДКП ( длинный концевой повтор ) из MMTV содержит глюкокортикоиды элемента ответа гормона . Этот глюкокортикоид элемент представляет собой промотор , который часто используется для создания мышей , которые развивают рак, как заболевание молочной железы, так как животная модель системы для рака молочной железы , близкой к человеческой болезни очень искал. Промотор MMTV используется в модельной системе PyMT из мышиных моделей метастазов рака молочной железы . Здесь Py это аббревиатура полиомы и MT является сокращением среднего Т. Есть еще модель системы рака молочной железы , которые используют промотор MMTV. Полиомы средний Т-антиген взят из вируса полиомы . Модель MMTV-PyMT было показано, что надежная модель метастаз рака молочной железы. При раке молочной железы человека полиома среднего Т- антиген не был найден.
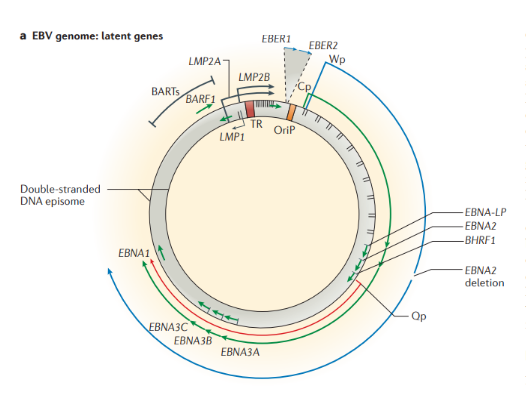
Инфекция, вызванная онкогенными вирусами, является причиной 15,4% заболеваний раком по всей земле. Первый онкогенный вирус, который был идентифицирован — это куриный вирус саркомы Рауса в 1911 году. Десятилетиями позже были обнаружены серии других онкогенных вирусов, в том числе вирус папилломы Шопа (вирус папилломы кроличьего хвоста), вирус опухоли молочной железы мыши, аденовирус, вирус SV40 (обезьяний вирус sv40). Теория опосредованного вирусом онкогенеза в итоге была экспериментально продемонстрирована в 1976 году Гарольдом Вармусом и Майклом Бишопом путем превращения инфицированных клеток в опухолевые вирусом саркомы (ген v-src вызывает образование опухоли после захвата протоонкогена человеческой клетки в результате трансдукции). Несмотря на то, что онкогенные вирусы нашли в исследованиях онкогенной активности животных клеток, они были не в состоянии преобразовать человеческие клетки. Теория вирусного онкогенеза в человеческой клетке оставалась спорной до 1965 года, когда вирус Эпштейн-Барр (EBV) был обнаружен в клетках лимфомы Беркитта. В ходе последующих исследований, в том числе выделении Т-лимфотропного вируса человека (HTLV) из клеток Т-клеточной лимфомы и выявлении роли папилломовирусов человека с высокой онкогенной активностью в развитии рака шейки матки, был определен путь для понятия человеческих онкогенных вирусов. Обнаружение связи между герпес-вирусом и саркомой Капоши (KSHV) и лимфомой и между полиомавирусом клеток Меркеля (MCV) и карциномой клеток Меркеля (MCC) подчеркнуло возможность открытия еще большего количества онкогенных вирусов с помощью современных технологий. Далее каждый вирус будет рассмотрен отдельно. Вирус Эпштейн-Барр Вирус Эпштейн-Барр (ВЭБ, EBV) — ДНК-содержащий вирус, который преимущественно поражает B-лимфоциты, также является митогеном для них; вызывает лимфопролиферативные болезни (лимфома Беркитта, носоглоточная карцинома, NK-клеточная лейкемия, лимфома Ходжкина и т.д.), а также инфекционный мононуклеоз. Вирионы вируса были обнаружены при электронной микроскопии биоптата лимфомы Беркитта в начале 1964 года Энтони Эпштейном и Ивонной Барр. Строение. ВЭБ имеет вирусный капсидный антиген (VCA), ядерные антигены-EBNAs 1, 2, 3, 3a, 3b, 3c; латентные мембранные протеины (LMPs) 1, 2 и две маленькие Эпштейна-Барр-кодируемые РНК (EBER) молекулы — EBER1 и EBER2. EBNAs и LMPs являются ДНК-связывающими белками, считающимися необходимыми для развития инфекции и фиксации.
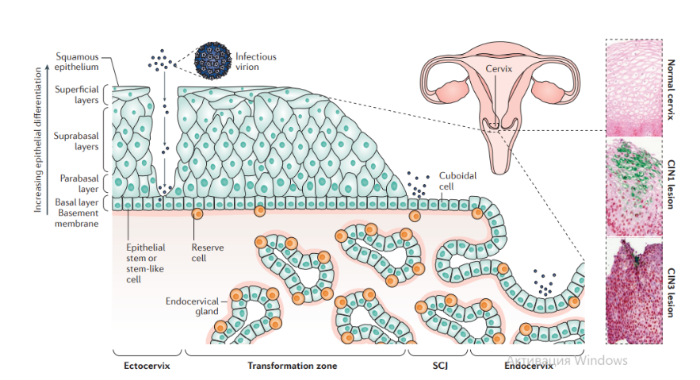
В зависимости от набора экспрессируемых вирусных генов в пораженных клетках выделяют три типа латентности (I, II и III тип), характерные для различных видов лимфом: I тип подразумевает избирательную экспрессию EBNA-1 при ВЭБ-положительной лимфоме Беркитта; II тип заключается в экспрессии EBNA-1, LMP-1 и LMP-2 и является отличительным признаком ВЭБ-положительной ходжкинской лимфомы, периферических T/NK-клеточных лимфом; латентность III типа, характеризуемая экспрессией всего набора из девяти латентных белков ВЭБ, наблюдается при лимфопролиферативных поражениях, возникающих у пациентов с тяжелым иммунодефицитом (после трансплантации паренхиматозных органов или стволовых клеток, ВИЧ-инфекции). Тип латентности определяет восприимчивость инфицированных клеток к различным иммунотерапевтическим тактикам. Индуцированные ВЭБ злокачественные новообразования связаны с экспрессией латентных генов. У большинства иммунокомпетентных носителей ВЭБ вирус не индуцирует опухолевый процесс. Новообразования развиваются при комплексном взаимодействии ВЭБ, иммуногенетических факторов, факторов внешней среды (паразитарных инфекций — чаще, малярии, недоедании, потреблении пищи, содержащей канцерогены) и иммунодефицита (ВИЧ-инфекция, трансплантация). Папилломавирусы человека Описано около 200 папилломавирусов. Вирусы передаются при контактах через микротравмы кожи и слизистых оболочек, а также половым путем. Папилломавирусы человека вызывают доброкачественные кожные, генитальные, оральные и конъюнктивальные папилломы; индуцируют пролиферацию эпителия, обладают онкогенным потенциалом. С папилломавирусом, особенно ПВЧ-5 и ПВЧ-8, тесно связано развитие немеланомных разновидностей рака кожи. Различают низкоонкогенные папилломавирусы, вызывающие бородавки, которые не малигнизируются, и высокоонкогенные, способные вызвать рак шейки матки, — ПВЧ-16, 18, 31, 33, 35, 45, 51, 52, 58. Строение. Капсид икосаэдрический, состоит из двух капсидных белков (L1-L2), формирующих 72 пентамера. Геном — двунитевая циркулярная ДНК; имеет в зависимости от вируса восемь ранних генов (E1-E8) и два поздних гена (L1-L2). Гены E6-E7 обладают онкогенной активностью. Патогенез. В целом, для развития продуктивного поражения ВПЧ (высокого или низкого риска) требуется, чтобы вирус имел доступ к эпителию базального слоя как только эпителиальный барьер был подвержен риску. Папилломавирусы должны инфицировать делящуюся клетку, чтобы стать признанными как малое количество копий ядерной эписомы, и для развития стойкого поражения первичная инфицированная клетка, вероятно, должна быть похожа на долгоживующую эпителиальную стволовую клетку или похожую на нее. Кроме того, связанные с заживлением ран изменения в местном микроокружении, включая увеличение количества факторов роста, могут играть ключевую роль в создании резервуара инфекции в базальном слое. Способность ВПЧ инфицировать, и реплицироваться, и управлять прогрессированием рака зависит от функции вирусного белка, положении в эпителии, где эти белки экспрессируются. Как только инфицированные базальные клетки поделились и в конечном итоге вошли в парабазальный слой, они начинают проходить программу экспрессии генов, которая связана с дифференциацией. Амплификация вирусного генома обычно происходит в срединно-эпителиальных слоях, тогда как сбор и выход вируса происходит вблизи наружной поверхности эпителия. Несмотря на то, что эффективная амплификация генома требует комбинированного действия множественных продуктов вирусного гена, включая E6, E7, E2 и кодированную вирусом геликазы E1, поддержание репликации в базальном слое эпителия может зависеть от факторов репликации клетки хозяина. Программа, зависящая от дифференциации, которая происходит в надбазальных слоях эпителиальной клетки, включает как временные изменения в активности промотора, так и изменения в шаблонах сплайсинга мРНК, которые облегчают производство различных продуктов вирусных генов на разных стадиях во время программы дифференциации. Функция вирусного белка далее регулируется посттрансляционной модификацией, включая фосфорилирование и протеолитическое деление клетки.
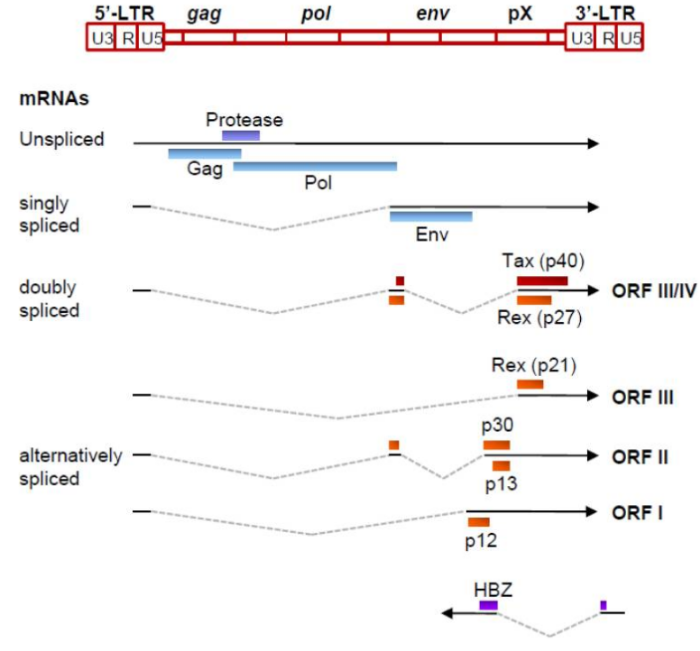
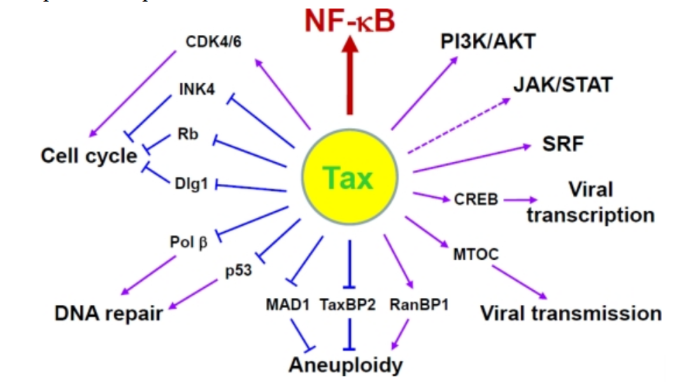
Герпесвирус, ассоциированный с саркомой Капоши KSHV, или человеческий герпесвирус 8, был обнаружен в 1994 году как член семейства гамма-герпеса человека, присоединившись к ВЭБ. Инфекция иммунокомпрометированных индивидуумов с KSHV была связана с развитием саркомы Капоши, полученной из эндотелиальных клеток, и по меньшей мере двумя B-лимфоцит лимфопролиферативными заболеваниями: первичная выпотная лимфома и многоцентричная болезнь Кастлмана. Однако изучение патогенеза и онкогенеза KSHV затруднено отсутствием значимой модели животных и восприимчивой клеточной культуры. Онкогенное действие. Две иммортализованные клеточные линии, KS Y-1 и SLK, когда-то использовались для исследований KS и KSHV, но в KS Y-1 были также обнаружены клетки линии рака мочевого пузыря T 24, что затруднило дальнейшую работу. Первичные эмбриональные метанефрические мезенхимальные клетки-предшественники почек крысы восприимчивы к инфекции и трансформации KSHV, но из них распространяются ограниченное количество инфекционных вирионов. Линии B-клеток, полученные из первичной выпотной лимфомы, обычно заражаются KSHV на латентной стадии и могут быть индуцированы для получения малого количества вирионов KSHV, но первичные B-лимфоциты из периферической крови или тонзиллярной ткани являются устойчивыми к инфекции KSHV, и для их инфицирования может потребоваться совместный рост с KSHV-позитивными клетками. KSHV кодирует несколько важных белков, которые обладают некоторой онкогенной активностью для индуцирования пролиферации клеток, иммортализации, трансформации и передачи сигналов; производства цитокинов; иммунного контроля; антиапоптозной активности; и ангиогенеза. К ним относятся вирусные латентные белки, латентный ассоциированный ядерный антиген (LANA), vFLIP (FADD (Fas-ассоциированный белок с доменом смерти), подобный ферменту, ингибирующему синтез интерферона или ингибирующему белок каспазы 8 (FLICE)), vCyclin и вирусные литические белки G-белкового рецептора (vGPCR), интерферон-регуляторный фактор 1 (vIRF-1) и K1. Хотя истинную онкогенную природу каждого белка еще предстоит определить, накопление доказательств указывает на то, что каждый из них вносит свой вклад в онкогенез KSHV. Таким образом, полный спектр вызванной KSHV злокачественности может потребовать, чтобы несколько онкогенных продуктов работали вместе в присутствии клеток хозяев и экологических факторов. Например, как LANA, так и vIRF-1 нацелены на клеточный опухолевый супрессор p53. LANA также ингибирует pRB и PP2A.vCyclin, активатор CDK4 6,198, подавляет p27kip1, ингибитор CDK199 и вызывает реакцию на задержку старения G1, результаты от гиперактивации NF-κB. vFLIP и K1 активируют путь сигнала NF-κB для предотвращения апоптоза B-клеток. vGPCR и K1 влияют на сигнальные пути AKT и NF-κB и способствуют ангиопролиферативному и воспалительному поражению саркомой Капоши. Т-лимфотропный вирус человека (HTLV) T-лимфотропный вирус человека (HTLV) относится к семейству ретровирусов, является возбудителем T-клеточного лимфолейкоза взрослых. Вирус впервые был изолирован в 1980 году от больного Т-лимфомой. Геном. Gag, Pol и Env являются вирусными структурными белками, другие — вирусными регуляторными/вспомогательными белками. За исключением гена hbz, который кодируется минус-цепью провирусного генома HTLV из 3'-LTR, все остальные гены кодируются плюсовой нитью по направлению 5'-LTR. Следует отметить, что 5'-LTR часто удаляется или метилируется по мере прогрессирования заболевания. Кроме того, на поздних стадиях лейкемиогенеза в гене tax часто возникают нонсенс- или миссенс-мутации. Хотя белок tax и ген HBZ индуцируют опухоли у трансгенных мышей, а p12 проявляет слабую онкогенную активность, ни один из вирусных белков/генов, кроме tax, не требуется для опосредованного HTLV-1 опухолеобразования. Продукт tax гена действует на терминальные повторы LTR, стимулируя синтез вирусной иРНК, а также образование рецепторов IL-2 на поверхности зараженной клетки.
Рисунок 4. К леточные пути вирусного онкобелка tax Патогенез. Проникновение HTLV-1 в клетку человека охарактеризовывает начало выживания и репликации вируса. HTLV-1 связывается с рецептором клеток, имеющих необходимый антиген, что инициирует процесс инвазии. Рецепторный комплекс состоит из транспортера глюкозы (GLUT1), гепаринсульфат протеогликана (HSPG) и рецептора VEGF-165 нейропилина-1 (NRP-1). HTLV-1 взаимодействует с HSPG. Процесс слияния происходит через комбинацию GLUT1 с HSPG/NRP-1, после чего ядро, содержащее вирусную РНК, доставляется в цитоплазму клеток-мишеней. После обратной транскрипции HTLV-1 встраивает свой геном в генома хозяина, чтобы сформировать провирус, окруженный двумя LTR на 5' и 3' концах. Затем провирус транскрибируется и кодирует структурные, регуляторные и вспомогательные белки. Впоследствии вирусные геномные РНК и Gag, Env и Gag-Pol белки переносятся в плазматическую мембрану, чтобы начать собираться в зрелую вирусную частицу. Вирусы гепатита Вирус гепатита В (HBV) и вирус гепатита С (HCV) представляют собой несвязанные вирусы, имеющие тропность к гепатоцитам и реплицирующиеся в них. Около 2 миллиардов человек инфицированы HBV, и более 350 миллионов человек становятся хроническими носителями. Только 5-10% взрослых, которые приобретают инфекцию, становятся хроническими носителями, у 30% развиваются прогрессирующие хронические заболевания печени: гепатит, фиброз, цирроз и, наконец, гепатоцеллюлярная карцинома (HCC). Патогенез. HCC, индуцированная посредством HBV и HCV, развивается в области воспаления и регенерации, что является результатом хронического повреждения печени, а это в свою очередь указывает на то, что патогенез HCC иммунно-опосредован. Эти вирусы постоянно реплицируются в культуре клеток без явных повреждений и смерти клеток, подразумевая, что они являются не цитопатическими. Постоянная репликация вируса является фактором риска для образования HCC, потому что воспаление часто приводит к длительным хроническим заболеваниям печени CLD без выведения вируса. В этом контексте HBV и HCV генерируют белки, подавляющие иммунитет, который должен контролировать хронические инфекции. HBV- и HCV-кодированные белки изменяют экспрессию гена хозяина и клеточный фенотип, что является признаком рака. Эти изменения способствуют независимой от фактора роста пролиферации, сопротивлению к ингибированию роста, инвазии тканей и метастазированию, ангиогенезу, перепрограммированию энергетического метаболизма и устойчивости к апоптозу. Хроническое воспаление также способствует генетической нестабильности в клетках опухоли. Вклад HBV в развитие HCC включает в себя экспрессию гена гепатита Bx (HBx) и, возможно, усеченные пре-S или S-полипептиды карбоксимицина; основной белок и неструктурные (NS) белки NS3 и NS5A HCV способствуют онкогенной трансформации. Изменения в экспрессии гена хозяина, которые способствуют возникновению опухолевого генеза, также, похоже, поддерживают репликацию вируса и/или защиты вирусных гепатоцитов от иммунного опосредованного повреждения и разрушения. Читайте также:
 Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу. Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.
|