Вирус гриппа и экология
К семейству ортомиксовирусов (греч. orthos - правильный, туха - слизь) относятся вирусы гриппа типов А (Вильсона-Смитта), В, С.
Рнк-сод, - нитевой, сферич форма, фрагментиров.
Вирион: имеет нуклеокапсид, суперкапсид. Нуклеокапс представлен РНК, кот сверху закрыт белковыми капсомерами, все заключено в белковую об, белок низкомолекул (М-б). М-б определяет фому вириона, его целостность, в процессе сборки распознает места локализации вирусных белков на мембране кл, отвечает за морфогенез, созревание вириона. Его синтез-на самых поздних этапах репродукции. Если синтез М-б нарушается, то либо абортивный пр, либо персистенция вируса.
Суперкапсид – поверх мембраны, двухслойная липидная оболочка. Имеет субъединицы (гемагглютинин, нейраминидаза). Они содержат не только б, но и УВ. Гемагглютнин представлен тримером, кажд мономер сост из 2 цепей: тяж и легк. В кажд цепи – 2 конца (гидрофобный – СООН и гидрофильный (NH2). Соединяются дисульфидной связью, C-конец тяж цепи связ с N-концом легкой цепи. На N-конце тяж цепи располаг уч-ок, кот принимает участие в связывании с различн р-рами (лигандный участок) = связь с чувствит кл-ами, р-рами, кот сод сиаловую к-ту.. На N-конце легкой цепи есть участок, кот является консервативным (один для всех штаммов и серотипов)=вакцина.+ этот конец несет ф-ю белка слияния.
Гемагглютинин экспонируется на поверхность при кислом знач рН. Ф-ии ГА: рецепторная (закрепление вир на мембр чувствит кл за счет родства к сиаловым стр-рам), слияния, протективная. Нейраминидаза (сиалидаза)=тетрамер, мономер представлен в виде стержня с кубической головкой, кот погружен в лип бислой. Отщепляет N-ацетил нейраминовую к-ту от естественных субстратов (муцины) и от синтетич. Индикация ее основана на обнаружении свободной нейраминовой к-ты, кот отщепляется от субстрата (видим по цветной р-ии).
Ее ф-ция: предотвращает агрегацию вириона, которая наступает в рез-те взаимодействия гемагглютинина с сиалоподобными р-рами клет мембраны. Антиген хозяина ковалентно связыв с ГА и Н=они присутств в вакцина. Клин картина: кор инкуб пер (не более 3 дней), очень выражен токсикоз, пораж дых пути.
Патогенез. В эпит кл-изменения-гибель-фагоциты выделяют большое кол-во БАВ=капилляро-токсикоз (расшир-е сос, стаз, образование мелких тромбов, кровоизлияний, отек, сдвиг рН в кисл сторону) выражен в трахее и бронхах. Токсикоз, повыш t, лихорадка, гол боль, миалгия, вялость, слобость. Обладает нейротропностью=пораж ЦНС (может закончиться шизофренией), иммунодепресивным действием (присоединение бактериальн инф-ии=пневмония).
Иммунитет. Интерферон и натуральные клетки-киллеры.У новорожд есть IgG=восприимчивость вируса как у матери. После утраты IgG-поражается (после 6 мес). Факторы неспецифической резистентности: защита слиз об в дых путях (хорошее покрытие муцином, хорош ф-я мерцательного эпит). Есть ингибиторы, кот препятств феномену гемагглютинации (в крови). Н-р, термостабильн ингибитор(гамма). Также-IgA, IgG. IgG определяются в сыв кров, IgM образуются первично, но долго не циркулируют.
Эпидемиология. Источник больные люди и вирусоносители. Передача воздушно-капельным путем. Грипп относится к эпидемическим инфекциям, которые чаще возникают в зимние и зимне-весенние месяцы. Примерно через каждые десять лет эпидемии гриппа принимают характер пандемий, охватывающих население разных континентов. Это объясняется сменой Н- и N-антигенов вируса типа А, связанного с антигенным дрейфом и шифтом.
Профил капилляро-токсикоза: используют ремантадин, который подавляет репродукцию вируса гриппа типа А. Для пассивной профилактики применяют противогриппозный иммуноглобулин человека, полученный из сыворотки крови доноров, иммунизированных гриппозной вакциной. Определенный эффект оказывает человеческий лейкоцитарный интерферон. Для вакцинопрофилактики используют живые и инактивированные вакцины (интраназально), цельновирусные вакцины (парентерально), сплит-вакцины (сод Н и ГА), ИФ(лучше генно-инженерный) Лечение: ингибиторы нейраминидазы (ингаляц, перорально).Принимать с 1-го дня.
Экспресс-мазки (отпечатки слиз носа) ищем АГ.
Вирусологич метод (культивир-е): амнион, аллантоид заражают опред АГ. Определяют серотип в РСК.
Серологич метод: парные сыворотки (в нач заб-я), РТГА.
Вирусы парагриппа. Характеристика. Экология. Патогенез. Лабораторная диагностика. Иммунитет.
Антропоноз!, аспирационн мех=м, возд-кап путь, аэрозоль крупнодисперсный. Ист=человек.
2 путь: контактно-опосред.
Первичная репликация =реснитчатый эпителий, вирусемии нет. Варианты: бессимптомный, только слиз носа, нос и глотка, захватываются нижележащие отд респират тракта. Является причиной ларинготрахеита.
Инкуб пер=3 дня. Клин картина: ринит, ларингит, сух кашель, осиплость голоса, слабая интоксикация.
НАЛИЧИЕ ЛОЖНОГО КРУПА, Отек слиз гортани-скапливается значит кол-во секрета-рефлекторный спазм-синдром ложного крупа – ДН. Ложному крупу способствует гиперсекреция IgE (адсорбция на тучных клетках-выброс медиатора) +ген предрасположенность к повышенной секреции IgE. РНК-сод, - нитевые, нуклеокапс покрыт матриксным белком, есть суперкапсид с шипами=гликопротеидами (Гемагглютинин, нейраминидаза) В суперкапсиде есть белок слияния=образование многоядерного симпласта=более длит инф пр.
Вакцинопрофилактика не применяется. Парагрипп может служить причиной внутрибольничных инфекций, особенно среди ослабленных детей. Среди острых респираторных заболеваний парагрипп встречается примерно в 10% случаев.
15 декабря 2011
- 1863
- 1,6
- 0
- 1
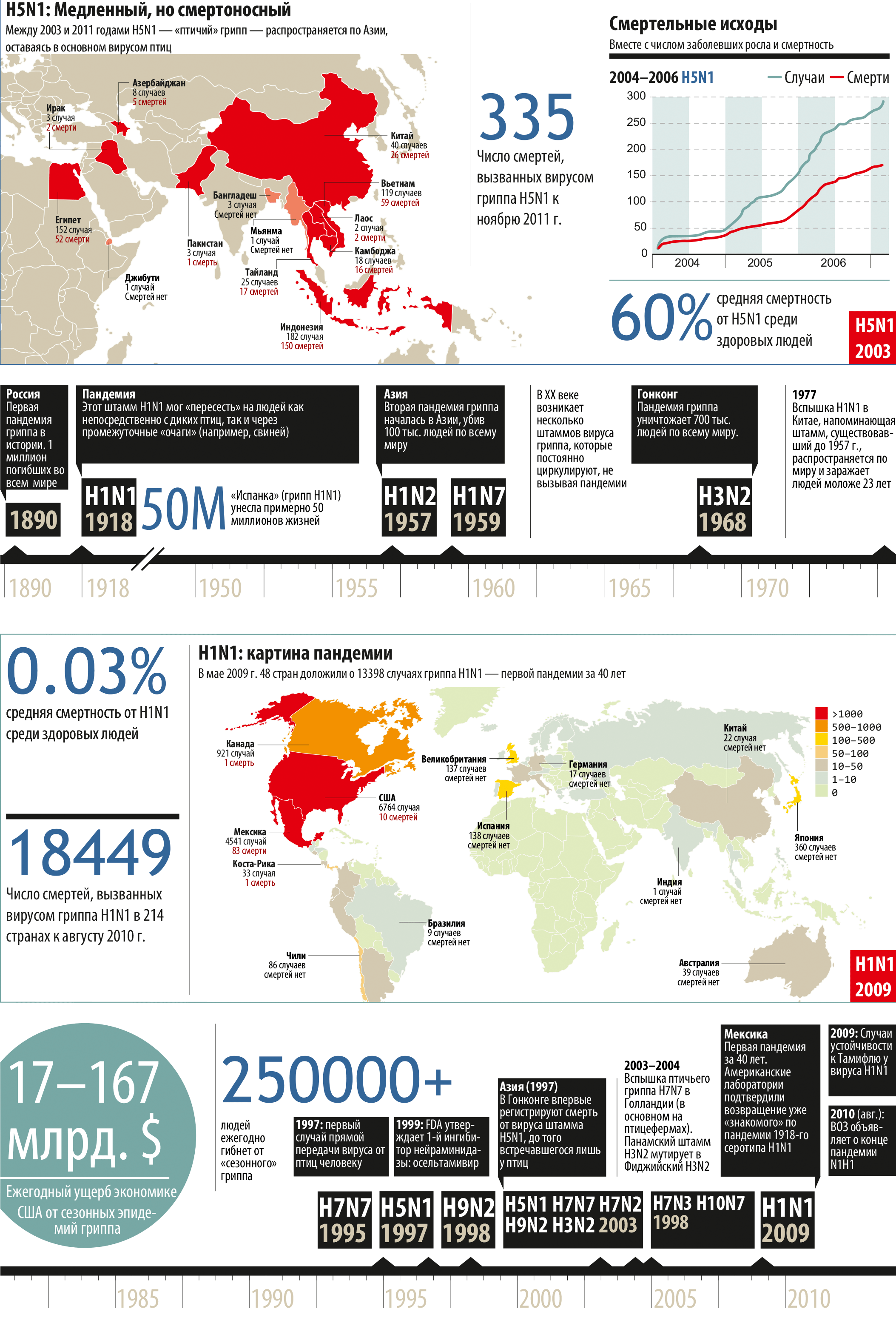
Такие маски в принудительном порядке носили в 1918—1919-х годах, во время крупнейшей пандемии гриппа, по современным подсчетам унесшей до 50 млн. человеческих жизней
Грипп
Среди наиболее трагических событий первой половины XX века — наряду с двумя мировыми войнами — выделяется пандемия гриппа 1918 года, ставшая не менее смертоносной, чем крупнейшие конфликты между людьми: в течение 18 месяцев около 50 млн. людей погибли от вирусной инфекции.
Гонки с гриппом
Ежегодно гриппом переболевает 5–15% всей мировой популяции. Наибольшему риску подвергаются дети до двух лет, пожилые люди от 65, а также больные астмой, диабетом или хроническими заболеваниями сердца вне зависимости от возраста. В то же время от болезни не застрахован никто — как показала пандемия 2009-го, когда больше всего пострадали как раз молодые люди с превосходной иммунной системой [4].
Гриппозный зоопарк
Это эстафета, которую ученые и органы здравоохранения уже так долго и с переменным успехом стараются прервать.
Ловец вирусов

— Что является самым главным в экологии вируса гриппа?
— Что еще мы узнали после встречи с птичьим гриппом?
— Болеют ли дикие птицы — природные носители вируса — гриппом?
— Как грипп передается между дикими птицами?
— Это неизвестно. Один из способов это выяснить — исследование природных очагов гриппа. Яркий пример, который наблюдаем мы с коллегами — залив Делавэр на востоке США. Птицы побережья во время сезонной миграции на север в мае останавливаются там, чтобы покормиться яйцами мечехвостов. По-видимому, в этом месте собирается критическая масса птиц, многие из которых еще не являются носителями гриппа, — что и становится определяющим фактором, позволяющим инфекции быстро распространяться. Есть и другие подобные места — в Австралии, Канаде, в других регионах. Потенциально подходит любое место массового скопления и кормления этой водной братии.
— Сколько разновидностей вируса гриппа циркулирует в природе?
— Над чем вы сейчас работаете?
Это исследование, в высшей степени ориентированное на практику. Используя наши диагностические методы, можно будет оперативно объявлять о появлении новых штаммов вируса и проводить грамотные кампании по вакцинации.

Рисунок 3. Во время пандемии поцелуи возможны только с защитой
— До сих пор птичий вирус гриппа H5N1 был не слишком активен, заражая людей. Какова вероятность, что в будущем эта его способность значительно возрастет?
— Вероятность пандемии вируса H5N1 значительно меньше, чем любого из H1, H2 или H3, потому что H5 далеко не так заразен для людей. Но если назвать вирус, который нам хотелось бы видеть пандемичным меньше всего, это будет как раз H5 из-за высокой смертности, причиной которой он становится. Одна из отличительных черт высокопатогенного вируса — молекулярные особенности строения гемагглютинина, позволяющие развиться системной инфекции, а не инфекции только дыхательных путей, как обычно [2]. Такая опасная способность числится только за вирусами H5 и H7.
У H5N1 было десять лет, чтобы переменить хозяина, а значит, это не одна-две и не три-четыре замены, которые должны произойти в нем, чтобы стать патогеном человека, а значительно больше. Есть примеры, когда для перемены хозяина вирусу требуется не одно десятилетие, несмотря на плотный контакт между видами, однако сейчас понятно хотя бы, что H5N1 не может передаться людям легко. Впрочем, совсем исключить эту вероятность нельзя, и если что-то и мешает нам спать спокойно по ночам, — то это вирус H5.
— Есть несколько вирусов, которые представляют наибольшую угрозу. H5 — один из них, потому что если уж он заразит человека, болезнь будет тяжелой. То же самое касается и H7. Кроме того, есть еще H2, который тоже является патогеном человека. Пандемия H2 была еще в 1957 году, а сам вирус исчез из широкой циркуляции в 1968-м, так что с тех пор подросли многие, не имеющие к нему иммунитета, — а, следовательно, можно ожидать и возвращения этого вируса.
— Что, на ваш взгляд, наиболее удивительно в вирусе гриппа?
— Не устаю удивляться, как мало мы про него знаем, несмотря на то, что так давно и так активно изучаем. Это же сравнительно простые вирусы, — но до сих пор так и не понятно, что позволяет им периодически преодолевать межвидовые барьеры.
Отдел экологии вирусов
Руководитель – академик РАН Д.К.Львов.
Лаборатория экологии вирусов.
Руководитель – кандидат биологических наук И.Т.Федякина.
Лаборатория была создана в 1968 г. по инициативе академика РАН Д.К.Львова, который на протяжении более четырех десятилетий являлся ее бессменным руководителем. С 2010 г. по 2014 г. лабораторию возглавлял ученик и последователь идей академика Д.К.Львова – доктор биологических наук М.Ю.Щелканов. С 2014 г. руководителем лаборатории назначена кандидат биологических наук И.Т.Федякина. Круг научных интересов – изучение противовирусной активности и механизмов действия химиопрепаратов в отношении гриппозной инфекции in vitro и in vivo, вызванной штаммами вируса гриппа А, хранящимися в Государственной коллекции вирусов, и вирусов гриппа птиц и человека, изолированных в лаборатории.
Традиционно основное направление исследований лаборатории – изучение новых и вновь возникающих вирусных инфекций с особым вниманием к агентам с высокой степенью изменчивости генома. Комплексные исследования направлены на изучение эволюции возбудителей. Изучение экологии возбудителей, межпопуляционных взаимодействий между позвоночными хозяевами (включая человека), вирусами, членистоногими переносчиками в разнообразных условиях среды обитания, анализ возникших эпидемических ситуаций – позволяют прогнозировать будущие эпидемические ситуации на территории РФ и сопредельных стран. Использование при этом молекулярно-генетических методов дает возможность определить тенденции в изменении генетических свойств вирусных популяций, создать условия для разработки эффективных диагностических и профилактических препаратов. На основе экологического подхода разработана принципиальная схема циркуляции арбовирусов в разных климатических поясах. Исходя из теоретических предпосылок, проведено обследование территории Северной Евразии на арбовирусы. В результате, изолировано 69 вирусов, 24 из которых зарегистрированы в Международном каталоге в качестве новых для науки. Описаны не известные ранее инфекции – Карельская лихорадка, Иссык-Кульская лихорадка, лихорадки Карши, Тамды, долины Сыр-Дарьи. Разработан прогноз возникновения эпидемических вспышек в различных ландшафтных поясах на территории России. Методами молекулярной экологии проведена генетическая характеристика вирусов Крымской геморрагической лихорадки и лихорадки Западного Нила (ЛЗН), вызвавших обширные эпидемические вспышки в 1999-2002 гг. на юге России. Показана идентичность геномов штаммов вируса ЛЗН, изолированных в этот период в России и США. За последние три года, совместно со специалистами лаборатории биотехнологии, впервые в мире генетически охарактеризованы более 300 штаммов зоонозных РНК-содержащих вирусов, принадлежащих семи семействам. Из них более 50 описаны как новые виды вирусов.
Экологический подход использован для изучения механизмов возникновения новых пандемических вирусов гриппа А. Установлена активная циркуляция 14 различных вирусов гриппа А в природных биоценозах Северной Евразии, в том числе – генетических вариантов, которые расцениваются в качестве возможных предшественников новых пандемических вирусов.
Ведется мониторинг генотипной композиции вируса гепатита С на территории РФ. Показано постоянное изменение процентного соотношения отдельных генотипов вируса, появление рекомбинантных форм этого вируса на территориях, ранее свободных от него. Обнаружен новый субтип вируса гепатита С.
В лаборатории разрабатываются модели для оценки эффективности новых лекарственных препаратов и химических соединений в отношении вируса гриппа в культуре клеток и на животных.
Для лаборатории характерно широкое внутри- и межинститутское комплексирование. Работа сотрудников лаборатории отмечена Государственной премией РФ, премией Совета Министров СССР и премиями имени Д.И.Ивановского РАМН.

Лаборатория этиологии и эпидемиологии гриппа.
Лаборатория молекулярной генетики.
Руководитель – доктор биологических наук А.Г.Прилипов.
Лаборатория была образована в 1987 г. под руководством доктора биологических наук В.В.Месянжинова. Первоначально лаборатория работала в основном с бактериофагом Т4 и занималась исследованием белков базальной пластинки, фибриллярных компонентов бактериофага и генов, кодирующих эти белки. Были определены полные нуклеотидные последовательности не менее чем 20 генов бактериофага Т4, отработаны системы экспрессии и очистки белковых продуктов и определены свойства белков. Начаты работы по определению третичной структуры белков в расчете на использование некоторых из них, в частности – продукта гена wac, в качестве белков-носителей антигенных детерминант вирусов человека и животных.
В 1997 г. лабораторию возглавил доктор А.Г.Прилипов. В это время интересы лаборатории сфокусировались на вирусе гепатита С. Была определена полная первичная последовательность вируса гепатита С генотипа 1b (впервые в России). Получена плазмида, несущая полную нуклеотидную последовательность данного варианта вируса (впервые в России). Получены экспрессионные конструкции, позволяющие нарабатывать структурные белки этого вируса (core, E1, E2).
В 2000 г. лаборатория приступила к работе с вирусом Западного Нила. Были определены полные нуклеотидные последовательности 14 геномов вируса из коллекции Института вирусологии им.Д.И.Ивановского, в том числе – для индийского генотипа вируса впервые в мире. Также впервые в мире был обнаружен 4-й генотип вируса Западного Нила, определена его полная нуклеотидная последовательность. В дальнейшем были сконструированы ОТ-ПЦР тест-системы для детекции РНК вируса и генотипирующая система для определения групповой принадлежности. Данные тест-системы были отлажены и успешно используются для детекции полевого материала (в том числе – пулов комаров и клещей). С помощью этих инструментов к настоящему времени обследовано не менее 2000 проб полевого материала на наличие РНК вируса Западного Нила. Проведена работа по определению нуклеотидной последовательности вирусов из положительных проб, осуществлен их филогенетический анализ. В течение последних 10 лет лаборатория работала, в основном, по двум направлениям: определению нуклеотидных последовательностей геномов новых арбовирусов и вирусу гриппа.
Для арбовирусов впервые в мире были определены полные последовательности геномов и уточнена классификация для вируса Киасанурской лесной болезни, вируса Карши, вируса зайца беляка. Открыт новый вирус из серокомплекса Калифорнийского энцефалита, получивший название вирус Хатанга. Для него обнаружено пять различных генотипов; показана внутривидовая и межвидовая реассортация.
Для вируса птичьего гриппа H5N1 было получено большинство полных геномов в России, описаны различные генетические линии вируса, проникающие на территорию РФ.
Для пандемического вируса гриппа H1N1 проведена большая работа по определению полногеномных нуклеотидных последовательностей, постоянно проводится мониторинг на появление новых мутаций, влияющих на устойчивость к лекарственным препаратам, адаптацию вируса к человеку и тяжесть вызываемого им заболевания.
Сконструировано большое количество ОТ-ПЦР тест-систем, в том числе – в реальном времени, облегчающих скрининг материала на наличие значимых изменений в геноме вируса. Используется система обратной генетики для проверки функциональной значимости замен в геноме.
Одновременно, проведена характеристика распространения на территории РФ и сопредельных государств вируса болезни Нью-Касла (NDV).
В лаборатории проводятся исследования по разработке универсального подхода для создания вакцин против флавивирусов методом обратной генетики.
— Несмотря на многочисленные опровержения учёных и представителей властей, в сети бытует мнение, что новый коронавирус мог быть создан искусственно.
— Эта распространенная гипотеза появилась ещё после возникновения предыдущих коронавирусов SARS-CoV и MERS-CoV. Уже тогда целый ряд исследователей начали поиск и оценку всевозможных коронавирусов в природе. Однако и тогда, и сейчас версии искусственного создания коронавирусов учёные признали маловероятными.
— Как вирусы преодолевают межвидовой барьер? Ещё вчера они поражали определённые виды животных, а сегодня способны инфицировать человека.
— Обычно вирус оказывается способным поражать нового хозяина только после определённых изменений в генах. Далее он должен размножаться внутри клетки, а это не всегда возможно. Для этого тоже нужны определённые условия. Например, если вирус поражает птиц, у которых температура тела выше, чем у человека, то, чтобы адаптироваться к температуре нового носителя, человека, ему нужна соответствующая мутация. Так, некоторые вирусы гриппа птиц выбрали подобный способ и смогли инфицировать человека.
— А что заставляет вирус изменяться? Почему он вдруг решает сменить один вид носителя на другой? Какие факторы на это влияют? И как часто вообще это происходит в природе?
— Любой вирус имеет геном. Он изменяется постоянно. Даже без влияния внешних факторов мутации происходят редко, но с постоянной скоростью. Внешние факторы могут повлиять на скорость и характер мутаций.
Вирусы не принимают решения о смене носителя. Просто их так много, и они так быстро размножаются и изменяются, что появляется много разных версий одного вируса. И какая-то из них в результате случайной мутации может преодолеть межвидовой барьер и поразить другого хозяина. Дальше вирус очень быстро размножается и уже эволюционирует в другом хозяине. Такой процесс постоянно происходит в природе.
Человек сталкивается с громадным числом вирусов животных, растений, грибов, бактерий. Обычно после такой встречи ничего не происходит, поскольку для преодоления вирусами межвидового барьера требуется сочетание множества факторов. На эволюцию вирусов, их мутации и преодоление барьера между видами влияют температура, влажность, иммунитет животного.
— Изменение климата тоже влияет на мутации вирусов?
— Сам климат как таковой на вирус никак не влияет, а вот на его хозяев, на миграции, образ жизни и питание может повлиять существенно. Есть интересная гипотеза, что с оттаиванием льдов и вечной мерзлоты оттаивают и древние вирусы.
— Можно ли повлиять на все эти факторы, чтобы предотвратить появление опасных возбудителей заболеваний или это человеку не подвластно?
— Не думаю, что можно как-то повлиять на эти факторы. Но можно снизить риски. К примеру, правильно применять препараты и проходить вакцинацию, чтобы избежать распространения устойчивых штаммов вирусов и бактерий.
— Способен ли коронавирус переходить от одних животных к другим?
— Теоретически способен. Такие механизмы сейчас изучаются, однако вряд ли это как-то значимо повлияет на эпидемиологию среди людей.
— В начале XXI века уже три коронавируса вызывали вспышки тяжёлых заболеваний у людей: SARS-CoV, MERS-CoV и SARS-CoV-2. А в прошлом веке сообщалось только про один такой вирус.
— Я предполагаю, их было много. В XX веке был хорошо изучен один известный постоянный коронавирус — респираторный человеческий вирус HCoV, Human Coronavirus. Это обычный вирус в структуре сезонного ОРВИ. Например, наши десятилетние исследования сезонных респираторных эпидемий выявили его в среднем у 2% пациентов с ОРВИ.
Могу предположить, что небольшие вспышки различных коронавирусов от животных могли происходить и ранее, но диагностика и методы исследований были не на таком уровне, как сегодня.
Не надо забывать, что коронавирусы окружают нас постоянно, они часто поражают домашних животных. Например, коронавирус кур, вызывающий у них инфекционный бронхит, приводит к большим потерям в сельском хозяйстве, но, к счастью, неопасен для людей.
— Какие вирусы, переходящие от животных к людям, могут представлять для человечества опасность в будущем?
— Наибольшую опасность представляют респираторные вирусы животных, которые вызывают острые воспалительные заболевания органов дыхания. Меньшую опасность представляют такие угрозы, как бешенство и клещевой энцефалит. Для заражения ими необходим укус животного или насекомого-переносчика, к тому же от подобных заболеваний разработаны вакцины.
Сейчас более актуальными становятся инфекции, переносимые насекомыми, которые вслед за изменением климата и потеплением проникают всё севернее и могут вызывать бактериальные и вирусные инфекции у человека. Например, вирус лихорадки Западного Нила, различные виды малярии, которые проникают в наши широты с распространением комаров.
— Может ли новый коронавирус мутировать и стать ещё опаснее для человека?
— Это маловероятно. Стратегия вируса заставляет его снижать вирулентность со временем, это показано для большинства актуальных вирусов. В целом высокая летальность — это эволюционный тупик для вируса.
— И он станет сезонным относительно безвредным явлением?
— Уже можно сказать, как этот SARS-CoV-2 поведёт себя в ближайшее время?
— Рискну предположить, что в начале лета распространение утихнет. Но в умеренной форме повторится в октябре — ноябре.
Филогенетический анализ связанных с птицами возбудителей позволяет получить существенную информацию о путях заноса вируса мигрантами с мест зимовки. Приведем некоторые результаты исследований по экологии вирусов гриппа A.
Основной задачей исследований по экологии гриппа в России, как и за рубежом, было изучение эволюции вирусов гриппа A в процессе взаимодействия вирусных популяций с популяциями диких птиц и домашних животных и формирования штаммов с эпидемической потенцией.
Для решения поставленных задач проводится мониторинг в ключевых точках Северной Евразии. В России выделено 16 известных в мире вирусов, изучены их биологические и молекулярно-генетические свойства ( рис. 1.33 ). Работа не прекращалась даже в смутные времена 1990-х годов, и это принесло свои плоды.
За 3 мес до первых сообщений о начале эпизоотии в конце 2003 г. птичьего гриппа Н5 в Юго-Восточной Азии российсикими учеными было доложено на Конгрессе по гриппу в Японии о выделении в России этого вируса от диких птиц - на Алтае и на юге Приморья. Эти штаммы по данным молекулярно-генетического изучения отнесены к группе низкопатогенных. Однако молекулярно-генетическое изучение указывало на высокую близость гемагглютинина сибирского штамма и штаммов, позднее появившихся в Юго- Восточной Азии. Тогда был сделан прогноз о возможности интродукции североазиатских штаммов с перелетными птицами в птичьи хозяйства в Юго- Восточной Азии, где они через какое-то время могли бы превратиться в высоковирулентные. Обширные пространства Северной Евразии можно сравнить с "кухней", где циркулируют различные генотипы вирусов гриппа A, а Юго- Восточную Азию - со "столовой", где происходит формирование высоковирулентных штаммов с пандемической и панзоотической потенцией. Возможно, так и произошло. Возникшая эпизоотия за короткий срок охватила 8 стран. Погибло и было забито более 100 млн кур и уток. В странах Азии, Европы и Африки заразилось 310 человек, 189 (61%) из которых погибли ( табл. 1.10 ). Эпизоотия, заражение и гибель людей продолжаются и сейчас. В любой момент могут сформироваться реассортанты при одновременном заражении свиней вирусом Н5 и вирусом гриппа человека H1 и вирусом гриппа человека H3 , циркулирующими по всему миру.
На этом этапе был сделан второй прогноз: в случае заражения в местах зимовок диких птиц высоковирулентными штаммами становится очень высоким риск их занесения на территорию России, особенно в Сибирь и на Дальний Восток, во время весенних миграций.
А затем произошло то, что и должно было произойти. В середине июля 2005 г. в ряде мест на юге Западной Сибири были выявлены эпизоотии среди домашних птиц с летальностью более 90% и быстрым распространением. Была показана высокая степень зараженности не только домашних, но и диких птиц. С приоритетом 8 августа 2005 г. выделенные штаммы депонированы в Государственную Коллекцию вирусов, проведен полноразмерный сиквенс всего генома и эти данные заложены в Международную базу данных GenBank с приоритетом от 5 сентября 2005 г. Других данных из России на тот период в GenBank не поступало.
Филогенетический анализ выявил высокий уровень гомологии гемагглютининов западносибирских штаммов со штаммами, выделенными весной 2005 г. от диких птиц на озере Цинхай (Кукунор) в северо-западной провинции Цинхай (КНР). Это подтвердилось полным сиквенсом остальных семи генов.
Сиквенс генома выделенных штаммов выявил ряд особенностей, коррелирующих с биологическими свойствами. Специфика аминокислотных последовательностей сайта протеолитического расщепления гемагглютинина определяет высокий уровень патогенности. Делеция в позициях 49-68 белка нейраминидазы указывает на принадлежность к генотипу Z с повышенным тропизмом к домашним птицам и потенциальной патогенностью для людей. Глутаминовая кислота в позиции 92 белка NS1 определяет устойчивость к действию интерферона и повышенную вирулентность для свиней. Серии в позиции 31 белка М2 указывает на чувствительность к ремантадину . Это единственная хорошая новость. Лизин в позиции 627 белка РВ2 определяет повышенный тропизм к клеткам млекопитающих, что объясняет способность изучаемых штаммов к репродукции в различных линиях клеток млекопитающих. Это очень опасно. Выявленные свойства проникшего на территорию России вируса свидетельствуют о его высоком патогенном потенциале в отношении и домашних птиц и людей. Осенью 2005 г. вирус выделен во время эпизоотии среди лебедей в дельте Волги, а в июне 2006 г. - от диких птиц в период обширной эпизоотии на озере Убсу-Нур на границе Республики Тыва и Монголии. С весны 2005 г. до лета 2006 г. генетическая характеристика этого цинхай-сибирского генотипа не изменилась ( рис. 1.34 ).
Итак, как и когда проник высоковирулентный грипп Н5 на территорию России и какова перспектива дальнейшего развития событий ( рис. 1.35 )
Сначала низкопатогенные штаммы, циркулирующие в Сибири и на Дальнем Востоке среди диких птиц, были занесены во время осенних миграций в места зимовок, в т.ч. и в страны Юго-Восточной Азии. Там они превратились в высоковирулентные и с дикими же птицами весной этого года через "джунгарские ворота" (между горными системами Тянь-Шаня и Монгольского Алтая) проникли в Западную Сибирь и резко активизировались в период появления молодняка птиц. А затем произошел эпизоотический взрыв после попадания вируса в популяции домашних птиц. Высоковирулентные штаммы разлетелись с птицами в места гнездовий на территории более 10 млн кв. км.
Третий прогноз заключался в том, что когда осенью птицы полетят обратно в места зимовок через густонаселенные территории России и других стран, они вновь разнесут вирус. Так и произошло. Вирус долетел до европейских стран, Индии, Ближнего Востока, Африки. Вирусом заражены многие водоемы в местах гнездовий и на путях пролета. Вирус там сохранится долгое время. Каждый водоем, куда попали фекалии зараженных птиц, превращается в мину замедленного действия. Это можно сравнить с вовлечением в таежный пожар торфяников. Во время миграций зараженные и здоровые птицы пролетают через эти "минные поля", и события в будущем могут быть еще более грозными. Учитывая существенные межпопуляционные связи разных видов на путях перелетов и в местах зимовок реально ожидать вовлечения в процесс диких, а за ними и домашних птиц и развития панзоотии на всех континентах. А когда высоковирулентные штаммы, циркулирующие сейчас среди диких птиц, вернутся к низкопатогенным, сколько времени займет этот процесс - месяцы или годы, предсказать невозможно. Это предмет приоритетного изучения.
Что касается пандемического вируса, то он может возникнуть и у нас через одновременное заражение свиней вирусами человека и птиц. Но скорее этот вирус попадет к нам из Китая, где возможности формирования реассортантов особенно велики, учитывая активность эпизоотического процесса и огромный восприимчивый контингент среди населения. Появление пандемического вируса может произойти в любой момент. Что, с нашей точки зрения, следовало бы делать, было сформулировано уже в 2004 г.: мониторинг, экспертная диагностика, производство противовирусных препаратов, готовность к производству адекватных вакцин, готовность к приему в палаты интенсивной терапии сотен тысяч пациентов.
Проведенные исследования рассматриваются как модельные при изучении чрезвычайных эпидемических ситуаций, возникших в результате природных факторов или криминальных действий. Приведенные примеры свидетельствуют о высокой эффективности эколого-вирусологического подхода.
Читайте также:


