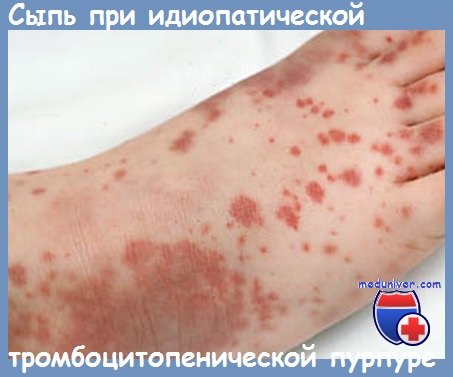
Вирус герпеса и тромбоциты
Эпидемиологическая анкета и специальные исследования показывают, что у детей младше 8 лет, вирусные инфекции предшествуют тромбоцитопенической пурпуре в 85% случаев и лишь 15% являются очевидно идиопатическими.
Болезнь наступает внезапно, обычно спустя 1—3 недель после вирусной инфекции, особенно дыхательных путей; бывают случаи, когда период после инфекции и до появления пурпуры продолжительнее — до 4 месяцев. Согласно McClure, вирусную этиологию можно установить по меньшей мере в 50% случаев из 413 исследованных детей.
Пурпура появилась спустя 3—6 недель, с одинаковой частотой у мальчиков и девочек, в то время как у взрослого преобладают женщины в пропорции 2/1 или даже 3/1.
Вирусная этиология была наглядно доказана у детей с тромбоцитопенической пурпурой, родившихся с краснухой (Luscher и сотр., Wallace, Svenigsen, Zinkham и сотр.), при которой обнаруживаются антивирусные антитела после состояния виремии.
Вполне возможно, что механизм тромбоцитопении происходит по поводу поражений типа III, благодаря иммунным комплексам, но не по поводу антитромбоцитарных антител. Виремия, как и при других вирусных инфекциях, находится лишь на 7 дней раньше и два дня после вирусного высыпания, следовательно задольго до пурпурного высыпания.
Вирусная этиология определяется после некоторых вирусных инфекций, проявляющих максимальную частоту в холодные времена года или в начале весны, как например различные высыпные лихорадки, корь, ветряная оспа, оспа, а также и инфекции с Pertussis. Бывают случаи и после инфекционных мононуклеозов, а также и после вирусных герпесов, инфекций с цитомегаловирусом, свинкой и даже после гепатита Боткина.
Вирусная этиология была доказана несомненно при тромбоцитопенической пурпуре после противокоревой или противооспенной вакцинации, но только в редких случаях (Alter и сотр., Oski и сотр., Bachand и сотр.). Реже можно ссылаться на иммунную этнологию после бактериальных инфекций (Clement и Diamond) или после интрадермореакций на туберкулин.
Следует обращать особое внимание на тромбоцитопеническую пурпуру, появляющиеся в разгаре септического состояния, микробного или вирусного, при котором механизм тромбоцитопении иной. В этих случаях микробные токсины, как при стрептококковых, пневмококковых, менингококковых инфекциях, а также и вследствие других граммотрицательных агентов, детерминируют появление во время септического периода синдрома с вторичной тромбоцитопенией путем явления Sanarelli-Schwartzmann.
Микробные токсины, но особенно вирусные частицы, могут прямо вызывать агглютинацию тромбоцитов и тяжелый прогрессивный синдром по поводу уничтожения тромбоцитов на уровне РЭС. Это тромбоцитопени-ческие расстройства по поводу снижения тромбоцитов на периферии, к которому добавляется однако и дефицит производства благодаря прямому поражению мегакариоцитов, которые являются очень благоприятной средой для размножения вирусов (Dalton и сотр.).
В разгаре вирусной инфекции или после вакцинации число мегакариоцитов понижается, они представляют дефекты созревания и дегенеративные поражения с вакуолями и многочисленными свободными ядрами, в то время как число тромбоцитов снижается. При тяжелых тромбоцитопениях констатируется признак разрушения тромбоцитов с повышением в сыворотке кислотных фосфатаз.
Подобные механизмы с периферическим лизисом возникают и при других инфекциях, как например лихорадка денга, токсоплазмоз, а также и при таиландской геморрагической лихорадке, вызв шной вирусом миэлодепрессивного действия (Bierman и Nelson). Эти данные смешанного патогенеза необходимы для диагностицирования известных вторичных форм путем изучения непосредственного действия инфекционных агентов, таких как вирусные агенты, антитела, иммунные комплексы, а также тромбоцитарного турновера и функций мегакариоцитов.
С клинической точки зрения, поствирусные формы у детей имеют в основном характер идиопатической тромбоцитопенической пурпуры. В обширной статистике, McClure находит, наряду с пурпурой у всех больных, эпистаксис у 30%, гематурию у 5— 10% и органиченную частоту для других кроворечений, как например гемоторакс. Внутричерепные кровоизлияния, хотя и редкие (1,2%), являются причиной смерти у 30% исследованных больных в период пурпуры.
Спленомегалии и иногда умеренные гепатомегалии появляются в 10% случаев и детерминированы скорее вирусной инфекцией, чем тромбоцитопеническим заболеванием.
С точки зрения эволюции, 50% случаев излечиваются после острого приступа за 1—2 и реже 3 месяца. В пропорции 10—20% случаев, тромбоцитопения с вариабильными значениями, с явлениями легкой или акцентуированной пурпуры персистирует от одного до нескольких лет.
У 8—10% случаев, после периода излечения, пурпура рецидивирует или принимает стойкий хронический характер, с акцентуированными приступами, детерминированными вероятно реинфекциями, которые усугубляют процесс самопродолжения путем генерирования новых иммунных комплексов или даже путем появления автоиммунного механизма после разрыва толерантности.

Герпес – это контагиозная вирусная инфекция, не поддающаяся эрадикации (полному устранению). Вирус обладает нейроинвазивностью – способностью проникать и намертво закрепляться в скоплении нервных узлов. Инфицированные клетки продуцирую новую партию вирусов, поражая соседние и распространяясь, таким образом, по всему организму.
Обнаружить герпес в крови можно посредством специальных исследований. Обычный клинический и биохимический анализ вирус не выявляет. Для противодействия вирусной атаке иммунная система вырабатывает специфические иммуноглобулины, осуществляющие контроль над инфекцией.
Герпес может годами не подавать признаков активности, но при срабатывании определенного триггера (толчка) снижается иммунитет и вирус мгновенно реактивируется, проявляясь яркими симптомами. Избавиться от герпетической инфекции полностью нельзя. Терапия дает временный, во многих случаях долгосрочный эффект, но не избавляет организм от вируса.
Единожды поселившись, микроскопический вирусный паразит остается с человеком пожизненно. Крепкий иммунитет ингибирует активность герпетической инфекции, но это не означает, что вирус герпеса в крови отсутствует. Человек может не испытывать симптомов, но являться вирусоносителем.
Пути заражения и разновидности вирусной инфекции
Контагиозность различных видов вируса проявляется:
- контактно-бытовым способом;
- воздушно-капельным путем;
- половым путем;
- при переливании крови или несоблюдении стерильности при медицинских процедурах;
- вертикальным способом (в перинатальный период и при родоразрешении).
Согласно медицинским утверждениям, носителями вируса являются 9 из 10 человек.
На сегодняшний день лабораторная диагностика выявляет восемь разновидностей герпетической инфекции, от вируса простого герпеса (ВПГ) до сложных, опасных для здоровья и жизни заболеваний. Вирус простого герпеса 1 типа подразделяется на несколько подтипов, в зависимости от локализации высыпаний:
ВПГ 1 типа на наружных половых органах встречается редко, заражение происходит при оральном сексе. ВПГ 2 типа, иначе генитальный герпес, передается при незащищенном интимном контакте. Симптоматическое высыпание проявляется на половых органах. Данный тип герпетической инфекции опасен многочисленными осложнениями, особенно у женщин в перинатальный период.
Третий тип вируса герпеса Зостер, по сути, является ветрянкой. Заражению чаще всего подвержена социализированная категория детей. Передача осуществляется воздушно-капельным способом. Сыпь может покрывать любые участки тела. Болезнь сопровождается сильным кожным зудом и субфебрильной температурой тела. Своевременное лечение устраняет симптомы, и вирус замирает в организме. Во взрослом возрасте, при сильном снижении иммунитета Зостер может проявиться в виде опоясывающего лишая.
Тип 4 вирус Эпштейн-Барра развивается в тяжелое заболевание слизистых оболочек с дальнейшим поражением лимфатической системы (инфекционный мононуклеоз). При некорректной терапии может спровоцировать развитие сахарного диабета, аутоиммунных и онкологических процессов.
Цитомегаловирус, или пятый тип герпеса, представляет серьезную опасность для внутриутробного развития ребенка. Рождение полноценного малыша практически исключается. Если инфицирование женщины произошло после наступления беременности, по медицинским показаниям производится искусственное прерывание.
Герпетический вирус 6 типа чаще выявляется в детском возрасте и развивается, как розеола (другие названия: псевдокраснуха, трехдневная лихорадка, внезапная экзантема). Характеризуется фебрильной температурой и сыпью, распространяющейся по всему телу, увеличением лимфоузлов. Вирусы седьмого и восьмого типа выделяются при лабораторной микроскопии, но медициной изучены недостаточно. Доказано, что 8 тип может стать триггером к развитию раковых патологий.
Общие характеристики всех герпетических вирусов:
- имеют схожие симптомы и продолжительность инкубационного периода;
- профилактических медикаментов для предупреждения заражения не разработано;
- лечить инфекцию антибиотиками бесполезно;
- эрадикационной терапии не существует;
- вероятность осложнений, в особенности у детей.
Причины рецидивов
Лечение противовирусными препаратами помогает ликвидировать симптомы, но не устранить сам вирус из нервных клеток и крови. Герпес принимает латентную форму, и проявляется вновь при ослаблении защитных сил организма. К факторам, провоцирующим обострение, относятся:
- анемия (снижение концентрации гемоглобина в крови или малокровие);
- простудные заболевания, переохлаждение организма;
- инфекционные болезни (включая заражение венерическими инфекциями);
- дистресс (постоянное нервно-психологическое напряжение);
- дисания (длительное расстройство сна);
- неблагоприятное воздействие внешней среды (экологии);
- ВИЧ и СПИД;
- недостаток витаминов (гиповитаминоз);
- хронический алкоголизм.
У женщин рецидивы могут быть одним из проявлений ПМС (предменструального синдрома).
Опасность герпеса в перинатальный период
В перинатальный период наиболее угрожающими типами инфекции является генитальный герпес (2 тип) и цитомегаловирус (5 тип). В особенности опасно первичное инфицирование, когда у беременной женщины отсутствуют антитела (иммуноглобулины) к тому или иному типу герпеса.
Вирус способен проникать через гематоплацентарный барьер, то есть малыш может быть инфицирован еще до появления на свет (неонатальный герпес). При этом нарушается нормальное внутриутробное развитие плода. Чем опасен герпес в крови у ребенка при условии внутриутробного инфицирования?
Прежде всего, тем, что зараженный малыш может умереть, не успев появиться на свет. В первом триместре высока вероятность самопроизвольного прерывания беременности (выкидыша). Для второго триместра более характерно замирание беременности. В третьем триместре возникает риск внутриутробной смерти плода.

Влияет ли неонатальный герпес, если ребенка удается доносить? Да, влияет, и крайне негативно. У малышей с внутриутробной инфекцией развивается высокая опасность рождения с такими патологиями:
- ДЦП (детский церебральный паралич);
- ЗПР (задержка психического развития);
- эпилепсия;
- нарушение или полное отсутствие зрения и слуха;
- порок сердца;
- физические аномалии.
Инфицирование новорожденных 2 типом герпетического вируса, чаще, происходит во время родоразрешения. По статистике, у 40% новорожденных, зараженных при прохождении через родовые пути, развиваются кожные болезни, у 35% – поражение нервной системы и головного мозга.
Для грудных детей герпетическая инфекция опасна развитием осложнений, таких, как менингит, пневмония, нарушение сердечной деятельности. При переходе осложнений в острую форму, развивается риск судорожного синдрома и летального исхода. Во избежание побочных проявлений и осложнений, лечение герпеса у маленьких детей проводится под контролем педиатра.
Диагностика
- кожные высыпания неизвестной этиологии (происхождения);
- длительное проявление симптомов герпеса, не исчезающих под воздействием противовирусной терапии;
- тяжелое течение инфекции у детей.
Обязательно нужно сдать кровь на герпес в перинатальный период и при планировании беременности. Лабораторная диагностика герпетической инфекции включает следующие виды анализов:
- ПЦР, иначе полимеразная цепная реакция. Методика определения генной структуры возбудителя инфекции.
- ИФА, или иммуноферментный анализ. Оценивает возможности иммунитета противостоять вирусам по реакции антиген-антитело.
- РИФ, или реакция иммунофлюоресценции. Родственный ИФА способ с применением флюорохромов и ультрафиолетовых лучей.
При генитальной разновидности инфекции дополнительно назначается анализ крови на реакцию Вассермана (сифилис), поскольку внешние проявления высыпаний имеют схожесть с сифилитическим твердым шанкром (узловое уплотнение на слизистой гениталий). Для полной картины диагностику дополняют общий клинический и биохимический анализ крови.
Справка! С помощью сложной иммунологической диагностики исследуется не только кровь. В качестве исследуемого образца оценивается любая биологическая жидкость организма: моча, ликвор (спинномозговая жидкость), мокрота и т. д., слизь из цервикального или мочеиспускательного канала. При осложненной беременности проводится анализ амниотических (околоплодных) вод и плацентарных клеток.
Для получения объективных результатов прежде чем сдавать кровь, организм рекомендуется подготовить. Пациентам необходимо:
- за неделю отказаться от применения любых медицинских препаратов (от антигистаминов – за десять дней);
- за 2–3 суток устранить из рациона жирную пищу, жареные блюда, исключить алкогольные напитки;
- соблюдать режим голодания перед процедурой, минимум 8 часов.
Забор венозной крови для любого анализа производится только натощак, или нет смысла в исследовании. Во-первых, любая пища изменяет состав крови, во-вторых, после еды кровь становится мутной от жирных кислот, что затрудняет диагностику.
Анализ ИФА определяет наличие в крови антител, иначе иммуноглобулинов (Ig), к специфическим антигенам. Чужеродным организмом (антигеном), в данном случае, выступает вирус герпеса.
Антитела представляют собой белковые соединения иммунной системы, в задачу которых входит распознать антигены и вступить с ними в реакцию для последующего уничтожения. Корреляция антиген-антитело носит название иммунный комплекс.
В лаборатории ИФА проводится в два этапа. Первично антиген размещается на исследовательской поверхности, и к нему добавляется кровь. Антитела вступают в реакцию и определяют принадлежность антигена к иммунной системе. Если объект не представляет опасности, то есть принадлежит системе, клетка открепляется.
В случае когда антитела обнаружили чужеродный агент (антиген), они стараются его окружить и обезвредить. Так образуется иммунный комплекс. На следующем этапе к комплексу присоединяют определенный фермент и наблюдают за интенсивностью окраски с помощью спецанализатора (колориметра).
ИФА определяет три основных вида иммуноглобулинов и два дополнительных. В ходе исследования на герпес оценивается IgM и IgG. Результат анализируется:
- по качественному показателю (наличие или отсутствие антител);
- по количеству активных возбудителей;
- по соотношению иммуноглобулинов друг к другу.
Расшифровка производится по таблице (в бланках анализа количественный показатель вирусов указывается редко).
| Иммуноглобулины и значения | IgM (-) IgG (-) | IgM (-) IgG (+) | IgМ (+) IgG (-) | IgМ (+) IgG (+) |
| Результат | иммунитета к герпесу нет (присутствует риск первичного инфицирования) | иммунитет есть, вирус находится в латентном состоянии, возможность рецидива зависит от здоровья защитной системы | первичное заражение герпетической инфекцией | обострение |
Иммуноферментный анализ считается информативным, достаточно оперативным по срокам получения результатов и доступным (анализ можно сделать в лечебных учреждениях Москвы и других городов).
РИФ относится к экспресс-методикам определения наличия возбудителя. Основывается на образовании связей антиген-антитело. При этом чужеродные агенты предварительно обрабатываются флюорохромами, которые светятся под направленными УФ-лучами люминесцентного микроскопа. Анализ информативен при высокой концентрации антигенов в крови.
Методика ПЦР выявляет вирус и определяет его генную структуру. Исследование базируется на многократном копировании фрагмента РНК (амплификации) в реакторе (амплификаторе). Кровь помещается в реактор, где обрабатывается термически до расщепления ДНК и РНК.
Далее, к биожидкости добавляются спецвещества, способные выявить нужные участки в ДНК и РНК и вступить с ними в связь. С каждым новым присоединение вещества к молекуле ДНК достраивается копия вируса. Реакция является цикличной, за несколько часов формируется многочисленные копии генетической структуры герпетического вируса.
Ложноположительные и ложноотрицательные результаты лабораторной экспертизы крови встречаются, если:
- пациент игнорировал правила предварительной подготовки к исследованию;
- лаборант нарушил условия забора крови;
- инфекция ослабла под воздействием антивирусных препаратов, но сам возбудитель присутствует в организме.
В случае когда результат анализа отрицательный, но симптоматика продолжает нарастать, процедуру проводят повторно.
Итоги
Герпетический вирус проникает в организм воздушно-капельным, контактно-бытовым способом, передается при половом контакте, при переливании крови, а также внутриутробно – от матери к ребенку. Достаточно однократного заражения, чтобы герпес навсегда поселился в нервных узлах и крови человека. Вылечить инфекцию полностью невозможно. Лабораторная диагностика по крови проводится методами ИФА, ПЦР, РИФ.
Различают восемь разновидностей герпеса. Самыми распространенными являются:
- первый тип (простой вирус);
- второй тип (генитальный);
- третий (ветрянка).
Инфекция имеет волнообразное течение. Рецидивная фаза сменяется латентным периодом, обуславливающим синдром ложного выздоровления. Обострение происходит на фоне ослабления иммунитета. Вакцинации от герпеса не существует. Профилактической мерой является поддержание иммунной системы в стабильно здоровом состоянии.

![]()
![]()

Комментарии пользователей



![]()
![]()





ЦИТОМЕГАЛОВИРУС (ЦМВ)
Цитомегаловирусную инфекцию можно эффективно лечить.
Существуют три основные группы пациентов, для которых актуален контроль за активностью ЦМВ:
- Беременные
- Лица, страдающие рецидивирующим герпесом
- Пациенты с нарушенным иммунным ответом
- Цитомегаловирус и беременность – эта проблема беспокоит каждую 4-ую женщину детородного возраста
- Подготовка к беременности женщин, страдающих герпесом и ЦМВ-инфекцией
- Своевременные лечебно-профилактические мероприятия во время беременности и при подготовке к родам – это реальная возможность избежать негативного влияния цитомегаловируса на течение беременности, развития патологии плода и новорожденного .
- Цитомегаловирус и генитальный герпес: одна из причин плохо поддающегося терапии рецидивирующего герпеса при любой локализации процесса – смешанная ЦМВ-ВПГ-инфекция, что требует значительной коррекции в проводимом противорецидивном лечении.
- Цитомегаловирус и иммунитет
- у лиц с нормальным иммунитетом (иммунокомпетентных) цитомегаловирус обычно находится в латентном (спящем) состоянии, не причиняя человеку вреда. При активации латентной инфекции могут возникать рецидивирующие бронхиты, пневмонии, воспаление периферических лимфатических узлов (лимфоаденопатия), астения: субфебрильная температура тела, ознобы, повышенная утомляемость, недомогание.
- у лиц с иммунодефицитом (ВИЧ-инфицированные, химиотерапия по поводу злокачественных новообразований, иммуносупрессивная терапия при трансплантации внутренних органов) цитомегаловирус вызывает тяжелые заболевания (поражение глаз, легких, пищеварительной системы и головного мозга), которые могут приводить к смерти.
ПОДРОБНЕЕ ДЛЯ ЛЮБОЗНАТЕЛЬНЫХ
Распространенность и пути заражения ЦМВ.
Цитомегаловирус был открыт- в 1956 г. Возбудитель (Cytomegalovirus hominis – ЦВМ) относится к семейству герпесвирусов (Herpesviridae). Вирус имеет сродство к ткани слюнных желез и при локализованных формах обнаруживается только в этих железах. ЦМВ персистирует в организме (сохраняется) пожизненно. Он широко распространен в популяции. Антитела к цитомегаловирусу выявляют у 10-15% подростков. К возрасту 35 лет эти антитела выявляют уже у 40% людей. ЦМВ не очень заразен. Для заражения обычно требуются длительное, тесное общение или многократные контакты.
Заражение цитомегаловирусом происходит:
- в быту: воздушно-капельным путем и контактным – со слюной при поцелуях
- половым путем: контактным – со спермой, слизью канала шейки матки
- при переливании крови и трансплантации донорских органов
- трансплацентарный путь – внутриутробное инфицирование плода
- инфицирование ребенка в родах
- нфицирование ребенка в послеродовом периоде через грудное молоко от больной матери
Клинические проявления цитомегаловирусной инфекции
Патология беременности, плода и новорожденного – наиболее серьезные осложнения ЦМВ-инфекции. Максимальный риск развития этой патологии возникает при инфицировании плода во время беременности. Однако, необходимо помнить, что проблемы нередко возникают и у беременных с активацией латентной ЦМВ-инфекции с развитием вирусемии (выход вируса в кровь) с последующим заражением плода. ЦМВ – одна из наиболее частых причин невынашивания беременности.
Внутриутробная ЦМВ-инфекция плода приводит к развитию тяжелых заболеваний и поражений центральной нервной системы (отставание в умственном развитии, тугоухость). В 20-30% случаев ребенок погибает.
Диагностика герпесвирусных (ВПГ и ЦМВ) инфекций
Диагностика герпесвирусных (ВПГ и ЦМВ) инфекций:
- Диагноз ВПГ и ЦМВ – инфекции можно ставить (особенно при малосимптомной, атипичной и скрытой формах герпеса) только на основании выявления вируса в биологических жидкостях организма (кровь, моча, слюна, отделяемое половых путей) методом ПЦР или при специальном посеве на культуру клеток.
- ПЦР отвечает на вопрос: вирус обнаружен или нет, но не дает ответа об активности вируса.
- Посев на культуре клеток не только выявляет вирус, но и дает информацию о его активности (агрессивности). Анализ результатов посева на фоне лечения позволяет делать заключение об эффективности проводимой терапии.
- Антитела IgM могут свидетельствовать или о первичной инфекции или об обострении хронической инфекции.
- Антитела IgG – говорят только о том, что человек с вирусом встречался, инфицирование произошло. IgG при герпесвирусных инфекциях сохраняются пожизненно (в отличии, например, от хламидиоза). Есть ситуации, в которых IgG имеют диагностическое значение.
Лечение ЦМВ-инфекции должно быть комплексным, включать в себя иммунную и противовирусную терапию. ЦМВ довольно быстро уходит с периферии и перестает выделяться из биологических жидкостей (кровь, слюна, грудное молоко) – наступает латентная фаза инфекции, – качественно проведенная иммунотерапия активирует защитные механизмы организма, которые контролируют в дальнейшем активацию латентной ЦМВ-инфекции.
Методические указания для студентов к практическому занятию № 6.
Тема: Лабораторная диагностика герпесвирусных инфекций.
Цель: Изучение лабораторной диагностики герпесвирусных инфекций.
Модуль 3. Общая и специальная вирусология.
Содержательный модуль 16. Специальная вирусология.
Тема 6:Лабораторная диагностика герпесвирусных инфекций.
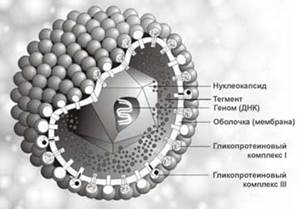
Актуальность темы:
Вирус простого герпеса – одна из самых распространенных вирусных инфекций человека, характеризующаяся лихорадочным состоянием и пузырьковыми высыпаниями, которые чаще всего локализуются на коже и слизистых оболочках. Важными особенностями герпетической инфекции являются пожизненное носительство вируса и частые рецидивы болезни.
Вирусная природа простого герпеса установлена в 1912 г. У. Грютером.
(Трёхмерное изображение вируса герпеса).
Герпесвирусы и вызываемые ими заболевания
| Типы вирусов герпеса | Вызываемые заболевания |
| ВПГ-1 (вирус простого герпеса типа 1) | Поражение: кожи, слизистой оболочки ротовой полости, конъюнктивы или роговицы глаза, энцефалиты |
| ВПГ-2 (вирус простого герпеса типа 2) | Поражение слизистых оболочек гениталий, у новорожденных - центральной нервной системы |
| ВЗВ (вирус ветрянки) | Ветряная оспа, опоясывающий лишай, постгерпетическая невралгия; язвенно-некротическая форма опоясывающего герпеса - СПИД-индикаторный признак заболевания |
| ЦМВ (цитомегаловирус) | Патологии новорожденных; осложнения после трансплантации органов и костного мозга: интерстициальная пневмония, гастроинтестинальные расстройства, гепатиты |
| ВЭБ (вирус Эпштейна-Барра) | Инфекционный мононуклеоз, лимфома Беркитта, рак носоглотки |
| ВГ-6 | Вирус, вызывающий фатальные интерстициальные пневмонии и инфекционные розеолы новорожденных |
| ВГ-7 | Вирус, выделенный от больных с синдромом хронической усталости |
| ВГ-8 | Вирус, выделенный из биоптата больного саркомой Капоши, ассоциированный с лимфопролиферативными заболеваниями |
| Примечание. ВГ - вирус герпеса. |
Таксономия, морфология, химический состав. Возбудитель простого герпеса - ДНК-содержащий вирус, относится к семейству Herpesviridae, роду Simplexvirus. По морфологии и химическому составу не отличается от вирусов ветряной оспы и опоясывающего герпеса.

Культивирование. Вирус простого герпеса (ВПГ) культивируют в куриных эмбрионах, культурах клеток и организме лабораторных животных. На хорионаллантоисной оболочке куриных эмбрионов вирус образует мелкие белые плотные узелки-бляшки; в зараженных культурах - вызывает цитопатический эффект: образование гигантских многоядерных клеток с внутриядерными включениями.
Антигенная структура. Вирус содержит ряд антигенов, связанных как с внутренними белками, так и с гликопротеидами наружной оболочки. Последние являются основными иммуногенами, индуцирующими выработку антител и клеточный иммунитет. Существует два серотипа вируса: ВПГ типа 1 и ВПГ типа 2.
Резистентность. Вирус может выживать на поверхности предметов при комнатной температуре в течение нескольких часов, чувствителен к УФ-лучам, обычным дезинфицирующим средствам, жирорастворителям, термолабилен.
Восприимчивость животных. Вирус простого герпеса патогенен для многих животных, у которых вызывает энцефалит при введении возбудителя в мозг или местный воспалительный процесс при заражении в глаз. В естественных условиях животные не болеют.
Эпидемиология. Простой герпес - одна из самых распространенных инфекций, которая поражает различные возрастные группы людей, чаще в осенне-зимний период. Отмечаются спорадические случаи заболевания, иногда небольшие вспышки в семьях, детских коллективах, больницах. Эпидемий не наблюдается.
Источником инфекции являются больные и носители. Основной механизм передачи - контактный, аэрогенный. Заражение происходит при попадании вирусов на поврежденные кожные покровы или слизистые оболочки.
Эпидемиология герпеса, вызванного вирусами типов 1 и 2, различна. ВПГ типа 1 передается через слюну, зараженные слюной руки и предметы быта, а ВПГ типа 2 - половым путем. Возможно заражение плода через плаценту.
Патогенез и клиническая картина. По клиническим проявлениям различают первичный и рецидивирующий герпес. Входными воротами возбудителя при первичной герпетической инфекции являются поврежденные участки кожи и слизистых оболочек рта, глаз, носа, мочеполового тракта, где вирусы репродуцируются. Затем по лимфатическим сосудам вирусы попадают в кровь и заносятся в различные органы и ткани.
Инкубационный период при первичном герпесе составляет в среднем 6-7 дней. Заболевание начинается с жжения, зуда, покраснения, отека на ограниченных участках кожи и слизистых оболочек, затем на этом месте появляются пузырьковые высыпания, наполненные жидкостью. Иногда заболевание сопровождается повышением температуры тела и нарушением общего состояния. При подсыхании пузырьков рубцов не образуется. Первичный герпес у новорожденных протекает тяжело и нередко заканчивается смертью. Однако у большинства людей первичная инфекция остается нераспознанной, так как протекает бессимптомно.
После первичной инфекции (явной и бессимптомной) 70-90 % людей остаются пожизненными носителями вируса, который сохраняется в латентном состоянии в нервных клетках чувствительных ганглиев. Нередко у носителей появляются рецидивы болезни в результате переохлаждения, перегревания, менструации, интоксикации, различных инфекционных заболеваний, стрессов, нервно-психических расстройств. Для рецидивирующего герпеса характерны повторные высыпания на коже и слизистых оболочках, нередко в тех же местах. Наиболее частой локализацией рецидивирующего герпеса, вызванного ВПГ типа 1, являются губы, крылья носа, полость рта, конъюнктива глаз. ВПГ типа 2 поражает мочеполовую систему и вызывает герпес новорожденных. Доказана роль ВПГ типа 2 в развитии рака шейки матки. Сравнительно редко встречаются генерализованные формы рецидивирующего герпеса, в частности поражения нервной системы и внутренних органов.
Иммунитет. В результате первичной герпетической инфекции в организме образуются сывороточные и секреторные антитела, которые обусловливают иммунитет к первичному герпесу, но не препятствуют сохранению вируса и возникновению рецидивов. Рецидивирующий герпес возникает при высоком уровне антител к вирусу герпеса. Основное значение в развитии рецидивирующего герпеса имеет состояние клеточного иммунитета.
Лабораторная диагностика. Материалом для исследования являются содержимое герпетических пузырьков, слюна, соскобы с роговой оболочки глаза, кровь, цереброспинальная жидкость, в летальных случаях . кусочки головного и спинного мозга.
Экспресс-диагностика заключается в обнаружении гигантских многоядерных клеток с внутриядерными включениями в мазках-отпечатках из высыпаний, окрашенных по Романовскому-Гимзе. Для дифференциации от других вирусов, принадлежащих к этому семейству, используют РИФ, ИФА, РИА, ПЦР. Выделение вируса проводят на куриных эмбрионах, культуре клеток и на лабораторных животных (мыши-сосунки), идентифицируют вирус с помощью РИФ или РН. В последние годы в диагностике простого герпеса начали применять моноклональные антитела, что дает возможность определить серотип вируса. Для серодиагностики заболевания используют РСК, РН, РИФ, ИФА.
Специфическая профилактика и лечение. Для профилактики тяжелых форм рецидивирующего герпеса в период ремиссии применяют многократное введение инактивированной, культуральной герпетической вакцины. Вакцинация, а также применение иммуномодуляторов, например реаферона, удлиняют межрецидивный период и облегчают течение последующих рецидивов. В остром периоде с лечебной целью используют химиотерапевтические препараты (виразол, ацикловир, оксолиновую, тебро-феновую, флореналовую мази, бонафтон), интерфероны и индукторы интерферона.
Вирус цитомегалии

Цитомегалия - инфекционное заболевание, возбудителем которого является цитомегаловирус (ЦМВ) Cytomegalovirus hominis (от греч. cytys - клетка, megas - большой). Вирус вызывает цитомегаловирусную инфекцию человека, характеризующуюся поражением почти всех органов (преимущественно слюнных желез) с образованием в них гигантских клеток с внутриядерными включениями, протекающую в различных формах - от бессимптомного носительства до тяжелой генерализованной формы, заканчивающейся летальным исходом.
Вирус впервые выделен К. Смитом в 1956 г.
Таксономия, морфология, антигенная структура. Возбудитель цитомегалии - ДНК-содержащий вирус, относится к семейству Herpesviridae, роду Cytomegalovirus.
Морфология, химический состав типичны для семейства герпесвирусов. Диаметр вирусной частицы (вириона) около 180 нм. В центре вириона находится двенадцатигранный нуклеокапсид, содержащий генетическую информацию - двухнитевую ДНК-вируса. Установлено 2 антигенных серотипа вируса.
Резистентность. Вирус термолабилен, чувствителен к дезинфицирующим средствам и жирорастворителям.
Эпидемиология. Цитомегаловирусная инфекция широко распространена на земном шаре. Источником вируса является больной человек или носитель. Вирус выделяется со слюной, мочой, секретами организма, реже фекалиями. Предполагается, что ведущий механизм передачи инфекции - контактно-бытовой, возможны аэрогенный и фекально-оральный механизмы передачи. Цитомегаловирус обладает высокой способностью проникать через плаценту (вертикальная передача), вызывая внутриутробную патологию плода.
Патогенез и клиническая картина. Патогенез не вполне выяснен. Инфекция связана с длительным носительством вируса, который в латентном состоянии сохраняется в слюнных железах, почках и других органах. Активация латентной инфекции происходит при иммунодефицитных состояниях, иммунодепрессивной терапии. Вирус поражает ЦНС, костный мозг, почки, печень, клетки крови. У беременных женщин цитомегалия может приводить к недоношенности, мертворождению, развитию аномалий у плода.
Иммунитет. У больных независимо от клинической формы инфекции, а также у носителей образуются антитела, которые, однако, не препятствуют сохранению вируса в организме и выделению его в окружающую среду. Интенсивность развития болезни находится под контролем клеточной иммунной системы хозяина.
Лабораторная диагностика. Обследованию на цитомегалию в первую очередь подлежат дети с поражением ЦНС и врожденными уродствами, а также женщины с неблагополучно протекающей беременностью. Исследуемый материал - слюна, моча, мокрота, цереброспинальная жидкость, кровь, пунктат печени.
Специфическая профилактика и лечение. Разработана живая аттенуированная вакцина. Для лечения применяют химиотерапевтические препараты (ганцикловир, фоскорнет натрия), иммуномодуляторы, интерферон.
Читайте также:


