Вирус гепатита электронный микроскоп
Вирус гепатита С (НСV) является самым коварным и опасным среди всех вирусов, поражающих печень. Ведущим фактором передачи инфекции является кровь. В 85% случаев заболевание принимает хроническое течение, что через 15 — 20 лет приводит к циррозу печени и развитию первичного рака печени. Длительное скрытое (бессимптомное) течение заболевания приводит к запоздалой диагностике. Лечение гепатита С дорогостоящее. Вакцина не разработана.
В мире насчитывается около 170 млн. инфицированных НСV лиц, что в 10 раз превышает количество таковых ВИЧ-больных. Ежегодно заражается от 3 до 4 млн. человек, 350 тыс. умирает от болезней печени. В РФ насчитывается около 3,2 млн. больных с хроническим гепатитом С, более половины из которых инфицированы первым генотипом НСV.
Рис. 1. Распространенность заболевания.
Микробиология возбудителя
Вирус гепатита С принадлежит к группе персистирующих патогенов, генетически неоднороден, является слабым антигеном, обладает средней степенью устойчивости и выраженной канцерогенностью, способен ускользать от иммунного надзора. HCV обнаруживается в крови и секретах. Продолжительность вирусемии длительная. Возбудитель, в основном, поражает клетки печени (гепатоциты), но доказано, что он также может размножаться в клетках крови — мононуклеарах.
Вирус гепатита С принадлежит к семейству флавовирусов (Flaviviridae), роду гепатовирусов (Hepacivirus).
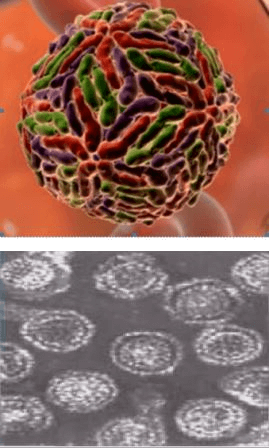
HCV является оболочечным вирусом. Ом имеет сферическую форму. Диаметр вириона составляет от 30 до 75- нм. Поверх капсида располагается суперкапсид — внешняя оболочка, состоящая из липидов и белков. Оболочечный комплекс белков Е1 и Е2 обеспечивает связывание вируса с клеткой-мишенью и проникновение в нее. Усилия ученых сегодня направлены на изучение этих механизмов, так как создание лекарственных препаратов, нарушающих эти процессы, привели бы к полной победе над возбудителем.
Рис. 2. Строение HCV.
Геном вириона маленький (содержит один ген), представлен однонитевой РНК, состоящей из 9400 — 9600 нуклеотидов, окружен капсидом. Области РНК, кодирующие белки Е1 и Е2, обладают большой изменчивостью, что определяет длительное сохранение (персистенцию) вируса в активном состоянии в клетках инфицируемого организма.
В процессе репликации HCV быстро меняют свою антигенную структуру и начинают воспроизводить себя в несколько измененном антигеном варианте, что позволяет им ускользать от воздействия иммунной системы больного.
Для всех типов вируса общим является участок РНК, состоящий из 321 — 341 нуклеотидов, который используется при постановке ПЦР.
1 генотип вируса гепатита С составляет 46,2% среди всех генотипов. Его отличительными признаками являются:
- Обнаруживается у пациентов, которым переливалась кровь или ее компоненты.
- Тяжелое течение заболевания.
- В клинической картине преобладает астеновегетативный синдром. Не всегда развивается желтуха.
- Большая частота рецидивов. Хронизация инфекции достигает 90%.
- Лечение длительное. При использовании противовирусных препаратов прямого действия длительность лечения составляет не менее 48 недель.
- Стойкий эффект при монотерапии наблюдается только у 18% (у 55% при инфицировании другими генотипами вируса). Стойкий эффект при комбинированной терапии наблюдается только у 28% больных (66% при инфицировании другими генотипами вируса).
- Является основным фактором риска при развитии первичного рака и цирроза печени.
Рис. 2. Жизненный цикл HCV. У больных с хронической формой заболевания вирионы образуются со скоростью 1012 частиц в сутки.
Преобладающими (мажорными) являются антигены — структурные оболочечные белки вируса Е1 и Е2 и белок нуклеокапсида С, а также 7 неструктурных белков-ферментов (NS1, NS2 и NS3, NS4a и NS4b, NS5a и NS5b), РНК-полимераза и протеаза. Присутствуют также минорные полипептиды — р7 и белок F.
Вне живого организма (в «пробирке) культивировать HCV не удается. Возможность репликации достигается путем заражения высших приматов — шимпанзе.
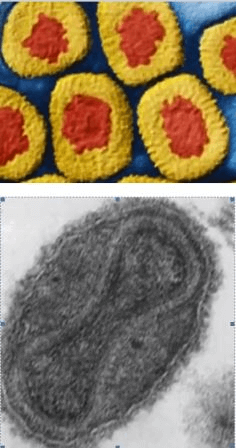
Рис. 4. Фото HCV. Электронная микрофотография.
Во внешней среде при комнатной температуре HCV сохраняют свои свойства от 16 часов до 4-х дней, годами сохраняет патогенность при отрицательной температуре, устойчив к воздействию УФО. При кипячении вирус погибает в течение 5 минут, при 60 0 С — в течение 30 минут.
Как передается гепатит С
HCV необычайно широко распространен среди населения многих стран мира. В РФ общее число заболевших составляет от 2,5 до 3,2 млн. Около 46,2% из них инфицировано 1 генотипом вируса. Мужчины болеют гепатитом С в 4 раза чаще женщин. В группу высокого риска входят подростки (15 до 19 лет) и взрослые (20 -39 лет). В этих группах регистрируется максимальная доля наркоманов.
Источником инфекции являются больные активной и латентной формами гепатита С. Наиболее насыщенными вирусными РНК являются клетки печени. У больных с хронической формой заболевания их концентрация в 37 раз выше, чем в сыворотке крови. Возбудители также находятся в крови и секретах больных.
Гепатит С передается парентеральным (является основным), контактным (половым, через слюну) и вертикальным (от матери плоду) путями. Механизм передачи заболевания реализуется естественными и искусственными путями.
- При искусственном пути передачи инфекции в организм доставляются огромные дозы вирусов. Это происходит при переливании инфицированной цельной крови и ее продуктов, при проведении инвазивных медицинских и немедицинских процедур. Частота развития посттрансфузионных гепатитов зависит от уровня носительства возбудителей в донорской популяции, количества перелитой крови или ее продуктов. В группе риска находятся больные гемофилией. Наибольшую опасность для них представляют концентраты крови и факторы свертывания. Маркеры вируса С у них обнаруживаются в 70% случаев.
- Опасности заражения подвергаются больные, получающие лечение гемодиализом.
- Одно из первых мест в структуре инфицированных HCV занимают парентеральные наркоманы. В разных странах мира их доля составляет от 30 до 70%.
- Вирус гепатита С передается при оперативных вмешательствах, парентеральных манипуляциях в медицинских учреждениях (от 9 до 22% случаев заражений).
- В группе риска находятся медицинские работники, осуществляющие гемодиализ и другие медицинские процедуры. Профессиональное заражение среди них составляет 5 — 30%.
- Передается гепатит С при проведении немедицинских манипуляций: татуировок, пирсинга, проколов мочек ушей, обрезании, проводимом в домашних условиях нестерильными инструментами, стоматологических и парикмахерских услугах.
Последние два при передаче гепатита С играют второстепенную роль.
Рис. 5. Гепатит С передается при гемодиализе (фото слева) и переливании крови (фото справа).
Половой, вертикальный и бытовой пути передачи гепатита С являются естественными.
- Вертикальный путь передачи инфекции (мать — дитя) фиксируется в пределах 1,6 — 19% случаев. Чаще всего инфекция передается детям от ВИЧ-инфицированных матерей.
- Вирусы гепатита С находятся в вагинальном секрете и сперме мужчин. Половой путь передачи чаще регистрируется у проституток, гомосексуалистов и супругов-носителей антител к вирусу (HCV-серопозитивных). Удельный вес полового пути передачи гепатита С составляет от 4 до 8%. Частота заражения зависит от числа сексуальных партнеров и длительности контакта.
Способ передачи гепатита С невозможно установить в 20% случаев.
Рис. 6. Одно из первых мест в структуре инфицированных HCV занимают парентеральные наркоманы. В разных странах Мира их доля составляет от 30 до 70%.
Иммунитет
HCV обладает слабой иммуногенностью. В процессе репликации вирусы быстро меняют свою антигенную структуру и начинают воспроизводить себя в несколько измененном антигеном варианте, что позволяет им ускользать от воздействия иммунной системы больного.
После перенесенного заболевания специфическая невосприимчивость при повторных заражениях не проявляется, так больной получает вирусы с мутациями в антигенной структуре.
Рис. 7. Вирус гепатита С поражает клетки печени. В 85% случаев заболевание принимает хроническое течение. На фото цирроз печени.
Гепатит С - это вирусное воспаление печени, очень плохо поддающееся лечению. Теперь датские ученые предложили совершенно новый подход к терапии этого тяжелого инфекционного заболевания.

Вирус гепатита С под растровым электронным микроскопом
Долгое время генетики уделяли практически все свое внимание изучению ДНК, то есть дезоксирибонуклеиновой кислоты, вещества, молекулы которого могут кодировать наследственную информации в клетках живых организмов. Однако в последние годы ученые все более пристально всматриваются в родственное ДНК вещество - РНК, то есть рибонуклеиновую кислоту.
Собственно, само по себе это вещество известно очень давно, но долгое время считалось, что оно служит всего лишь матрицей для синтеза белков, посредником в передаче информации от генов, то есть кодирующих участков молекулы ДНК, к белкам. Однако затем выяснилось, что этим функции РНК в клетке отнюдь не исчерпываются. Так, оказалось, что наряду с РНК-посредниками, или матричными РНК, существуют и рибосомные РНК, и РНК-переносчики, или транспортные РНК.
Помимо этих основных видов РНК, были открыты и другие разновидности рибонуклеиновых кислот, прежде всего, так называемые малые РНК. Одно из исследований в этой области даже удостоилось в 2006 году Нобелевской премии по медицине. Эти молекулы РНК, состоящие не более чем из 300 нуклеотидов, выполняют в клетке множество специфических регулирующих функций, многие из которых еще и сегодня остаются неизвестными науке. Но зато те, что известны, уже начинают использоваться фармацевтическими фирмами.
В частности, датская компания Santaris разработала субстанцию, эффективно подавляющую вирус гепатита С. Вирусам, как правило, свойственна большая избирательность в том, что касается клеток-хозяев. Не является исключением и вирус гепатита С - он может размножаться только в клетках печеночной ткани. "Вирусу гепатита С необходима для размножения одна вполне определенная молекула, синтезируемая только клетками печени, - говорит Хенрик Эрум (Henrik Ørum), научный руководитель компании Santaris. - Эта молекула - микроРНК-122. Без нее вирус гепатита С размножаться не может, поэтому он и поражает исключительно клетки печени, поскольку только они вырабатывают эту молекулу".
Правда, детали механизма, посредством которого микроРНК-122 способствует размножению вируса (или, возможно, защищает его от иммунной системы человека), пока неясны. Однако уже известно, что эта микромолекула непосредственно встраивается в наследственный материал вируса, состоящий также из РНК. "В молекуле вирусной РНК есть два участка, к которым всегда "причаливает" микроРНК-122, - поясняет Хенрик Эрум. - Без этой связи вирус не может запустить синтез жизненно важных белков". Эти белки необходимы ему как стройматериал для оболочек, их отсутствие лишает вирус способности к размножению.
В здоровой печени микроРНК-122 выполняет важную роль, следя за тем, чтобы белки синтезировались в клетке в должном количестве. "МикроРНК-122 участвует в регуляции активности очень многих генов, - говорит Хенрик Эрум. - Прежде всего, речь идет о генах, связанных с обменом жиров, с поддержанием оптимального уровня холестерина в крови. Если, например, в здоровой печени заблокировать микроРНК-122, уровень холестерина снижается".
От мышей - к обезьянам
Но это в здоровой печени. Если же печень поражена вирусом гепатита С, тут уж не до поддержания оптимального уровня холестерина, гораздо важнее прервать размножение патогена. Это соображение и побудило датских исследователей разработать вещество, блокирующее микроРНК-122. Пока эта субстанция не получила торгового названия и фигурирует под рабочим обозначением SPC3649. Она представляет собой короткий фрагмент искусственной ДНК и выполняет функцию своего рода "заглушки": связывается с микроРНК-122 и тем самым препятствует ее встраиванию в геном вируса.
Вещество разрабатывалось в опытах на мышах, но грызуны, как известно, не болеют гепатитом С, поэтому теперь препарат был испытан на четырех шимпанзе, инфицированных вирусом и страдавших хроническим гепатитом С. Три месяца инъекций привели к тому, что уровень содержания вирусов в организме животных снизился в 1000 раз. "Но и после завершения испытаний мы не зарегистрировали сколько-нибудь значительного повышения этого показателя, - говорит Хенрик Эрум. - Даже два месяца спустя вирус едва обнаруживался в крови животных. И серьезных побочных реакций мы не отметили. А главное - за все время терапии не возникло резистентных вирусов. Вот это действительно сенсация".
Сегодня стандартное лечение гепатита С состоит в комбинированном приеме двух медикаментов - иммунного гормона интерферона и противовирусного препарата рибавирина. Однако такая терапия оказывается эффективной лишь в 50 процентах случаев. Кроме того, эти медикаменты (особенно интерферон) часто вызывают тяжелые побочные реакции. А ведь полный курс терапии занимает от полугода до года.
Есть, правда, препараты новейшего поколения, блокирующие те ферменты, которые необходимы вирусу для размножения, но к этим медикаментам вирус гепатита С быстро становится резистентным. Именно поэтому результаты испытаний новой субстанции вселяют в ученых оптимизм. Не исключено, что SPC3649 сможет заменить интерферон в стандартной комбинированной терапии. "Мы находимся в самом начале пути, - говорит Хенрик Эрум. - До допуска в качестве медикамента может произойти все что угодно. В фармацевтике не бывает гарантированного успеха. Но пока дело представляется весьма перспективным".
Клинические испытания нового препарата на людях, страдающих гепатитом С в хронической форме, уже начались. Но судить об их результатах можно будет не раньше чем через год.
Как выглядят вирусы под микроскопом?
Сегодня описано больше 5 тысяч вирусов, и каждый из них питается и размножается за счет других клеток, то есть паразитирует внутри организма. По мнению ученых, вирус способен выживать в экстремальных условиях, обладает разумом и хитростью. Сам по себе вирус не представляет никакой опасности, но, попадая в организм, начинает активно размножаться. Выбрав нужные клетки, он словно ввинчивает в них свой код ДНК. Это происходит настолько быстро, что с момента вторжения до первых признаков заболевания проходит менее суток.
Многие вирусы считаются смертельными. При этом даже самые безобидные могут при определенных обстоятельствах настолько мутировать, что, попав в организм, вызовут тяжелые заболевания.
Эбола — вирус, вызывающий геморрагическую лихорадку, сопровождающуюся резким повышением проницаемости сосудов. Болезнь развивается очень быстро. Человек погибает за несколько дней от массивных кровотечений.
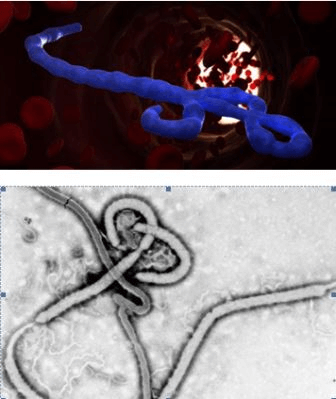
Бешенство — болезнь, вызываемая смертельным для человека вирусом. Передается от больных животных контактным путем или через укус. Вирус в организме продвигается со скоростью 3 мм/ч и поражает, в первую очередь, нервную систему.
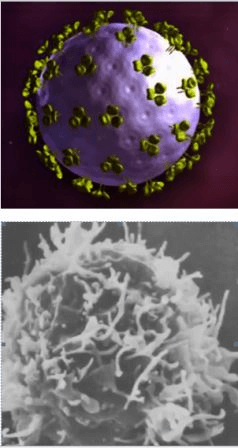
ВИЧ — медленное и прогрессирующее заболевание, вызванное вирусом, поражающим иммунные клетки. За несколько лет заболевание перерастает в СПИД.
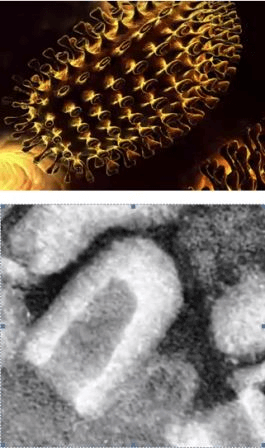
Вирус полиомиелита вызывает детский спинномозговой паралич, который может развиться за 2 дня. В группу высокого риска входят дети до 7 лет. Вакцинация — лучший способ избежать заболевания.

Вирус папилломы размножается в верхних слоях кожи и является очень заразным заболеванием, вызывающим рак. Особенно опасен для людей со сниженным иммунитетом.
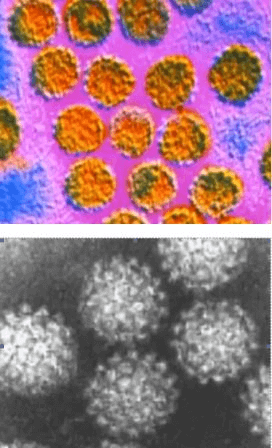
Оспа — высокозаразное и опасное заболевание, которое также вызывает вирус. Поражает в основном детей, вызывая различные осложнения.
Вирусы гриппа вызывают острое инфекционное респираторное заболевание верхних дыхательных путей, которое без отсутствия лечения может протекать в тяжелой форме и вызывать осложнения. Сегодня описано более 2000 видов данного вируса.
Ротавирус вызывает кишечные инфекции. Попадая в пищеварительный тракт, начинает активно размножаться в тонком кишечнике. Главная опасность — обезвоживание организма, которое может привести к печальным последствиям.
По мнению ученых, вирусы являются самым загадочным явлением на Земле. Только современные электронные микроскопы способны максимально увеличивать такие микроскопические объекты и позволяют человеку изучать их разновидности, правильно ставить диагнозы, лечить, а, самое главное, находить способы профилактики и защиты.
Неклассифицируемые вирусы
Глава 47. Возбудители гепатита
Инфекционный гепатит известен давно. Еще Гиппократ описал заразную форму желтухи. Но только в 1883 г. русский врач С. П. Боткин после длительных наблюдений и исследований пришел к выводу о том, что это заболевание инфекционной природы. В честь Боткина инфекционный гепатит был назван его именем "болезнь Боткина".
Предположение о вирусной этиологии гепатита было высказано в 1937 г. при изучении вспышки желтухи после массовой иммунизации солдат.
В настоящее время известно, что вирусный гепатит объединяет два самостоятельных заболевания: гепатит А - инфекционный, гепатит В - сывороточный, Возбудители этих заболеваний относятся к разным квалификационным группам.
Выявлен Фейстоном и другими в 1973 г. в фекалиях больного при помощи электронной микроскопии.
Морфологическая структура. Это мелкий вирус (20-25 нм). Тип нуклеиновой кислоты окончательно не установлен. Предполагают, что он содержит РНК. Форма вируса кубоидальная. Он состоит из нуклеоида и внешней оболочки.
Вирус типа А называют HAV (hepatitis A virus).
Культивирование. Вирусы не репродуцируются в клеточных культурах, но их удается культивировать в организме южноамериканских обезьян.
Антигенная структура. У вируса гепатита А не обнаружены серотипы. Он взаимодействует только с антителами HAV.
Устойчивость к факторам окружающей среды. Вирусы типа А довольно устойчивы. Полная их инактивация происходит только при кипячении в течение 30-40 мин. Они хорошо переносят низкие температуры, высушивание, воздействие кислот, эфира, не разрушаются под действием УФ-лучей. Обычные концентрации дезинфицирующих растворов губят их через 40-60 мин.
Восприимчивость животных. К вирусу гепатита типа А чувствительны обезьяны (шимпанзе).
Источники инфекции. Больные люди с клинически выраженной желтушной и безжелтушной формой заболевания.
Пути передачи. HAV передается преимущественно пищевым путем. Мухи могут быть механическими переносчиками. Вирус чаще передается в первые дни болезни.
Патогенез. Основной путь проникновения вируса - через слизистую оболочку желудочно-кишечного тракта. Попав в желудочно-кишечный тракт, HAV проникает в эпителиальные клетки слизистой оболочки кишечника, а оттуда в кровь. Возникает вирусемия. С кровью вирусы разносятся по всему организму и поражают паренхиматозные органы. Наибольшим тропизмом HAV обладает к гепатоцитам (клеткам печени), в цитоплазме которых вирус репродуцируется. При этом нарушается белковый и углеводный обмен. В крови появляются желчные кислоты, кал обесцвечивается, а моча темнеет. Нарушение углеводного обмена приводит к увеличению в сыворотке крови ферментов: альдолазы и трансфераз. Вирусом гепатита А чаще заражаются дети в возрасте от 1 года до 15 лет.
Иммунитет. Постинфекционный иммунитет стойкий. Антитела относятся к IgM и IgG (см. главу 12).
Профилактика. Изоляция больных, обеззараживание испражнений, мокроты больных, общесанитарные мероприятия.
Специфическая профилактика. Детям в возрасте от 3 до 15 лет, контактировавшим с больным гепатитом, вводят иммуноглобулин, что снижает заболеваемость, а в случае заболевания облегчает тяжесть течения.
Парентеральный сывороточный гепатит вызывается вирусом типа В. Он называется HBV (hepatitis В virus).
В 1961 г. Блумберг с соавторами в сыворотке крови больных обнаружила антиген, который был назван австралийским. А в 1970 г. Дейн также в сыворотке крови больных гепатитом обнаружил более крупные частицы, которые назвали частицами Дейна.
Морфологическая структура. Вирус HBV встречается в трех морфологических формах.
1. Мелкие сферические частицы - 22 нм в диаметре.
2. Трубчатые частицы разной длины. Полагают, что эти две формы представляют собой свободные белковые частицы - капсиды.
3. Вирусоподобные частицы - 40 нм (описаны Дейном и называются частицами Дейна). Они имеют двунитчатую ДНК. У них обнаружены липиды, полипептиды, углеводы и двойная оболочка. В настоящее время их считают полноценным вирионом - собственно HBV.
Культивирование. Вирус гепатита типа В репродуцируется в культуре гепатоцитов эмбриона человека, в диплоидных клетках печени человека, а также в органах и тканях обезьян шимпанзе. Культивировать вирус сложно, что затрудняет диагностику.
Антигенная структура. У частиц Дейна обнаружен HBV-антиген. Это сложный антиген, в состав которого входят: полипептиды, углеводы, липиды. Антитела, образующиеся к нему, называются анти-HBS. В сердцевине частицы Дейна имеется cor-антиген, - антитела к нему называются анти-НВс.
Устойчивость к факторам окружающей среды. При температуре 60° С вирус сохраняется 3-4 ч. Низкие температуры на него не действуют. В замороженных препаратах крови он остается жизнеспособным до 20 лет. HBV устойчивы к эфиру. 5% раствор формалина инактивирует их через 12 ч, 3% раствор хлорамина - через 2 ч.
Источники инфекции. Кровь больных и носителей антигена.
Пути передачи. Гепатит типа В передается парентерально при инъекциях вакцин, сывороток, лекарств, нестерильными зараженными вирусом гепатита иглами, шприцами, скарификаторами.
Патогенез. Инкубационный период при гепатите типа В - 2-6 мес (при гепатите А - 3-6 нед.) Проникнув гематогенно, лимфогенным путем, HBV попадает в печень, в дальнейшем заболевание развивается так же, как при гепатите, вызванном HAV. Дифференциальная диагностика гепатитов А и В по клиническим данным затруднена.
Профилактика. Наибольшее значение для профилактики гепатита типа В имеет правильная стерилизация инструментов и отбор доноров при использовании их крови. Донорскую кровь проверяют на наличие HBS-антигена.
Профилактические мероприятия в отношении медицинского персонала, работающего с материалом, инфицированным HBV, основаны на соблюдении особой осторожности при работе с кровью (обработке рук, загрязненных кровью, 2% раствором перекиси водорода и т. д.).
Специфическая профилактика. Лицам, подвергшимся опасности заражения, вводят иммуноглобулин.
В настоящее время разрабатывается вакцина, приготовленная из НВS-антигена.
Для диагностики гепатитов А и В широко используются биохимические показатели сыворотки крови больных, которые отражают функциональное состояние печени. О нарушении пигментного обмена функции печени судят по количеству свободного и связанного билирубина в сыворотке. Для выявления нарушения белково-синтетической функции ставят тимоловую пробу. Все эти исследования проводят в клинических лабораториях.
Вирусологические тесты диагностики HAV. Вирусологическая диагностика проводится путем определения антигенов и антител в крови. Для этой цели применяют наиболее чувствительные серологические методы: РПГ (реакция преципитации в геле), встречный иммуноэлектрофорез и др. Разработаны серологические методы для ранней и ретроспективной диагностики вирусного гепатита: в острой форме диагноз сводится к выявлению вируса в фекалиях больных методом иммуноэлектронной микроскопии с сывороткой реконвалесцентов.
Ретроспективная диагностика гепатита А осуществляется методом исследования парных сывороток крови больного в РСК и РПГ (см. главу 12).
Вирусологические тесты диагностики HBV. 1. В острой стадии диагностика осуществляется путем выявления HBS-антигена в сыворотке крови больного.
2. Выявление анти-НВS в РСК. Анти-HBS появляются только через 2-4 нед после начала заболевания и длительно циркулируют в крови.
3. Ретроспективная диагностика гепатита В осуществляется путем определения анти-HBS в парных сыворотках крови больного в реакции преципитации в геле (см. главу 12).
1. Какие заболевания вызывают вирусы гепатита и каковы пути передачи?
2. Какова устойчивость вирусов гепатита?
3. Какие иммуноглобулины обусловливают иммунитет после инфекционного гепатита А?
4. Что такое частицы Дейна?
5. Какие показатели используют для лабораторной диагностики гепатита А и В?
6. Какие исследования проводятся для ретроспективной диагностики при гепатитах А и В?
Суть цитологического исследования
Цитологический метод позволяет выявлять различные патологии в развитии клеток. В основе исследования лежит тот же принцип, что и при гистологическом анализе биопсийного материала, — морфологический, но в данном случае требуется лишь совсем небольшое количество биоматериала. Цитологический препарат — мазок-отпечаток или соскоб — можно сделать в течение нескольких минут, не используя специальную аппаратуру. Также, в отличие от биопсии, анализ менее инвазивен.
Анализ назначает врач: терапевт, хирург, онколог, гинеколог и т.д. К показаниям для назначения цитологического исследования относятся:
- подозрение на воспалительный процесс, раковое заболевание, вирусную инфекцию — для уточнения диагноза;
- подтверждение онкологического диагноза при хирургическом вмешательстве (удалении тканей);
- отслеживание динамики лечения различных заболеваний;
- контроль результатов терапии;
- скрининг в профилактических мерах;
- контроль за состоянием при вероятности рецидивов (обязательно — после излечения от онкологии).
Для анализа, как мы уже сказали, может использоваться различный биоматериал, в зависимости от исследуемого органа.
Цитологический анализ в основном не предполагает вмешательства в организм пациента: почти все биологические материалы можно собрать практически безболезненно. К таким относятся:
- мокрота;
- моча;
- секрет предстательной железы;
- выделения из молочных желез;
- амниотическая жидкость;
- смывы и мазки с шейки и из полости матки, из цервикального канала;
- соскобы с ран, свищей, эрозированных поверхностей, язв.
Однако есть биоматериалы, сбор которых может причинить неприятные ощущения пациенту. Но процедура проходит быстро, зачастую собрать нужный материал удается во время проведения других исследований, что ограждает человека от новых болезненных процедур.
Более или менее инвазивными способами собирают:
- смывы с органов во время проведения эндоскопии;
- кровь;
- цереброспинальную жидкость;
- пунктаты из суставных и серозных полостей (их забирают с помощью тонкой иглы).
Также на цитологическое исследование могут быть отправлены отпечатки удаленных во время операции или взятых для гистологического анализа тканей.
После получения образец отправляется на процедуру анализа по одной из методик.
В разных клиниках могут быть использованы различные способы цитологического анализа, но основными являются следующие:
Световая микроскопия
Как следует из названия, в основе метода — анализ с помощью оптического (светового) микроскопа. Образец исследования в данном случае должен быть прозрачен или полупрозрачен, чтобы световой луч мог пройти сквозь него. Самые современные оптические микроскопы способны давать увеличение до 3 000 раз, что позволяет исследовать образцы размером от 200 нанометров. Минус метода как раз в том, что клетки меньшего размера не поддаются анализу.
Световая микроскопия дает возможность не только рассмотрения общего плана клетки, но и процессов ее жизненного цикла — деления, перемещения цитоплазмы, движений клетки и т.д. Существует несколько видов оптической микроскопии: UV, люминесцентная, темного и светлого поля и другие. Такой метод подойдет для исследования различных штаммов заболеваний, опухолевых или измененных клеток. Точность оптической микроскопии приближается к 100%.
Электронная микроскопия
Метод центрифугирования
Данный метод применяется для детального исследования химического состава клеточных органелл. Для этого раздробленный в гомогенизаторе образец помещают в центрифугу и запускают вращение. Органеллы оседают слоями на дно центрифуги. Затем фракции разделяют на отдельные компоненты и изучают субклеточные структуры. Таким образом получают материал для цитохимического анализа. С помощью центрифугирования проводят один из самых известных и распространенных цитологических анализов — тест Папаниколау (ПАП-тест). Специфичность исследования — почти 100%.
Метод меченых атомов
Метод рентгеноструктурного анализа нужен для изучения пространственного расположения и свойств ДНК, РНК, белковых цепочек в составе клеточной структуры.
Метод клеточных культур заключается в выращивании клеток в условиях питательной среды и их последующем изучении.
Цитологические исследование — один из самых точных анализов, которые на данный момент предлагает медицина. В среднем для всех методов точность результатов близка к 100%. Чувствительность — способность тестов не выдавать ложноотрицательные результаты — примерно 94% для всех типов цитологического анализа. Специфичность, то есть способность не давать ложноположительных результатов при отсутствии болезни, меняется от метода к методу, но обычно не ниже 99%.
В бланке, который пациент получает на руки, будут указаны стандартные данные: ФИО, дата рождения, дата исследования, а также вид сданного биоматериала, его адекватность, метод анализа и описание результата. Если в биоматериале обнаружены измененные клетки, лаборант обязательно это укажет, как и наличие воспалений и других аномальных явлений, таких как присутствие микробов. Злокачественность клеток определяется по степеням: от первой (клетки не изменены) до пятой (обнаружены раковые клетки).
- воспалительные процессы (в том числе менингиты);
- наличие антигенов вирусов и инфекций в биоматериале;
- незлокачественные заболевания (пневмония, туберкулез, застойная сердечная недостаточность и т.д.);
- зрелость плода (при анализе амниотической жидкости);
- воспалительные заболевания ЦНС;
- инфаркты.
Цитологическое исследование — один из самых информативных и сравнительно оперативных способов получения важной информации о состоянии различных органов. Этот метод позволяет своевременно выявить онкологию или предраковое состояние, а также ряд других болезней и подобрать адекватное лечение. Очень важно правильно выбрать диагностический центр для проведения исследования: от медицинского оборудования и применяемых методик анализа зависит точность, чувствительность и специфичность результата.

Некоторые факторы могут искажать картину исследования, поэтому стоит избегать их влияния. В частности, за несколько дней до проведения анализа стоит воздержаться от приема спиртного, за несколько часов до анализа не следует курить. Если пациент принимает антибиотики, недавно проходил рентгенографию с контрастированием, то следует сообщить об этом врачу.
Читайте также:


